西瓜蔓枯病抗性遗传、基因定位及育种研究进展
程 瑞, 王学征, 徐兵划, 张朝阳, 黄大跃, 白 甜, 罗德旭, 孙玉东
(1.江苏徐淮地区淮阴农业科学研究所/淮安市设施蔬菜重点实验室,江苏淮安 223001;2.东北农业大学园艺园林学院,黑龙江哈尔滨 150030)
西瓜蔓枯病(gummy stem blight of watermelon,GSB)是一种世界性真菌病害,病原菌为Stagonosporopsisspp.,包含S.caricae及其演生的姊妹种S.citrulli和S.cucurbitacearum(Didymellabryoniae)3种病原菌,这3种病原菌在形态上无明显差异,需要通过基因型进行区分[1-3]。据报道,蔓枯病病原菌不仅在全球范围内分布广泛,并且能危害多种葫芦科作物[4],包括西瓜[5]、甜瓜[6]、黄瓜[7]、南瓜[8]等,该病原菌主要通过土壤、灌溉等途径传播,高温高湿环境更有利于病原菌孢子的存活和扩散,相应病害在西瓜的整个生育期均可发生,茎蔓、叶片是最主要的发病部位,严重时还会侵染果实[9]。近年来,随着我国温室大棚等设施栽培的快速发展,人们长期进行的多茬次栽培,不仅会造成农业生态条件的恶化和植物自毒作用,引发植株生长代谢障碍与抗逆性减弱,同时土壤中蔓枯病病原菌基数也急剧增加,加上高温高湿环境有利于蔓枯病病原菌快速繁殖,导致在西瓜生产实践中暴发大面积蔓枯病[3,9]。相关研究显示,西瓜蔓枯病病株率一般为15%~25%,严重时高达80%以上,能在短时间内使植株藤蔓枯死,病蔓率达10%,严重发生时可减产15%以上,且该病发病快,一旦发生便很难控制,从而严重影响西瓜的产量和品质,目前已经发展成为西瓜生产上的主要病害,严重制约了我国西瓜产业的健康发展[10-12]。目前,防治西瓜蔓枯病以化学药物为主,但因该病害在西瓜生产的各个生育期均可发生,并且能够侵害西瓜植株的不同部位,加上该病原菌的寄主分布广泛且结构复杂多样,从而严重影响了该病害的防治效果[13-15]。同时,化学防治不仅成本高、效率低,还会引起病原菌的抗药性及环境污染等问题[16]。利用抗病品种是防治西瓜蔓枯病最经济、最有效的措施。育种家们一直在进行西瓜蔓枯病抗源筛选和利用的研究,但是由于西瓜经长期驯化,致使其遗传背景狭窄,由于抗性材料多为野生种质,且病原菌分布广泛、结构复杂、目前西瓜蔓枯病的抗性遗传机制尚不清晰等[17-22],使得采用传统育种方法难以培育出优质抗病品种。因此,至今都未见可用于生产的蔓枯病抗性西瓜新品种。随着西瓜基因组和重测序数据的公布及分子生物学技术应用于病原菌研究[22-24],近年来育种家们在西瓜蔓枯病抗性鉴定、遗传分析、基因/数量性状座位(QTL)定位及分子标记开发等方面开展了许多工作,也取得了很大进展。本文着重就近5年的研究进行总结,旨在为西瓜蔓枯病抗性育种提供参考。
1 西瓜蔓枯病病原菌的研究
掌握病原菌的特征、分布是利用抗性材料进行抗病育种的重要依据。1891年,Chester在美国特拉华州的西瓜植株上发现西瓜蔓枯病病原菌并将其命名为PhyllostictacitrullinaChester,是在西瓜上发现该病原菌的最早记录[5]。研究发现,蔓枯病病原菌存在有性世代、无性世代2个部分,且在全球分布广泛,前人主要通过形态学进行独立区分和命名,导致蔓枯病病原菌命名比较混乱[25],最后统一学名为D.bryoniae。直到2015年,Stewart等首次在前人研究的基础上明确了3种蔓枯病致病菌并重新对其进行命名划分:S.caricae及其演化生成的姊妹种S.citrulli、S.cucurbitacearum(D.bryoniae),这3种病原菌形态相似,但基因型存在差异,可以通过基于聚合酶链式反应(PCR)的微卫星标记进行区分[1-2]。
西瓜蔓枯病自发现以来,一直呈现出扩大蔓延的暴发趋势,如今已广泛分布于南美洲、亚洲、欧洲、非洲及大洋洲等地区[26]。近年来,研究者们对各地区西瓜蔓枯病病原菌进行了调查分析。Stewart等对北美、南美、欧洲、北非和亚洲等地区的蔓枯病病原菌进行系统分析发现,在北美、南美、亚洲和东南亚等地区分布的主要为S.caricae,而S.cucurbitacearum则主要来自北美、欧洲、亚洲和新西兰的温带地区[1]。在美国境内,S.citrulli为优势种,主要分布在美国东南部,S.cucurbitacearum在美国东北部更为常见[27]。2014年,Li等对我国华东地区西瓜蔓枯病害进行调查研究发现,D.bryoniae是引发我国华东地区西瓜蔓枯病病害的主要病原菌[28]。基于Stewart等对蔓枯病病菌最新的分类方法[1],徐彦刚对我国江苏、安徽、浙江、江西地区西瓜蔓枯病发病植株进行分离鉴定,发现致病菌均为S.citrulli[20]。谭蕊对我国西南地区西瓜蔓枯病病原菌进行调查发现,我国西南地区西瓜蔓枯病的致病菌主要为S.citrulli、S.caricae2种,未见S.cucurbitacearum,其中S.citrulli是该地区的优势种[25]。Huang等对我国台湾地区西瓜蔓枯病病原菌进行鉴定统计发现,S.citrulli是引发台湾地区西瓜蔓枯病的主要病原菌[29]。近2年,Wang等以及笔者所在团队从田间分离西瓜蔓枯病发病植株发现,我国浙江、江苏地区西瓜蔓枯病致病菌主要为S.cucurbitacearum[30]。以上研究结果表明,西瓜蔓枯病的3种病原菌在全球广泛存在,不同地区的优势种存在差异,而我国西瓜蔓枯病病原涵盖以上3种,且不同地理区域、不同年份的优势种群可能不同。
在病原菌遗传多样性及致病力方面,研究者们也开展了一系列研究,但是由于生物学技术及测序技术的限制,前人的研究结论多数认为蔓枯病病原菌遗传多样性较低[31-34],并且不同病原菌菌株之间的致病力差异不显著[35-36]。近年来,人们对蔓枯病病原菌的研究不断深入,Gimode等对6份从不同寄主上分离获得的蔓枯病菌(S.cucurbitacearum、S.citrulli、S.caricae每种各2份不同分离菌株)分别通过苗期接种鉴定的方式进行病原菌致病性、西瓜种质蔓枯病抗性研究,接种12份不同西瓜种质资源的结果表明,西瓜蔓枯病病原菌的侵染性水平不仅与菌种有关,不同分离菌株的侵染力也存在明显差异;西瓜种质对蔓枯病病原菌株的抗性也存在不确定性。另有研究发现,不仅不同来源的蔓枯病致病菌株的致病力存在差异,同时对杀菌剂的敏感性也显著不同[37-39]。S.caricae对戊唑醇类杀菌剂存在耐药性,而S.citrulli、S.cucurbitacearum则对这类杀菌剂敏感[37];S.caricae对啶酰菌胺类和氟吡菌酰胺类杀菌剂敏感,但S.citrulli对该类杀菌剂具有一定抗性[38];在我国东部发现的S.citrulli对甲基硫菌灵具有一定抗性,而在美国弗罗里达州分离的S.citrulli却对甲基硫菌灵敏感[39]。西瓜蔓枯病病原菌菌株间的致病力、耐药性存在差异,西瓜种质对蔓枯病病原菌的抗性具有不确定性,这些都给西瓜蔓枯病的防治和抗性品种选育带来了巨大挑战。虽然目前关于西瓜蔓枯病病原菌致病机制、不同病原菌及菌株之间的差异特性尚不清楚,但是人们近2年对蔓枯病病原菌的研究不断深入,如浙江大学宋凤鸣老师团队完成了从浙江地区分离获得的西瓜蔓枯病病原菌S.cucurbitacearum分离株DBTL4的基因组测序工作,共获得35.28 Mb基因组数据和 9 844 个预测蛋白[30],并在NCBI等数据库中公布了全部数据(https://www.ncbi.nlm.nih.gov/data-hub/taxonomy/749889/),这将有助于研究者更全面地了解蔓枯病病原菌。
2 抗性种质、遗传分析和基因/QTL定位
西瓜蔓枯病抗性种质资源主要集中在野生西瓜(Citrullusamarus)中,通过传统杂交方式选育抗性西瓜品种不仅周期长,而且不确定性高。近年来,育种工作者通过人工接种方式进行西瓜蔓枯病抗性资源评价鉴定、抗性遗传分析研究,并积极开展抗性基因/QTL定位及分子标记开发研究,有关西瓜蔓枯病抗性的定位研究主要以S.cucurbitacearum(D.bryoniae)和S.citrulli2种病原菌为研究对象,并且各地研究病原的菌株以当地分离菌株为主。虽然起步较晚,但近2年已成为研究热点,并取得积极进展。
2.1 抗性种质鉴定
在长期驯化的过程中,因过于重视果实品质,导致一些性状损失,并导致栽培西瓜的遗传基础非常狭窄,其他瓜类品种已被用作西瓜多种病害抗性性状的主要来源[22-24,40]。早在1962年,Sowell和Pointer就发现了抗蔓枯病的西瓜种质PI 189225[41],随后育种家们试图将这种抗性引入商业品种中,但未成功[42-47]。后来,PI 271778被确定为另一个西瓜蔓枯病抗性的来源[48]。2005年,PI 164248、PI 244019、PI 254744、PI 271771、PI 279461、PI 296332、PI 482276、PI 482379、PI 490383和PI 526233被鉴定为新的西瓜蔓枯病抗性种质资源[49]。我国对西瓜蔓枯病抗性种质资源的鉴定工作起步较晚,顾卫红等通过苗期接种鉴定,获得美国引进提纯的Al-l golden producer、Al-l sweet scarlet和自育的新品系A5-6、H2-5等4个西瓜种质对蔓枯病具有较强抗性[17]。宋荣浩等对78份西瓜种质资源进行蔓枯病抗性评价,未发现有免疫或高抗种质,获得AU-sweet scarlet、AU-Jubilant、AU-Producer及自交系W6-9、W23-18和W23-47等中抗西瓜蔓枯病种质资源[18-19]。徐彦刚等对80份不同地域来源的西瓜种质进行蔓枯病接种抗性鉴定,筛选出21份高抗、抗西瓜蔓枯病种质材料,其中仅PI 189225、PI 482276被鉴定为高抗材料[20-21]。综合前人的研究结果,西瓜蔓枯病抗性主要来源于野生西瓜种C.amarus(表1),通过杂交转育方式获得部分西瓜新品种(系),但因地域、气候条件、病原菌菌种等的不同在田间抗性表现并不稳定[3,9]。尽管有上述的抗性来源,但抗蔓枯病西瓜品种的育种研究并不成功。蔓枯病可由3种不同病原菌引起,宿主对不同菌株的不同抗性存在差异、不同病原菌菌株致病力及耐药性不同可能是部分抗性育种工作不成功的主要原因之一。

表1 西瓜抗蔓枯病资源
2.2 抗性遗传分析
蔓枯病可在葫芦科多种作物上发生,目前研究者已经在西瓜、甜瓜、黄瓜、南瓜等多种葫芦科作物上开展了蔓枯病抗性遗传和基因/QTL定位研究[9],但西瓜蔓枯病抗性遗传研究较为滞后,遗传机制尚不明晰。多项研究结果表明,西瓜蔓枯病抗性遗传特性极为复杂,不仅不同品种(系)之间存在不同的遗传特性,同时该特性还受到寄主、病原及环境条件等因素的协同影响[50]。Norton等通过将西瓜抗性种质PI 189225与感病品种Charleston Gray进行杂交,根据F2代及BC代群体的抗性表现,得出西瓜蔓枯病抗性基因是由1对隐性基因(db、db)控制的[44]。顾卫红等通过将西瓜抗蔓枯种质与栽培易感品种杂交,根据后代抗性表型分析结果,认为西瓜蔓枯病抗性遗传为显性基因控制[17]。Gusmini等通过不同抗性水平的西瓜品种杂交,根据F1、F2代和BC群体的抗性特性,认为西瓜对蔓枯病的抗性受遗传、非遗传因素的共同影响,并且存在较大的环境影响和基因修饰[15]。全球有多位研究者分别独立试验,以抗性西瓜种质和易感材料杂交获得F2(F2:3)代群体,并以苗期人工喷雾西瓜蔓枯病病原菌悬浮孢子液的方式进行接种抗性鉴定,结果均表明,西瓜对蔓枯病的抗性遗传属于数量性状,且受环境等因素的影响较大[51-54]。多项研究发现,蔓枯病的抗性在西瓜中存在显著的变异性[49,55]。西瓜种质资源作为抗蔓枯病育种和有关生物学研究的基础,需要不断完善种质资源遗传多样性的评价体系,明确西瓜种质遗传多样性的分布特点。
2.3 基因/QTL定位
虽然西瓜蔓枯病抗性遗传分析的工作起步于40年前,但对抗性基因/QTL定位研究则是近几年的事。如上所述,目前在主要研究区域的优势种为S.cucurbitacearum(D.bryoniae)和S.citrulli,因此,主要研究工作集中在抗这2种菌种的遗传分析和基因/QTL定位上。Ren等以抗性种质PI 189225(C.amarus)为父本、易感西瓜品种K3(C.lanatus)为母本进行杂交,获得264个F2代株系和211个F2:3代株系,在2016年春、秋2季分别于苗期进行喷雾接种抗性鉴定[51],所用病原菌为我国华东地区优势种S.cucurbitacearum分离株JS002。结果表明,西瓜蔓枯病抗性遗传为隐性数量性状。采用BSA测序分析方法定位到8号染色上1个约5.7 Mb大小的主效位点QTL8.1,解释了31.54%~32.42%的表型变异(表2)。通过开发KASP分子标记进行精细定位,将候选区间缩至KASP_JS9383和KASP_JS9186标记之间(571.27 kb)(表3),以西瓜97103 v1为参考基因组,发现该区域内有19个注释基因,其中包含2个与抗性有关基因(LRR-RLK基因)Cla001017、Cla001019,并通过qRT-PCR进一步证实这2个基因在抗性种质PI 189225和易感品种K3接种过程中的表达量存在显著差异[51]。Lee等以抗性种质PI 189225(C.amarus)为父本、易感种质920533(C.lanatus)为母本杂交后获得178个F2代群体,通过苗期喷雾接种进行抗性鉴定,依据叶片发病、茎部发病2种鉴定标准分别进行抗性鉴定和连锁遗传分析[52],病原菌为韩国本土分离的S.cucurbitacearum分离株KACC 40937。结果表明,西瓜蔓枯病抗性遗传为数量性状,QTL定位分析获得位于8号染色体、6号染色体上的qLL8.1、qSB8.1和qSB6.1的3个QTL位点。并开发了4套KASP分子标记,在9个野生种质及13个栽培西瓜品种中进行验证。位于8号染色体上的qLL8.1、qSB8.1被鉴定为主要的QTL,解释了10.0%~10.5%的表型变异(表2)。以西瓜基因组97103 v1为参考基因组,发现位于8号染色体的主要QTL(qLL8.1、qSB8.1)在分子chr8_WGRS240 和chr8_WGRS(3)185标记之间(0.87 Mb)(表3)包含83个注释基因,其中包含4个与抗性相关的基因(RLK基因)被鉴定为可能与西瓜抗性相关的候选基因Cla022133、Cla022184、Cla022195、Cla022196[52]。Gimode等以抗性种质PI 482276(C.amarus)为父本、以美国栽培种Crimson Sweet(C.lanatus)为母本进行杂交,获得178个F2:3代株系,通过苗期喷雾接种方式分别进行了2次独立的接种抗性鉴定试验,病原菌为美国优势种S.citrulli分离株12178A。结果表明,西瓜蔓枯病抗性在F2代中出现正态分离,表现为数量性状[53]。Gimode等经表型鉴定与遗传连锁分析定位获得3个与西瓜蔓枯病抗性相关的QTL位点(ClGSB3.1、ClGSB5.1和ClGSB7.1),表型变异解析系数为6.4%~21.1%(表2)。以西瓜Charleston Gray v1为参考基因组,发现ClGSB3.1位点区域中包含65个注释基因,ClGSB5.1位点中包含712个注释基因,ClGSB7.1位点中包含574个注释基因。开发了3套KASP分子标记进行群体验证,发现位于ClGSB5.1和ClGSB7.1上的标记与西瓜蔓枯病抗性存在紧密连锁(表3),通过序列比对和共线性分析进一步锁定ClGSB7.1位点中的ClCG07G013230和ClGSB5.1位点中的ClCG05G019540(与97103v1版本基因组中Cla020705基因同源)可能为主要的抗性候选基因。Hong等通过喷雾接种的方式进行西蔓枯病抗性定位研究,病原菌为韩国国家园艺和草本科学研究所(NIHH)提供的韩国本土Didymellabryoniae分离株13-020,以抗性种质PI 279461(C.lanatus,致病系数为24%)为母本、以易感种质PI 223764(C.lanatus,致病系数为85%)为父本进行杂交,F1代表现出抗病(致病系数为26%),进一步获得128个F2代群体单株中85株表现为抗病、43株表现为感病,表明西瓜蔓枯病抗性为多基因控制的数量遗传[54]。经表型鉴定与遗传连锁分析定位获得3个与西瓜蔓枯病抗性相关的QTL位点(ClGSB1.1、ClGSB10.1和ClGSB11.1),表型变异解析系数为10.236%~10.237%(表2)。进一步在3个QTL位点开发HRM分子标记,共开发出5个SNPs在ClGSB1.1、ClGSB10.1存在多态性,最终确定WmGSB1.1-2(Chr01_28 572939)和WmGSB1.1-7(Chr01_28931313)可能与西瓜蔓枯病抗性紧密连锁(表3),以西瓜97103 v2为参考基因组,发现标记WmGSB1.1-2和WmGSB1.1-7间(0.36 Mb)包含40个注释基因,其中,包含与抗病相关基因ClC01G014900、ClC01G015010(RLKs基因)、ClC01G014910、ClC01G014990(WRKY基因)、ClC01G015130被确定为西瓜蔓枯病抗性基因[54]。上述研究采用西瓜抗源材料PI 482276(C.amarus)、PI 189225(C.amarus)、PI 279461(C.lanatus)进行西瓜蔓枯病抗性遗传定位,在西瓜第1、3、5、6、7、8、10、11号染色体上累计9个抗性相关基因QTL位点(表2),通过以SNP开发KASP、HRM分子标记在抗感群体中验证,进一步筛选出与西瓜1、5、7、8号染色上5个主要抗性QTL位点紧密连锁的9套蔓枯病抗性分子标记(表3),并获得可能与西瓜蔓枯病抗性相关基因13个(表2),获得的抗性基因多为RLKs基因,其在西瓜蔓枯病中的抗性作用并未得到验证。在西瓜蔓枯病抗性研究中采用抗源材料、易感材料均不同,并且使用的病原菌菌株来源不同,试验环境和季节均存在不确定性,进而导致研究结果差异较大。综上,西瓜蔓枯病抗性基因定位研究结果并不理想,虽有多项相关研究报道,但研究结果差异较大,并未获得真正可以应用于育种的抗性分子标记。可能与病原菌株致病力与西瓜蔓枯病抗性间关系较为复杂,且受多基因控制有关。

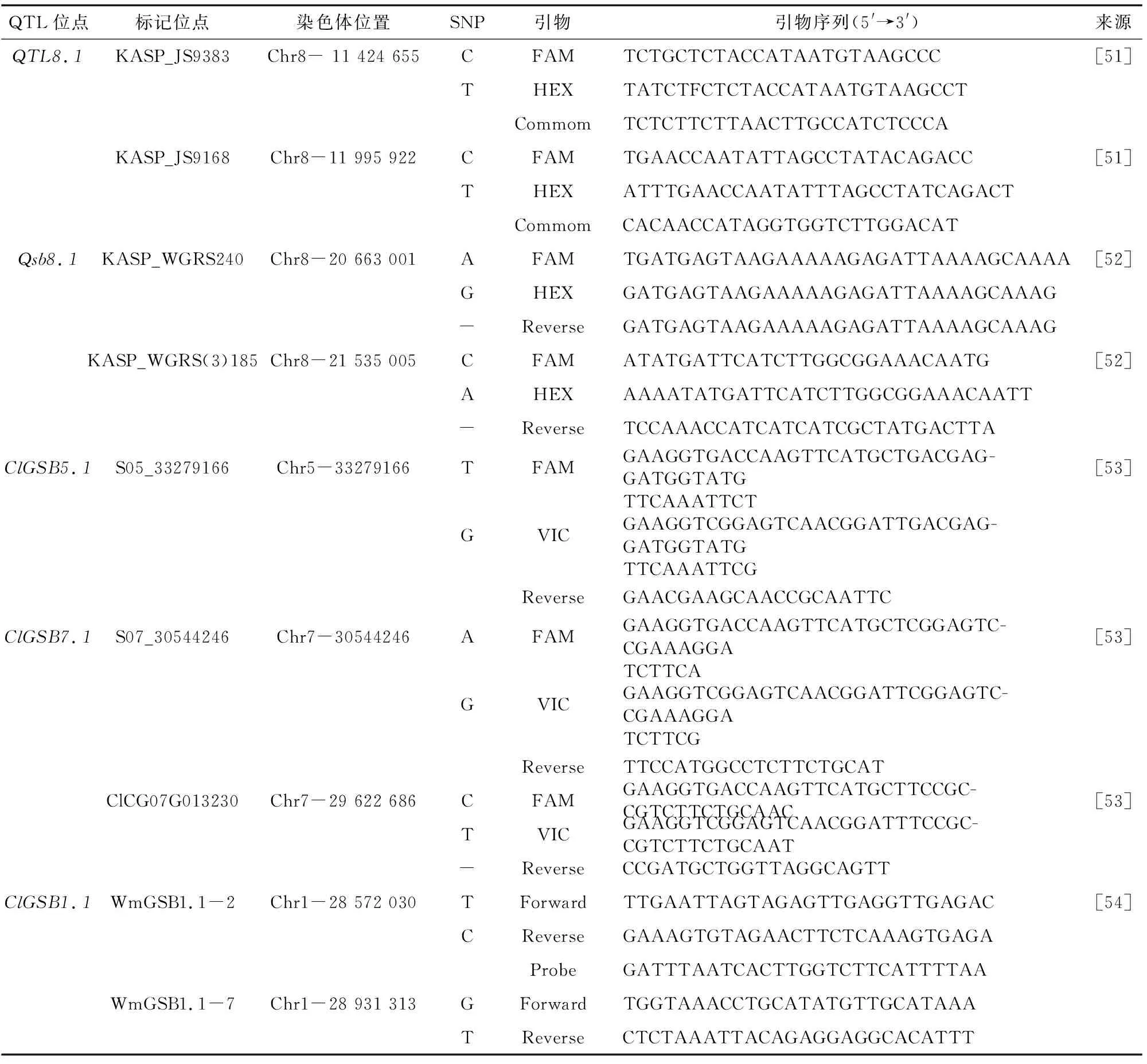
表3 西瓜蔓枯病抗性连锁分子标记
2.4 其他
在长期的进化过程中,植物逐渐形成了一套复杂的防御系统,抗病性可能受多种因素调控。但是随着人们对抗病基因及其编码产物的结构与功能的研究,以及对植物信号转导途径中其他组分的进一步解读,有关植物与病原体互作、抗病基因进化的分子机制研究也不断深入。尽管基因产物针对的病原体及致病因子截然不同,但其植物抗性基因的分子内结构特征相对十分保守。目前,西瓜蔓枯病抗性基因尚不明确,遗传机制尚不清晰。Hassan等分别通过对西瓜蔓枯病抗性种质PI 189225和易感种质PI 438676在苗期接种蔓枯病病菌(韩国本地分离的S.cucurbitacearum,菌株编号:13-020)后,进行西瓜抗性基因(NBS-R基因)表达谱分析。结果表明,Cla001821、Cla019863、Cla020705、Cla012430、Cla012433和Cla0124396个基因在抗性种质PI 189225中的相对表达量显著高于易感种质PI 438676,且其中有5个基因的相对表达量在接种病菌后12 h达到峰值,Cla001821在接种后72 h的相对表达量达峰值,Cla020705在接种12、72 h后均出现相对表达量峰值[55]。Ren等对西瓜GDSL基因家族进行系统分析,在接种蔓枯病病原菌S.cucurbitacearum(JS002)后,有12个GDSL基因在抗性种质PI 189225和易感品种K3中存在显著差异表达,其中基因CLCG02G001050在易感品种K3中的相对表达量始终显著高于在抗性种质PI 189225中的相对表达量[56]。抗病基因(R-基因)在植物免疫系统中发挥着重要作用,以应对各种病原体和昆虫,包括病毒、细菌、真菌、蚜虫和线虫[57],NBS类抗病基因作为抗病基因中数目最多的家族,在植物抵御病虫害中起着关键作用[58]。GDSL脂肪酶是脂肪酶家族中重要的亚家族之一,GDSL脂肪酶广泛参与植物生长发育、逆境胁迫响应、油料种子的脂肪酸代谢等过程[59]。以上研究结果表明,在西瓜抗性种质和易感种质接种蔓枯病菌后,R-基因和GDSL脂肪酶基因均存在响应机制,说明西瓜抗蔓枯病可能是一个系统过程,受到多种代谢途径调控。
3 存在问题与展望
西瓜栽培种遗传基础狭窄[22-24],蔓枯病病原菌多样[1],表现出不同病原菌及分离菌株对不同抗源的侵染力存在差异,给西瓜抗蔓枯病育种带来了严峻挑战。虽然近几年来育种研究者在病原菌分布调查、抗性遗传、基因/QTL定位、分子标记开发等方面开展了大量工作,也取得了显著进展,但仍有几个亟待解决的问题。
首先,西瓜蔓枯病病原菌在世界范围的分布及变异尚不清楚。当前,普遍认为西瓜蔓枯病病原菌有3个近缘种,其形态相似,可在核酸水平加以区分[1-2]。目前,美国[1]、中国[12,25,28-29]、韩国[52,54]、土耳其[26]等国家已经开展了西瓜蔓枯病病原菌的调查研究,但其他国家和地区有关西瓜蔓枯病病原菌鉴别情况的报道较少。我国对西瓜蔓枯病病原菌的研究起步较晚,虽然Li等完成了对华东地区西瓜蔓枯病病菌的分布调查[28],谭蕊完成了西南地区西瓜蔓枯病病原菌的调查[25],认为S.cucurbitacearum是我国华东地区的优势种,在西南地区无分布[28],西南地区存在S.citrulli、S.carica2种病原菌,未见S.cucurbitacearum,以S.citrulli为优势种[25]。而徐彦刚2020年通过田间病株分离鉴定发现我国江苏、浙江、安徽、江西等地西瓜蔓枯病致病菌为S.citrulli[20]。Huang等通过对我国台湾地区西瓜蔓枯病病原菌的调查发现,S.citrulli是引发台湾地区西瓜蔓枯病的主要病原菌[29]。以上结果表明,我国西瓜蔓枯病致病菌在不同地区、不同时间优势种存在明显差异,给西瓜蔓枯病防治带来巨大挑战。同时,我国西北、东北地区西瓜蔓枯病致病菌报道较少,随着设施栽培的发展,西瓜种植区不断扩大,以上结果未必能全面反映我国西瓜蔓枯病病原菌分布的全貌。2020年,我国已完成了S.cucurbitacearum基因组测序工作[30],但尚未公布S.citrulli、S.carica基因组的信息,病原菌间的遗传特性和遗传变异尚不清晰。
其次,西瓜蔓枯病病原菌致病及抗性机制研究滞后。虽然人们对西瓜蔓枯病病原菌致病机制及耐药性均开展了一系列研究,但迄今,关于蔓枯病病原菌的致病机制尚不明确。虽然我国已经从南瓜、西瓜中分离获得蔓枯病病原菌S.cucurbitacearum的分离株zq-1[60]、DBTL4[30],并完成了相应的基因组测序工作,但两者之间缺少系统比较研究,其遗传特性和变异尚不清楚。近2年来,有多项关于西瓜蔓枯病抗性基因/QTL定位的相关报道,但因使用的抗源材料、易感材料、病原菌菌种及分离株系、试验过程等不完全一致,使得抗性基因/QTL定位结果存在很大差异[51-54],迄今,已在西瓜第1、3、5、6、7、8、10、11号染色体上累计定位出9个抗性相关基因QTL位点(表2),针对不同抗源材料开发出与西瓜1、5、7、8号染色体上5个抗性QTL位点高度连锁的9套西瓜蔓枯抗性分子标记(表3),但这些标记并未能在育种中得到实际应用,充分说明了西瓜蔓枯病抗性机制较为复杂,属于多基因控制的数量性状,尚未明确西瓜蔓枯病植物自身的主要抗性基因,西瓜材料抗蔓枯病机制研究依然处于空白状态。
再次,抗病育种进展缓慢。虽然早在1962年人们就开始了西瓜抗性材料的筛选[41],但真正将抗病材料用于育种中并成功得到抗病品种的却鲜有报道。根据现有报道,西瓜蔓枯抗源材料主要来源于栽培种C.lanatus的近缘种C.amarus[46-49],而我国相对缺乏抗源材料,对抗性种质材料的收集、筛选与鉴定工作有待进一步加强。虽然Norton等通过多年摸索和积累,选育出部分抗蔓枯病西瓜新品种Au-producer、All-sweet scarlet、Au-Jubilant[44-46],顾卫红等选育出了抗蔓枯病西瓜新品种抗病948等[17],但这些品种的田间抗性表现不明显,并且部分品种的商品性状有待改善,未能得到大面积推广应用。由于在生产上缺少抗病材料,使得病原菌能够多样化存在,加上设施栽培的普及,西瓜蔓枯病迅速蔓延,对西瓜生产构成了严重威胁。
针对以上问题,国际研究者应加强合作,开展全球西瓜主产区西瓜蔓枯病病原菌调查研究,充分了解蔓枯病病原菌的分布特征及遗传多样性。共享病原菌基因组测序结果,研究病原菌之间的遗传差异,为研究病原菌的毒性、侵染性和对寄主的选择性提供新的线索。同时,加强开展西瓜蔓枯病抗性种质材料的搜集、鉴定和筛选工作,为抗病育种挖掘重要材料。另外,抗性基因鉴定最关键的点在于表型鉴定的准确性,西瓜蔓枯病病原菌致病性与寄主抗病性之间的机制较为复杂,建立稳定的抗性鉴定体系是抗性基因挖掘的基础之一。针对已定位获得的潜在抗性基因,进一步开展生物功能验证,明确西瓜抗性基因作用机制,筛选获得西瓜蔓枯病主效抗性基因,开发西瓜蔓枯病抗性育种核心分子标记,所有这些努力都将为西瓜蔓枯病抗性育种提供理论依据。

