不同菌种发酵对诺丽果酵素的抗氧化性及风味物质的影响
刘 倩,袁 越,张 杰,赵瑞丽,赵黎明,
(1.华东理工大学生物工程学院,上海 200237;2.华东理工大学生物工程学院,发酵工业分离提取技术研发中心,生物反应器工程国家重点实验室,上海 200237;3.上海皇润食品科技有限公司,上海 201815)
诺丽是茜草科巴戟天属的一种植物,其果实称之为诺丽果,胶状果肉以及强烈的腐臭气味是成熟水果的特征,因此,其又称为“乳酪果”或“呕吐果”。诺丽果因含有酚类化合物、有机酸、环烯醚萜类、蒽醌类和生物碱等生物活性物质广受消费者青睐。诺丽果的主要产品有果汁和酵素,发酵是最为广泛的一种生产方式[1]。诺丽果酵素有抗氧化[2]、护肝[3]、抗炎和刺激免疫系统[4]等功能,现市售的诺丽果酵素多采用传统的自然发酵方式,自然发酵属于混菌共生的发酵体系,存在参数变化复杂、安全质量难以控制且发酵周期长等问题。
目前,酵素行业中常选择人工接种乳酸菌和双歧杆菌进行酵素生产,不仅能够缩短酵素的发酵周期和改善产品风味,还因菌种独特的益生功能(抗氧化、提高免疫力和改善肠道屏障功能等)更好地提高酵素活性[5-6]。不同的菌种发酵相同的原料时,发酵过程产生的活性成分和风味物质具有一定差异,从而对产品的功效及其品质产生不同影响。Kwaw等[7]用3种乳酸菌发酵桑葚汁,确定了植物乳杆菌发酵液清除自由基的活性最高。王储炎等[8]比较了3种乳酸菌发酵蓝莓汁,确定了副干酪乳杆菌比其它两种乳酸菌发酵更有利于提高蓝莓多酚的含量和抗氧化活性。Chen等[9]确定了嗜酸乳杆菌对发酵液挥发谱的影响大于其它菌株,显著提高了2-乙基己醇、3-甲基-1-丁醇和乙酸乙酯等的含量。相似的,黄豪等[10]选用6种乳酸菌分别对山楂汁进行发酵,发现双歧乳杆菌发酵山楂汁具有较高的抗氧化性、丰富的香气物质和良好的感官品质。目前,诺丽果汁、自然发酵酵素产品和相关研究较多,相比于其它果蔬,因成熟的诺丽果风味不佳,果汁pH低(3.4~3.7),且含有抑菌成分,导致发酵很难进行,所以市场上接种发酵的诺丽果酵素产品较少,诺丽果发酵菌种的筛选以及发酵对其理化性质、功能成分和风味物质等影响也鲜有研究。在前期研究中,我们将实验室中的9种乳酸菌和双歧杆菌分别接种到诺丽果汁中,通过比较发酵液总酸和还原糖含量的结果,确定了鼠李糖乳杆菌12(LGG)、植物乳杆菌08(LP-08)、植物乳杆菌K11(LP-K11)、戊糖片球菌03(PP)和乳双歧杆菌36(BLA)开展不同菌种发酵对诺丽果酵素的抗氧化活性及风味物质的影响研究。
因此,本研究以诺丽果为原料,选用LGG、LP-08、LP-K11、PP和BLA进行发酵,研究不同菌种的选择对发酵液的理化指标、总酚含量、SOD酶活性、抗氧化活性、有机酸和感官风味的影响。以期为诺丽果的高值化利用、诺丽果酵素发酵菌种的选择提供依据。
1 材料与方法
1.1 材料与仪器
诺丽果 海南陵水市;白砂糖(食品级) 沃尔玛超市;福林-酚、芦丁、食品级Na2CO3、草酸、酒石酸、乳酸等 分析纯,上海泰坦科技股份有限公司;DPPH试剂盒、ABTS试剂盒、FRAP试剂盒 南京建成生物工程研究所;纤维素酶(20000 U/g)、果胶酶(30000 U/g) 南宁庞博生物工程有限公司;鼠李糖乳杆菌12(Lactobacillus rhamnosus,LGG)、植物乳杆菌08(Lactobacillus plantarum08,LP-08)、植物乳杆菌K11(Lactobacillus plantarumK11,LP-K11)、戊糖片球菌03(Pediococcus pentosaceus,PP)、乳双歧杆菌36(Bifidobacterium lactis,BLA) 保藏于华东理工大学生物工程学院发酵工业分离提取技术研发中心实验室。
SW-CJ-ID超净工作台 苏州净化设备有限公司;Infinite M200 PRO酶标检测仪 Tecan;LC-20AT液相(配有PDA检测器) 日本岛津;7890B-5977B气相色谱质谱联用仪 美国Agilent公司;50 μm DVB/CAR/PDMS SPME萃取纤维头 美国Supelco公司;PHS-3C数字pH计 雷磁公司;DHP-9162电热恒温干燥培养箱 上海齐欣科学仪器有限公司。
1.2 实验方法
1.2.1 菌种的活化 BLA所用的培养基为TPY培养基,其余四株菌株为MRS培养基。将保藏于甘油管中的5株菌,分别取20 μL于固体培养基中,挑取长出的单菌落接种于液体培养基中活化。分别取活化液1 mL加入到10 mL培养基中,37 ℃培养24 h。然后将各菌悬液加入到100 mL培养基中,37 ℃下培养12 h,4 ℃离心收集菌体,用无菌生理盐水洗涤3次后制备菌悬液,用于接种发酵。
1.2.2 诺丽果酵素制备工艺 挑选成熟度统一、无生果、无霉烂、无异物的诺丽果,清洗、沥水、破碎入罐,分别加入2.5‰(w/w)果胶酶和纤维素酶,45 ℃酶解6 h,按1:3(v/v)果汁与水的比例进行混合,加入5%(w/v)的白砂糖,用食品级Na2CO3调节pH至6.0左右,然后进行巴氏杀菌(80 ℃,15 min),作为发酵基质,冷却至室温后按1%(v/v)的接种量接种,(36±1) ℃恒温发酵,分别于发酵前(第0 d)、第1 d、第3 d、第5 d、第7 d和第9 d同一时间段取样。
1.2.3 pH和总酸含量测定 取新鲜诺丽果发酵液8000 r/min离心10 min后取上清液,采用pH计测定。参照GB 12456-2021进行诺丽果酵素中总酸含量的测定。
1.2.4 还原糖含量的测定 采用DNS(二硝基水杨酸)法[11],取400 μL样品加入600 μL DNS中,沸水浴10 min后,于540 nm测定吸光值,以葡萄糖为标准品作标准曲线为:y=3.7258x-0.0392,R²=0.9991。
1.2.5 总酚含量测定 采用福林-酚法测定总酚含量[12],适当修改:准确移取100 μL样品,加入100 μL去离子水,加入1.0 mL 50%的福林酚,摇匀静置5 min后加入2.0 mL质量分数为7.5%(m/v)Na2CO3,避光30 min。于760 nm波长处测定吸光度,以没食子酸为标准品作标准曲线为:y=1.8446x+0.0158,R2=0.9995。
1.2.6 SOD酶活力测定 按照SOD酶检测试剂盒(WST-1法)进行测定。
1.2.7 抗氧化活性的测定 DPPH自由基清除能力(以Trolox为标准品作标准曲线为y=0.0003x-0.0027,R²=0.9996)、ABTS+·清除能力(以Trolox为标准品作标准曲线为y=0.9264x+0.0605,R²=0.9994)、FRAP还原力(以FeSO4为标准品作标准曲线为y=0.3485x-0.0054,R²=0.9994)测定采用试剂盒进行检测。
1.2.8 有机酸含量测定 对诺丽果发酵前后有机酸含量进行检测,有机酸检测条件[13]:色谱柱HPX-87(4.6 mm×250 mm,5 μm);流动相:5 mmol/L硫酸;流速:0.6 mL/min;柱温:65 ℃;进样量:10 μL;检测波长:210 nm;检测器:DAD检测器。
1.2.9 感官评价 采用9点快感标度法[14]评价发酵前后诺丽果汁的感官性质,评定小组由20名经过感官训练的学生(年龄阶段:20~30岁,男女比例为1:1)组成,对颜色、酸甜度、香气、味道、体态、风味和整体接受性七个性质进行评价,评分分为9个等级对应评价人员的喜好程度,9:极度喜欢;8:很喜欢;7:中等喜欢;6:轻度喜欢;5:无所谓;4:轻度不喜欢;3:中等不喜欢;2:很不喜欢;1:极度不喜欢。
1.2.10 样品的前处理 顶空固相微萃取参照陈臣等[15]的方法,适当修改:称取3.0 g样品置于15 mL顶空瓶中,加入40 μL内标(2-辛醇:22 mg/L)。用聚四氟乙烯硅胶垫密封后于250 r/min、50 ℃水浴中平衡5 min。
1.2.11 色谱条件(GC-MS)
1.2.11.1 GC条件 参照陈臣等[15]的方法,适当修改。色谱柱:HP-Inno wax(60 m×0.25 mm×0.25 μm);升温程序:烘箱在初始温度40 ℃下保持2 min,以5 ℃/min速率升至100 ℃,以8 ℃/min升至230 ℃,保持10 min;载气(He),流速1 mL/min;进样方式为不分流进样,进样口温度为250 ℃。
1.2.11.2 MS条件 质谱条件:电子轰击(EI)离子源,电离能量为70 eV;离子源温度230 ℃,接口温度250 ℃,四级杆温度150 ℃;扫描模式为全扫描,质量扫描范围m/z 35~450。
1.2.12 GC-MS数据分析 所有挥发性化合物的定性首先采用NIST17质谱库进行检索,根据匹配度、离子碎片等信息初步确定化合物,并与文献报道值进行比对。定量分析:挥发性物质含量的测定采用内标半定量法,根据化合物与内标物峰面积的比值进行计算。所用内标物为40 μL 2-辛醇(22 mg/L),根据于海燕等[16]的方法,按下式计算待测物质的质量浓度及香气活力值,见式(1)、式(2)。

1.3 数据处理
每组实验均重复3次,结果以平均值±标准差的形式显示。采用Origin 2018软件绘图;IBM SPSS Statistics 26软件进行单因素方差分析(ANOVA),P<0.05表示差异显著。
2 结果与分析
2.1 不同菌种发酵过程中pH与总酸含量的变化
酸度是衡量发酵液品质的主要指标之一,不同菌株发酵过程中pH和总酸的动态变化趋势如图1所示,两者含量在发酵过程中呈现相反趋势。由图1A可知,发酵结束后,5株菌种的发酵液从pH为6.30下降到pH为3.60~3.97。由图1B可知,发酵第3 d,发酵液总酸含量由1.93~2.41 g/L上升到23.73~40.23 g/L,这是因为此时发酵液中碳源充足,乳酸菌可以迅速消耗碳源生成乳酸和乙酸等,导致总酸含量升高。发酵后期乳酸菌逐渐衰亡,酸度趋于稳定[17]。5株菌发酵后总酸含量为26.28~43.71 g/L,LP-08、LP-K11、BLA发酵后显著高于LGG和PP(P<0.05)。发酵结束后,LP-08产酸效果最好,总酸含量为43.71 g/L,较发酵前(第0 d)提高了19.87倍,可能因为LP-08糖酵解能力较强[18],其次是BLA,总酸含量达到43.49 g/L。

图1 不同菌种发酵过程中pH(A)和总酸(B)含量变化Fig.1 Changes in pH (A) and total acid (B) content during fermentation with different strains of bacteria
2.2 不同菌种发酵过程中还原糖含量及还原糖利用率的变化
糖含量的变化反映了发酵液中微生物活动情况[19]。由图2所示,条形图代表还原糖含量变化,折线图代表以发酵第1 d还原糖含量为初始值时,还原糖的利用率变化图。还原糖含量仅在发酵前期呈现上升趋势,发酵第1 d后呈下降趋势。这与王迪等[20]的研究一致,这可能是由于发酵初期在蔗糖酶的作用或弱酸作用下蔗糖转化为果糖和葡萄糖,使发酵液中还原糖含量增加。发酵1~3 d时,还原糖含量下降,利用率在20%~50%之间,表明该阶段大量的葡萄糖和果糖被乳酸菌等用于生长代谢。发酵第9 d时各菌种还原糖利用率差距较大,LP-08利用还原糖能力最强,在发酵结束后,还原糖含量为6.66 mg/mL,还原糖利用率为60.65%;LP-K11和BLA还原糖利用率相当,为54.48%和54.55%;PP利用还原糖的能力较差,发酵结束后含有8.60 mg/mL的残糖量。综上,5株菌对还原糖的利用能力从大到小依次是LP-08、BLA、LP-K11、LGG和PP。
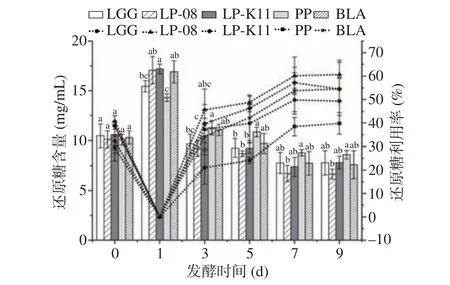
图2 不同菌种发酵过程中还原糖含量及利用率变化Fig.2 Changes in reducing sugar content and utilization rate during fermentation of different strains
2.3 不同菌种发酵过程中总酚含量变化
由图3所示,发酵过程中总酚含量呈先上升后下降的趋势。PP发酵第3 d时,总酚含量是发酵前的1.02倍;LGG、LP-08、LP-K11和BLA发酵第5 d总酚含量最高,分别比发酵前提高12.20%、29.74%、28.54%和24.11%,显著高于PP发酵(P<0.05)。其中,LP-08和LP-K11发酵后总酚含量较LGG、BLA和PP发酵均有显著提高(P<0.05)。可能是因为LP-08和LP-K11发酵可产生多种酶(水解酶、脱羧酶和β-糖苷酶等),提高游离态多酚和释放结合态多酚的能力优于其它菌种[21]。发酵后,LP-08、LP-K11和BLA总酚含量分别为0.251、0.248和0.248 mg/mL,显著高于发酵前(P<0.05),而PP发酵后,多酚含量显著下降(P<0.05)。多酚含量的增加可能是植物细胞破裂酚类物质的溶出或者菌体释放水解酶水解结合酚成单体酚[22-23],下降的原因可能是与生物大分子和金属离子发生吸附或沉淀[24],发酵后期,较多的酚类物质被不断氧化和降解,也会造成其含量的下降[25-26]。
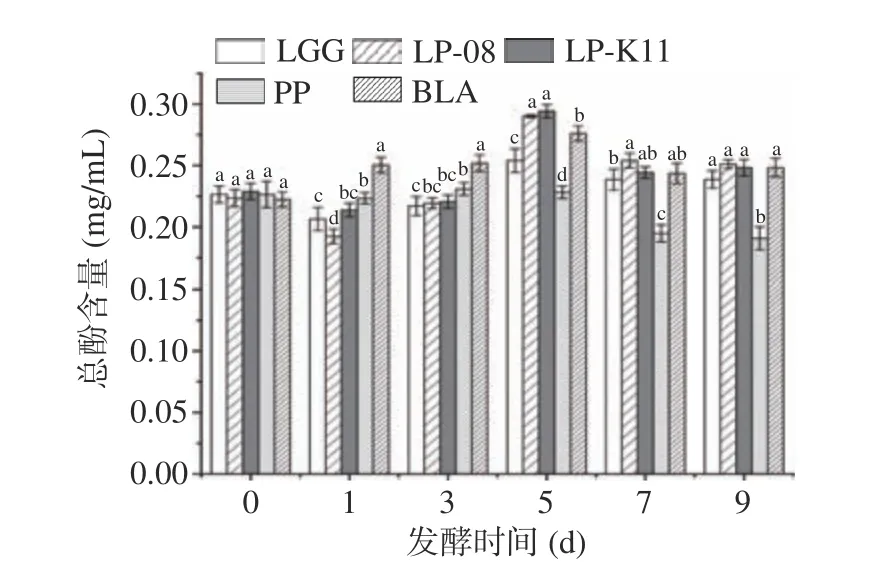
图3 不同菌种发酵过程中总酚含量变化Fig.3 Changes in total phenol contents during fermentation of different strains of bacteria
2.4 不同菌种发酵过程中SOD酶活力变化
SOD酶的活力常被用来衡量酵素酶活性的高低和发酵系统的抗氧化活性强弱[27]。由图4所示,发酵过程中,PP在发酵第1 d最先达到了SOD酶活力最大值,为65.48 U/mL;LP-08和LP-K11在发酵第5 d时,SOD酶活性达到最大值,分别为75.54和72.16 U/mL,较发酵前分别提高43.58%和34.08%,同时显著高于其它菌株发酵(P<0.05)。LGG和BLA在发酵第3 d达到SOD酶活力最大值,分别是70.06和75.16 U/mL,其中,BLA发酵后酶活力提高44.59%。发酵结束后,不同菌种发酵液中SOD酶活性从大到小依次为BLA、LP-08、LP-K11、LGG和PP,且都显著高于发酵前(P<0.05)。发酵初期,SOD作为胞内酶,可通过微生物的细胞裂解而释放[28],导致SOD酶活性升高,到发酵后期,基质环境的酸化以及微生物不断分泌相应的功效酶等因素使得其含量降低[17,29]。

图4 不同菌种发酵过程中SOD酶活力变化Fig.4 Changes in SOD enzyme activity during fermentation of different strains of bacteria
2.5 不同菌种发酵过程中抗氧化活性变化
进一步考察了诺丽果酵素发酵过程中抗氧化活性的变化,如图5~图7所示,不同菌株发酵抗氧化能力有明显差异。LP-08、LP-K11发酵第5 d达到DPPH自由基清除力最大值,分别为347.83和368.80 μmol/L(以Trolox当量计),较发酵前分别提高13.54%和19.80%,DPPH自由基清除力升高的机制较为复杂,Karaman等[30]曾报道酚类物质能很容易地给出1个氢离子,并通过共振杂化而稳定,这是具有高自由基清除力的主要原因。所以,LP-08和LP-K11发酵时,DPPH自由基清除力的提高与酚类物质的增加具有一定的相关性。该结果与周映君等[19]相关研究一致。BLA于第7 d达到清除力最大值,为349.44 μmol/L,显著高于LGG、LP-K11和PP发酵(P<0.05)。LGG和PP在发酵第3 d达到DPPH自由基清除力最大值,分别为340.02和334.57 μmol/L,与其它菌株发酵无显著差异。
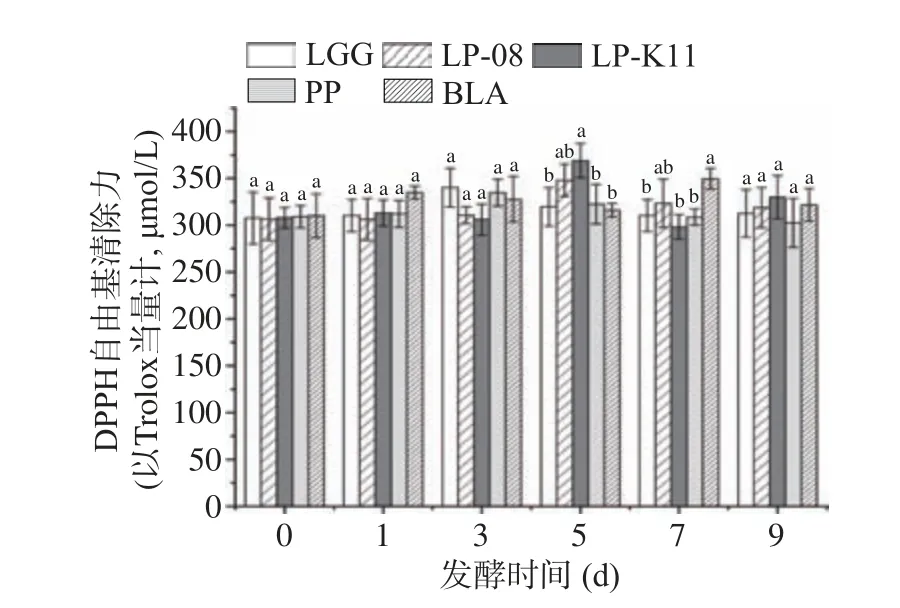
图5 不同菌种发酵过程中DPPH自由基清除力变化Fig.5 Changes in DPPH radical scavenging rate during fermentation of different strains of bacteria
ABTS+自由基清除能力用Trolox标准品的抗氧化活性表示。PP、LGG和BLA发酵第1、3和3 d达到最大ABTS+自由基清除力,抗氧化活性较发酵前分别提高14.83%、20.97%和21.72%。LP-08和LP-K11在发酵第5 d抗氧化活性分别相当于0.86和0.83 mmol/L Trolox标准品,分别提高33.17%和32.36%,其中LP-08发酵显著高于LGG、PP和BLA发酵(P<0.05)。发酵9 d后,除PP外,与发酵前相比,其它菌株发酵均提高了ABTS+自由基清除力(P<0.05)。ABTS+自由基清除能力与高浓度酚类、有机酸等物质的芳香环数量、分子数量和羟基取代基的性质密切相关[20]。
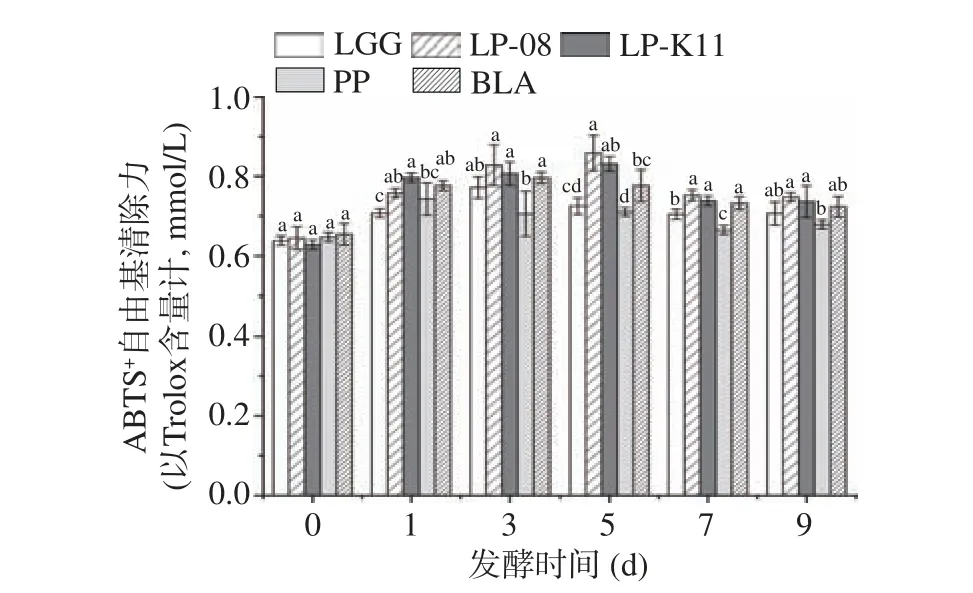
图6 不同菌种发酵过程中ABTS+自由基清除力变化Fig.6 Changes in ABTS+ free radical scavenging rate during fermentation of different strains of bacteria
FRAP还原力测定中,以FeSO4标准品作为衡量标准。PP、LP-08、LGG和LP-K11分别在发酵第1、3、5和5 d达到还原力最大值,分别提高13.83%、23.83%、12.64%和15.19%。BLA发酵在第5 d达到还原力最大值,增幅为22.22%,显著高于其它菌株发酵(P<0.05)。5株菌株发酵9 d后,只有LP-08和BLA的发酵液较发酵前有所提高(P<0.05)。发酵液三种抗氧化活性指标整体呈现先上升后下降的趋势,这与Yang等[31]的研究相一致,可能与诺丽果发酵过程中活性物质的变化和乳酸菌代谢产物作用有关。LP-08、LP-K11和BLA发酵3~7 d时有利于诺丽果酵素抗氧化活性的提升。
2.6 诺丽果酵素发酵前后有机酸含量变化
有机酸会影响诺丽果酵素的稳定性、感官品质和营养品质等。有机酸变化的差异除与原料密切相关外,还源于微生物及各物质间的相互转化[32]。由表1可知,诺丽果中有机酸主要有草酸、酒石酸、苹果酸、琥珀酸、乳酸和乙酸。

表1 诺丽果发酵前后有机酸含量变化(mg/mL)Table 1 Changes in organic acid content before and after fermentation of noni fruit (mg/mL)
5株菌种发酵后草酸和乳酸含量都显著提高(P<0.05),其中,BLA发酵后乳酸含量最高,为16.18 mg/mL,比发酵前提高了23.89倍,是其它菌株发酵的1.36~2.48倍,主要是发酵菌种通过糖代谢生成乳酸[33],给发酵液增添了柔和的酸味。除PP外,其它4株菌株显著降低了苹果酸含量(P<0.05),LGG发酵后,苹果酸的利用率为36.25%,苹果酸作为生物体三羧酸循环的中间体,参与多个不同的生化反应。另外,苹果乳酸酶可实现苹果酸和乳酸两者之间的转化,所以其含量处在变化中[34-35]。LGG和PP发酵大大提高了酒石酸含量,增幅分别为14.13%和11.47%。此外,LGG和BLA显著提高了琥珀酸含量(P<0.05),增幅分别为20%和10%。BLA发酵后,乙酸含量提高了1.03倍,可能是乳酸菌通过代谢丙酮酸产生[34]。
2.7 不同菌种发酵诺丽果酵素的感官评价
感官评价是食品能否获得消费者认可的关键指标,未发酵的诺丽果汁呈现暗黄褐色,而发酵后的诺丽果酵素颜色都呈现红棕色,更具感官吸引力,平均分高;酸甜方面,由表2可知,在喜好程度评分中得分最高的是LP-08组(7.19±0.98),BLA组酸味明显,导致得分较低;香气方面,发酵组有明显的诺丽果汁的果香和发酵味,香味柔和,得分较高;味道方面,发酵前的诺丽果汁味道寡淡,有苦涩味,发酵组味道酸甜清爽,但又具有诺丽果果香味;体态方面,所有样品在5~6分之间,均有少量细小果肉沉淀;风味方面,发酵组具有明显的果香味,得分高于发酵前;整体包括整体印象和接受度,此项得分较高的是LP-08和LP-K11发酵。LP-08发酵在颜色(6.57±1.03)、味道(6.71±1.19)得分处于中上等,酸甜度(7.19±0.98)、香气(7.24±0.83)、风味(7.00±1.05)和整体(7.24±0.77)得分最高。LP-08发酵在一定程度上改善了诺丽果汁的感官品质,使得诺丽果酵素具有更高的可接受度。

表2 不同菌种发酵诺丽果后感官喜好程度评分结果Table 2 Sensory preference scores of noni fruit fermented by different strains
2.8 诺丽果酵素发酵前后风味物质变化
对LP-08发酵的诺丽果酵素进行风味物质研究,风味物质含量及OAV值见表3。发酵后,发酵液增加了25种挥发性香气成分,包括10种小分子有机酸、5种醇及其衍生物、4种醛类、3种酯类、2种酮类和1种酚类。酸类物质中,发酵前和发酵后都以正辛酸和正己酸为主,两物质的OAV值都大于1,属于诺丽果发酵后的特征香气,赋予了发酵液奶酪味和刺激性酸味,这与Pino等[36]的研究结果相同,可能跟脂肪分解、蛋白质水解等相关[37];发酵后乳酸含量(109.78±20.28)的增加使得发酵液酸味温和适中。对照组中存在的三乙酸甘油酯具有苦味,于发酵后消失,同时新生成的3-辛基己酸酯和丙位辛内酯(OAV为1)不同程度地丰富了酯香。酯类物质可能是在乳酸菌复杂酶系的催化作用下由醇类和有机酸等生成[38];醇类物质中,发酵前以有刺激性的3-甲基-3-丁烯-1-醇为主,发酵后新生成了其它三类醇,少量醇类物质的检出赋予了诺丽果酵素一定的酒香味。在乳酸菌进行乳糖、氨基酸、甲基酮等的物质代谢时,某些醇可由相应的醛通过脱氢酶还原形成[9];酮类物质在浓度低于阈值时仍具有较强的香味,2-庚酮(药香)发酵后减少,α-异甲基紫罗兰酮、巯基丙酮和2-壬酮发酵后消失,又新生成了2-戊酮(5.70±0.36)、苯乙酮(9.68±0.75),发酵液逐渐由药香味转化为果香味。发酵后3,5-二甲基苯甲醛等醛类物质的消失可能是被还原成醇或氧化为酸;新生成的苯乙醛(OAV为8-11)属于诺丽果发酵后的特征香气,赋予了发酵液花香,可通过苯丙氨酸代谢途径产生[39]。此外,呋喃类、烷类和烯类物质也有少量检出。发酵前后虽然都以辛酸和己酸为主,但发酵后酸类、醇类和酯类等物质的变化对诺丽风味的调控起到了积极的作用,在一定程度上改善了香气成分,提高了消费者的接受度。

表3 诺丽果发酵前后风味物质含量及OAV值Table 3 Contents of flavor substances and OAV values before and after fermentation of noni fruit
3 结论
本文探究了5株菌发酵对诺丽果酵素品质的影响,研究发现,不同菌种对诺丽果发酵的理化性质变化趋势较一致,但对SOD酶活力、抗氧化活性及有机酸含量的影响差异显著。不同菌种发酵时,LP-08和BLA产酸能力较强;LP-08和LP-K11发酵使得总酚含量显著提升(P<0.05);另外,LGG、LP-08、LP-K11和BLA发酵后SOD酶活性均有显著提高(P<0.05)。在抗氧化活性比较中,不同菌种达到最大值的时间和含量有显著差异,5株菌中,LP-08、LPK11和BLA在发酵3~7 d时有利于诺丽果酵素抗氧化活性的提升(P<0.05)。BLA发酵后乳酸含量最高,比发酵前提高了23.89倍,其次是LP-K11和LP-08。LP-08发酵后感官评价得分最高,风味物质分析表明,发酵后新增了25种挥发性成分,包括10种小分子有机酸、5种醇及其衍生物、4种醛类和3种酯类等,赋予了诺丽果酵素奶酪香、花香和果香,丰富了诺丽果酵素的香气成分。
综上,5株菌中,LP-08发酵诺丽果汁产酸较强,显著提高了发酵液的总酚含量和SOD酶活性,具有较高的抗氧化活性、良好的感官品质和丰富的香气物质,是适宜发酵诺丽果汁的菌株,具有潜在的研究和商业开发价值。此外,发酵菌种的筛选、发酵工艺调控和发酵过程代谢物变化规律的相关性仍需要进一步研究,以期为果蔬酵素开发探索平台技术和调控策略,同时也为高质量诺丽果酵素的开发提供研究依据。

