羟考酮复合舒芬太尼对腹腔镜胃癌手术患者镇痛效果、苏醒质量及免疫应答的影响
郑晓宇,张燕,黄滨
(联勤保障部队第九〇〇医院麻醉与围术期医学科,福建 福州 350025)
胃癌居全球癌症致死率第二位,手术切除原发病灶是目前临床上主要的治疗方式,腹腔镜胃癌手术具有微创、术后恢复快、感染率低等优势,目前临床应用较为广泛[1]。除切口导致的体表疼痛外,机械操作引起的内脏牵拉、肌肉痉挛等导致的内脏痛亦可引起术后剧烈疼痛反应,加重免疫功能抑制,不利于患者快速康复及预后,因此,选择合适而有效的麻醉及镇痛方案尤为重要[2]。舒芬太尼为 μ 阿片受体激动剂,具有起效快、消除迅速、镇痛效果好等特点,但剂量控制不佳则易引起躁动、呼吸抑制等不良反应[3]。羟考酮为 μ、κ 阿片双受体激动剂,在体表镇痛基础上可有效抑制内脏引起的疼痛,镇痛效果更好,但具有单一使用剂量大、不良反应高等弊端[4]。基于此,本研究将舒芬太尼和羟考酮联合应用于腹腔镜胃癌手术患者中,以探究其临床镇痛效果及对患者苏醒质量和免疫应答的影响。
1 资料与方法
1.1 一般资料
选取2020年2月至2022年4月联勤保障部队第九〇〇医院收治的93例腹腔镜胃癌手术患者为研究对象。纳入标准:(1)经CT、MRI等影像学检查和术后病理学检查确诊为胃癌;(2)符合手术治疗指征;(3)美国麻醉医师协会(ASA)评级为 Ⅰ~Ⅱ级。(4)无精神、认知障碍疾病,可正常交流。排除标准:(1)合并严重器质性疾病者;(2)阿片类药物依赖者。本研究符合《赫尔辛基宣言》要求。按照麻醉方法不同分为观察组(n=47)和对照组(n=46)。两组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。
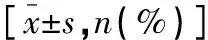
表1 两组患者一般资料比较
1.2 方法
患者入室后均开放上肢静脉,行动脉穿刺监测血氧饱和度、心率及脑电双频指数(BIS)。麻醉诱导:静脉推注地塞米松5 mg(湖北天药药业)、咪达唑仑0.05 mg/kg(江苏恩华药业)、丙泊酚1~2 mg/kg(北京费森尤斯卡比医药)、顺阿曲库铵0.2 mg/kg(浙江仙琚制药);对照组静脉推注舒芬太尼0.4 μg/kg(宜昌人福药业),观察组静脉推注舒芬太尼0.2 μg/kg和羟考酮0.2 mg/kg[萌蒂(中国)制药],待肌松起效后行机械通气。麻醉维持:靶控输注丙泊酚1.5~2.5 μg/mL,持续吸入1%~2%的七氟烷(上海恒瑞医药),维持BIS 45~55、气腹压12 mmHg。术毕前30 min对照组静脉推注舒芬太尼0.2 μg/kg,观察组静脉推注舒芬太尼0.1 μg/kg和羟考酮0.1 mg/kg。术后镇痛:两组均接镇痛泵行患者自控镇痛。镇痛方案:100 μg舒芬太尼+0.25 mg帕洛诺司琼(辽宁海思科制药有限公司),采用生理盐水稀释至100 mL,输注速率2 mL/h,自控锁定时间为15 mim。
1.3 观察指标
(1)苏醒质量:统计两组自主呼吸恢复时间、苏醒时间、拔管时间及拔管30 min后苏醒质量。苏醒质量采用苏醒质量(steward)评分[5]分别从清醒程度、呼吸通畅程度、肢体活动程度3个方面评估,总分为6分,>4分为苏醒质量良好。(2)术后疼痛比较:分别于术后1、6、12、24、48 h采用视觉模拟评分法(VAS)[6]评估两组疼痛状况,共10分,分值越高表示疼痛程度越深。(3)术后疼痛补救:统计两组术后48 h内疼痛补救次数及疼痛补救率。(4)免疫功能:分别于麻醉前及术后24 h采集患者空腹静脉血,采用流式细胞仪检测两组血液CD3+、CD4+、CD8+,计算CD4+/CD8+比值。(5)不良反应:统计两组术后不良反应。
1.4 统计学分析
2 结果
2.1 两组患者苏醒质量比较
观察组自主呼吸恢复时间、苏醒时间、拔管时间均低于对照组(P<0.05),Steward评分高于对照组(P<0.05)。见表2。

表2 两组患者苏醒质量比较
2.2 两组患者术后镇痛效果比较
术后1、6、12、24、48 h两组VAS评分均呈先升后降的趋势,组内比较,差异有统计学意义(P<0.05);观察组术后6、12、24 h VAS评分均低于对照组(P<0.05)。见表3。

表3 两组患者VAS评分比较分)
2.3 两组患者术后补救镇痛比较
观察组术后48 h内补救镇痛次数和补救镇痛率均低于对照组(P<0.05)。见表4。
2.4 两组免疫功能比较
术后24 h,两组CD3+、CD4+、CD4+/CD8+均降低(P<0.05),但观察组术后24 h指标均高于对照组(P<0.05),CD8+比较,差异无统计学意义(P>0.05)。见表5。
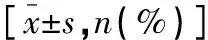
表4 两组患者补救镇痛比较

表5 两组患者免疫功能比较
2.5 两组麻醉药物不良反应比较
观察组不良反应总发生率为12.77%,对照组为21.74%,两组不良反应比较,差异无统计学意义(P>0.05)。见表6。

表6 两组麻醉药物不良反应比较 [n(%)]
3 讨论
腹腔镜下胃癌根治术由于手术创伤、二氧化碳气腹建立、术中机械性牵拉等原因术后疼痛较为严重,如镇痛管理不当则易引起严重的应激反应,加重机体免疫抑制和术后复发感染风险,对术后恢复和预后产生不利影响。因此,做好疼痛管理是手术方案重要部分[7]。
舒芬太尼具有较高的脂溶性,可通过血脑屏障且分布容积小,可通过作用于痛觉传导区的 μ 阿片受体发挥镇痛效应。此外,舒芬太尼可通过组织酯酶和血浆降解,体内清除快、蓄积少,因而广泛应用于各类外科手术麻醉中[8]。但临床应用时背景剂量过高可引起不良反应,严重者可造成低血压、心动过缓,而背景剂量过低则可引起镇痛效果不佳,加重患者术后疼痛反应[9]。研究[10]发现,手术除切口创伤、二氧化碳气腹引起的疼痛外,机械性牵拉、痉挛、缺血等引起的深部内脏疼痛也较为严重,而大多数阿片类药物因不作用于 κ 受体,因而不能抑制内脏痛。复合镇痛可根据不同疼痛发生机制选择相应的镇痛类药物而使镇痛效果改善,同时还可减少单一药物剂量使用,有效降低药物不良反应[11]。羟考酮可通过激动 μ受体进行镇痛,还可以通过 κ 受体作用于平滑肌,有效减轻内脏疼痛,其镇痛效应接近于吗啡,但羟考酮血脑屏障转运效率较高,起效更为迅速,一般为2~3 min,因而镇痛效果较强,且其代谢产物不具有镇痛效应,因而药效消除迅速[12]。研究[13]表明,术前静脉推注羟考酮可有效缓解腹腔镜手术患者术后疼痛。也有研究[14]发现,采用羟考酮联合镇痛可有效预防患者术后免疫功能下降,但单一采用羟考酮镇痛剂量需求较大,易引起术后不良反应,因而临床上常用于复合镇痛。
本研究将舒芬太尼与羟考酮联合应用于胃癌手术患者的围麻醉期镇痛中,结果表明术后观察组患者整体苏醒质量更高。这主要与镇痛剂的使用量有关,羟考酮和舒芬太尼复合镇痛可降低单一镇痛剂使用量,有效提高术后药物清除效率,进而提高苏醒质量。在术后镇痛方面,观察组术后24 h内镇痛效果更好,且观察组补救镇痛次数、补救镇痛率更低,提示复合镇痛优于舒芬太尼单独镇痛。其主要原因为,腹腔镜手术后内脏痛是一种内源性疼痛,其范围较为弥散,定位不明确,仅采用舒芬太尼进行浅表镇痛效果有限,而羟考酮通过作用于 κ受体可有效抑制内脏疼痛,故而联合镇痛效果更佳[15]。
研究[16]发现,镇痛不当可加重术后免疫抑制。CD3+是机体细胞免疫功能的总体体现;CD4+亚群具有辅助性免疫作用,可对炎症、刺激引起的免疫信号做出回应;CD8+亚群具有促炎作用,通常情况下其与CD4+相互制约,CD4+/CD8+比例失衡可加重免疫抑制。本研究结果显示,观察组术后24 h CD3+、CD4+、CD4+/CD8+更高,提示通过有效而全面的镇痛,患者术后免疫抑制得以有效控制,这对预后具有积极意义。两组不良反应总发生率比较,差异无统计学意义。
综上,羟考酮复合舒芬太尼镇痛,有助于改善腹腔镜胃癌手术患者镇痛效果,提高苏醒质量,降低术后免疫抑制。

