纤维素酶法提取油莎豆多糖及其抗氧化性
王旭升,吴琼*,吴迪,于特,刘力齐,康立宁
(1.长春大学 食品科学与工程学院,吉林 长春 130022;2.吉林省农业科学院加工中心,吉林 长春 130033)
油莎豆(Cyperus esculentus)别称油莎草、地杏仁[1],属莎草科块茎类植物[2]。油莎豆适应能力强,并有改良土壤、固沙防风的作用,且产量可观[3],在我国许多省市得到了广泛栽培[4]。油莎豆营养成分丰富,是一种优质、综合应用价值高的植物资源,具有多种生理功能[5]。油莎豆具有温和肠胃、保护神经的功效[6],其提取物能够预防心脏病、癌症、骨质疏松症等疾病[7-8]。多糖作为油莎豆的重要成分,其含量在15%~25%,因为多糖有着独特的结构且易被修饰[9-10],故具有降血脂、调节免疫等多种生理功能。多糖可作为增稠剂应用到蛋白饮料中[11],还可作为生产婴幼儿食品、保健产品的原料[12]。
目前对油莎豆的研究主要集中在油脂及淀粉的提取应用[13-14],鲜有对其多糖的研究。油莎豆多糖的提取方法有热水浸提法、超声辅助法等。热水浸提法的优点是操作简单,提取多糖时安全、经济,但存在温度高、耗时长、多糖得率低等缺点。超声辅助法的优势在于提取时间短、耗能低;缺点是多糖得率不高。胡炜东等[15]以油莎豆粕为原料,探究提取条件对水溶性多糖提取率的影响,通过水浴浸提法获得的油莎豆多糖提取率为10.36%;张莉弘等[16]采用超声辅助法提取的油莎豆多糖得率为14.7%。酶法提取油莎豆多糖是通过酶解细胞壁使胞内物质溶出,以此来提高多糖的得率[17]。本文采用纤维素酶对油莎豆进行酶解来提取多糖,探究油莎豆多糖的最佳制备工艺及其抗氧化性,以期为油莎豆多糖的研究和应用提供参考。
1 材料与方法
1.1 材料与试剂
油莎豆:市售;纤维素酶(酶活10 000 U/g):深圳润友化学有限公司;石油醚、苯酚、盐酸、浓硫酸、硫酸亚铁、过氧化氢、氢氧化钠、葡萄糖:北京化工厂;无水乙醇:国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH): 上海麦克林生化科技有限公司;水杨酸:大连美仑生物技术有限公司。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;3K15医用离心机:曦玛离心机(扬州)有限公司;JA2003电子天平:上海舜宇恒平科学仪器有限公司;UV-2700紫外可见分光光度计:岛津仪器(苏州)有限公司;GZX-9070MBE电热鼓风干燥箱:上海博迅实业有限公司医疗设备厂;WJX-A1000高速多功能粉碎机:上海缘沃工贸有限公司;PHS-3C pH检测计:上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 油莎豆多糖的提取
无杂质油莎豆洗净→烘箱烘干→粉碎后过筛→石油醚脱脂后干燥、过筛[18]→油莎豆粉→加入纤维素酶→油莎豆粉和水按料液比1:25(g/mL)水浴加热→沸水浴灭酶5 min→离心(6 000 r/min)→取上清液→过滤→油莎豆粗多糖溶液→旋转蒸发浓缩→加入乙醇于4℃冰箱中静置24 h→离心(4 000 r/min)得沉淀→真空冷冻干燥→油莎豆多糖。
1.3.2 多糖含量的测定
分别以葡萄糖浓度(x,μg/mL)和490 nm处吸光度(y)为横坐标和纵坐标绘制标准曲线,葡萄糖标准曲线方程为 y=0.015 5x+0.083 5;R2=0.998。取 2.5 μL 0.1 mg/mL的油莎豆多糖溶液,进行多糖含量的测定[19]。
1.3.3 多糖得率的计算
多糖得率按下式计算。
油莎豆多糖得率/%=(T×10-6×W×P)/M×100
式中:M为原材料质量,g;T为回归方程计算得到的油莎豆多糖浓度,μg/mL;W为定容的体积,mL;P为稀释倍数。
1.3.4 单因素试验
称取2 g油莎豆粉,以油莎豆多糖得率为指标,进行单因素试验。
1)控制酶解温度为60℃,加酶量为1.5%,pH值为 4.5,酶解时间设置为 10、20、30、40、50 min,考察酶解时间对油莎豆多糖得率的影响。
2)控制酶解时间为30 min,加酶量为1.5%,pH值为 4.5,酶解温度设置为 40、50、60、70、80 ℃,考察酶解温度对油莎豆多糖得率的影响。
3)控制酶解时间为30 min,酶解温度为60℃,pH值为4.5,加酶量设置为0.5%、1.0%、1.5%、2.0%、2.5%,考察加酶量对油莎豆多糖得率的影响。
4)控制酶解时间为30 min,酶解温度为60℃,加酶量为 1.5%,pH 值设置为 3.5、4.0、4.5、5.0、5.5,考察pH值对油莎豆多糖得率的影响。
1.3.5 响应面试验设计
以酶解时间、酶解温度、加酶量、pH值为考察因素,以多糖得率为响应值,运用Design-Expert8.0.6进行四因素三水平的响应面试验设计,优化油莎豆多糖提取工艺条件。因素水平见表1。

表1 试验设计因素与水平Table 1 Factors and levels of test design
1.3.6 DPPH自由基清除能力的测定
分别配制浓度为 0.5、2.5、4.5、6.5、8.5 mg/mL 5 个梯度的油莎豆多糖溶液,各取2mL不同浓度样品溶液,加入2 mL 0.2 mmol/L的DPPH-乙醇溶液[20],室温下避光静置30 min后,于517 nm波长下测得吸光度A1,同时做空白对照,测定2 mL蒸馏水和2 mL DPPH溶液吸光度为A0,2 mL无水乙醇和2 mL多糖溶液测得吸光度为A2,以VC为参比,各样品测3次后取平均值,DPPH自由基清除率计算公式如下。
DPPH 自由基清除率/%=[1-(A1-A2)/A0]×100
1.3.7 羟自由基清除能力的测定
分别配制浓度为 0.5、2.5、4.5、6.5、8.5 mg/mL 5 个梯度的油莎豆多糖溶液,取2 mL不同浓度样品溶液与2 mL 6 mmol/L FeSO4溶液、2 mL 6 mmol/L水杨酸溶液、2 mL H2O2混合,37℃下反应1 h,于517 nm波长下测得吸光度 A1,2 mL样品加入 2 mL 6 mmol/L FeSO4溶液、2 mL 6 mmol/L水杨酸溶液、2 mL蒸馏水,避光反应后测得吸光度A2,2 mL蒸馏水加入2 mL FeSO4溶液、2 mL H2O2、2 mL水杨酸溶液,避光反应后测得吸光度A0,以VC为参比[21]。各样品测3次后取平均值,羟自由基清除率计算公式如下。
羟自由基清除率/%=[1-(A1-A2)/A0]×100
1.4 数据处理
试验重复3次,使用Origin 8.5进行绘图,采用Design-Expert8.0.6进行数据分析。
2 结果及分析
2.1 单因素试验结果
2.1.1 酶解时间对多糖得率的影响
酶解时间对油莎豆多糖得率的影响见图1。
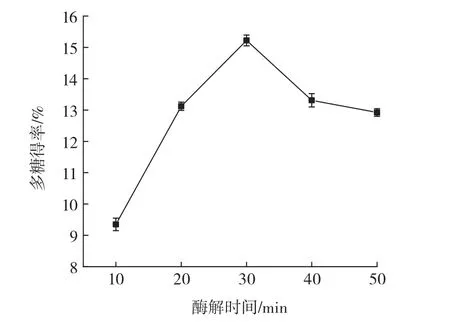
图1 酶解时间对多糖得率的影响Fig.1 Effect of enzymolysis time on the yield of polysaccharide
从图1中可以看出,油莎豆多糖得率随酶解时间的延长先升高后降低,在酶解30 min时,多糖得率达到最大值。原因可能是在酶的催化作用下,多糖从细胞内溶出,含量逐渐增加;但随酶解时间的延长,会导致酶的活性降低[22]。因此,选择酶解时间中心水平为30 min进行后续优化试验。
2.1.2 酶解温度对多糖得率的影响
酶解温度对油莎豆多糖得率的影响见图2。
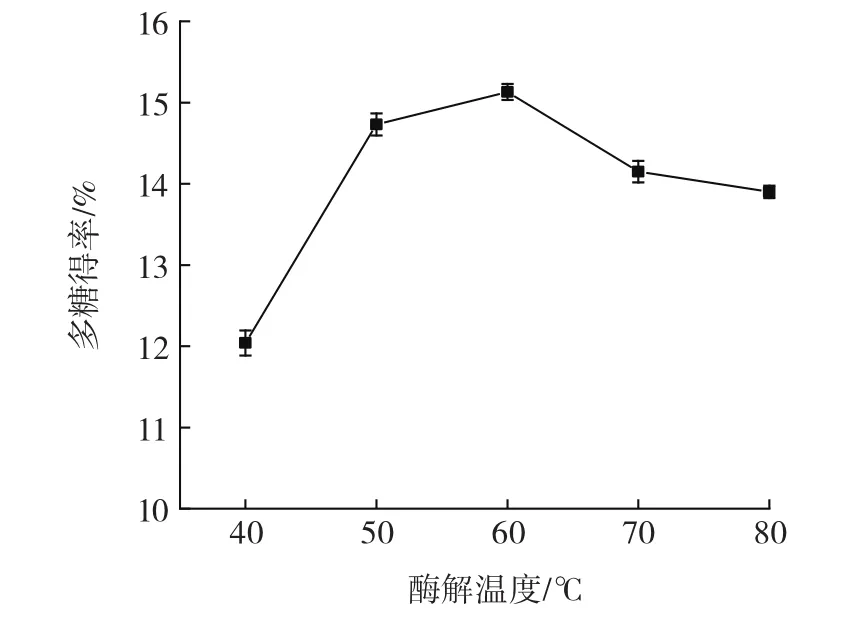
图2 酶解温度对多糖得率的影响Fig.2 Effect of enzymolysis temperature on the yield of polysaccharide
由图2可以看出,随酶解温度升高,油莎豆多糖得率呈先升高后降低的趋势,在酶解温度60℃时多糖得率达到最大值。低温时,酶解反应速率较慢且酶的活力低,温度过高会弱化酶的活性,活性物质亦可能会发生降解[23]。因此,选择酶解温度中心水平为60℃进行后续优化试验。
2.1.3 加酶量对多糖得率的影响
加酶量对油莎豆多糖得率的影响见图3。
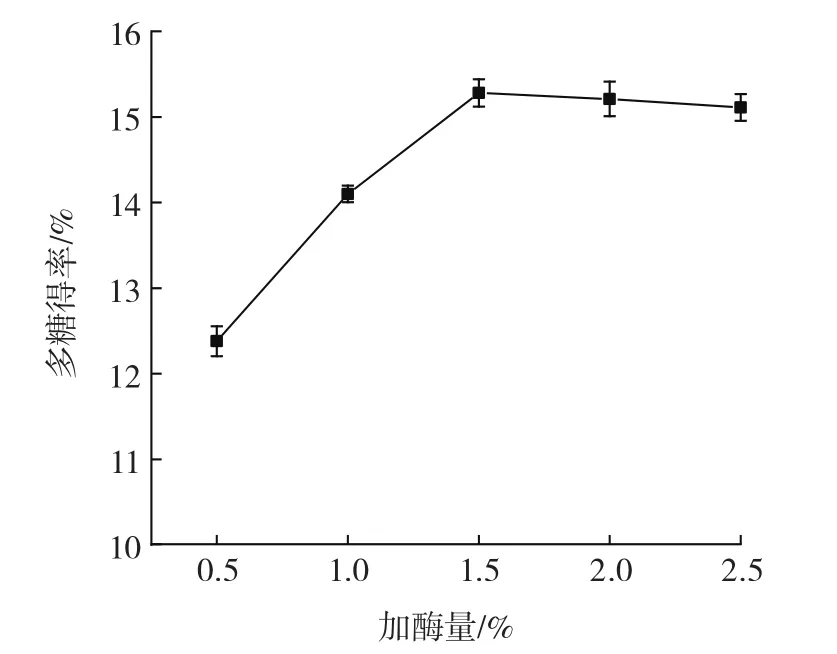
图3 加酶量对多糖得率的影响Fig.3 Effect of enzyme dosage on the yield of polysaccharide
从图3可以看出,随加酶量增大,多糖得率先升高后在加酶量1.5%时趋于平缓,原因是加酶量越多,酶与底物的结合率会变大,促进酶解反应的进行,使胞内多糖扩散到溶剂中,多糖得率上升;当加酶量大于1.5%后,趋势较为平缓,说明加酶量充足,反应已达饱和状态[24]。因此,选择加酶量中心水平为1.5%进行后续优化试验。
2.1.4 pH值对多糖得率的影响
pH值对油莎豆多糖得率的影响见图4。
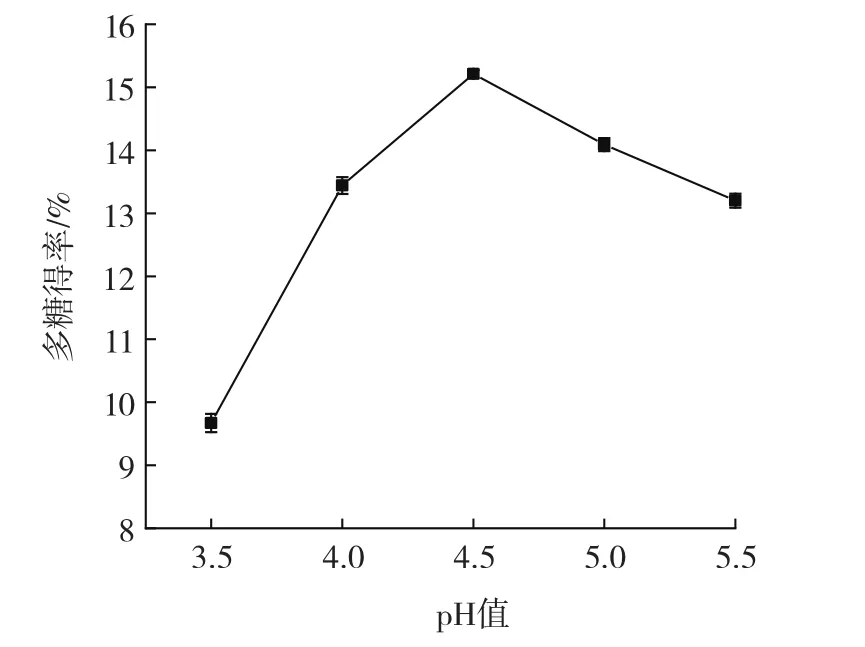
图4 pH值对多糖得率的影响Fig.4 Effect of pH value on the yield of polysaccharide
由图4可以看出,随着pH值的增大,多糖得率呈先上升后下降的趋势。pH值为4.5时得率达到峰值,之后随pH值增大,多糖得率逐渐减少。因为酶在一定pH值范围内发挥作用,超出此范围可能会使酶的催化效率降低,故多糖得率下降。因此,选择pH值中心水平为4.5进行后续优化试验。
2.2 响应面优化试验
2.2.1 响应面试验结果
响应面试验设计与结果见表2,方差分析见表3。

表2 响应面试验设计方案及结果Table 2 Design and results of the response surface optimization
运用Design-Expert8.0.6对表2的试验数据进行多元回归拟合分析,得到多糖得率(R)与酶解时间(A)、酶解温度(B)、加酶量(C)、pH 值(D)之间的二次多项回归方程为R=15.41+1.71A+0.73B+0.80C+0.18D-0.32AB-0.39AC-0.13AD-1.29BC+1.50BD+1.06CD-2.33A2-2.79B2-0.27C2-1.27D2。
根据表3可知,模型P<0.000 1,表明模型极显著。决定系数 R2为 0.931 0,R2Adj为 0.862 0,变异系数(C.V)为6.97%。精密度为13.201,大于4,说明该模型可以用来对试验结果进行拟合,可以用此模型说明各因素与响应值之间的关系。失拟项P值=0.170 9>0.05,失拟项不显著。 A、C、BD、A2、B2、D2的影响极显著(P<0.01),B、BC、CD 的影响显著(P<0.05)。
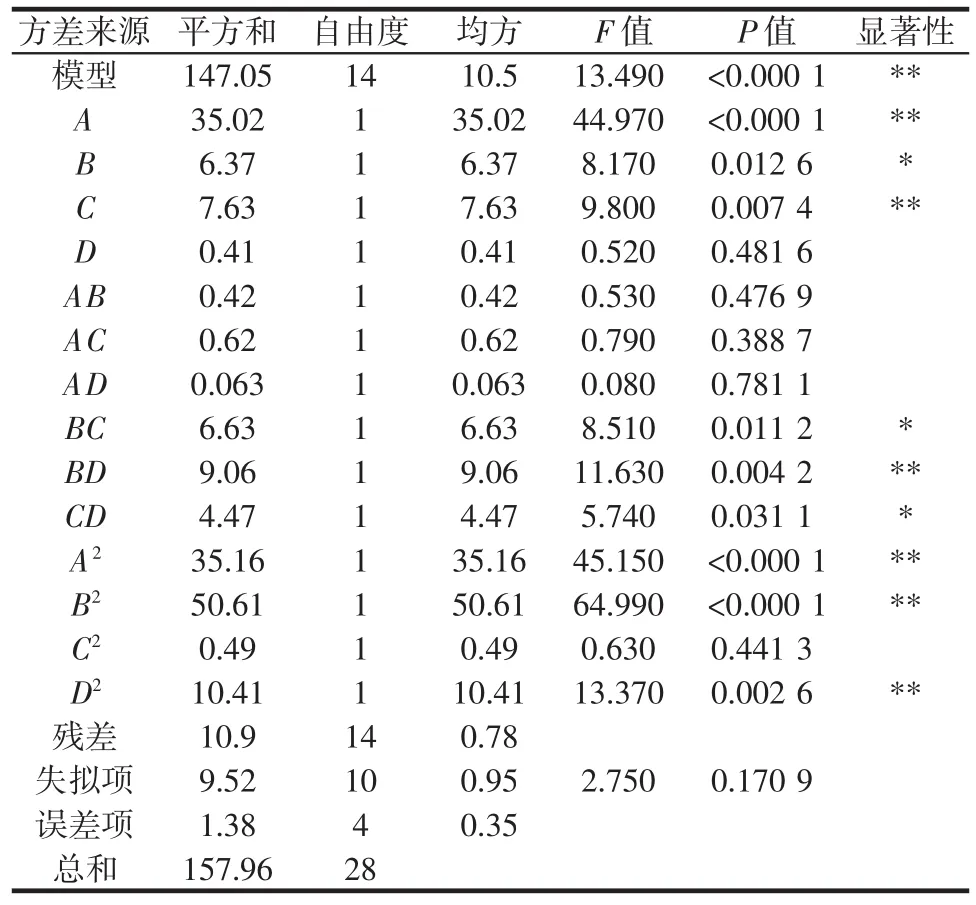
表3 回归方程方差分析Table 3 Analysis of variance of regression equation
2.2.2 响应面分析
各因素交互作用的响应面图见图5~图7。
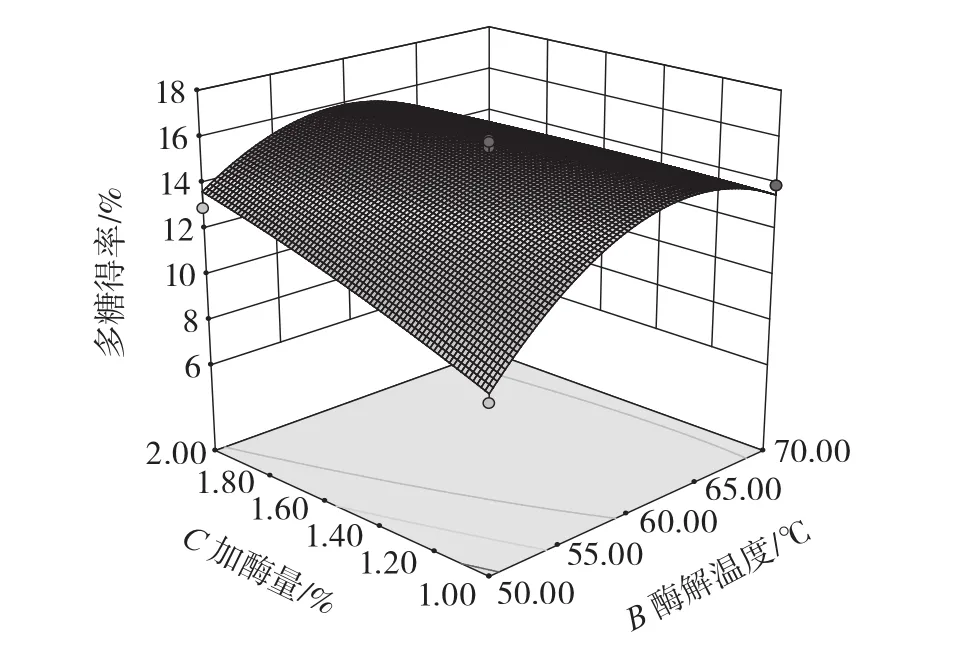
图5 酶解温度和加酶量的交互作用对多糖得率的影响Fig.5 Effect of interaction between enzymolysis temperature and enzyme dosage on polysaccharide yield
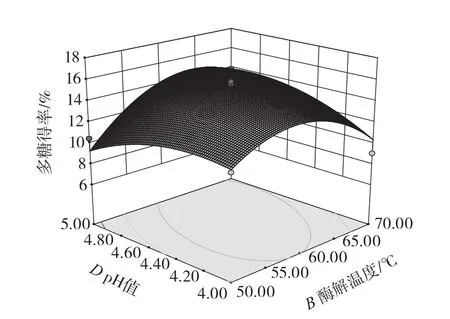
图6 酶解温度和pH值的交互作用对多糖得率的影响Fig.6 Effect of interaction between temperature and pH value on polysaccharide yield

图7 加酶量和pH值的交互作用对多糖得率的影响Fig.7 Effect of interaction between enzyme dosage and pH value on polysaccharide yield
从图5可以看出,当酶解温度不变时,随着加酶量的增大,油莎豆多糖得率呈先上升后下降的趋势;加酶量不变时,随酶解温度的升高,油莎豆多糖得率呈先上升后下降的趋势。从图6可以看出,当酶解温度不变时,随着pH值的提高,油莎豆多糖得率呈先上升后降低的趋势;当pH值不变时,随酶解温度的升高,油莎豆多糖得率呈先上升后下降的趋势。从图7可以看出,当加酶量不变时,随着pH值的提高,油莎豆多糖得率呈先上升后降低的趋势;当pH值不变时,随加酶量的升高,油莎豆多糖得率呈先上升后下降的趋势。由图5~图7可知,响应曲面坡度均较为陡峭,各因素之间的交互作用对多糖得率的影响显著,与方差分析结果一致。
2.2.3 验证试验
利用Design-Expert8.0.6软件,对提取工艺参数进行优化,得到油莎豆多糖最佳工艺为酶解时间33.87min、酶解温度60.39℃、加酶量1.7%、pH4.55,此时多糖得率预测值为15.98%。根据试验的实际可操作性,将工艺条件调整为酶解时间34 min、酶解温度61℃、加酶量1.7%、pH4.55,进行3次平行验证试验,实际得到多糖得率为15.86%,与预测值基本接近。
2.3 抗氧化能力结果分析
2.3.1 DPPH自由基清除能力
不同浓度油莎豆多糖和VC对DPPH自由基清除能力的对比见图8。
由图8可知,油莎豆多糖对DPPH自由基的清除能力较强。浓度为0.5 mg/mL~8.5 mg/mL时,油莎豆多糖对DPPH自由基的清除率与其浓度呈正相关,清除效果低于相同浓度条件下VC对DPPH自由基的清除能力。当浓度为8.5 mg/mL时,油莎豆多糖对DPPH自由基清除能力可达到VC对DPPH自由基清除能力的2/3左右[25],说明油莎豆多糖具有良好的清除DPPH自由基的能力。
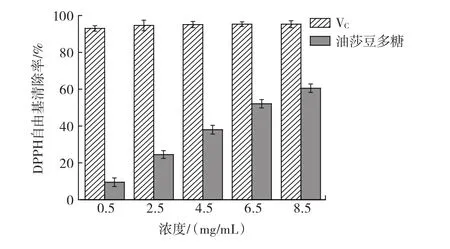
图8 油莎豆多糖和VC对DPPH自由基清除率Fig.8 DPPH radical scavenging activities of Cyperus esculentus polysaccharide and VC
2.3.2 羟自由基清除能力
不同浓度油莎豆多糖和VC对羟自由基清除能力的对比见图9。
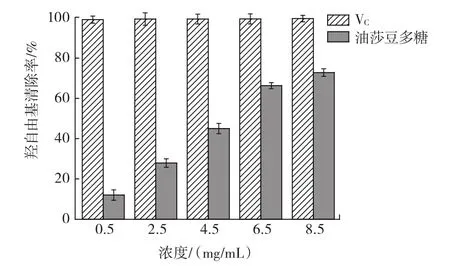
图9 油莎豆多糖和VC对羟自由基清除能力Fig.9 Hydroxyl radical scavenging activities of Cyperus esculentus polysaccharide and VC
由图9可知,浓度为0.5 mg/mL~8.5 mg/mL时,油莎豆多糖对羟自由基的清除率随浓度的增加而增大;当多糖浓度从0.5mg/mL增长到8.5mg/mL时,羟自由基的清除率从11.97%增长到72.82%,VC对羟自由基的清除率始终维持在极高水平。在浓度为8.5 mg/mL时,油莎豆多糖对羟自由基清除率达到VC对其清除率的50%以上,表明油莎豆多糖具备较强的清除羟自由基的能力。
3 结论
本研究采用纤维素酶法提取油莎豆中的多糖,利用响应面分析法进行优化,以多糖得率为指标,得到油莎豆多糖最优提取工艺参数为酶解时间34 min、酶解温度61℃、加酶量1.7%、pH4.55,此时多糖得率为15.86%。各因素对多糖得率影响的先后顺序为酶解时间>加酶量>酶解温度>pH值。通过测定油莎豆多糖清除DPPH自由基、羟自由基能力来评价其抗氧化性,油莎豆多糖的DPPH自由基和羟自由基清除率分别达到60.54%、72.82%,说明其具有较好的抗氧化性。选取作用条件温和的酶法提取多糖,可破坏细胞壁,并有效地保留油莎豆多糖活性,为油莎豆多糖资源的综合利用及多糖的活性、结构分析等提供依据。

