臭氧水处理对草鱼片贮藏过程中微生物群落结构的影响
徐国栋,安玥琦,2,熊善柏,2,尹涛,2,覃凤阳,陈萍,尤娟,2*
(1.华中农业大学食品科学技术学院,国家大宗淡水鱼加工技术研发分中心(武汉),湖北武汉 430070)(2.长江经济带大宗水生生物产业绿色发展教育部工程研究中心,湖北武汉 430070)
当前,居民饮食消费不断升级,新零售、新餐饮经济模式迅猛发展,我国预制调理食品行业处于快速增长阶段[1]。由于疫情期间“到家经济”的助推,消费者主动购买预制食品的意愿大幅提高,更进一步推动行业发展。我国水产资源丰富[2],将水产鱼类等经过简单预处理做成调理水产品,对于水产品行业发展具有重要的现实意义。但是由于大部分的调理水产品为半成品,采用传统的热处理使产品达到商业无菌要求,无法保证其感官与营养品质[3],且处理后常在低温下进行贮藏、销售以保持产品新鲜口感和质地,因此特别容易受到微生物污染[4],造成产品的腐败变质。这将给调理水产品的品质保持、质量安全、贮藏稳定性带来挑战。
臭氧是一种环境友好型的非热杀菌技术。臭氧及其分解产物(超氧自由基、羟基自由基等)氧化破坏微生物细胞膜组分(蛋白、呼吸酶、不饱和脂肪酸)、细胞壁(肽聚糖)、细胞质(酶、核酸)、孢子外壳和病毒衣壳,从而对各类微生物均具有杀灭作用[5],且适量的臭氧处理对产品的品质影响小[3],特别适用于调理水产品的杀菌保鲜。目前,臭氧水在水产品应用方面的研究主要集中在两个方面,一方面是研究臭氧水处理条件对水产品杀菌效果的影响,方敏等[6]研究臭氧水处理方式对鲫鱼体表杀菌效果的影响,结果显示臭氧水冲洗方式杀菌效果最好,其次是流水浸渍,静水浸渍最差。Silva等[7]研究臭氧水浓度和时间对罗非鱼减菌效果的影响,结果表明1.5 mg/L的臭氧水处理罗非鱼片15 min,减菌率达88.25%。臭氧对微生物灭活的同时,亦可能会造成蛋白变性[8]、脂肪氧化[9]等问题,因此另一个方面是研究臭氧水处理条件对产品品质的影响。张红杰等[10]研究臭氧水处理对罗非鱼片品质的影响,结果发现臭氧水处理提高了罗非鱼片亮度,改善了罗非鱼片的硬度和咀嚼性,但促进了贮藏过程中蛋白质的变性和脂肪氧化。Zhang等[11]研究臭氧水处理对鳙鱼中土腥素去除及理化品质的影响,结果发现臭氧水处理可有效去除鳙鱼中土腥素,提高盐溶性蛋白,Ca2+-ATPase酶活性,且对过氧化值、TBA值改变不大。调理食品不同于传统包装加工食品,在稳定贮藏环境下货架期是恒定的[12]。不同来源的水产品加工成的调理水产品会由于初始菌相不同,导致在贮藏期间微生物的消长以及品质变化存在差异,最终致使贮藏时货架期终点不一致,给调理水产品的贮藏销售带来困难。目前研究表明,臭氧水处理可显著降低食品中微生物的种类和数量,从而可能将不同来源水产品菌相变得相似。因此研究臭氧水处理对水产品菌相影响尤为重要,但是目前研究较少。
已有研究者采用传统分离鉴定技术[13]及PCR-DGGE技术[14]研究臭氧水处理对牡蛎、鳕鱼片菌群结构的影响,但是均未采用高通量测序技术对臭氧水处理水产品的微生物群落结构进行较全面研究。本文以草鱼片为研究对象,采用高通量测序技术研究臭氧水处理方式对草鱼片菌群结构的影响及臭氧水处理对冷藏草鱼片微生物菌群结构的影响,分析臭氧水处理对草鱼片细菌群落组成和多样性的影响。以期进一步探究臭氧抑菌保鲜的机理,推进臭氧杀菌技术在生鲜调理水产品行业的应用。
1 材料与方法
1.1 材料与试剂
鲜活草鱼(质量2.5~3 kg),购于菜市场,置于冰水中运至实验室;平板计数琼脂培养基,青岛海博生物技术有限公司;氢氧化钠、硼酸、氯化钠、甲基红、溴甲基绿均为分析纯,国药集团化学试剂有限公司;DNA抽提试剂盒(E.Z.N.A.® Soil DNA Kit型),美国Omega Bio-Tek公司;琼脂糖(biowest agArose型),西班牙 biowest公司;FastPfu Polymerase,中国TransGen公司;AxyPrep DNA Gel Extraction Kit,美国 Axygen公司;建库试剂盒(NEXTFLEX Rapid DNA-Seq Kit型),美国Bioo Scientific公司;测序试剂盒(MiSeq Reagent Kit v3/NovaSeq Reagent Kits),美国Illumina公司。
1.2 仪器与设备
AVANTI J-26XP型高速冷冻离心机,美国Beckman公司;IKA2000型高速分散均质机,德国IKA公司;FOSS kjeltec8400型自动凯氏定氮仪,丹麦FOSS公司。HD-1360型水平流超净工作台,哈尔滨市东联电子技术开发有限公司。GCQJ-1-3型电解式高浓度臭氧气机,武汉威蒙环保科技有限公司;SHP-350型生化培养箱,上海精宏实验设备有限公司;NanoDrop2000型超微量分光光度计,美国 Thermo Fisher Scientific公司;Quantus™型微型荧光仪,美国Promega公司;DYY-6C型电泳仪,北京市六一仪器厂;ABI GeneAmp®9700型PCR仪,美国ABI公司;Illumina Miseq型测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 样品处理
草鱼击头致死,去除鳞片和内脏,清水洗净后置于消毒过的案板上,用无菌刀取其背部两侧鱼肉去皮,用自来水冲洗30 s,转入超净工作台切成5 cm×5 cm×2 cm左右的鱼片。将鱼片随机分为3组,一组未做处理(CK组),另两组分别用0.85 mg/L[15]的臭氧水浸泡10 min(CYJP组)和冲淋10 min(CYCL组),各组处理后在超净工作台沥干水分装于无菌均质袋(每组分装9袋,每袋8个鱼片),随机取各组3袋鱼片(3个平行)进行各项指标的测定(每袋中三个鱼片用于感官评价,两个鱼片用于菌落总数测定,两个鱼片用于TVB-N的测定,一个鱼片-80 ℃冻藏用于高通量测序),其余置于25 ℃培养箱贮藏。每隔1 d随机取各组3袋鱼片进行指标的检测。取各组冻存腐败样品以及新鲜鱼肉样品进行基于细菌16S rRNA高通量测序。
按上述方法制作鱼片。混匀后将鱼片分成两组。一组用0.85 mg/L臭氧水冲淋10 min(A组),一组用清水冲淋10 min(B组)做对照,处理后在超净工作台沥干水分。将A组和B组鱼片分装于无菌均质袋中(A组60袋、B组60袋,每袋4个鱼片)。随机取A、B组草鱼片各36袋置于4 ℃恒温箱中贮藏,分别为4 ℃-A组、4 ℃-B组;取A、B组草鱼片各24袋置于10 ℃的恒温箱中贮藏,分别为10 ℃-A组、10 ℃-B组。每隔一天随机取出3袋(三个平行)进行感官评价(每袋三片鱼片用于感官评价,一片鱼片冻藏用于高通量测序)取臭氧处理后达到感官拒绝点的草鱼片进行基于细菌16S rRNA的高通量测序,4 ℃贮藏两组腐败草鱼片分别为4-9-A、4-9-B组,10 ℃贮藏两组腐败草鱼片分别为10-5-A组、10-5-B组。
1.3.2 感官评价
参考GB 2733-2015《食品安全国家标准鲜、冻动物性水产品》并结合黄渊等[16]的方法对草鱼片进行感官评价,评定小组由15名食品科学专业硕士生组成,分别从色泽、气味、肌肉形态、肌肉弹性4个方面进行打分,每项总分均为5分,以3分作为可接受度临界值。评分标准见表1,感官总分=色泽得分+气味得分+肌肉形态得分+肌肉弹性得分。感官总分低于 12分时表明样品不可接受。

表1 草鱼片感官评分标准Table 1 Sensory evaluation standard of grass carp slices
1.3.3 总挥发性盐基氮的测定
参照GB 5009.228-2016《食品安全国家标准食品中挥发性盐基氮的测定》[17]自动凯氏定氮仪法测定样品TVB-N含量。称取打碎的鱼肉样品10 g于蒸馏管内,加入75 mL水,振摇,使试样在样液中分散均匀,浸渍30 min后加入1 g氧化酶和2 mL消泡剂,立刻连接到蒸馏器上,按照仪器设定的条件(标准滴定酸浓度0.10 mol/L;加碱、加水体积为0 mL;硼酸+指示剂接收液30 mL;蒸馏时间180 s)和仪器操作说明书开始测定。
1.3.4 菌落总数的测定
参照GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》[18]进行菌落总数测定。无菌条件下取鱼肉样品 25 g于无菌均质袋中,加入225 mL无菌生理盐水,用拍击式均质器拍打1 min,制成1:10的样品匀液,取制得的拍打上清液(1 mL)用生理盐水连续10倍梯度稀释,选择3个适当的稀释度,将稀释液(1 mL)转移到培养皿中,每个稀释度做 2个平皿。然后及时将冷却至适宜温度的平板计数培养基(灭菌后,放置于(46±1)℃水浴中保温)注入培养皿,约15 mL,并转动培养皿混合均匀,同时培养基倾入加有1 mL稀释液灭茵培养皿内作空白对照。待琼脂凝固后,倒置平板,在 30 ℃温箱内培养(72±3)h。选取菌落数在30 CFU~300 CFU之间、无蔓延菌落生长的平板计数。
1.3.5 高通量测序
1.3.5.1 DNA抽提和PCR扩增
根据 E.Z.N.A.® soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)说明书进行微生物群落总DNA抽提,使用m=1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop 2000测定DNA浓度和纯度;使用 338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和 806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3-V4可变区进行PCR扩增,扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火 30 s,72 ℃延伸 30 s),然后 72 ℃稳定延伸10 min,最后在4 ℃进行保存。PCR反应体系为:5×TransStart FastPfu缓冲液 4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfuDNA 聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。每个样本3个重复。
1.3.5.2 Illumina Miseq测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用 PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序。
1.3.6 数据处理
理化部分实验数据采用IBM SPSS 22.0进行处理,采用OriginLab Origin 9.0进行作图,实验结果显示为平均值±SD,显著性差异采用Duncan模型进行比较检验分析。高通量测序部分实验使用fastp(https://github.com/ OpenGene/fastp, version 0.20.0)软件对原始测序序列进行质控;使用FLASH(http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件进行拼接;使用UPARSE 软件(http://drive5.com/uparse/,version 7.1),根据97%[19,20]的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v138),设置比对阈值为70%。
2 结果与讨论
2.1 臭氧水处理方式对草鱼片微生物菌群结构的影响
2.1.1 货架期终点的判定
图1显示的是不同臭氧水处理方式对常温贮藏草鱼片品质的影响。由图1a、1b、1c可以看出,3组草鱼片在第0天,感官得分、TVB-N值均无显著性差异(p>0.05),但 CYJP组、CYCL组草鱼片菌落总数显著低于对照组。贮藏1 d后,各处理组菌落总数均超出食品微生物规范国际委员会[21]规定的限量值7.00 lg CFU/g,但此时CYCL、CYJP组草鱼片感官得分仍显著高于CK组草鱼片(p<0.05),TVB-N值显著低于 CK组草鱼片(p<0.05),微生物指标与感官指标、化学指标之间存在差异的主要原因是鱼肉中部分微生物没有或者仅具有较小的致腐能力[22],因此尽管鱼肉微生物数量达到7.0 lg CFU/g,但其感官品质仍可接受,TVB-N值仍未超标。并且此时CK组草鱼片出现明显的腥臭味,感官上已无法接受,且 TVB-N值达到20.48 mg/100 g,超出我国GB 2733-2015《食品安全国家标准鲜、冻动物性水产品》规定的限值(20 mg/100 g)。贮藏2 d后,虽然CYCL组草鱼片感官得分仍显著高于其它两组(p<0.05),TVB-N值显著低于其它两组(p<0.05),但此时各处理组草鱼片均肌肉组织松散,色泽暗淡,有强烈的腥臭味,且草鱼片 TVB-N值皆超出国标规定的限值,均已腐败。综合各处理组感官得分、TVB-N值的变化以及菌落总数变化,结果表明常温贮藏1 d后3组处理草鱼片均已到达货架期终点。
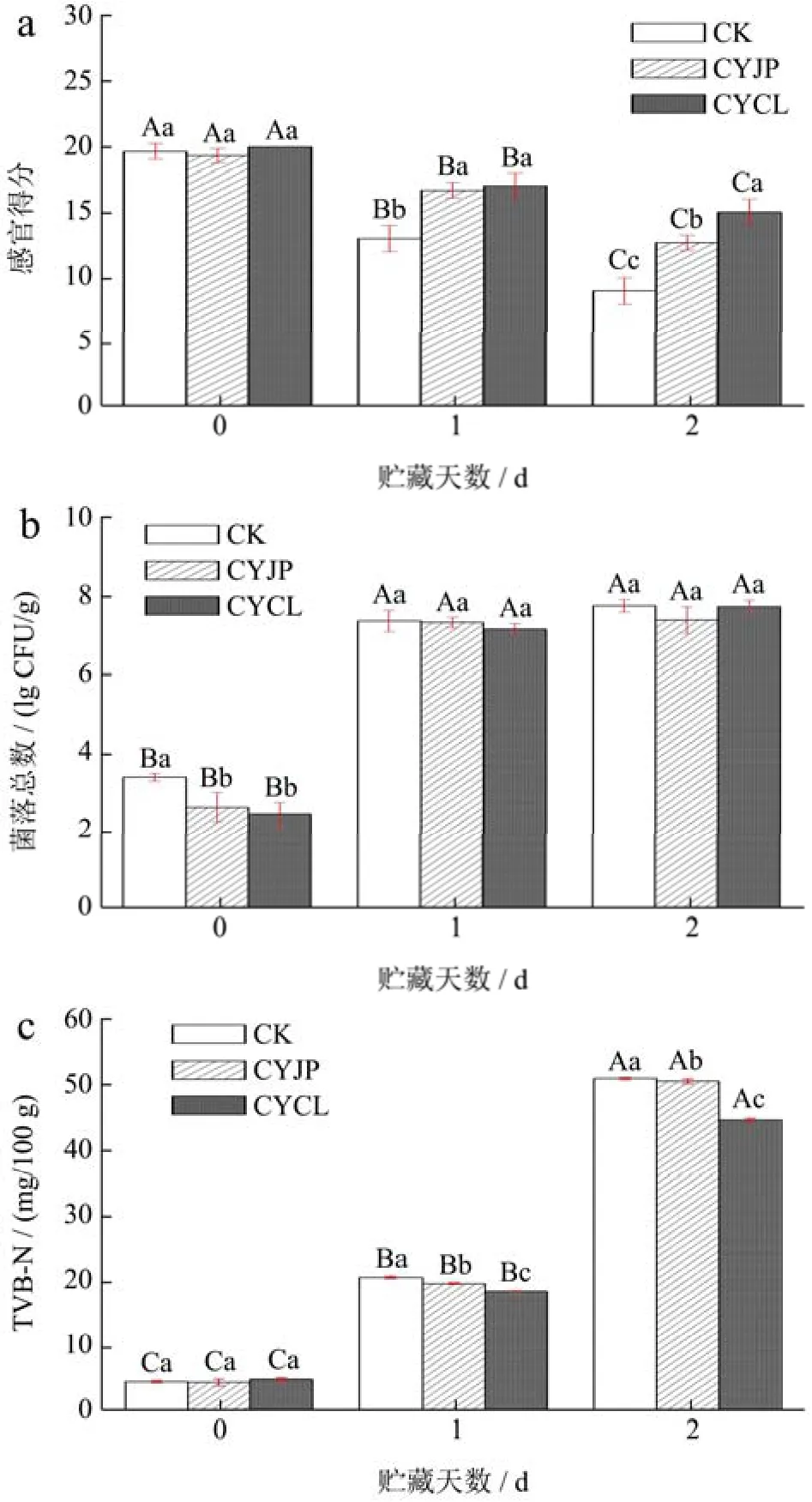
图1 臭氧水处理方式对常温贮藏草鱼片品质的影响Fig.1 Effect of ozonated water treatment methods on the quality of grass carp slices stored at room temperature
2.1.2 菌群多样性分析
用于测序的4组样品共获得优化序列182 930,平均序列长度449 bp。Coverage指数是样品的测序深度也表明测序对样品的覆盖率。4组样品的Coverage值均在0.99以上,表明样品达到足够的测序深度,且序列未被检测到的可能性较低,用于后续的分析结果可信。α多样性指数包括 Shannon、Simpson、Chao1、ACE指数。其中Shannon指数越大表明样品的群落多样性越高,Simpson指数越大,表明群落多样性越低,ACE、Chao1指数越大表明样品的群落物种丰富度越高。各处理组α多样性指数值的大小由表2所示。综合各α指数值大小可知,对照组新鲜草鱼片微生物群落多样性高于各组腐败草鱼片微生物群落多样性,CYCL组、CYJP组腐败草鱼片群落多样性低于CK组腐败草鱼片微生物群落多样性。这可能是由于鱼类在贮藏至腐败过程中,不同菌种之间相互竞争,初始丰度较低的菌种以及竞争能力弱的菌种逐渐消亡,优势菌群最终占据主导地位,致使腐败鱼类的菌群多样性减少[23]。而草鱼片经臭氧处理后,不耐受臭氧的微生物均被杀死,腐败菌相是臭氧以及贮藏条件共同选择的结果,因而菌群构成更简单,多样性降低。
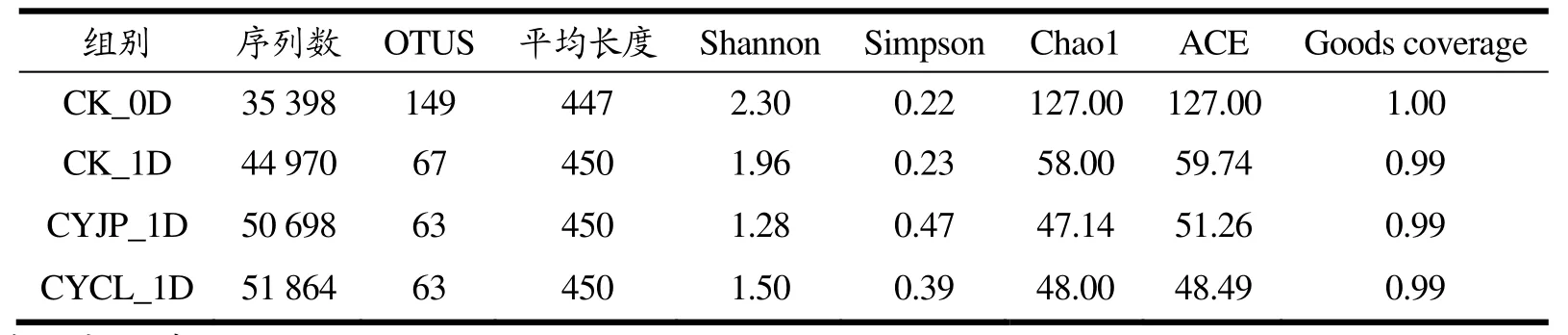
表2 不同处理组草鱼片的测序信息及α多样性指数Table 2 Sequencing information and alpha diversity index of grass carp fillets in different treatment groups
2.1.3 菌群构成分析
图2显示的是门水平(a)和科水平(b)上的不同处理组草鱼片细菌相对丰度,统计分析时将相对丰度<1%的物种归为others。由图2a可知,与CK组腐败草鱼片相比,CYCL、CYJP组腐败草鱼片中厚壁菌门(Firmicutes)的相对丰度增大,其它菌门均减少,表明臭氧水处理抑制了常温贮藏草鱼片中除厚壁菌门外其它菌门的生长繁殖。由图2b可知,CK组新鲜草鱼片菌群主要由葡萄球菌科(Staphylococcaceae)、莫拉氏菌科(Moraxellaceae)、链球菌科(Streptococcaceae)等微生物构成。Zhang等[24]在新鲜草鱼片中发现莫拉氏菌科、链球菌科是其主要细菌科,蓝蔚青等[25]在鲳鱼中发现葡萄球菌科微生物是新鲜鲳鱼块的主要优势菌。与CK_1D组腐败草鱼片相比,CYJP组、CYCL组腐败草鱼片菌群构成中葡萄球菌科、莫拉氏菌科和链球菌科的微生物相对丰度大于 90%,占有绝对优势,其它类菌群占比少,这与上述菌群α多样性分析结果一致,即臭氧水处理降低草鱼片菌群多样性,并且臭氧水处理组中链球菌科、气单胞菌科微生物相对丰度下降明显,表明臭氧水处理可以有效抑制常温贮藏草鱼片中链球菌科、气单胞菌科微生物的生长繁殖。顾卫瑞[26]采用传统分离鉴定方法,发现臭氧可以有效杀灭气单胞菌属(Aeromonas)的细菌。张清平等[27]在流动杀菌实验中发现臭氧水对粪链球菌的杀菌率在 99.99%。
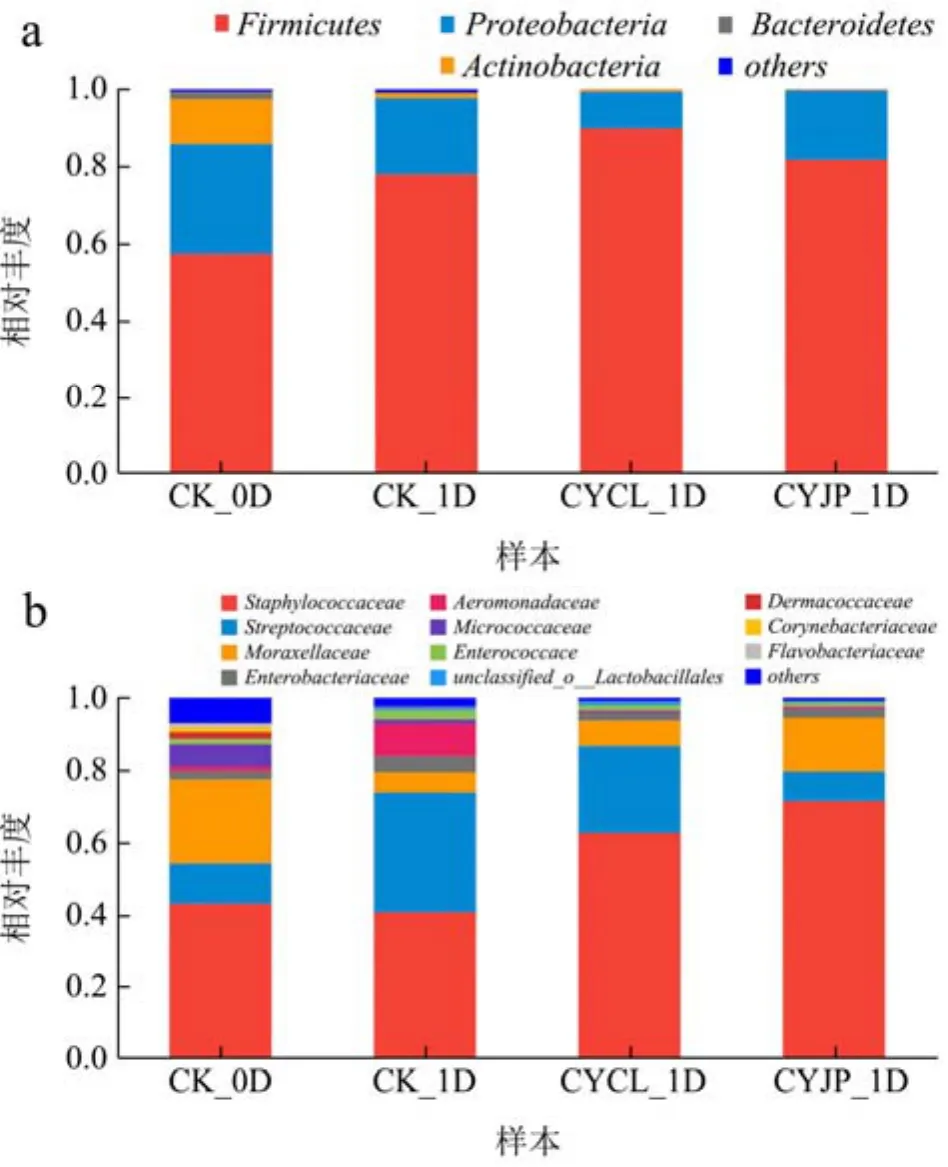
图2 门水平(a)和科水平(b)上的草鱼片细菌相对丰度分析Fig.2 Analysis of relative abundance of bacteria in grass carp fillets at the phylum level (a) and family level (b)
2.1.4 菌群构成差异分析
图3是不同处理组草鱼片在分类学属水平上相对丰度排名前50的物种组成热图。群落热图可将高丰度和低丰度菌群分块展示,通过颜色变化来反映不同分组在各分类学水平上群落组成的相似性和差异性。横向聚类上两样本越近,表示两样本中各物种变化趋势越相似。从相对丰度来看,CK_0D组新鲜草鱼片各类菌属在热图中颜色的对比没有各组腐败草鱼片中各类菌属颜色对比明显,说明新鲜草鱼片的微生物群落构成更加均匀。从横向聚类来看,CYJP组和CYCL组腐败草鱼片微生物群落组成相似度高于其它各组,表明草鱼片经臭氧处理后,菌群结构相似性提高。吴永祥等[28]采用超高压技术处理臭鳜鱼,结果发现超高压处理对臭鳜鱼的菌相组成影响显著,其能使微生物组成类型明显减少,漫游球菌属(Vagococcus)和冷杆菌属(Psychrobacter)为超高压处理后的优势腐败菌。这说明贮藏前采用非热杀菌技术对不同来源的水产品进行处理,有可能将水产品的初始菌相变得简单,以控制不同来源的水产品加工成的调理水产食品的贮藏稳定性。
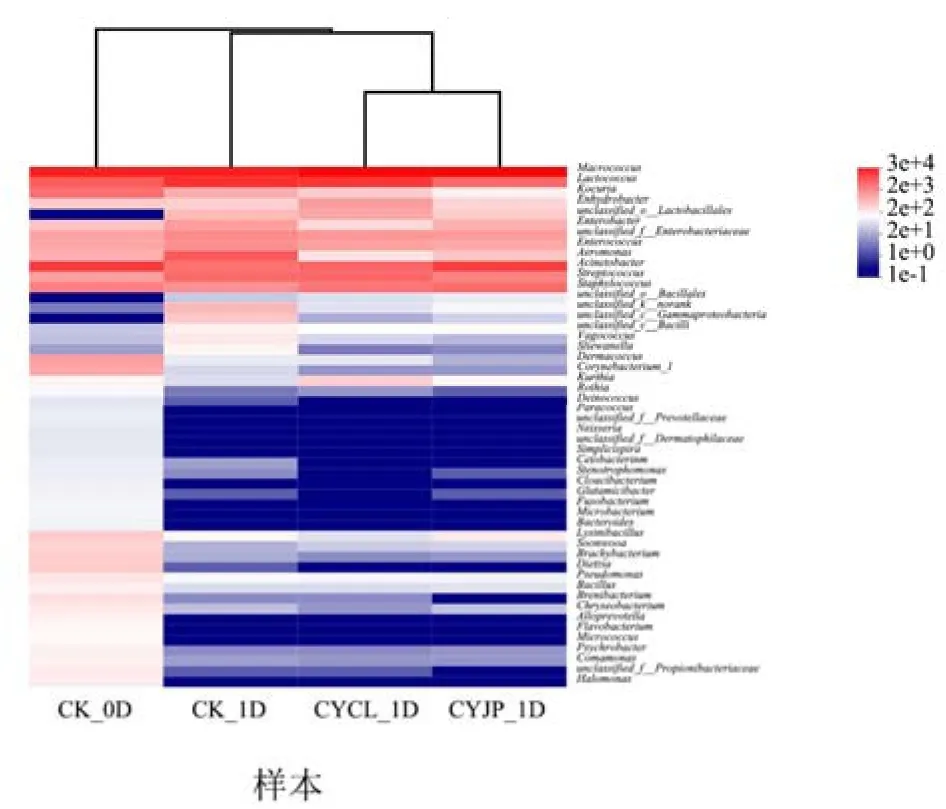
图3 属水平上草鱼片的细菌物种组成热图Fig.3 Heat map of bacterial species composition of grass carp fillets at the genus level
为进一步比较分析臭氧浸泡处理和臭氧冲淋处理草鱼片微生物菌群结构的差异,对CYJP组和CYCL组腐败草鱼片中细菌相对丰度排名前十的菌属进行显著性检验。由图4可知,CYJP组、CYCL组腐败草鱼片在相对丰度排名前十的菌属中均存在显著性差异。特别是在主要的优势菌群葡萄球菌属、乳球菌属、不动杆菌属的相对丰度上。表明臭氧水冲淋、浸泡处理对草鱼片菌群结构影响不同。这可能是由于臭氧作用过程易分解,臭氧水冲淋处理可连续提供新鲜臭氧且起到冲洗减菌作用,而与臭氧水浸泡处理具有不同的杀菌效果,方敏等[6]研究臭氧水处理方式对鲫鱼体表杀菌效果的影响,结果显示臭氧水冲洗方式杀菌效果最好,其次是流水浸渍。Chawla等[29]研究喷雾处理和浸泡处理对去皮虾肉的影响,结果发现对其具有不同的杀菌效果。
臭氧水冲淋处理草鱼片可达到更高的减菌率,且对草鱼片感官品质的保持效果好。不同的臭氧水处理方式对草鱼片菌群结构具有显著差异,这种差异可能会对草鱼片后续品质保持、贮藏稳定性有很大的影响。通过分析不同臭氧处理方式对贮藏草鱼片品质及菌相的影响,明确后续采用臭氧水冲淋处理草鱼片,研究臭氧水处理对冷藏草鱼片腐败菌相的影响。
2.2 臭氧水处理对冷藏草鱼片微生物菌群结构的影响
2.2.1 腐败终点的判定4天,感官得分降低到12分以下,到达感官拒绝点。综上,臭氧水处理后草鱼片4 ℃下贮藏,可延缓感官品质劣变3 d。臭氧水处理后草鱼片10 ℃下贮藏,可延缓感官品质劣变1 d。已有研究者应用臭氧水对罗非鱼[31]和鳕鱼[32]进行处理,均发现可有效延缓品质劣变,延长货架期。
Gram 等[30]指出虽然微生物在食品腐败过程中发挥重要作用,但食品腐败(即货架期终点)的界定主要取决于感官评价。不同处理组草鱼片在冷藏时引起感官品质的变化如图5所示。由图5可以看出,随着冷藏时间的延长,臭氧水未处理组和臭氧水处理组的草鱼片感官品质均不断下降,但臭氧水处理组(A组)品质下降速度明显慢于臭氧水未处理组(B组),表明臭氧水处理可以有效延缓草鱼片感官品质的下降。4 ℃、10 ℃下贮藏的各处理组草鱼片在第0天感官得分均无显著性差异(p<0.05)。4 ℃下贮藏的A组和B组草鱼片在第 3天感官品质出现显著性差异(p<0.05),且分别在贮藏的第9天和第6天感官得分降低到12分以下,感官上已不可接受。10 ℃下贮藏的两组草鱼片,A组在贮藏第5天,B组在贮藏第
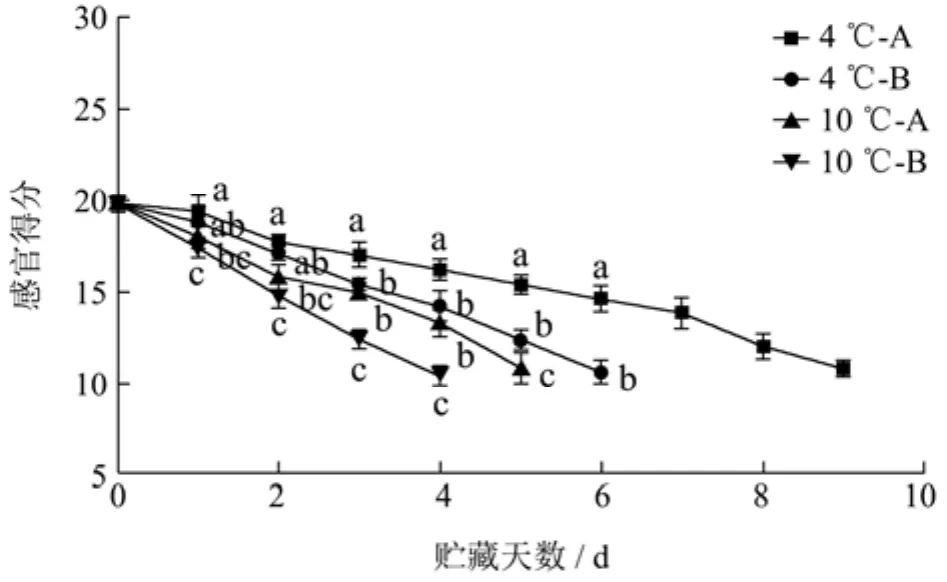
图5 臭氧水处理对冷藏草鱼片感官得分的影响Fig.5 Effect of ozonated water treatment on sensory scores of grass carp fillets during cold storage
2.2.2 菌群多样性分析
表3是在Illumina Miseq™平台上进行高通量测序的4组样品的测序信息及α多样性指数。4组样品共获得质控后序列162 166,平均序列长度427 bp。在97%的序列相似度下,共获得1067个OTU。4组样品的Coverage指数值均在0.99以上,可用于后续分析。由表3可知,4 ℃、10 ℃下贮藏臭氧处理组腐败草鱼片Shannon指数均低于4 ℃、10 ℃下贮藏臭氧未处理组腐败草鱼片,Simpson指数大于4 ℃、10 ℃下贮藏臭氧未处理组腐败草鱼片,ACE、Chao1指数均大于4 ℃下和10 ℃下贮藏臭氧未处理组腐败草鱼片。综合α多样性分析结果,臭氧水处理降低草鱼片微生物群落多样性,而又保持其微生物群落物种丰富度,使冷藏草鱼片中微生物群落结构变得具有高丰富度而低均匀性。
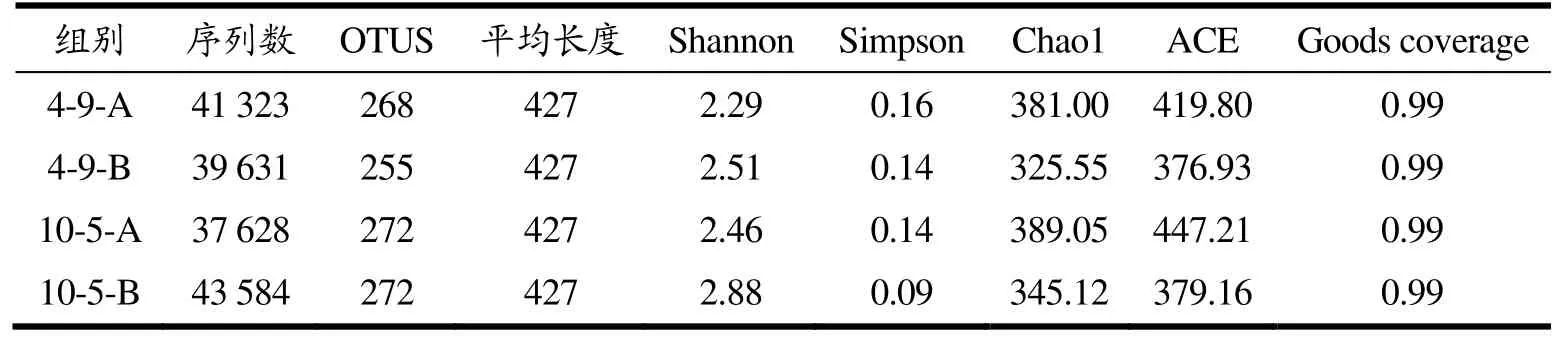
表3 草鱼片的测序信息及α多样性指数Table 3 Sequencing information and application of grass carp fillets with different treatments α diversity index
2.2.3 菌群构成分析
图6显示的是门水平(a)和科水平(b)上的不同处理组草鱼片细菌相对丰度。由图6a可知,4 ℃、10 ℃下贮藏臭氧处理组草鱼片与臭氧未处理组草鱼片相比,拟杆菌门、放线菌门相对丰度下降,表明臭氧水处理抑制了冷藏草鱼片中拟杆菌门、放线菌门的生长繁殖。由图6b可知。4 ℃、10 ℃下贮藏臭氧处理组和未处理组腐败草鱼片科水平上的菌群均主要由肠杆菌科(Enterobacteriaceae)、假单胞菌科(Pseudomonadaceae)、链球菌科、李斯特菌科(Listeriaceae)、莫拉氏菌科微生物构成,但两组草鱼片在主要菌群的相对丰度上存在较大差异。臭氧水处理对莫拉氏菌科微生物生长的抑制效果最为显著,在4 ℃下贮藏臭氧处理后腐败草鱼片莫拉氏菌科微生物相对丰度从12.81%下降到3.54%,在10 ℃下贮藏臭氧处理后腐败草鱼片莫拉氏菌科微生物相对丰度从29.88%下降到8.19%。
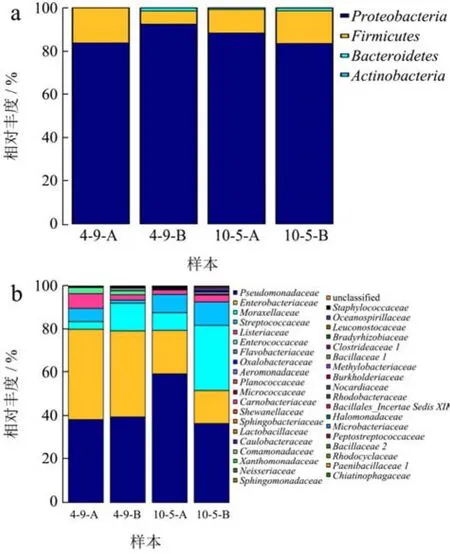
图6 门水平(a)和科水平(b)上的草鱼片细菌相对丰度分析Fig.6 Analysis of relative abundance of bacteria in grass carp fillets at the phylum level (a) and family level (b)
2.2.4 菌群构成差异分析
图7是不同处理组草鱼片在分类学属水平上相对丰度排名前50的物种组成热图。从热图横向聚类来看,不同冷藏温度下贮藏的臭氧处理组与未处理组腐败草鱼片群落结构更相似,表明相比于臭氧水处理对草鱼片菌群结构的改变,后续贮藏条件的改变对菌群结构的影响更大。4 ℃、10 ℃下贮藏各组腐败草鱼片中主要优势菌为假单胞菌属(Pseudomonas)、沙雷氏菌属(Serratia)、不动杆菌属、乳球菌属、环丝菌属(Brochothrix)、布丘氏菌属(Buttiauxella)。假单胞属属于假单胞菌科(Pseudomonadaceae),已有大量研究结果表明耐冷的假单胞菌属微生物是冷藏水产品常见的特定腐败菌[33],布丘氏菌属、沙雷氏菌属属于肠杆菌科,生活在受污染水域的水产品中肠杆菌科微生物检出率高[34],沙雷氏菌属是肉产品的常见腐败菌,多次在肉制品中被检测到[35]。乳球菌属属于链球菌科,不动杆菌属属于莫拉氏菌科,环丝菌属属于李斯特菌科,皆是水产品中常见的微生物。

图7 草鱼片属水平上的微生物群落组成热图Fig.7 Heat map of microbial community composition at the level of grass carp
为进一步比较不同冷藏温度下臭氧处理组和未处理组腐败草鱼片微生物菌群结构的差异,对4 ℃、10 ℃下贮藏臭氧处理组和未处理组腐败草鱼片中相对丰度排名前 25的菌属进行显著性检验。结果如图8a和图8b所示,图中标红的菌种表示在两组中具有显著性差异(p<0.05)。由图8a可知,4 ℃贮藏臭氧处理组和未处理组腐败草鱼片在相对丰度占比前 25的菌属中,22个在相对丰度上存在显著性差异。臭氧处理后4 ℃贮藏至腐败草鱼片中不动杆菌属、沙雷氏菌属等微生物显著减少,布丘氏菌属、乳球菌属、环丝菌属等微生物显著增加。由图8b可知,10 ℃贮藏臭氧处理组和未处理组腐败草鱼片在相对丰度占比前 25的菌种中,24个存在显著性差异,臭氧处理后10 ℃贮藏至腐败草鱼片中不动杆菌属显著减少(p<0.05),沙雷氏菌属、假单胞菌属显著等微生物显著增加。表明臭氧处理显著改变了贮藏草鱼片的微生物群落结构,特别对相对丰度高的优势菌群影响更显著。
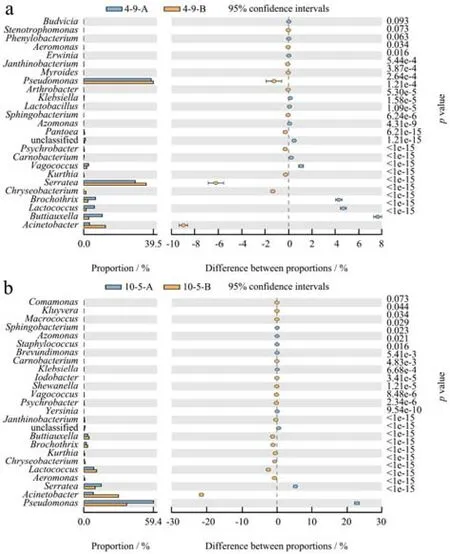
图8 冷藏草鱼片属水平的菌群差异的显著性检验Fig.8 Significant test of the difference of the bacterial community at the level of genus of chilled grass carp
3 结论
臭氧水冲淋处理草鱼片可达到更高的减菌率,且对草鱼片感官品质的保持效果好。臭氧水冲淋处理、臭氧水浸泡处理均会改变草鱼片菌群结构,降低草鱼片菌群多样性,常温下可有效抑制链球菌科、气单胞菌科微生物生长繁殖。但不同的臭氧水处理方式对草鱼片微生物菌群结构具有显著性差异,特别是在相对丰度高的优势菌葡萄球菌属、乳球菌属、不动杆菌属相对丰度方面差异更显著。草鱼片经臭氧水冲淋处理后在4 ℃、10 ℃下冷藏感官品质的劣变均显著减缓,且在门、科、属水平上均可抑制部分相同微生物的生长繁殖,特别是不动杆菌属微生物;但不同冷藏温度仍会导致菌群结构差异显著。臭氧水处理对草鱼片微生物菌群结构的影响研究可为臭氧杀菌技术在生鲜调理水产品行业的应用奠定基础。

