MicroRNA在糖尿病性骨质疏松症中作用的研究进展
杨孟迪,丁雨露,王玉洁,何风英,孙琳楠,甄东户
1.兰州大学 第一临床医学院 内分泌科, 甘肃 兰州 730000; 2.兰州大学第一医院 内分泌科,甘肃 兰州 730000
糖尿病性骨质疏松症(diabetic osteoporosis,DOP)是在糖尿病基础上形成的以骨量减少、骨的微细结构破坏、脆性增加为特点,进而容易发生骨折的一种代谢性骨病。其中高糖抑制骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)的成骨分化,促进成脂分化,是导致DOP患者骨形成减少、骨稳态破坏的重要原因[1]。Wnt/β-catenin信号通路是决定BM-MSCs命运的关键信号通路[2]。在高糖(high glucose, HG)环境下BM-MSCs的成骨潜能会因该信号通路的抑制而受损,微小RNA(microRNA,miRNA)作为当前研究最热表观遗传学调控因子,在这个过程中起着至关重要的作用,决定了该信号通路下游的基因在细胞中的表达[3]。本文主要以Wnt/β-catenin信号通路为轴心, 对HG环境中异常表达的 miRNA在调控BM-MSCs成骨分化过程中的具体作用途径进行综述。
1 miRNA概述
miRNA是一类长度约21~25个核苷酸的单链非编码小RNA。前体miRNA在细胞核经过处理后转运到细胞质,并在细胞质中被核酸内切酶加工为成熟的miRNA,后者通过结合argonaute蛋白形成miRNA诱导沉默复合体,与信使RNA的3′非翻译区互补结合,控制信使RNA的翻译或降解,在转录后水平调节基因的表达[4]。
2 经典Wnt/β-catenin信号通路与成骨分化
Wnt/β-catenin信号通路是调控BM-MSCs成骨细胞分化的经典路径。Wnt蛋白与跨膜受体卷曲蛋白(frizzled, Frz)和低密度脂蛋白受体相关蛋白(low density lipoprotein receptor-related protein 5 and 6,LRP5/6)结合后,活化细胞质内支架蛋白(disheveled,DVL),使得轴蛋白(axis inhibitor, Axin)-结直肠腺瘤性息肉蛋白(adenomatous polyposis coli, APC)-糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)所形成的降解复合物解离,稳定β-连环蛋白(β-catenin)。后者在胞质内不断积累,随后转入细胞核激活Wnt相关靶基因的表达,如:成骨分化特异性转录因子(Runt-related transcription factor 2,RUNX2),达到促进成骨分化的目的[5]。
3 异常表达miRNAs调控Wnt信号通路导致DOP
Wnt/β-catenin信号通路中许多蛋白表达水平均可影响BM-MSCs向成骨细胞分化的过程。β-catenin被视为经典Wnt/β-catenin信号通路的核心,其上下游乃至本身都可受到miRNA的调控。下面将从miRNA对β-catenin上游信号、β-catenin本身、其他通路信号因子与该通路的串扰、RUNX2表达的影响来分别阐述miRNA在DOP发生中的作用(图1)。
3.1 异常表达miRNA作用于β-catenin调控成骨分化
首先,转录阻抑物锌指E-box结合同源异型盒2(zinc finger E-box binding homeobox-2,ZEB2)位于β-catenin上游,可以通过调节E-钙黏蛋白增加胞质β-catenin的表达。HG通过上调靶向ZEB2的miR-493-5p,抑制Wnt/β-catenin途径进一步阻止人BM-MSCs的成骨分化,最终导致DOP[6]。DDX17(DEAD-box protein17,DDX17)属于RNA解旋酶家族,可以增强β-catenin靶基因的转录。miR-9-5p的下调改善了HG条件下BM-MSCs的体外成骨分化,并通过靶向DDX17缓解了体内大鼠的DOP状况[7]。其次,miRNA也通过靶向Wnt信号拮抗剂影响该通路。HG降低了MC3T3-E1成骨细胞中miR-295的表达, 从而上调了Dickkopf-1(DKK1)的蛋白表达水平。DKK1可通过结合LRP6, 促使胞质β-catenin降解,抑制Wnt /β-catenin途径[8]。GSK-3β是又一个经典Wnt信号通路的抑制剂,一方面,GSK-3β受胰岛素样生长因子-1(insulin-like growth factors1,IGF-1)调控,另一方面,活化的GSK-3β导致胰岛素受体底物(insulin receptor substrate, IRS)降解,导致β-catenin上游组分DVL-2的稳定性降低,促使β-catenin降解[9]。在HG处理的大鼠BM-MSCs中,miR-124-3p的抑制使得Wnt通路中的GSK-3β上调,加强了HG对β-catenin的表达的抑制,促使β-catenin降解,从而使糖尿病大鼠BM-MSCs成骨分化受阻,引起DOP的发生[10]。而miR-29c-3p通过有针对性地调节DVL2表达来减少DOP大鼠的骨质流失[11]。动物实验表明,miR-26a通过阻止糖尿病小鼠体内DKK1的上调以及抑制GSK-3β的表达,促进成骨细胞的分化和骨形成[12]。再者,一些miRNA通过作用于β-catenin本身,从而影响成骨分化。HG随着时间和剂量的增加显著上调骨髓间充质干细胞miR-214-3p的表达。后者通过直接与β-catenin的3′-UTR结合而降低了β-catenin的mRNA和蛋白水平,抑制了Wnt/β-catenin途径,从而抑制成骨细胞分化[13](表1)。上述研究表明干预β-catenin的表达可为控制DOP提供新的思路。
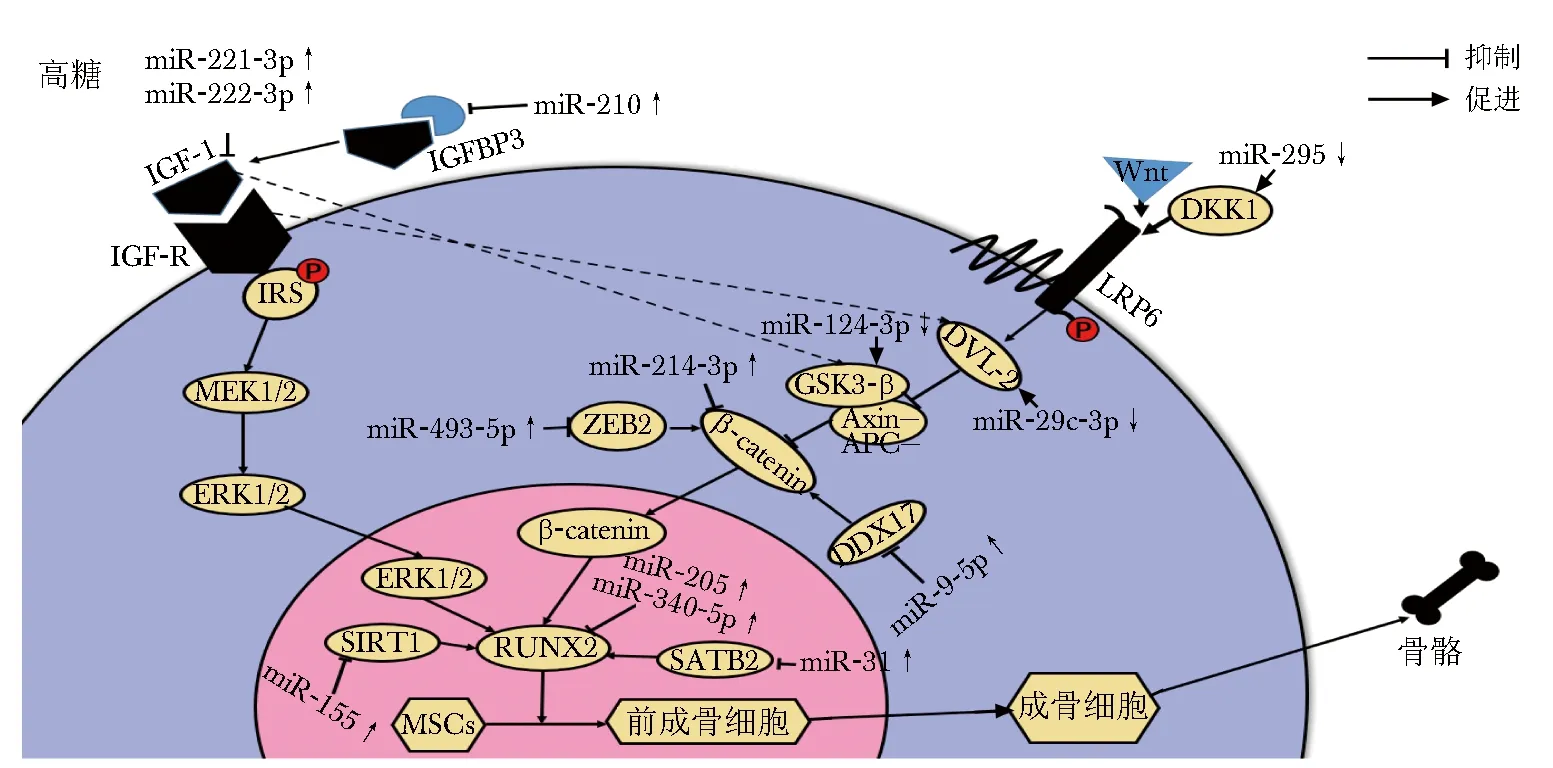
图1 异常表达miRNAs调控Wnt信号通路导致DOPFig 1 Abnormally expressed miRNAs lead to DOP by regulating Wnt signal pathways
3.2 异常表达miRNA通过IGF/β-catenin调控成骨分化
骨骼形成和吸收并非是由一条通路孤立起作用的,不同信号通路之间相互交叉相互影响。Wnt信号作为骨骼发育中必不可少的途径,其中的信号分子能够与其他途径的信号分子相互干扰,从而调节骨骼发育过程[14]。miRNA决定了多种信号分子的表达,也在这其中发挥关键性作用。
胰岛素样生长因子-1(insulin-like growth factors1,IGF-1)是葡萄糖和骨骼代谢紊乱的关键介质,并在DOP的发生中起重要作用[15]。IGF-1是与胰岛素原高度同源的小肽激素,其发挥作用主要通过与特异性受体(insulin-like growth factor-1 receptor,IGF-R)结合,诱导IRS磷酸化,触发下游信号通路,进而生成成骨所需的各种因子,如RUNX2[16]。IGF-1不仅可以激活MAPK/ERK通路,还可以通过调控经典Wnt信号通路的组成部分GSK-3β进一步调节β-catenin,并且其受体也可以通过稳定DVL2(β-catenin上游成分)来促进Wnt /β-catenin信号传导,实现两个通路的协同工作[9]。
使用小剂量链脲佐菌素联合高脂喂养构建糖尿病大鼠模型,提取BM-MSCs并使用不同培养基诱导分化时发现,在HG培养基中,大鼠BM-MSCs中的miR-221-3p和miR-222-3p的表达显著升高, 使得IGF-1mRNA和IGF-1表达下调,抑制了BM-MSCs中成骨所需相关蛋白的表达,抑制成骨分化[17]。胰岛素样生长因子结合蛋白-3 (insulin-like growth factor binding protein-3,IGFBP-3)作为IGF转运蛋白,起到储存和“缓冲”的作用[18]。在DM伴OP患者的血清中发现HG状态下miR-210表达上调。一方面, miR-210表达上调影响血管生成,影响骨代谢;另一方面,上调miR-210抑制IGFBP3表达, 导致IGFBP3与IGF-1二者结合率降低,削弱IGF-1在骨代谢过程中的正向作用,进一步加重骨代谢紊乱[19]。中药淫羊藿-仙茅药及利拉鲁肽都通过调控体内miRNA-144表达水平提高IRS1表达,保护HG状态下的成骨分化[20-21]。这为DOP的新药研发和治疗提供了新方向(表2)。

表1 异常表达miRNA作用于β-catenin调控成骨分化
3.3 异常表达miRNA通过RUNX2调控成骨分化
RUNX2是BM-MSCs向成骨细胞分化和由分化的成骨细胞形成骨所必需的关键转录因子,也是各个信号通路发挥作用的共同枢纽。其表达调节成骨细胞相关基因的表达,如:碱性磷酸酶、骨钙素及Ⅰ型胶原等[22]。RUNX2可受到miRNA的调控,影响其控制基因的表达,进而影响成骨。
miR-205及miR-340-5p的过表达直接抑制靶基因RUNX2的表达,抑制了患有DOP的雌鼠骨髓间充质干细胞成骨分化[23-24]。转录激活因子1(silent information regulator 1,SIRT1)可与RUNX2相互作用,并通过积极促进RUNX2转录来刺激成骨细胞分化。在探索DOP的发病机制时,发现细胞中显著上调的miR-155直接作用于SIRT1,抑制其在人BM-MSCs的表达,进而抑制了成骨分化关键标志因子RUNX2的表达,从而抑制人BM-MSCs成骨分化[25]。特异AT序列结合蛋白2(special AT-rich sequence-binding protein2,SATB2)是一个有效的成骨诱导因子,不仅可以直接促进成骨相关基因的表达,还可能通过协同作用增强其他转录因子影响RUNX2等,调节骨发生和成骨细胞的分化。在DOP小鼠来源的BM-MSCs中,miR-31的表达明显升高,并且miR-31通过直接与靶基因SATB2的3′-非翻译区结合,减少SATB2生成,继而下调RUNX2的表达,同时降低其协同作用,参与HG抑制的成骨分化[26-27](表3)。上述研究不仅证实了RUNX2在成骨细胞增殖分化过程中的核心地位, 而且围绕在RUNX2周围发挥调控作用的miRNA有可能成为DOP治疗的新靶点。

表2 异常表达miRNA作用于IGF/β-catenin调控成骨分化
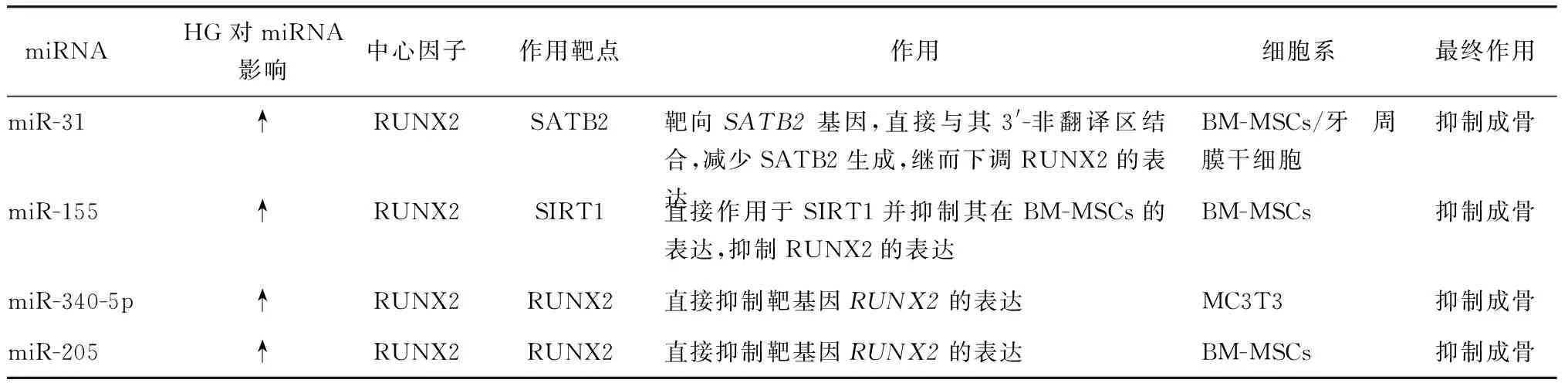
表3 异常表达miRNA作用于RUNX2调控成骨分化Table 3 Abnormal expression of miRNA plays an important role in the regulation of osteogenic differentiation by RUNX2
4 问题与展望
参与DOP骨代谢过程的miRNA及其靶标的发现证实了miRNA在维持糖尿病骨的动态平衡方面具有巨大潜力,对DOP的认识由原来的细胞层面拓宽到分子层面。目前已有的研究多是围绕着与Wnt/β-catenin信号通路相关的成骨分化展开的,但对于其他通路以及破骨细胞方面的研究相对较少。尽管一些miRNA模拟物及抑制物的作用已在动物模型及体外实验中得到证实,但如何将其应用于DOP的诊断以及如何研制靶向投递miRNA模拟物或抑制物的技术并且使其在逆转糖尿病患者骨代谢失衡中发挥作用,目前尚不明确。未来可针对各种miRNA及其靶标探索不同信号通路在DOP骨代谢中的作用,并尝试建立信号通路网络,深入研究miRNA作为DOP潜在生物诊断标志物的意义,以便开展针对此疾病的新诊疗策略及治疗手段。

