BEND6过表达对小鼠神经干细胞基因转录表达的影响
周梦杰,孙倩倩,于 洋
中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系,北京 100005
近年来,随着生物信息学的发展,越来越多未知的蛋白结构域被预测出来。BEN结构域[1]是2008年首次预测出的一个新的蛋白结构域。在该结构域被预测后不久,果蝇INSV蛋白的BEN结构域被发现能够直接与DNA结合,并抑制其结合基因的表达[2]。近年来对BEN-solo蛋白[3-5]和其他含有BEN结构域的相关蛋白[6-11]的研究表明,该类蛋白具有抑制或隔离基因表达以及调节染色质结构的功能,但是目前该类蛋白中许多成员的生物学功能及其发挥功能的分子机制尚未阐明。BEND6蛋白与INSV蛋白类似,因其只含有一个BEN结构域而不含有其它可识别结构域,又被叫做BEN-solo蛋白。小鼠的BEND6蛋白在细胞核中表达,并且具有促进神经细胞在小鼠大脑皮层中向上迁移的功能[3],但BEND6可能发挥的生物学功能尚不清楚。本研究旨在通过对BEND6过表达的小鼠神经干细胞进行全转录组测序并分析BEND6对其基因转录表达的影响,从而推测BEND6在小鼠发育中的潜在功能。
1 材料与方法
1.1 材料
1.1.1 质粒:pCMV-mScarlet,pFRT-FH-BEND6(北京协和医学院基础学院,生物化学与分子生物学系,于洋实验室)。
1.1.2 小鼠神经干细胞:取自P14小鼠(C57)侧脑室周围组织。实验小鼠来自北京协和医学院基础学院动物中心。
1.1.3 试剂和试剂盒:NeuroCultTMProliferation Kit (Mouse & Rat)(Stem Cell公司);PCR引物合成与质粒测序(北京诺赛基因组研究中心有限公司);Trizol(Thermo Fisher公司); SYBR(YESEN公司);全转录组测序(北京诺禾致源生物技术有限公司);Poly-D-Lysine (PDL)和Laminin(Sigma-Aldrich公司);Lipofectamine Stem Reagent(Invitrogen公司);mCherry抗体(Abbkine公司);荧光二抗(Abcam公司)。
1.2 方法
1.2.1 质粒的构建:从pFRT-FH-BEND6质粒中克隆BEND6片段并将其插入EcoRⅠ和BamHⅠ双酶切的pCMV-mScarlet载体中。将连接好的质粒转化到感受态细菌中进行克隆,用卡那霉素进行筛选,测序确认pCMV-mScarlet-BEND6质粒是否构建成功。获取BEND6片段的上游引物:5′-CGAGCTCAAGCT TCGAATTCTATGCAGAAGATCTTGCAGAC-3′,下游引物:5′- TATCTAGATCCGGTGGATCC TTTTAAGAT ACCATCCTGAGAGTTC-3′。
1.2.2 小鼠神经干细胞(neural stem cells, NSCs)的获取与培养:参照NeuroCultTMProliferation Kit中描述的方法。
1.2.3 细胞免疫荧光染色验证蛋白表达:将pCMV-mScarlet和pCMV-mScarlet-BEND6质粒转染到贴壁培养的神经干细胞中,24 h后使用4% PFA溶液将细胞固定,然后依次用mCherry抗体和荧光二抗进行孵育,封片后在莱卡倒置显微镜下成像。
1.2.4 RNA样品的制备:分别收集对照组和实验组细胞于1.5 mL离心管中,加入1 mL Trizol吹打混匀,室温静置10 min,然后加入200 μL氯仿充分混匀后于4 ℃离心10 min。吸取上层液体于新的RNase-free的1.5 mL离心管中,加入等体积的异丙醇,混匀,室温静置5 min后4 ℃离心10 min。弃上清,用700 μL 75%乙醇清洗RNA沉淀2次,用适量RNAase-free的水溶解室温干燥的RNA沉淀。
1.2.5 q-PCR实验验证基因转录水平:反转录对照组和实验组细胞的RNA得到相应的cDNA,以cDNA为模板进行q-PCR扩增反应,分别检测两组细胞中目标基因的Ct值,反应体系为20 μL,每组设置3个生物学重复,内参基因为m18srRNA,采用2-△△Ct法得到两组细胞中目标基因的相对表达量。
1.2.6 测序数据分析:使用HISAT2软件对质控后的测序数据进行比对,然后通过基因表达定量分析获得实验组和对照组样本的基因表达矩阵。采用DESeq2软件获得实验组中有差异表达的基因,并对差异基因进行生物功能富集分析。差异表达基因的筛选条件为P≤0.05, |log2fold change|≥1。
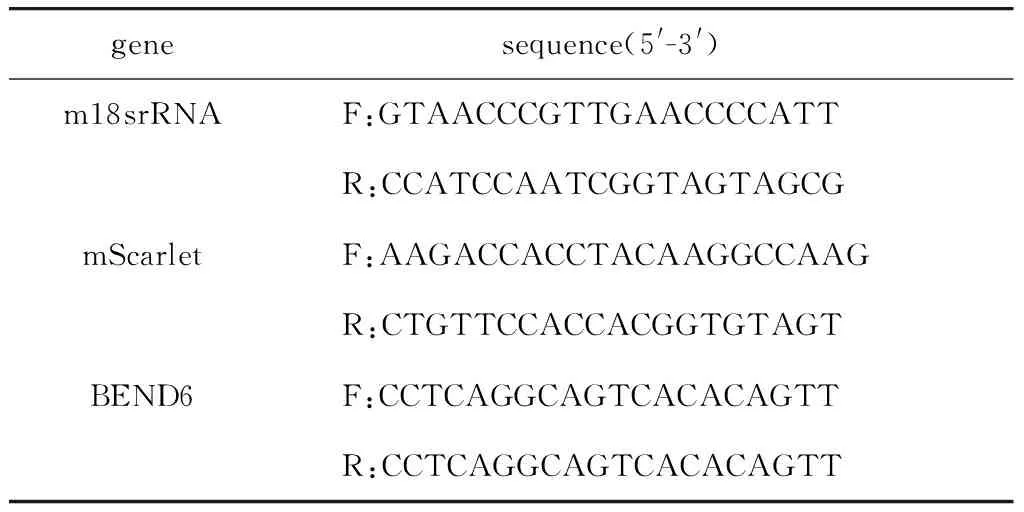
表1 q-PCR引物序列Table 1 Sequences of q-PCR primers
2 结果
2.1 小鼠神经干细胞的获取
成功获得小鼠神经干细胞(图1B),并将其在细胞培养板中贴壁培养(图1A)。
2.2 在小鼠神经干细胞中过表达mScarlet和mScarlet-BEND6
分别将pCMV-mScarlet和pCMV-mScarlet-BEND6质粒(图1C)转染到贴壁培养的神经干细胞中(图1A)。转染24 h后,mScarlet在两组细胞中的转录水平相差不大(图2C),而BEND6在实验组细胞中的表达明显高于在对照组中的表达(图2D)。此外,mScarlet在神经干细胞的细胞核和细胞质中均有表达(图2A),而mScarlet-BEND6仅在细胞核中有明显表达(图2B)。
2.3 BEND6过表达对小鼠神经干细胞基因转录的影响
与过表达mScarlet的神经干细胞相比,过表达mScarlet-BEND6的细胞中共有165个基因的表达发生了变化。其中上调的基因有102个,如Mx1、Mx2、Socs1、Map1b、Kcnq3、Ppp1r13l、Stmn4、Cd274、Tgtp1等;下调的基因有63个,如Timp1、Cd68、Otx2、Casp12、Fn1、Gxylt2、Cryab、Acta2等(图3A,B)。
2.4 差异表达基因的生物学功能富集分析
在过表达mScarlet-BEND6的神经干细胞中筛选出的差异表达基因主要与生长发育调控,生物代谢过程、免疫过程、细胞内生物学过程及种间互相作用等多种生物学过程相关(图4A)。这些生物学过程主要包括膜电位的调节、细胞对干扰素-的反应、肽基丝氨酸磷酸化的正调控、炎性反应、内肽酶活性的调节、化学突触传递、多巴胺能神经发生、正向调节神经元分化、2型免疫反应的调节、细胞分化的负调控、神经系统过程的调节、胰岛素受体信号通路的调控、微管聚合或解聚的调节等(图4B)。

A.flow chart of culture and transfection of mouse neural stem cells; B.neural stem cells in suspension culture(×100);C.schematic of mScarlet and mScarlet-BEND6 proteins
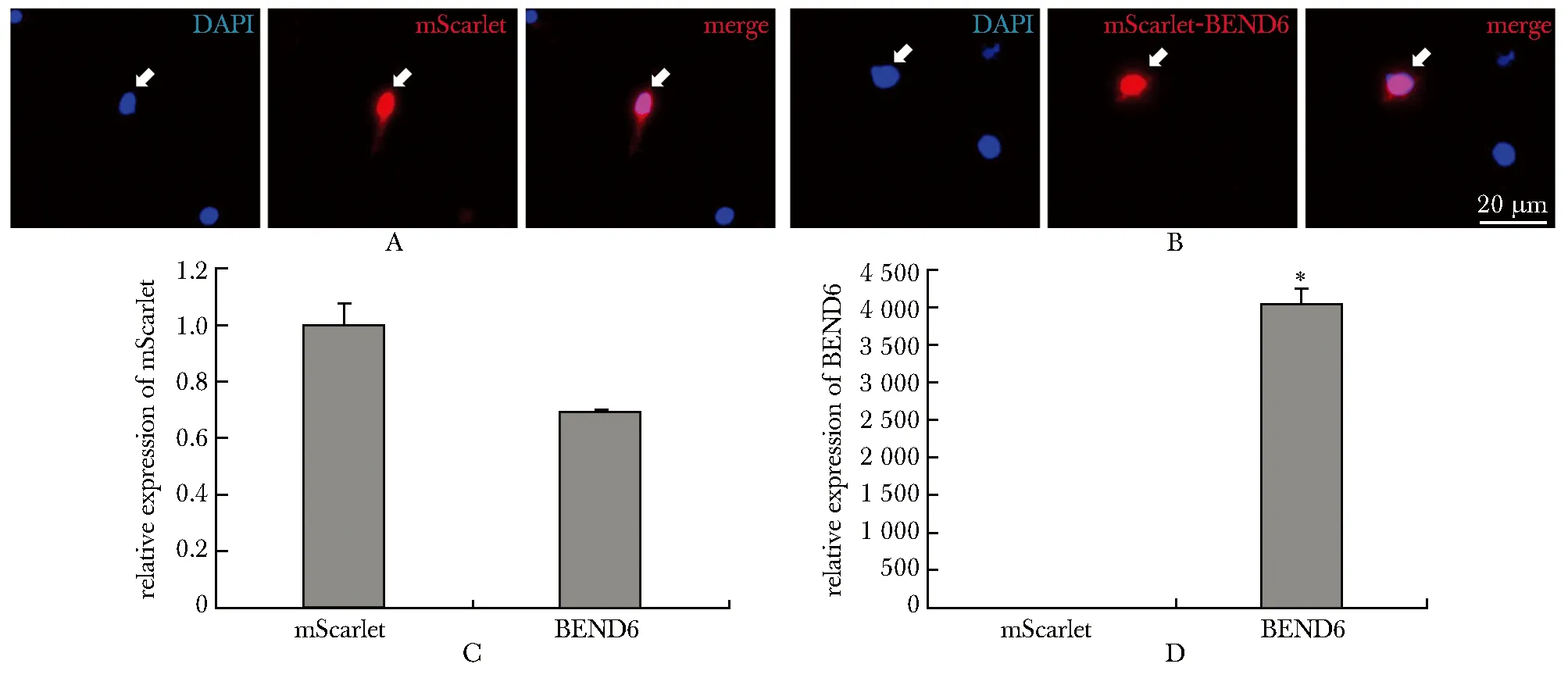
A.mScarlet was expressed in the nucleus and cytoplasm of mouse neural stem cells; B.mScarlet-BEND6 was restricted in the nucleus of mouse neural stem cells; C.there was no significant difference in the expression of mScarlet between control and experimental group; D.the expression of mScarlet-BEND6 in the experimental group was significantly higher than that in the control group;*P<0.001 compared with mScarlet

A.the volcano plot showing differentially expressed genes upon BEND6 overexpression; B.heatmap showing differentially expressed genes regulated by BEND6
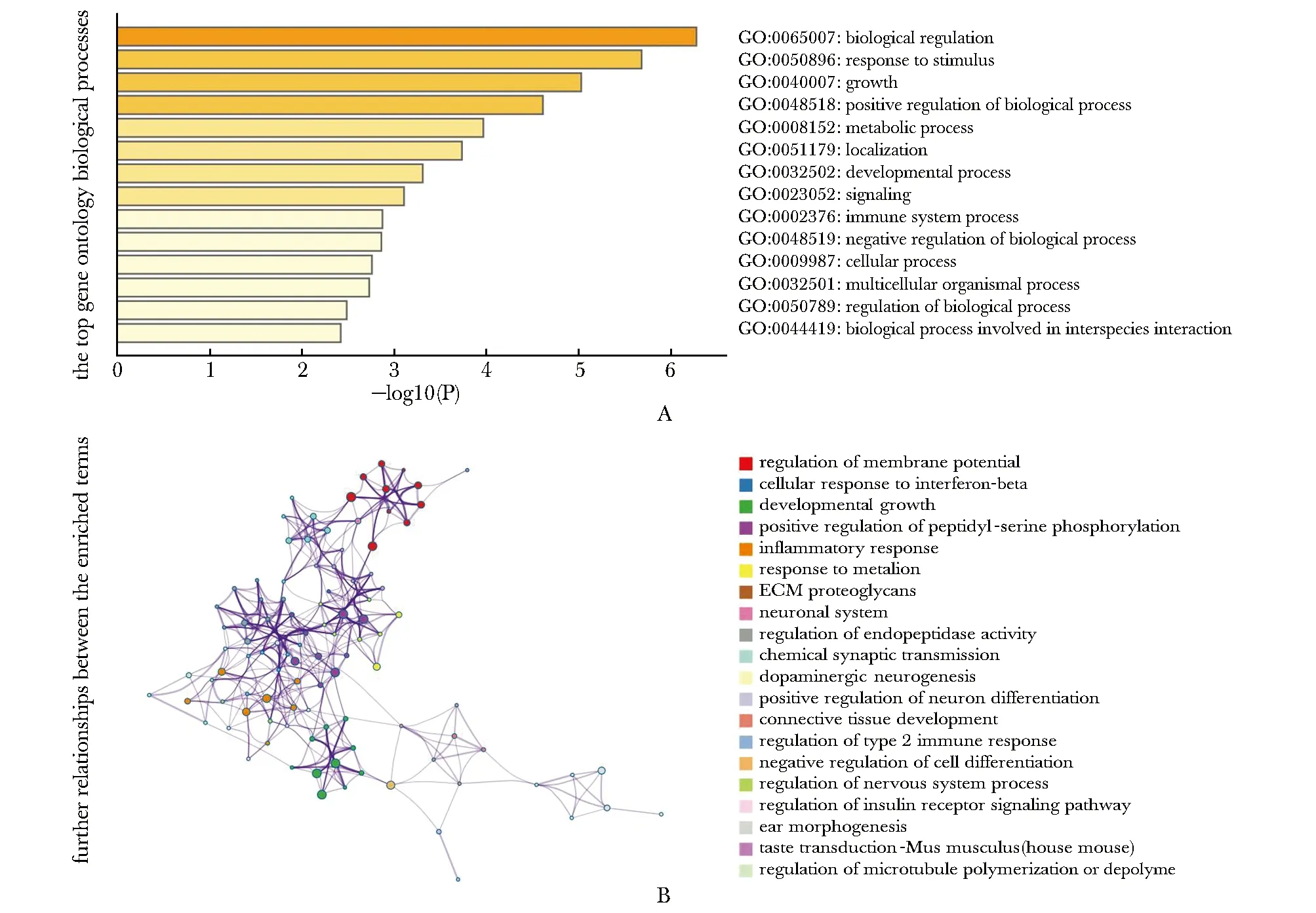
A.funcitonal annotation of differentially expressed genes upon BEND6 over-expression; B.biological relationship between the enriched terms
3 讨论
在本研究中,与过表达mScarlet的小鼠神经干细胞相比,过表达mScarlet-BEND6的细胞中有165个基因的转录水平发生了变化。这些差异表达基因与神经系统的调节和多种生物学过程相关。差异表达分析发现过表达mScarlet-BEND6的小鼠神经干细胞中S100a6基因下调,该蛋白可能是成年小鼠海马体亚颗粒区神经干细胞和星形胶质细胞的新型标志物[12]。有趣的是,实验组中Fn1基因的转录水平也呈现下调,该基因参与轴突延伸的正向调节,而对神经分化有负向调节作用的Zfp536基因的转录水平出现了上调。此外,与调节微管聚合和神经元投射发展相关的Slc39a12基因呈现下调,而同样参与调节微管聚合或解聚及神经元投射发育的Stmn4基因确呈现上调。这表明,小鼠神经元的成熟和轴突形成是一个十分复杂的过程,BEND6在小鼠神经干细胞向神经元发育的过程中可能并不是起到单向促进作用,而是促进神经干细胞进入某个神经元分化成熟过程中的特殊状态。值得注意的是,差异表达基因中下调的Prrx2具有DNA结合转录激活剂活性,上调的Zfp57具有结合染色质和双链甲基化DNA的活性。这提示BEND6在小鼠神经干细胞中可能通过调节其他具有转录因子从而调节神经分化过程。
BEND6过表达除了对神经分化调节相关的基因转录产生影响,也导致很多参与其他生物学过程的基因转录水平发生了变化。例如与突触膜电位调节及神经递质分泌相关的基因中Kcnc4、Gabra4呈现转录下调,Kcnq3和Insyn2a基因呈现上调;下调的Timp1、Cd68、Il33、Cryab基因和上调的Tgtp1、Gbp5、Cd274、Gpr17、Mx2、Mx1基因主要与免疫反应、炎性反应和伤口愈合等生物学过程相关。
本研究通过对过表达BEND6的神经干细胞进行转录组测序和分析发现,BEND6过表达会导致参与神经分化和多种生物学过程的基因转录水平发生变化,为BEND6生物学功能的探究提供方向。但BEND6具体的生物学功能及其发挥作用的分子机制还有待进一步的研究去探索。

