正相–高效液相色谱法测定菜籽油中菜籽多酚Canolol的研究
李昕阳,李贵友✉,杨 微,杨 军
(四川省粮油中心监测站,四川 成都 610041)
大宗商品油料中,油菜籽产品中的多酚类化合物含量显著高于其他相应的油料作物种子[1],油菜籽和菜籽粕中的酚酸总量是豆粕中的5倍,是其他油料作物中的10~30倍[2]。油菜籽中的多酚分为酚酸和单宁,酚酸又包括游离酚酸和酯化酚酸,其中游离酚酸占总酚的9%~16%,芥子酸是主要游离酚酸,占游离酚酸总量的70%~85%[1,3]。Koski[4]等报道:油菜籽中天然存在的芥子酸在高温高压下脱酸转化而成另外一种多酚,即2,6-二甲氧基-4-乙烯基苯酚(2,6-dimethoxv-4-vinylphenol,vinylsyringol)。Wakamatsu[5]等在 2005 年从加拿大低芥酸油菜籽中提取出该物质,经分离提纯后鉴定确认,结果显示该化合物的分子质量为180,结构为C10H12O3,并命名为Canolol。与芥子酸及其他常见抗氧化物如生育酚和抗坏血酸及其衍生物相比,Canolol具有更优越的抗氧化活性及抗诱变、抗癌、抗病原微生物,抑菌等生理活性,因此具有重要的医药和营养价值[5-7]。
我国是油菜籽生产和消费大国,产量位居世界前列,每年提供优质食用油约 520万 t,约占国产油料作物产油量的50%,是我国第一大油料作物[8]。其中浓香型压榨菜籽油已占菜籽油三分之一的市场份额,在四川地区需求稳定,价格和利润总体较高,这种以浓郁风味为特点的压榨浓香型菜籽油,是在高温高压下压榨出油,没有经过精炼的菜籽油。已有研究表明[4,9-10]未经精炼的植物油中酚类化合物显著高于经过精炼的植物油,而四川的浓香型压榨菜籽油中的 Canolol含量更是远远高于其他类型菜籽油的多酚含量。为促进实现四川地区菜籽油整体价值的提升,加大影响力,为全产业链综合经济效益的提升提供强力技术体系支撑,从而促进油菜产业的高质量发展,因此研究开发准确高效地检测菜籽油中菜籽多酚 Canolol含量的测定方法具有非常重要的应用及经济价值。
许多分析技术已被报道用于鉴定和定量多酚化合物,报道最常见的技术有薄层色谱法、气液色谱法、气相色谱–质谱法和毛细管电泳法,此外,高效液相色谱(HPLC)是应用最广泛的定量方法之一[11-12]。纸色谱,薄层色谱法操作简便,成本低廉,但能分离的多酚组分不多且定量不准确,因此较少使用;GC法灵敏度高、分离成分多,但一般用于分离弱极性、易挥发、热稳定性高的有机化合物;植物多酚是强极性、不易挥发且结构复杂的有机物,故HPLC法在多酚的分离纯化上应用较多[13]。Khattab[14]等采用高效液相色谱–二极管阵列检测法测定了油菜籽中包括芥酸衍生物在内的总酚含量。对10种加拿大西部油菜籽,6种其他商品油菜籽及其对应的菜籽饼粕进行了分析。采用水–甲醇–o–磷酸溶液梯度洗脱分离多酚化合物,流速为0.8 mL/min。芥子碱(SP)和芥子酸(SA)的检出限和定量限分别为 0.20~0.40 μg/mL和0.50~0.80 μg/mL,回收率均超过98.0%。油菜提取物中总酚、SP和 SA含量分别为9.16~16.13 mg/g、6.39~12.28 mg/g 和 0.11~0.59 mg/g,品种间差异显著。Wakamatsu[5]等从加拿大低芥酸油菜籽Canola中提取出Canolol,采用薄层色谱法结合高效液相色谱法进行分离提纯,用高分辨率的大气压力化学电离质谱(APCI)以及液质联用(LC/MS)进行鉴定确认,结果显示该化合物的分子质量为180,结构为C10H12O3。并得出当甲醇用量为 70%时,可最大限度地提取油菜籽中的酚类化合物。
目前国内的文献报道[3,10,15-17]基本仅限于对菜籽多酚的提取、分离纯化和活性评价的综述,检测方法有行业标准 LS/T 6119—2017《粮油检验 植物油中多酚的测定分光光度法》[18],该标准测定的多酚总量,样品提取需要经过繁琐的固相萃取净化,分析周期长并且消耗的试剂较多,不利于环境保护。而国外对于测定菜籽多酚的文献报道大多为油菜籽和菜籽粕,样品提取过程繁琐,如甲醇氨水处理菜籽粕[19],甲醇回流提取菜籽和菜籽粕[11],硅胶柱层析分离提取物[5,7],固相萃取净化提取物[4]等,采用反相色谱柱分离测定,同样存在上述问题。本文侧重于研究测定Canolol的方法,旨在挖掘四川地区浓香型菜籽油的价值,体现其区别于其他菜籽油的优点,因此提出测定Canolol这一特征物质。本文采用正相–高效液相色谱法(NP-HPLC)测定菜籽油中菜籽多酚Canolol含量的方法,该方法可直接溶解样品上机,简单易操作,溶剂使用少,检测周期短,准确度高,重现性好。
1 材料与方法
1.1 材料与试剂
菜籽多酚标准溶液,0.2 mg/mL:四川普西奥标物科技有限公司;正己烷,色谱纯:Kewell科威;异丙醇,色谱纯:上海安谱公司;甲醇,色谱纯:MREDA。
称取10 mg(精确至0.01 mg)2,6-二甲氧基-4-乙烯基苯酚(CAS:28343-22-8,纯度大于99.0%)于50 mL容量瓶中,用正己烷溶解、定容,混匀。于2~8 ℃保存,有效期1个月。
1.2 仪器与设备
超高效液相色谱仪(Thermo UltiMate 3000 UHPLC),配荧光检测器:赛默飞世尔科技公司;二醇基硅胶柱(Athena Diol,长250 mm,内径4.6 mm,粒径 5 μm)、0.45 μm微孔滤膜:上海安谱公司;万分之一分析天平(型号ME204,精度0.000 1 g):梅特勒公司;25 mL棕色容量瓶、50 mL容量瓶:天玻公司。
1.3 实验方法
1.3.1 试样溶液的制备
称取(0.25±0.1) g(精确至1 mg)试样于25 mL棕色容量瓶中,先加入一定量的正己烷溶解试样,再用正己烷稀释到刻度,混匀。如果溶液不清澈,用0.45 μm微孔滤膜过滤,避光保存,并在当天完成分析。
1.3.2 标准品的配制
将 1.1中配制好的菜籽多酚标准溶液稀释成一系列梯度浓度:200、500、1 000、1 500、2 000 ng/mL,临用前现配。
1.3.3 色谱条件
色谱柱:二醇基硅胶柱(长 250 mm,内径4.6 mm,粒径5 μm);检测仪器为荧光检测器,激发波长:298 nm;发射波长:325 nm;流动相:正己烷+异丙醇=96+4,v/v;流速:0.8 mL/min;进样量:20 μL;柱温:30 ℃。
1.4 数据分析
在仪器的最佳条件下,分别取标准系列溶液和试样溶液上机测定。以保留时间定性,色谱峰面积多点校正定量,外标法计算试样中菜籽多酚Canolol的含量。实验数据用变色龙软件(Chromeleon software,Version 7.2 SR4)和Excel进行分析。
2 结果与分析
2.1 仪器分析条件的选择
2.1.1 检测器和波长的选择
荧光检测器灵敏度非常高,其检出限可达到10–9g/mL,同时具有选择性好的优势。本文采用荧光检测器作为检测器。文献[5]报道菜籽多酚的结构为2,6-二甲氧基-4-乙烯基苯酚,紫外光谱表明该化合物具有苯甲酸特征,最大吸收峰在275 nm,同时还表现较强的荧光,本文采用的激发波长为298 nm,发射波长325 nm,实验结果见2.2,结果表明在此条件下检测菜籽多酚具有较高信噪比。
2.1.2 色谱分析条件的优化
本文采用正相色谱的方法对样品进行测定,正相液相色谱以非极性或弱极性溶剂为流动相,溶质与流动相的相互作用较弱,通常是在饱和烷烃(如正庚烷、正己烷)中加入一种极性较大的溶剂(如异丙醚、异丙醇等)作为极性调节剂构成的混合溶剂,可以保持溶剂的低黏度,以降低柱压和提高柱效,以及提高选择性,改善分离。国标GB/T 26635—2011《动植物油脂生育酚及生育三烯酚含量测定高效液相色谱法》[20]也采用正相液相色谱分离和检测生育酚及生育三烯酚含量,其流动相为正庚烷和四氢呋喃,正庚烷价格较高,四氢呋喃毒性较大,因此本文采用的流动相为正己烷和异丙醇。
考虑到待测菜籽油中含有各种酚酸、生育酚和生育三烯酚,按实验方法1.3改变流动相正己烷和异丙醇的比例,对生育酚、生育三烯酚和Canolol进行分离实验,结果见图1~2,样品测定谱图见图3。从图1~3可以看出:在荧光检测器激发波长298 nm,发射波长325 nm的条件下,生育酚、生育三烯酚和 Canolol均有响应,菜籽油基质对生育酚、生育三烯酚和 Canolol的测定均没有干扰;在流动相正己烷+异丙醇=98+2,v/v的条件下,Canolol与δ-生育酚的色谱峰重合;在流动相正己烷+异丙醇=96+4,v/v的条件下,Canolol与生育酚及生育三烯酚的色谱峰完全分离。因此本文采用流动相条件为正己烷+异丙醇=96+4,v/v。
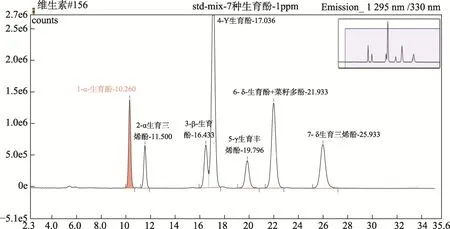
图1 流动相:正己烷+异丙醇=98+2,v/v的标准溶液色谱图Fig.1 HPLC chromatogram of the volume ratio 98:2 of hexane to isopropanol as the mobile phase
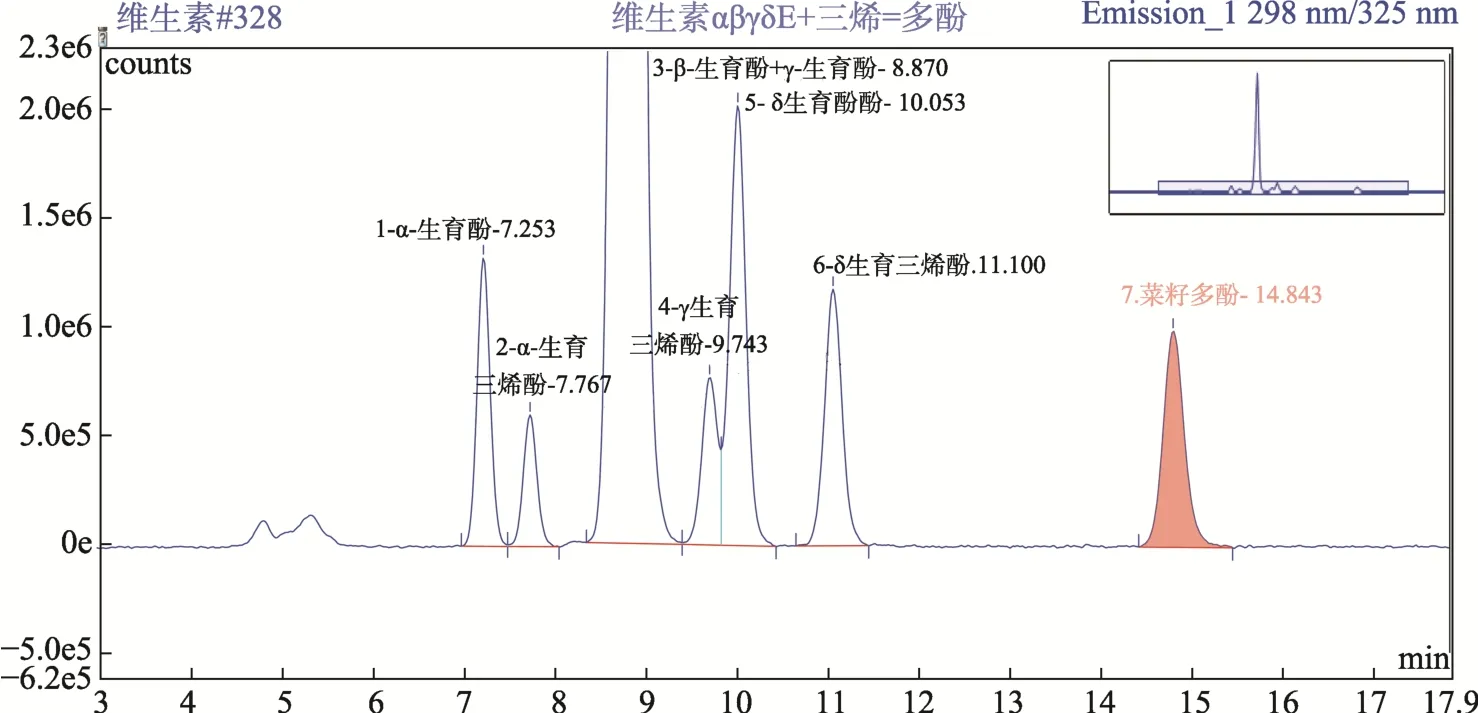
图2 流动相:正己烷+异丙醇=96+4,v/v的标准溶液色谱图Fig.2 HPLC chromatogram of the volume ratio 96:4 of hexane to isopropanol as the mobile phase

图3 压榨浓香型菜籽油色谱图Fig. 3 HPLC chromatogram of pressed rapeseed oil
2.2 方法的线性范围和检出限
按照实验方法1.3,在相同的色谱条件下测定其峰面积,以浓度x(ng/mL)为横坐标,色谱峰面积(y)为纵坐标得到标准曲线,并求出相应的线性回归方程及相关系数,结果见图4。结果表明:菜籽多酚在浓度范围内具有良好的线性关系,相关系数r为0.999 5。按照3倍信噪比计算得到的检出限为15 ng/mL,说明本文方法对菜籽多酚具有较高的检测灵敏度。
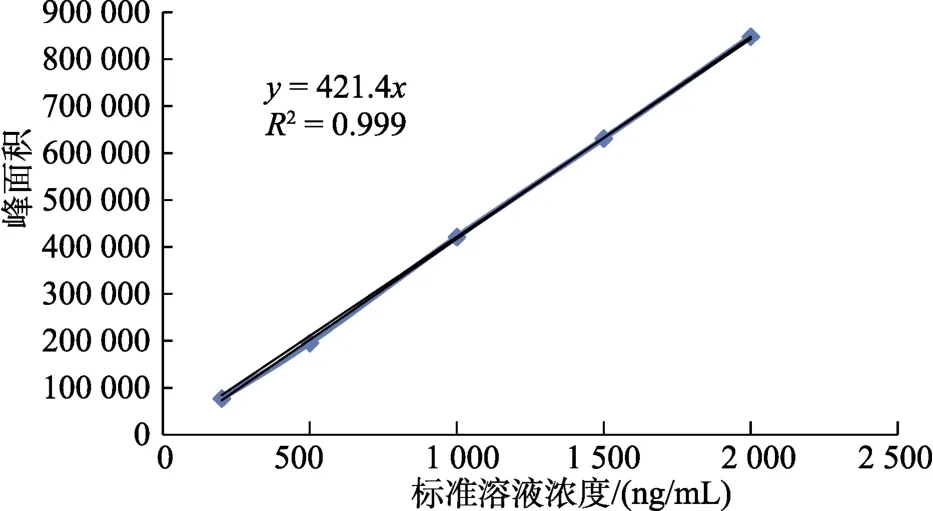
图4 菜籽多酚标准工作曲线Fig. 4 Standard working curve of Canolol
2.3 方法回收率和精密度测定
按实验方法 1.3在样品中添加三个不同浓度水平的菜籽多酚标准溶液,采用同样的色谱检测条件重复测定7次,实验结果见表1,表1表明本文方法的加标回收率在96%~110%之间,精密度在1.5%~2.9%之间。
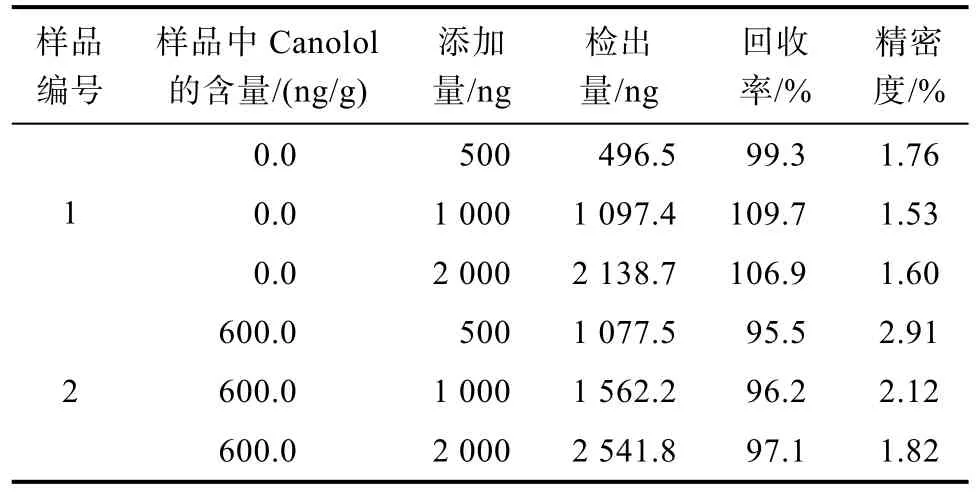
表1 方法回收率和精密度测定Table1 The recovery rate and precision of the method
2.4 样品测定
按照实验方法,我们同时测定了一级菜籽油、浸出菜籽油、压榨浓香型菜籽油、大豆油、花生油、玉米油中Canolol的含量,结果见表2,其中压榨浓香型菜籽油为成都市农林科学院收集全国不同地区不同品种的油菜籽采用压榨工艺生产的菜籽油,共计90个样品,浓香型菜籽油测定谱图见图3。结果表明:一级菜籽油、浸出菜籽油、大豆油、花生油、玉米油中菜籽多酚 Canolol含量为未检出,浓香型菜籽油菜籽多酚 Canolol含量在190~2 246 mg/kg之间,不同地区的不同品种的油菜籽生产的菜籽油的菜籽多酚含量差异很大,本方法适用于多种植物油的测定。

表2 样品测定Table 2 Sample determination
3 结论
本文采用正相-高效液相色谱法(NP-HPLC)测定菜籽油中菜籽多酚 Canolol的含量。方法的线性相关系数为0.999,加标回收率在96%~ 110%之间;仪器检出限为15 ng/mL,精密度优于3%。该方法具有操作简便、分析时间短、准确度高、环境污染少的特点,本方法的建立对挖掘浓香型菜籽油营养价值和油菜籽品种育种的优选提供技术支撑,对促进实现四川地区油菜籽产业整体价值的提升,加大浓香型菜籽油影响力具有重要意义。

