燕麦酵素的营养性及其对α-淀粉酶活性抑制效果的研究
胡爱玲,杨婉婷,马利华
(徐州工程学院食品与生物工程学院,江苏 徐州 221111)
植物酵素是以一些植物为主要原料,通过有益菌群进行发酵得到的发酵产品[1],含有丰富的代谢产物、植物本身营养成分和益生菌等功能成分,特别是富含小分子功能成分[2],通过微生物的发酵,使这些成分的功效提高,并减小人体吸收过程中产生的副作用,促进消化吸收,降低血脂,提高抗氧化性和免疫性[3-4]。包怡红等[5]以蓝靛果和米糠为主要原料,开发出一种新型复合酵素;夏国灯等[6]以玫瑰干花瓣为主要原料,使用复合乳酸菌发酵,通过Box-Behnken设计试验获得了酵素发酵最佳工艺条件。
α-淀粉酶可以促进人体内的淀粉及寡糖中的糖苷键水解,使淀粉分解为在体内血液中易被人体利用的碳水化合物,如葡萄糖和麦芽糖等[7]。通过抑制淀粉酶活性可以降低人体对淀粉的吸收,延缓体内的淀粉代谢,降低葡萄糖吸收,从而达到防治高血糖的目的[8]。服用抑制剂类药物是目前治疗糖尿病的首选方式,市面上化学类药物容易引起胀气、消化不良等副作用[9],从天然物质中提取抑制剂更具安全性,已有研究报道植物提取物中多酚类、多糖类[10]等物质具有良好的α-淀粉酶抑制活性。孟爱莲等[11]研究了苦笋壳不同提取物的抗氧化作用及其对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用,发现苦笋壳乙酸乙酯相的抗氧化能力大于正丁醇相和石油醚相,其对α-葡萄糖苷酶和α-淀粉酶的抑制活性最强。
燕麦为禾本科一年生草本植物,属小杂粮。燕麦中含有脂质、蛋白质、抗氧化物等营养成分,是一种优质谷物[12]。近年来,由于燕麦等谷物食品对糖尿病、肥胖症、心血管疾病等具有潜在抑制作用,从谷物中发现的具有保健功效的生物活性成分已成为越来越多科研工作者的研究热点。以燕麦为原料制作酵素亦有报道,如张越等[13]研究了糖添加量对燕麦酵素发酵特性的影响,但有关燕麦酵素对α-淀粉酶抑制作用及燕麦酵素中营养素与抑制作用的相关性尚未见报道。
本文以燕麦为原料,经过发芽处理后制作酵素,考察了燕麦发酵过程中β-葡聚糖、总酚等的含量变化,以及燕麦酵素对α-淀粉酶活性的抑制作用,以期为燕麦产品的开发利用提供一定的科学依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
燕麦:本地大润发超市购买。发酵菌粉:昆山佰生优生物科技有限公司。
刚果红、联苯三酚、茚三酮、硝酸铝、α-淀粉酶、β-葡聚糖、亮氨酸、芦丁、3,5-二硝基水杨酸:均为分析纯,国药集团化学试剂有限公司;福林酚:美国Sigma试剂公司。
1.1.2 仪器与设备
TDZ4台式低速离心机:济南东仪实验室设备有限公司;7230G型可见分光光度计:常州三丰仪器科技有限公司;DNP-9082恒温培养箱:苏州威尔实验用品有限公司;ZNCL-BS恒温磁力加热搅拌器:上海越众仪器设备有限公司;TG-16W-I高速离心机:济南鑫宇鑫医疗设备有限公司;DHG-9053鼓风干燥箱:上海善志仪器设备有限公司;FSJ-A05N6磨粉机:小熊电器有限公司。
1.2 方法
1.2.1 燕麦样品的处理
选用成熟且颗粒饱满的优质燕麦,浸入浓度为1%的次氯酸钠中消毒杀菌20 min,再清洗干净,浸入蒸馏水泡16 h,以两层充分被去离子水浸湿的滤纸为发芽介质,将浸泡清洗好的燕麦粒用干净的纱布挤干水分后平铺在发芽床上,放入托盘,放进20℃恒温培养箱中,每12 h进行换水通风,恒温箱内相对湿度保持在95%以上。待燕麦发芽至0.5~1.0 cm后,干燥,磨粉,即为样品,备用。
1.2.2 燕麦酵素的制备
分别取发芽燕麦粉100 g放入烧杯中,加入适量水,混合均匀后加入1 g发酵菌粉,30℃恒温培养箱中发酵168 h,发酵结束后过滤,取上清液备用。
1.2.3 β-葡聚糖含量的测定
参考刚果红显色法[14]测定燕麦酵素中β-葡聚糖含量。以β-葡聚糖质量浓度(C)为横坐标,吸光度(A)为纵坐标绘制标准曲线,回归方程为:y=0.003 6x+0.129,R2=0.993 5。
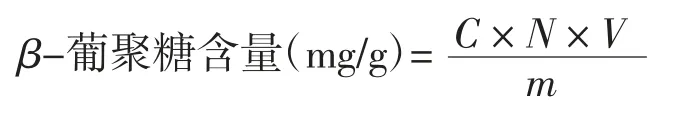
式中:C为燕麦酵素β-葡聚糖质量浓度,mg/mL;N为燕麦酵素上清液稀释的倍数;V为燕麦酵素提取样液的总体积,mL;m为燕麦原料的质量,g。
1.2.4 总酚含量的测定
采用福林酚比色法[15]测定燕麦酵素中总酚含量。以联苯三酚质量浓度(C)为横坐标,吸光度(A)为纵坐标绘制标准曲线,回归方程为:y=0.960 8x+0.012 41,R2=0.994 9。
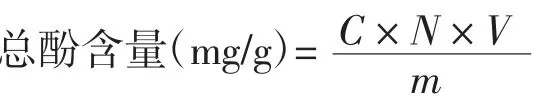
式中:C为酵素液中提取总酚的质量浓度,mg/mL;N为酵素上清液稀释的倍数;V为燕麦酵素提取样液的总体积,mL;m为燕麦原料的总质量,g。
1.2.5 游离氨基酸含量的测定
采用茚三酮比色法[16]测定燕麦酵素中游离氨基酸含量。以亮氨酸质量浓度(C)为横坐标,吸光度(A)为纵坐标绘制标准曲线,回归方程为:y=2.713 7x-0.016 3,R2=0.993 4。
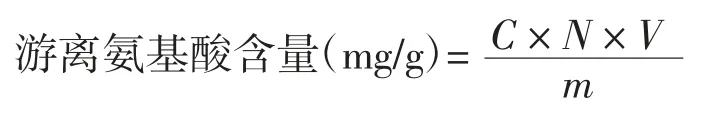
式中:C为酵素液中提取的游离氨基酸质量浓度,mg/mL;N为酵素上清液稀释的倍数;V为燕麦酵素提取样液的总体积,mL;m为燕麦原料总质量,g。
1.2.6 总黄酮含量的测定
采用硝酸铝显色法[17]测定燕麦酵素中总黄酮含量。芦丁为标准品,以芦丁质量浓度(C)为横坐标,吸光度(A)为纵坐标绘制标准曲线,回归方程为:y=0.198x+0.005,R2=0.991 2。
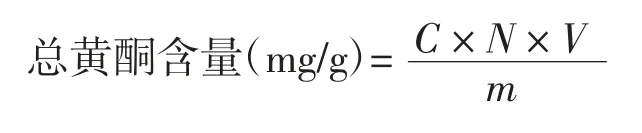
式中:C为酵素液中提取总黄酮的质量浓度,mg/mL;N为酵素上清液稀释的倍数;V为燕麦酵素提取样液的总体积,mL;m为燕麦原料总质量,g。
1.2.7 燕麦酵素对α-淀粉酶的抑制率测定及抑制动力学分析
取α-淀粉酶溶液0.3 mL和1 mL酵素上清液,混匀,加0.4 mL 1%淀粉溶液,37℃反应15 min,加入3,5-二硝基水杨酸0.5 mL,摇匀混合后于100℃下反应5 min,冷却,用水定容至25 mL。用去离子水代替燕麦酵素溶液作空白组,去离子水取代α-淀粉酶作对照组,去离子水取代燕麦酵素溶液、α-淀粉酶作空白对照,在540 nm处测其吸光度,计算抑制率[18]。
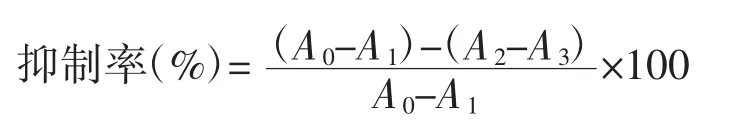
式中:A0为去离子水代替燕麦酵素溶液在540 nm处的吸光值;A1为去离子水代替酵素溶液和α-淀粉酶在540 nm处的吸光值;A2为酵素溶液在540 nm处的吸光值;A3为去离子水代替α-淀粉酶在540 nm处的吸光值。
半数抑制率IC50定义为抑制率为50%时的样品浓度。IC50越小,说明该物质抑制效果越明显。
米氏方程是指在理想状态下,酶促反应的起始速度随底物浓度变化而变化的速度方程。双倒数方程如下:
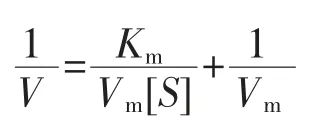
酶促反应中的米氏常数(Km)和最大酶促反应速度(Vm)值通常都是采用米氏方程的转换形式求出。通过Lineweaver-Burk双倒数和Hanes作图法即可以测定计算得到Km和Vm。
在其他反应条件一定的情况下,改变底物浓度([S]),添加或不添加燕麦酵素的条件下,测定酶促反应速度(V),以1/V对1/[S]作图,得到Lineweaver-Burk曲线,确定抑制类型[19]。
1.2.8 数据处理
使用Origin 9.0软件作图,并应用Microsoft Excel 2010进行数据分析。
2 结果与分析
2.1 燕麦发酵过程中β-葡聚糖含量和游离氨基酸含量的变化
燕麦富含碳水化合物、蛋白质、脂类、酚类化合物、维生素和矿物质,以及β-葡聚糖、总黄酮、生物碱等对人体有利的活性成分,其中β-葡聚糖是燕麦可溶性纤维的主要成分之一,它被公认为燕麦中的主要有效活性成分,主要作用是降低胆固醇和抗糖尿病[20]。由图1可见:发酵过程中,燕麦酵素中β-葡聚糖及游离氨基酸含量总体呈现上升趋势,发酵96 h时含量最高,与发酵前相比,β-葡聚糖含量增加了1.8%,游离氨基酸含量增加了25.46%。这是由于随着发酵的进行,微生物的生长繁殖释放了燕麦细胞中的营养物质,使其溶出增多,另一方面微生物代谢也导致其含量有所上升,这与史小萌等[21]的研究结果一致。
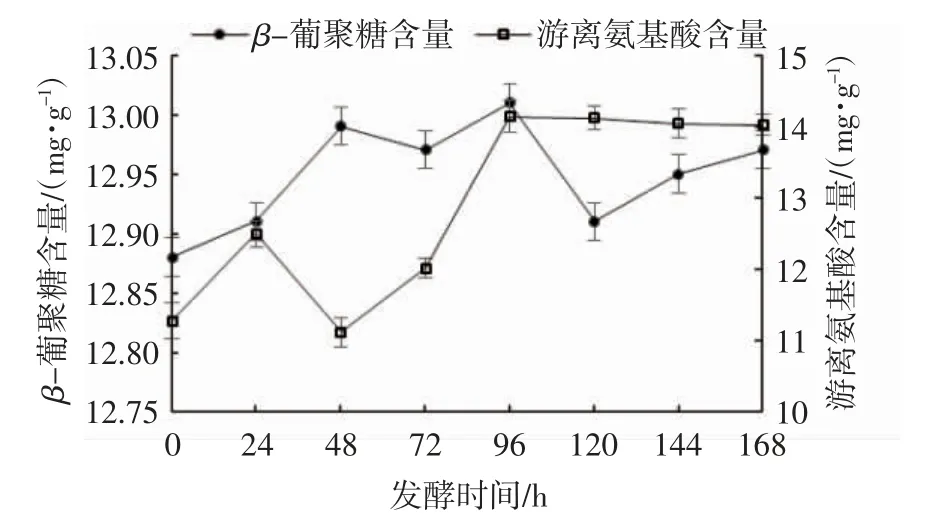
图1 发酵时间对燕麦酵素β-葡聚糖、游离氨基酸含量的影响Fig.1 Effect of fermentation time on the contents ofβ-glucan and free amino acid in oat Jiaosu
2.2 燕麦发酵过程中总酚含量和总黄酮含量的变化
燕麦中的酚类化合物可以抵御各种病原体的攻击,预防癌症、脑卒中和冠心病等疾病。由图2可见:燕麦酵素发酵过程中,其总酚和总黄酮含量于发酵96 h达到最高,与发酵前相比分别增加了40.31%和47.62%。这是由于微生物发酵产生的酶系可以破坏细胞壁纤维成分的致密结构,或者破坏多酚、黄酮类物质与其他物质之间交联的共价键,促进这类物质的释放和转化,从而增加了酵素中游离酚、酮类物质的浓度。这与丁玉锋等[23]的研究结果一致。
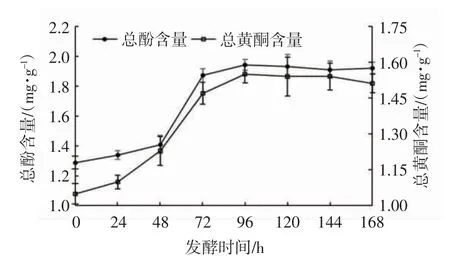
图2 发酵时间对燕麦酵素总酚、总黄酮含量的影响Fig.2 Effect of fermentation time on the contents of total phenols and total flavonoids in oat Jiaosu
2.3 燕麦发酵过程对α-淀粉酶活性抑制效果分析
2.3.1 燕麦发酵过程对α-淀粉酶活性抑制率的影响
α-淀粉酶是参与小肠碳水化合物消化降解的关键酶,抑制其活性就可减缓淀粉分解,从而降低糖尿病患者的餐后血糖水平[24]。
由图3可见:燕麦酵素在发酵过程中对α-淀粉酶的抑制于发酵96 h达到最高,抑制率为72.27%,比发酵前提高了22.58个百分点。
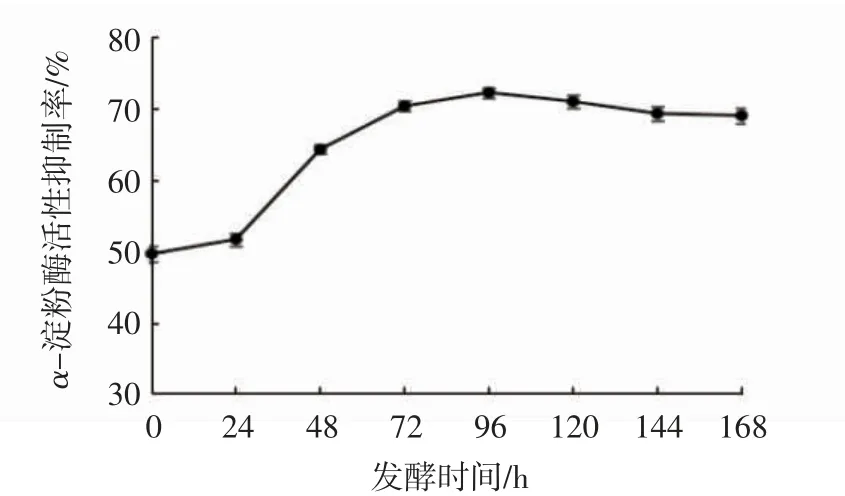
图3 燕麦发酵时间对α-淀粉酶活性抑制率的影响Fig.3 Effects of fermentation time on inhibition rate ofα-amylase activity in oat Jiaosu
为研究不同燕麦酵素浓度对α-淀粉酶的抑制效果,分别在发酵96 h的燕麦酵素中加入蒸馏水稀释,制成不同质量浓度的酵素,测定其对α-淀粉酶活性的抑制率,以半数抑制率IC50衡量其对α-淀粉酶活性的抑制效果。以酵素质量浓度为横坐标,α-淀粉酶活性抑制率为纵坐标进行线性回归拟合,结果见图4。结果显示:燕麦酵素在一定质量浓度范围内与α-淀粉酶活性抑制率呈线性正相关,所得到的线性方程式为:y=1.701 4x-3.261 8,R2=0.990 6,存在很好的线性关系;经计算得出IC50=30.96 g/L。这与李云姣等[25]的研究结论相似。

图4 燕麦酵素质量浓度与α-淀粉酶活性抑制效果的相关性Fig.4 Correlation between oat Jiaosu cocentration and inhibition ofα-amylase activity
2.3.2 燕麦酵素对α-淀粉酶活性的抑制动力学分析
以底物浓度倒数值为横坐标,酶促反应速率倒数值为纵坐标,绘制不同燕麦酵素浓度下的双倒数曲线图,可以得到4种类型:
①竞争性抑制:Km值增大,Vm值不变。
酶抑制剂和底物在结构上有相似之处,当酶抑制剂与酶结合以后,阻断了底物与酶的结合,降低了酶与底物的亲和能力,酶反应速率减慢,增大抑制剂的浓度即可增强抑制强度。
②非竞争性抑制:Km值不变,Vm值减小。
酶抑制剂会与游离的酶发生结合作用,但不影响酶对底物的反应作用。因酶与底物作用同时可与抑制剂结合,导致酶分子结构发生变化,从而降低酶活性。
③反竞争性抑制:Km值减小,Vm值减小。
酶抑制剂能与酶-底物复合物作用,不能同游离的酶作用,反应最大速率小于未添加抑制剂的反应最大速率。
④混合型抑制:Vm值减小,Km值增大;Vm值减小,Km值减小。
该类型是非竞争性抑制与另外两种抑制类型的混合,作用机理与非竞争性抑制大体相似,但因酶与底物种类或底物结合次序不同,因而反应常数不同。竞争性与反竞争性抑制两者之间不属于混合型[26]。
由图5可见:未添加燕麦酵素样品的反应方程为y=0.09x+18.319,R2=0.994 1,Vm=0.054 5 mg/(mL·min),Km=0.004 9 mg/mL。33.91g/L低浓度燕麦酵素样品的反应方程为y=0.0901x+25.346,R2=0.995,V’m=0.039 4 mg/(mL·min),K’m=0.003 6 mg/mL。100 g/L高浓度燕麦酵素样品的反应方程为y=0.146 9x+18.418,R2=0.996 8,V’m’=0.0543 mg(/mL·min),K’m’=0.008 mg/mL。
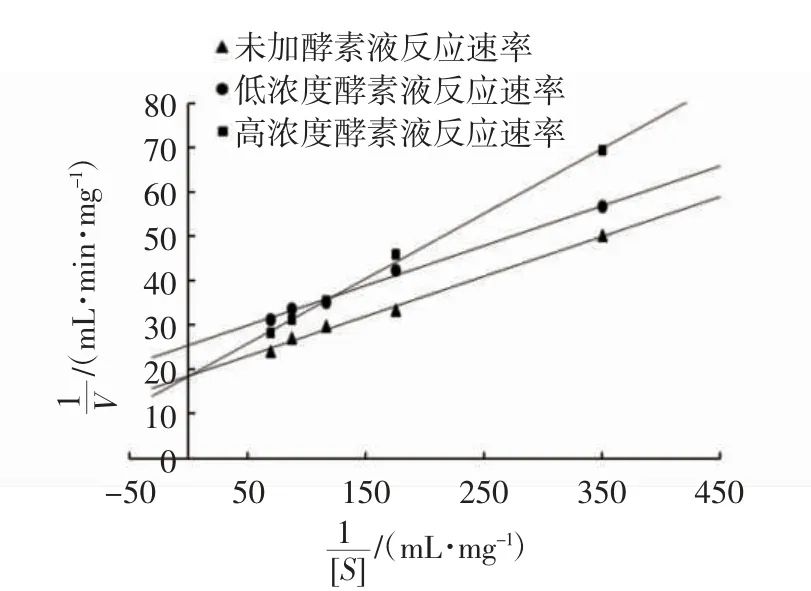
图5 燕麦酵素对α-淀粉酶活性抑制的动力学分析Fig.5 Kinetics of oat Jiaosu on inhibition of α-amylase activity
加入低浓度燕麦酵素后,Vm值变小,同时Km值也变小,因此低浓度燕麦酵素对α-淀粉酶活性的抑制为反竞争性和非竞争性特性混合的抑制类型;加入高浓度燕麦酵素后,Vm值变小,同时Km值变大,因此高浓度燕麦酵素对α-淀粉酶活性的抑制为反竞争性和非竞争性特性混合的抑制类型,这与潘玥等[27]的研究结果一致。
2.4 燕麦酵素中β-葡聚糖、游离氨基酸含量与α-淀粉酶活性抑制效果的相关性
以不同发酵时间的燕麦酵素中β-葡聚糖、游离氨基酸含量为横坐标,α-淀粉酶活性抑制率为纵坐标拟合曲线,考察β-葡聚糖、游离氨基酸含量与α-淀粉酶活性抑制率间是否存在相关性。
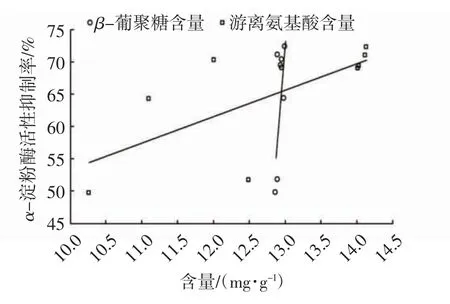
图6 燕麦酵素中β-葡聚糖、游离氨基酸含量与α-淀粉酶活性抑制率的相关性Fig.6 Correlation between the content ofβ-glucan,free amino acid in oat Jiaosu andα-amylase inhibition rate
由图6可以看出:燕麦酵素中的β-葡聚糖含量与α-淀粉酶活性抑制率的线性方程为y=138.92x-1 734.2,R2=0.4825,游离氨基酸含量对α-淀粉酶活性抑制率的线性方程为y=4.093 3x+12.428,R2=0.491 6,说明在发酵过程中随着β-葡聚糖、游离氨基酸含量的增加,其对α-淀粉酶的抑制率呈现增加趋势,均存在着一定的正相关,但相关性不显著,决定系数均小于0.5。
2.5 燕麦酵素中总酚含量、总黄酮含量与α-淀粉酶活性抑制效果的相关性
以不同发酵时间的燕麦酵素中总酚、总黄酮含量为横坐标,α-淀粉酶活性抑制率为纵坐标拟合曲线,考察总酚、总黄酮含量与α-淀粉酶活性抑制率之间是否存在相关性。

图7 燕麦酵素中总酚、总黄酮含量与α-淀粉酶活性抑制率的相关性Fig.7 Correlation between the content of total phenols and total flavonoids in oat Jiaosu andα-amylase inhibition rate
由图7可见:燕麦酵素中的总酚含量与α-淀粉酶活性抑制率的线性方程为y=32.151x+11.068,R2=0.857 8,总黄酮含量与α-淀粉酶活性抑制率的线性方程为y=40.557x+9.004 5,R2=0.918 2,说明在发酵过程中随着总酚、总黄酮含量的增加,其对α-淀粉酶活性的抑制率亦增强,均存在着显著正相关(P<0.05),决定系数分别达到0.857 8和0.918 2。
3 结论
燕麦酵素中β-葡聚糖、游离氨基酸、总酚、总黄酮含量均随着发酵时间的延长而呈现一定的增加趋势,在发酵96 h达到最高,比发酵前分别提高了1.8%、25.46%、40.31%、47.62%;燕麦酵素对α-淀粉酶活性有一定的抑制作用,最高抑制率为72.27%,IC50=30.96 g/L;动力学分析发现,无论是高浓度还是低浓度的燕麦酵素,其对α-淀粉酶活性的抑制类型都是混合型抑制。通过相关性分析可以看出:燕麦发酵过程中,随着总酚、总黄酮、β-葡聚糖、游离氨基酸含量的增加,其对α-淀粉酶活性的抑制作用增强,总酚含量及总黄酮含量均与α-淀粉酶活性的抑制率存在显著正相关(P<0.05),而β-葡聚糖、游离氨基酸含量均与α-淀粉酶活性的抑制率无明显相关性,说明燕麦酵素对α-淀粉酶活性的抑制作用主要是与燕麦酵素中的总酚和总黄酮含量有着密切关系。综上可见,燕麦酵素是一种开发前景广阔、营养丰富、具有较好的营养性和抗氧化性的产品。

