两种配合饲料对美洲鲥幼鱼生长、消化酶和非特异性免疫酶的影响
严银龙 袁新程 施永海 徐嘉波 张之文 邓平平 蒋飞
(上海市水产研究所,上海市水产技术推广站,上海 200433)
美洲鲥(Alosasapidissima)俗称美洲西鲱,隶属于鲱形总目(Clupeomorpha)、鲱形目(Clupeiformes)、鲱科(Clupeidae)、西鲱属(Alosa),主要分布于大西洋西海岸和太平洋海岸,是典型的溯河产卵鱼类。作为北美地区重要的经济鱼类,美洲鲥因其肉质鲜嫩、营养和经济价值较高而被世界各国广泛引种[1-3]。在鱼类养殖过程中,由于不同鱼类的生长和消化等存在差异,选择投喂不同饲料会对其产生不同影响,从而养殖成本也有所不同[4-5]。因此,选择适合特定鱼类的饲料对于提高养殖鱼类的产量和经济效益具有十分重要的意义。目前国内有关美洲鲥的研究主要集中在苗种繁育、生长特性、养殖运输等方面[6-9],而国外对美洲鲥的研究主要集中在捕捞、迁徙及遗传多样性等方面[10-12],至今尚未见关于不同膨化配合饲料对美洲鲥幼鱼生长特性、消化能力和非特异性免疫力影响的研究报道。本研究采用普通膨化配合饲料和特种绿色膨化配合饲料对美洲鲥幼鱼进行饲养试验,比较了这两种配合饲料对美洲鲥幼鱼生长、消化酶及非特异性免疫酶的影响,以期为美洲鲥的健康养殖和专用配合饲料的研发提供基础数据。
1 材料和方法
1.1 试验材料
试验鱼为上海市水产研究所奉贤科研基地当年人工繁育的美洲鲥幼鱼,选取体质量均匀、规格一致的幼鱼进行饲养试验。试验饲料为市场购买的膨化颗粒饲料,分别是普通膨化配合饲料(即常规的海水鱼膨化配合饲料,简称CF)和特种绿色膨化配合饲料(即经过国家绿色认证的膨化配合饲料,简称SF),后者水分和粗脂肪含量少,粗蛋白质含量高,干燥,易保存(见表1)。养殖试验用水由淡水加少量天然海水配制而成,盐度在3~5。试验在上海市水产研究所奉贤科研基地育苗大棚2号棚内进行。试验池为长方形水泥池,规格(长×宽×深)为5.50 m×2.35 m×1.30 m。

表1 两种试验饲料主要营养成分(质量分数) 单位:%
1.2 试验方法
试验自2019年9月4日开始,至10月30日结束,历时8周(56 d)。饲养试验分为2个不同饲料组,每组设3个平行。挑选规格均匀一致的幼鱼随机放入室内水泥池中,每个平行组200尾,共计1 200尾。试验开始前15~20 d,用2种配合饲料按1∶1(质量比)混合均匀后投喂已驯化好的美洲鲥幼鱼。试验前停食1 d,然后拉网,随机捞取30尾幼鱼进行称量,测得试验鱼的初始体质量为(2.81±0.61)g,同时随机捞取10尾幼鱼送至实验室用于初始酶活测定,作为初始组。试验期间,2个试验组分别投喂2种饲料,采用人工抛撒方式投喂,日投2次(9:00和15:00),投饲量以饱食为准。观察美洲鲥幼鱼的摄食情况,看其摄食是否踊跃。每天吸污1次,每周换水1次,换水量为70%。试验期间水温为20~25 ℃,连续不间断充气增氧。
1.3 样品采集
养殖试验结束后,停食1 d,从每个平行组中随机捞取30尾试验鱼,测量其体质量和体长,并随机取10尾鱼送至实验室用于酶活测定。测定步骤:将试验鱼用清水洗净,放于冰盘上进行解剖,取出肝脏、肠和胃,剔除附着物,用事先准备好的生理盐水(4 ℃,0.86%)冲洗后,用滤纸吸干,并按照质量(g)∶体积(mL)为1∶9的比例加入事先预冷的生理盐水,在冰浴下用事先准备好的玻璃匀浆器进行匀浆,制成10%匀浆液,并放入4 ℃的高速离心机中以2 500 r/min离心10 min。取上清液保存于-80 ℃冰箱中,之后进行消化酶、非特异性免疫酶活力的测定。
1.4 试验测定指标和方法
1.4.1 生长性能
生长指标计算公式[13]如下。
成活率(%)=100×(Nt/N0)
(1)
体质量特定增长率(%/d)=100×(lnWt-lnW0)/t
(2)
饲料系数=Wf/(Wt-W0)
(3)
肥满度(g/cm3)=100×Wt/Lt3
(4)

(5)
式(1)~(5)中:N0为试验初始时的美洲鲥幼鱼尾数,Nt为试验结束时的幼鱼尾数;W0为初始体质量(g),Wt为试验终末体质量(g);Lt为试验终末体长(cm);t为试验时长(d);Wf为消耗饲料的干质量(g)。
1.4.2 消化酶及非特异性免疫酶活性
本试验中,鱼消化道和肝脏组织样品中消化酶和抗氧化酶活性的检测均采用南京建成生物工程研究所提供的试剂盒,即C016-1-1淀粉酶(AMS)试剂盒(碘-淀粉比色法)、A054-1-1脂肪酶(LPS)试剂盒(比色法)、A080-1-1胃蛋白酶(PPS)试剂盒、A080-2胰蛋白酶(TPS)试剂盒、A001-1总超氧化物歧化酶(T-SOD)试剂盒(羟胺法)、A007-2过氧化氢酶(CAT)试剂盒(可见光法)、A005谷胱甘肽过氧化物酶(GSH-Px)试剂盒。本试验中所有酶活检测均严格按照试剂盒说明书的检测方法和步骤进行操作。
1.5 数据处理
运用软件EXCEL 2007整理试验数据,用软件SPSS 17.0进行数据处理。利用独立样本t检验比较检验两种饲料对美洲鲥幼鱼生长、消化酶和非特异性免疫酶活力大小的差异性。所得数据均以(平均值±标准差)表示。以P<0.05表示差异显著,P<0.01表示差异极显著。

注:柱状图标有不同字母表示组间差异显著(P<0.05),标有相同字母表示组间差异不显著(P>0.05)。图2 两种饲料对美洲鲥幼鱼消化道中消化酶活力的影响
2 结果
2.1 两种饲料对美洲鲥幼鱼生长指标的影响
经过56 d的养殖试验,美洲鲥幼鱼体质量随时间的变化情况见图1。由图1可见,CF组(投喂普通膨化配合饲料)试验鱼体质量的增长速度要快于SF组(投喂特种绿色膨化配合饲料)。在第28天时,CF组美洲鲥幼鱼的体质量显著大于SF组(P<0.05),且两组间的差异随着养殖时间的延长逐渐增大,在第56天时,CF组幼鱼的体质量极显著大于SF组(P<0.01)。试验鱼的其他生长参数见表2。由表2可见,CF组美洲鲥幼鱼的体质量特定增长率和肥满度均显著大于SF组(P<0.05),且其饲料系数显著小于SF组(P<0.05);CF组的摄食率和成活率与SF组均无显著性差异(P>0.05)。以上结果表明,投喂普通膨化饲料的美洲鲥幼鱼,其生长要快于投喂特种绿色膨化配合饲料的。

表2 两种饲料对美洲鲥幼鱼生长性能的影响
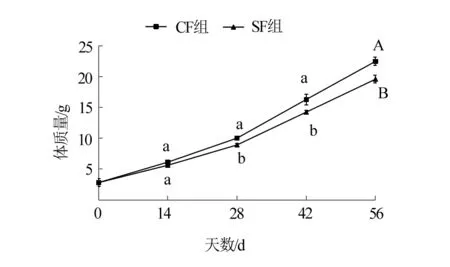
注:同一时间标有不同小写字母表示组间差异显著(P<0.05),标有不同大写字母表示组间差异极显著(P<0.01)。图1 投喂两种配合饲料美洲鲥幼鱼的体质量变化情况
2.2 两种饲料对美洲鲥幼鱼消化道消化酶活力的影响
试验初始和结束时美洲鲥幼鱼消化道消化酶活力大小情况见图2。图2-a和图2-c显示,CF组美洲鲥幼鱼的淀粉酶(AMS)和脂肪酶(LPS)活力均显著大于SF组以及初始组(P<0.05),而SF组与初始组则无显著差异(P>0.05)。图2-b显示,SF组幼鱼的胃蛋白酶(PPS)活力显著大于CF组(P<0.05),二者与初始组均无显著差异(P>0.05)。由图2-d可见,CF组与SF组美洲鲥幼鱼的胰蛋白酶(TPS)活力无显著差异(P>0.05),二者均显著大于初始组(P<0.05)。
2.3 两种饲料对美洲鲥幼鱼肝脏非特异性免疫酶活力的影响
试验初始和结束时美洲鲥幼鱼肝脏非特异性免疫酶活力情况见图3。从图3-a、图3-b中可以看出,CF组幼鱼的过氧化氢酶(CAT)和总超氧化物歧化酶(T-SOD)活力与SF组间均无显著差异(P>0.05)。图3-c显示,SF组幼鱼的谷胱甘肽过氧化物酶(GSH-Px)活力显著大于CF组(P<0.05)。CF组幼鱼的3种非特异性免疫酶活力与初始组相比均有所降低,但均无显著性差异(P>0.05)。SF组幼鱼的T-SOD活力显著小于初始组(P<0.05),而CAT和GSH-Px活力与初始组相比均略有升高,但无显著性差异(P>0.05)。

注:柱状图标有不同字母表示组间差异显著(P<0.05),标有相同字母表示组间差异不显著(P>0.05)。图3 两种饲料对美洲鲥幼鱼肝脏中非特异性免疫酶活力的影响
3 讨论
3.1 两种配合饲料对美洲鲥幼鱼生长的影响
在水产养殖生产中,投喂不同饲料会对水产动物的生长率、摄食率、饲料转化率和成活率等指标造成影响,也间接影响着养殖产量和经济效益[14-15]。蒋飞等[16]研究发现,投喂软性颗粒饲料对褐菖鲉(Sebastiscusmarmoratus)幼鱼的生长有一定促进作用,其体质量相对增长率显著大于投喂膨化颗粒饲料的。柯玉清等[17]发现,投喂配合饲料、蚯蚓、鲢肉3种不同饲(饵)料对黄鳝(Monopterusalbus)的体质量增长率有显著影响。汤保贵等[18]也发现,不同饵料系列(轮虫、卤虫无节幼体、桡足类和鱼糜)对军曹鱼(Rachycentroncanadum)生长和成活率的影响明显不同。本研究也发现相似的结果。经过56 d的饲养,投喂普通膨化配合饲料的美洲鲥幼鱼,其生长速度快于投喂特种绿色膨化配合饲料的,尤其表现在体质量的增长速度方面,随着养殖时间的延长,投喂两种饲料的试验组,幼鱼体质量的差异越来越大,当饲养至第56天时,两组幼鱼的体质量出现极显著差异(P<0.01)。同时,投喂普通膨化配合饲料的美洲鲥幼鱼,其体质量特定增长率和肥满度均显著大于特种绿色膨化配合饲料组(P<0.05),且饲料系数显著低于特种绿色膨化配合饲料组(P<0.05),表明普通膨化配合饲料更有利于美洲鲥幼鱼的生长。究其原因,一方面可能是普通膨化配合饲料中粗脂肪的质量分数(5.43%,干质量)相对较高,提高了饲料转化率,降低了饲料系数[19],而特种绿色膨化配合饲料中粗脂肪的质量分数(2.72%,干质量)相对较低;另一方面,可能是普通膨化配合饲料在生产过程中添加了二十碳五烯酸(EPA)或二十二碳六烯酸(DHA),或两者均添加,提高了饲料转化率及鱼的生长速度,增强了鱼的消化吸收功能[20]。诸多研究表明,配合饲料中粗蛋白质含量的高低对鱼类生长有明显影响[15-16]。本研究所用普通膨化配合饲料和特种绿色膨化配合饲料中粗蛋白质含量是否对美洲鲥幼鱼的生长有影响还需进一步研究。根据本研究结果,建议特种绿色膨化饲料研制和生产厂家应优化配合饲料配方比例,适当增加饲料中粗脂肪的含量,以满足美洲鲥幼鱼生长的需求。
3.2 两种饲料对美洲鲥幼鱼消化酶活力的影响
消化酶作为鱼类机体消化生理及吸收外界营养物质的重要参与者,其活性大小在一定程度上直接反映了鱼类机体对营养物质消化、吸收能力的大小[21]。食物在动物体内能激发消化酶的产生,当鱼类摄食饲料时,会引起其体内消化酶活力的变化[22]。因此,在鱼类养殖过程中,饲料的营养组成和含量与鱼的消化酶活力有密切联系[14]。有研究表明,饲料中粗蛋白质的含量与鱼类胃蛋白酶活力有关。宋林等[23]发现,翘嘴鲌(Culteralburnus)体内胃蛋白酶的活力受饲料中粗蛋白质含量影响显著,并随着粗蛋白质含量减少而明显降低。黄峰等[24]对南方鲇(Silurusmeridionalis)的研究也发现,鱼体内胃蛋白酶的活力与饲料中的粗蛋白质含量呈正相关。本研究中,普通膨化配合饲料的粗蛋白质含量显著低于特种绿色膨化配合饲料的,从而导致投喂普通膨化配合饲料的美洲鲥幼鱼,其胃蛋白酶活力显著低于特种绿色膨化配合饲料组,这与上述研究结果相一致。
饲料中粗脂肪含量的高低与鱼类机体中脂肪酶的活力存在着密切相关性。Cara等[25]研究发现,在投喂高脂肪含量的配合饲料之后,重牙鲷(Diplodussargus)幼鱼体内的脂肪酶活力显著增加,说明幼鱼体内脂肪酶活力与配合饲料中脂肪的含量具有正相关性。李芹等[26]研究发现,瓦氏黄颡鱼稚鱼机体中脂肪酶活力的大小与饲料中脂肪的含量呈正相关关系;Nagase[27]则发现,莫桑比克罗非鱼(Tilapiamossambica)体内脂肪酶的活力与所摄食的饵料无密切相关性。本研究结果显示,普通膨化配合饲料组幼鱼的脂肪酶活力显著高于特种绿色膨化配合饲料组,这主要是因为普通膨化配合饲料中粗脂肪含量相对较高,美洲鲥幼鱼摄食后,高脂肪含量饲料刺激其释放出大量脂肪酶进行食物消化。这一结果也在Cara等[25]和李芹等[26]的研究中得到证实,但与Nagase[27]的研究结果不同,这可能与试验鱼种类、试验条件和脂肪源不同有关。
国内外的一些研究表明,鱼体内淀粉酶的活力与摄食饲料中淀粉的含量呈正相关关系[14,26,28],而另一些研究结果则相反[15,29],这可能是由于试验条件、鱼的种类及其摄食习性不同造成的。本研究结果与前者相一致。本试验所用普通膨化配合饲料中的粗灰分含量显著大于特种绿色膨化配合饲料,淀粉含量也高于特种绿色膨化配合饲料的,因此,投喂普通膨化配合饲料幼鱼的淀粉酶活力显著高于投喂特种绿色膨化配合饲料的。幼鱼机体消化淀粉等碳水化合物的能力较强,当饲料中的淀粉含量较高时,鱼类机体受到刺激,会产生更多淀粉酶来消化体内的淀粉。本研究中,两种不同饲料试验组间的胰蛋白酶活力没有显著差异,但均显著高于初始组,这可能与美洲鲥幼鱼的生长发育有关。随着机体发育并不断完善,鱼体产生胰蛋白酶的能力随之增强,因此胰蛋白酶活力显著高于初始组。
3.3 两种饲料对美洲鲥幼鱼非特异性免疫酶活力的影响
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)是水产动物体内重要的非特异性免疫酶。这3种酶在生物体的自我保护系统中起着重要作用,是自我防护防御系统的关键性酶。因此,非特异性免疫酶在鱼类抵御外源有害微生物过程中的作用极其重要[30-31]。其中,SOD能够通过歧化反应催化超氧阴离子自由基(O2-),生成H2O2和O2,是O2-的清除剂;CAT和GSH-Px两种酶可将肌体细胞中的H2O2转变为水,进而保护生物机体不受O2-的伤害[32]。因此SOD、CAT和GSH-Px均是鱼类机体内关键性的抗氧化酶,也是评价水产动物非特异性免疫酶能力大小的重要参数。本研究中,普通膨化配合饲料组幼鱼机体中SOD和CAT的活力与特种绿色膨化配合饲料组均无显著差异,说明美洲鲥幼鱼摄食这两种配合饲料对SOD和CAT无影响。这与施永海等[15]报道的配合饲料和活饵料对刀鲚幼鱼肝脏中SOD和CAT活力无显著影响的研究结果相似。投喂特种绿色膨化配合饲料组美洲鲥幼鱼机体中GSH-Px的活力显著大于投喂普通膨化配合饲料组,说明特种绿色膨化配合饲料可使其机体内GSH-Px的活力明显增强,从而对外界环境的抗逆性更高。相似结果也出现在对褐菖鲉幼鱼的研究[16]中。
4 结论
从本研究结果看,普通膨化配合饲料不仅可以促进美洲鲥幼鱼的生长,显著提高幼鱼的体质量特定增长率和肥满度,还能有效降低饲料系数,提高饲料利用率。同时,投喂普通膨化配合饲料,美洲鲥幼鱼的消化能力得到提升,尤其是对淀粉和脂肪的消化能力提高。特种绿色膨化配合饲料可显著提高美洲鲥幼鱼的非特异性免疫力,使其抗逆性更强,但对消化能力提高作用不明显。由此可见,投喂普通膨化配合饲料,美洲鲥幼鱼生长更快,而投喂特种绿色膨化配合饲料,美洲鲥幼鱼的非特异性免疫能力更强。因此建议,应按照养殖生产的需求,改进饲料配方,获取更加优质、高效的配合饲料,以满足美洲鲥规模化养殖的需要。

