润目灵护眼液治疗苯扎氯铵诱导的干眼症及其作用机制研究
宋健涛,刘鑫,祁兴华,张巧,陈忆菁,朱慧,裴科,段煜,蔡皓
(1.南京中医药大学药学院,江苏 南京 210023;2.南京中医药大学国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023;3.南京中医药大学网络管理与信息化办公室,江苏 南京 210023;4.山西中医药大学中药与食品工程学院,山西 晋中 030619)
干眼症是一种多因素疾病,常引起眼部不适或视力障碍,并伴有不同程度的眼表上皮病变、炎症和神经感觉异常[1]。在中国,约有31%的人患有干眼症,成年人患病率大约为21%。流行病学调查结果显示,干眼症发病率与年龄、性别、地区和医疗水平密切相关[2-3]。
干眼症的潜在发病机制通常被认为与眼表高渗环境引起的炎症反应有关,角膜高渗环境激活炎症信号通路导致眼表炎症,最终形成干眼症[4]。中医临床上常用的润目灵颗粒对治疗干眼症具有一定的疗效[5],但其发挥治疗效果的药效物质基础和作用机制目前尚不明晰。
经研究和提取分析发现,润目灵组方含有较多的黄酮类化合物,且有关文献[6-7]已证实其方中含有的金丝桃苷和木犀草苷等成分具有显著的体内外抗炎和抗氧化等作用,并可在一定程度上抑制TNF-α和IL-6等炎症细胞因子的活性。同时,方中含有的绿原酸具有抗炎、抗氧化以及调节细胞凋亡等功效[8-9]。
基于上述研究,本实验在原方基础上,拟通过提取工艺的优化来提高绿原酸、金丝桃苷和木犀草苷的含量。通过比较不同给药组间对苯扎氯铵诱导的干眼症模型兔的治疗效果,探索润目灵组方治疗干眼症的药效物质基础及作用机制。
1 材料
1.1 实验动物
清洁级3~4月龄新西兰大白兔16只(雌雄各半,2.0~2.5 kg),购自江苏振林生物科技有限公司,许可证号:SCXK(苏)2021-0011。动物饲养于南京中医药大学实验动物中心,饲养条件:室温(23±2)℃,相对湿度(60±10)%,自由摄食及饮水。整个实验研究过程严格遵守动物实验的各项伦理规定,并获得南京中医药大学实验动物伦理委员会批准(批准号:202109A018)。
1.2 实验仪器
裂隙灯显微镜(BL-5000,上海博览光电仪器有限公司);超声雾化机(WH-802,粤华医疗器械厂有限公司);酶标仪(iMark,美国Bio-Rad公司);倒置显微镜(Zeiss Axion A1,德国Carl Zeiss公司);生物样品匀质仪(Bioprep-24,杭州奥盛仪器有限公司);共聚焦激光扫描显微镜(AE41,厦门麦克奥迪电气股份有限公司);纯水机(TANKPE060,美国Millipore公司)。
1.3 药品及试剂
润目灵组方中的鬼针草BidenspilosaLinn(产地:安徽亳州,批号:210101)、枸杞LyciumchinenseMil(产地:宁夏,批号:210702)以及菊花ChrysanthemummorifoliumRamat(产地:浙江嘉兴,批号:210408)均购自安徽亳州京皖中药饮片厂,经南京中医药大学药学院陈建伟教授鉴定为正品。苯扎氯铵(批号:A194586)购自南京晚晴化玻仪器有限公司;荧光素钠试纸与泪液分泌检测试纸购自天津晶明新技术开发有限公司;兔白细胞介素6(IL-6)ELISA试剂盒(批号:ML027844)和兔肿瘤坏死因子-α(TNF-α)ELISA试剂盒(批号:ML028087)均购自上海酶联生物科技有限公司;4%多聚甲醛(批号:BL539A)购自Biosharp生物科技有限公司;PBS缓冲液(批号:SH30256.01B)购自美国Hyclone公司;NF-κB P65(批号:AF00726)、P-P65(批号:AF06781)、MUC5AC(批号:AF20123)、TNF-α(批号:AF06294)、JNK(批号:AF02708)、P-JNK(批号:AF00640)、P38(批号:AF07562)、P-P38(批号:AF00638)和MMP-9(批号:AF06799)均购自湖南艾方生物科技有限公司。
2 方法
2.1 分组及模型制备
新西兰兔实验前经裂隙灯显微镜检查无眼部异常,随机分为空白对照组、模型组、原方组和考察组,每组4只。除空白对照组外,其余各组每日2次双眼滴加0.2%苯扎氯铵溶液1滴,点眼后手动闭合眼睑10 s,共持续14 d[10]。
2.2 润目灵护眼液的制备及给药方式
润目灵护眼液原方组参照江苏省中医院制备方法,即称取鬼针草30 g,枸杞15 g,菊花6 g,加8倍量纯水,浸泡30 min,武火煮沸并保持微沸煎煮15 min,四层纱布过滤[11]。浓缩至生药量为0.51 g·mL-1,4 ℃保存。
考察组由实验前期对原方组进行工艺优化而得,制备方法为称取鬼针草30 g,枸杞15 g,菊花6 g,加14倍量纯水,浸泡30 min,武火煮沸并保持微沸煎煮15 min,提取2次,四层纱布过滤。浓缩至生药量为0.51 g·mL-1,4 ℃保存。
经HPLC测定,原方组中绿原酸、金丝桃苷、木犀草苷的浓度分别为0.123 63、0.017 25、0.095 83 mg·mL-1;考察组中绿原酸、金丝桃苷、木犀草苷的浓度分别为0.225 18、0.042 11、0.183 10 mg·mL-1。
本实验采用超声雾化机给药,在造模14 d后,取50 mL药液置于超声雾化机内雾化,每日给予新西兰兔双眼熏蒸20 min,持续给药14 d。
2.3 Schirmer试纸测定兔眼泪液分泌量
实验第0、3、5、7、14、21、28天时,使用Schirmer试纸测量兔眼泪液分泌量。具体方法为:将Schirmer纸条插入兔眼的下眼睑中、外三分之一交界处附近的结膜囊位置,5 min后读取湿纸条的长度(mm),为保证实验结果的客观性和准确性,每次每只兔子双眼均由同一人完成。
2.4 荧光素钠试纸测定兔眼泪膜的稳定性及兔眼角膜染色评分
分别于实验第0、3、5、7、14、21、28天进行兔眼泪膜破裂时间测定。手持荧光素钠试纸底端,在试纸表面滴加2滴生理盐水稀释,将试纸头部置于兔眼的下结膜囊内5 s后取出,手动闭合眼睑数次,使荧光素钠均匀分布在眼表,在裂隙灯的钴蓝光下用宽裂隙带观察,最后一次瞬目后睁眼至角膜出现第1个黑斑的时间为泪膜破裂时间,连续测量3次取平均值。
将生理盐水稀释后的试纸,轻抚于兔眼表面,使荧光素钠分布均匀,2 min后,在裂隙灯的钴蓝光下用宽裂隙带观察并进行评分。本次实验采用NEI角膜荧光染色评分分级法[12],NEI干眼症临床试验研讨会推荐的分级系统将角膜分为5个区:中央区、上区、颞区、鼻区和下区。对于每个区域,角膜荧光素染色的数量在0到3的范围内分级:0级正常或阴性裂隙灯发现;1级轻度或浅层点画;2级中度或点状染色,包括角膜表面磨损;3级严重磨损或角膜侵蚀、角膜深层磨损或复发性侵蚀。最大分数为15分。
2.5 HE切片染色观察眼表组织
空气栓塞法处死实验兔后,取兔眼的下角膜和睑结膜,用4%多聚甲醛固定24 h以上。脱水后石蜡包埋、切片并进行HE染色,在光学显微镜下观察并拍照。
2.6 免疫荧光染色法测定兔眼结膜中MUC5AC表达水平
所有样本在4 ℃的丙酮中固定10 min,磷酸盐缓冲溶液(PBS,pH 7.4)洗涤3次,每次5 min。滴加非免疫正常山羊血清100 μL,室温孵育30 min,与MUC5AC(1∶100)抗体4 ℃孵育过夜。PBS洗涤后,将样本与4',6-二脒基-2-苯基吲哚(DAPI)结合的FITC山羊抗兔在室温下孵育50 min,玻片置于PBS中,在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后在圈内滴加自发荧光淬灭剂孵育5 min,流水冲洗15 min。在载玻片的组织中央滴加适量抗荧光淬灭封片液,盖上盖玻片。在共聚焦激光扫描显微镜下观察,采用image J软件进行平均荧光强度计算。
2.7 ELISA法测定兔眼泪腺、房水及哈氏腺中TNF-α和IL-6表达水平
取兔眼泪腺、房水及哈氏腺,经匀浆机匀浆后,取上清液,严格按照各试剂盒说明书测定TNF-α和IL-6的含量。
2.8 Western blot法测定兔眼角膜组织中P38、P-P38、P-P65、NF-κB P65、TNF-α、MMP-9及MUC5AC蛋白表达水平
取适量新鲜兔眼角膜用PBS清洗2~3次,剪成小块置于匀浆机中,加入RIPA裂解液与蛋白酶抑制剂,置于冰上充分匀浆。结束后,收集匀浆液,12 000 r·min-1离心10 min,取上清液,采用BCA法测定上清液中蛋白浓度。SDS-PAGE凝胶电泳,转膜后,5%BSA封闭。封闭结束,加入一抗JNK (1∶500)、P-JNK(1∶500)、P38 (1∶800)、P-P38(1∶800)、P-P65(1∶800)、NF-κB P65(1∶1 000)、TNF-α(1∶500)、MMP-9(1∶1 000)及MUC5AC(1∶1 000),4 ℃孵育过夜。次日,洗膜,二抗(1∶200)室温孵育1 h,洗膜后,ECL化学发光法显影,Image J软件进行灰度值定量。
2.9 统计学分析

3 结果
3.1 润目灵组方对干眼症模型兔眼泪液分泌量的影响
Schirmer试纸的测量结果如图1所示。0~7 d内,与空白对照组相比,其余各组具有下降趋势,但无显著性差异。造模第10、14天差异具有显著性(P<0.05),兔眼泪液的分泌量小于15 mm,表明模型复制成功。
超声雾化给药1周后(第21天),与模型组相比,考察组兔眼泪液的分泌量明显增加(P<0.01),原方组无明显差异,且考察组兔眼泪液的分泌量与原方组相比显著升高(P<0.01)。超声雾化给药2周后(第28天),与模型组相比,原方组试纸润湿长度明显增加(P<0.05)。

注:与空白对照组相比,ΔP<0.05;与模型组相比,*P<0.05,**P<0.01;与原方组相比,图1 润目灵组方对兔眼泪液分泌量的影响Fig.1 Effects of Runmuling formula on tear secretion in rabbit eyes
3.2 荧光素钠眼表染色实验
3.2.1 润目灵组方对干眼症模型兔眼泪膜破裂时间的影响 荧光素钠试纸测定兔眼泪膜破裂时间的结果如图2所示。造模第7、14天,与空白对照组相比,其余各组兔眼泪膜的稳定性变差,破裂时间缩短(P<0.05)。实验第21、28天,与模型组相比,原方组与考察组实验兔的泪膜稳定性显著提高(P<0.05)。原方组与考察组两者之间无明显差异(P>0.05)。
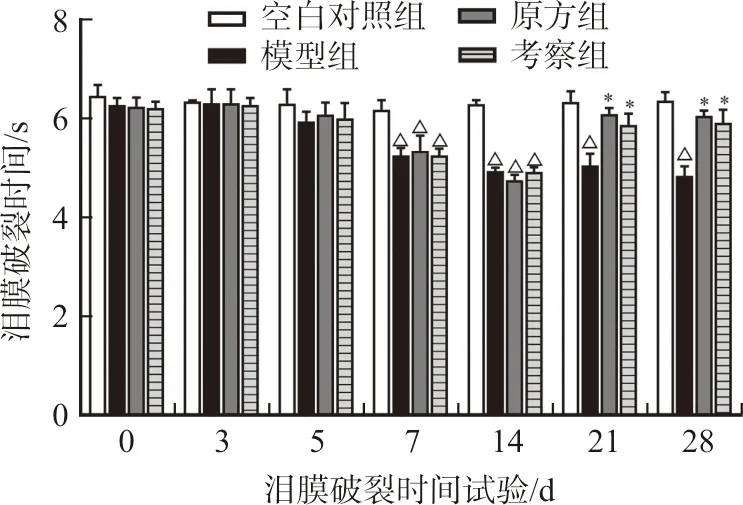
注:与空白对照组相比,ΔP<0.05;与模型组相比,图2 润目灵组方对干眼症模型兔眼泪膜稳定性的影响Fig.2 Effects of Runmuling formula on tear film stability in rabbit xerophthalmia model
3.2.2 润目灵组方对干眼症模型兔眼角膜受损的影响 荧光素钠试纸兔眼角膜染色评分的结果如图3~4所示。在基线检查时,各组之间的最小角膜点状染色没有显著性差异。在第5、7、14天,空白对照组与模型组之间存在显著性差异(P<0.05,P<0.01)。第21、28天,原方组和考察组的兔眼角膜染色评分较模型组显著下降(P<0.05,P<0.01)。
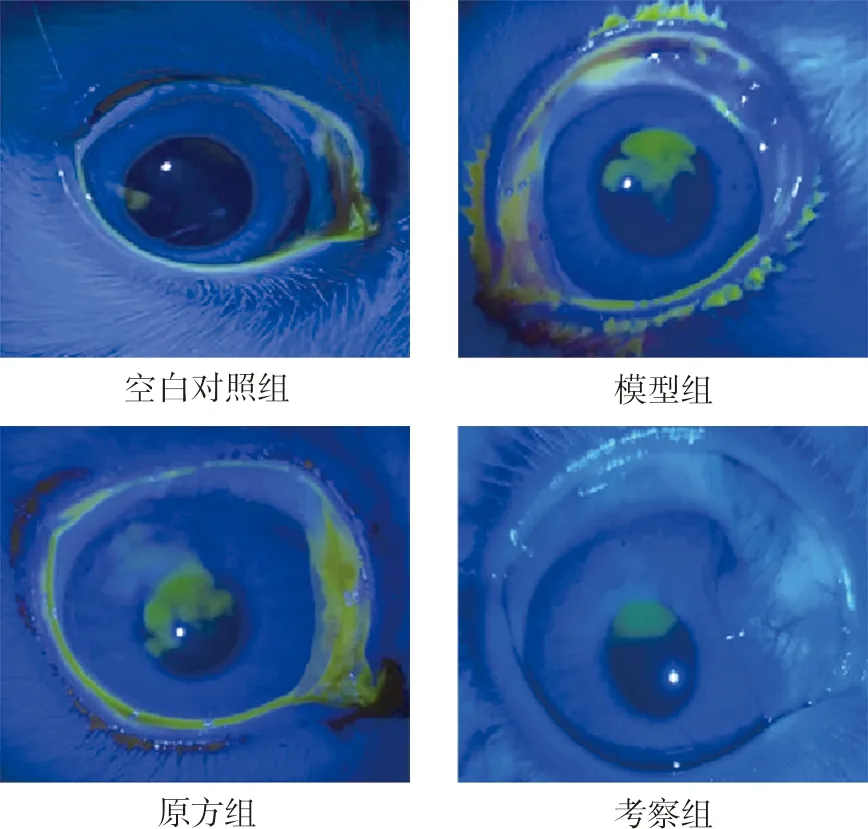
图3 造模第14天荧光素钠试纸染色不同程度的眼表损伤Fig.3 Varying degrees of ocular surface damage after staining with sodium fluorescein test strip at d14 of modeling
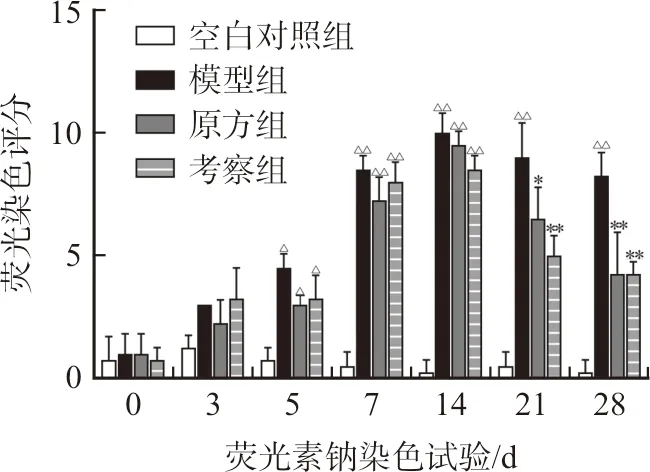
注:与空白对照组相比,ΔP<0.05,ΔΔP<0.01;与模型组相比,图4 润目灵组方对干眼症模型兔眼角膜荧光染色评分的影响Fig.4 Effects of Runmuling formula on scores of corneal fluorescence staining in rabbit xerophthalmia model
3.3 润目灵组方对干眼症模型兔眼结膜中MUC5AC表达水平的影响
如图5所示,绿色代表MUC5AC染色,而蓝色代表Hoechst 33342染核。
空白对照组可见多数结膜细胞被MUC5AC抗体染色。与空白对照组相比,模型组中几乎未见兔眼结膜细胞被MUC5AC抗体染色(P<0.01)。与模型组相比,原方组与考察组中少量兔眼结膜细胞被MUC5AC抗体染色(P<0.05,P<0.01),同时,考察组中被MUC5AC抗体染色结膜细胞明显多于原方组(P<0.05),提示干眼症经润目灵治疗后,眼表损伤得到改善,且考察组效果优于原方组。
3.4 润目灵组方对干眼症模型兔眼角膜、球结膜和睑结膜的影响
结果如图6所示。光学显微镜下可观察到空白对照组兔眼角膜基质中有3~5层上皮细胞和胶原纤维。与空白对照组相比,模型组的兔眼角膜上皮变薄同时存在炎性细胞浸润;原方组上皮细胞与基质中均存在炎性细胞浸润,兔眼角膜上皮细胞变薄;考察组兔眼角膜各层的结构是整合的,各层之间界限明显,兔眼角膜上皮细胞层无坏死或脱落,基质无明显的炎性细胞浸润和增多。
空白对照组兔眼球结膜和睑结膜均包含1个立方基底上皮层和3或4个上覆的柱状层,其间散布着杯状细胞。模型组兔眼球结膜和睑结膜均变薄并失去立方层,PAS阳性杯状细胞显著减少。原方组和考察组兔眼球结膜和睑结膜组织中杯状细胞的数量均有增加。

注:与空白对照组相比,ΔΔP<0.01;与模型组相比,*P<0.05,**P<0.01;与原方组相比,图5 润目灵组方对干眼症模型兔眼结膜中MUC5AC表达水平的影响Fig.5 Effects of Runmuling Formula on expression levels of conjunctival MUC5AC in rabbit xerophthalmia model
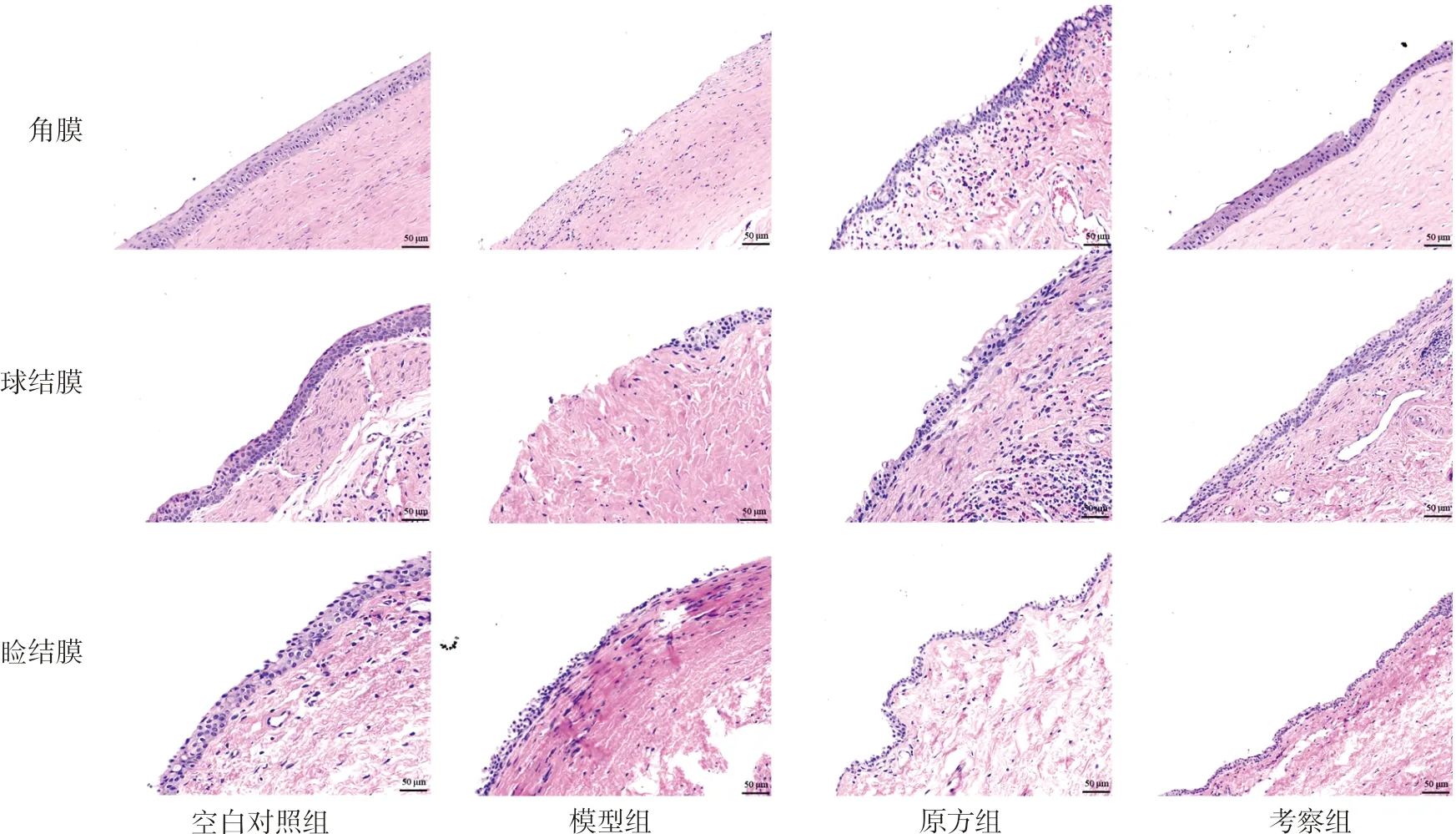
图6 润目灵组方对干眼症模型兔眼角膜、球结膜和睑结膜的影响Fig.6 Effects of Runmuling formula on cornea, bulbar conjunctiva and palpebral conjunctiva in rabbit xerophthalmia model
3.5 润目灵组方对干眼症模型兔眼泪腺、房水及哈氏腺中TNF-α及IL-6表达水平的影响
结果如图7所示。与空白对照组相比,模型组中兔眼泪腺和房水中TNF-α的表达水平显著升高(P<0.01)。与模型组相比,原方组和考察组兔眼泪腺与房水中TNF-α的表达水平均显著降低(P<0.01)。兔眼哈氏腺中各组TNF-α的表达水平均未表现出差异性。
与空白对照组相比,模型组中兔眼泪腺和房水中IL-6的表达水平显著升高(P<0.01)。与模型组相比,原方组和考察组兔眼泪腺和房水中IL-6的表达水平显著降低(P<0.05,P<0.01)。原方组与考察组之间兔眼房水中IL-6的表达水平也具有显著性差异(P<0.05)。兔眼哈氏腺中各组IL-6的表达水平均未表现出差异性。
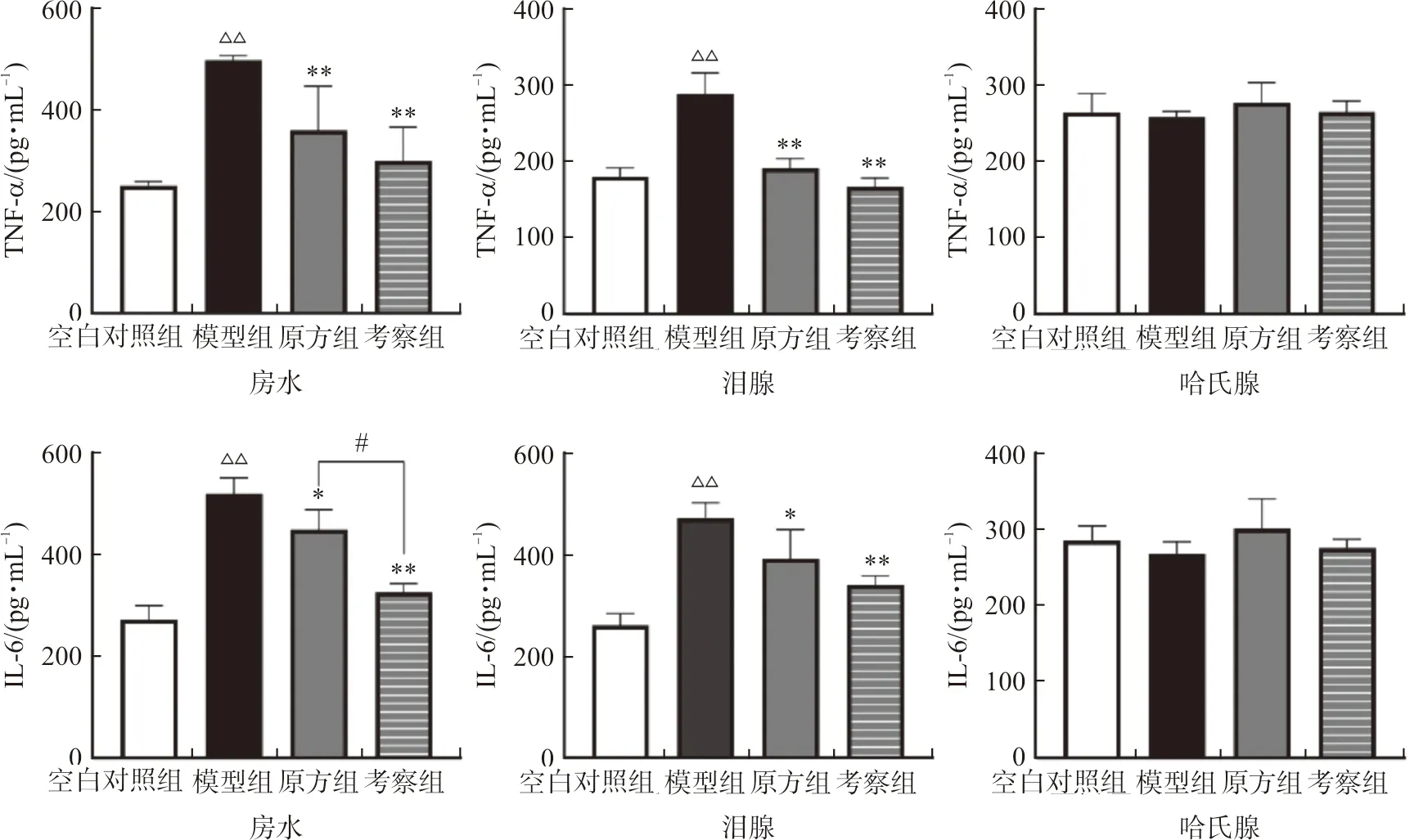
注:与空白对照组相比,△△P<0.01;与模型组相比,*P<0.05,**P<0.01;与原方组相比,图7 润目灵组方对干眼症模型兔眼泪腺、房水及哈氏腺中TNF-α及IL-6表达水平的影响Fig.7 Effects of Runmuling formula on expression levels of TNF-α and IL-6 in lacrimal gland, aqueous humor, and Harderian gland in rabbit xerophthalmia model
3.6 润目灵组方对干眼症模型兔眼角膜中 P-JNK/JNK、P-P38/P38、P-P65/P65、TNF-α、MMP-9 及 MUC5AC 蛋白表达水平的影响
结果如图8~9所示。与空白对照组相比,模型组兔眼角膜组织P-JNK/JNK、P-P38/P38、P-P65/P65及TNF-α的蛋白表达均显著升高(P<0.01,P<0.001);与模型组相比,原方组与考察组P-JNK/JNK、TNF-α、P-P38/P38、P-P65/P65的蛋白表达水平显著降低(P<0.05,P<0.01),且与原方组相比,考察组P-P38/P38和P-P65/P65的改善效果更加明显(P<0.05)。
与模型组相比,原方组与考察组中MUC5AC蛋白表达水平提高(P<0.05,P<0.01),且考察组的上升趋势与原方组相比更为显著(P<0.05)。与模型组相比,考察组中MMP-9的表达水平显著降低(P<0.01),原方组次之(P<0.05),且考察组与原方组相比,两者具有一定的差异性(P<0.05)。
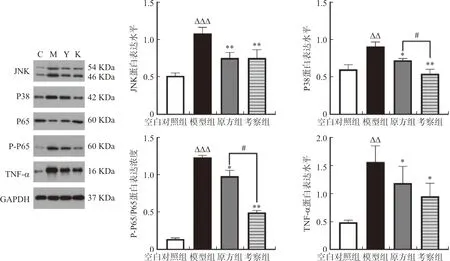
注:C.空白对照组;M.模型组;Y.原方组;K.考察组;与空白对照组相比,ΔΔP<0.01,ΔΔΔP<0.001;与模型组相比,*P<0.05,**P<0.01;与原方组相比,图8 润目灵组方对干眼症模型兔眼角膜中JNK/P38通路相关蛋白表达水平的影响Fig.8 Effects of Runmuling formula on expression levels of JNK/P38 pathway related proteins in cornea in rabbit xerophthalmia model
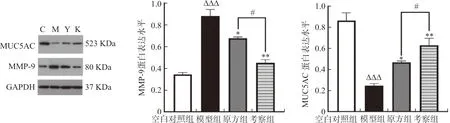
注:C.空白对照组;M.模型组;Y.原方组;K.考察组;与空白对照组相比,ΔΔΔP<0.001;与模型组相比,*P<0.05,**P<0.01;与原方组相比,图9 润目灵组方对干眼症模型兔眼角膜中MMP-9和MUC5AC蛋白表达水平的影响Fig.9 Effects of Runmuling formula on expression levels of MMP-9 and MUC5AC proteins in cornea in rabbit xerophthalmia model
4 讨论
干眼症从临床角度一般可分为水样缺乏性和过度蒸发性2种类型,但2者的发病机制与病理表征是相互交错的。通常认为,滴加苯扎氯铵溶液会使眼表黏蛋白发生改变,而黏蛋白是维持泪膜稳定性和质量的关键因素[13]。泪膜的不稳定会导致眼表过度蒸发,形成高渗环境,从而引发炎症。同时,炎症会干扰与角膜或结膜上皮细胞结合的黏蛋白分泌,影响杯状细胞的分化和增殖,最终加重眼表高渗环境,形成恶性循环[14]。因此,炎症可能不是导致干眼症形成的根本原因,但常被认为是干眼症发病潜在机制的一部分。
以往文献证明,黄酮类化合物具有较好的抗炎效果。例如,杨梅素和槲皮素通过抑制体内外NF-κB的表达来调节TNF-α水平[15]。金丝桃苷通过抑制TNF-α、IL-6和一氧化氮等炎症因子的产生发挥抗炎作用[16]。此外,绿原酸可通过抑制TNF-α和IL-6等炎症因子的活化以及影响花生四烯酸的代谢进而调节炎症[17]。
实验前期利用加权评分法结合Box-Behnken设计-响应面法优化润目灵护眼液提取工艺,将优化后的药液设立为考察组与原方组进行药效对比。从实验结果我们得出结论,兔干眼症模型经过考察组治疗2周后,在泪液分泌量、MUC5AC的表达以及角膜、球结膜和睑结膜的修复等方面均明显优于原方组(P<0.05)。与原方组相比,考察组兔眼房水中IL-6的表达水平和角膜中P-P38/P38、P-P65/P65、MMP-9的蛋白表达水平显著降低(P<0.05)。在荧光素钠染色实验中,考察组和原方组虽然最终染色评分相同,但考察组眼表损伤修复得更快。以上实验结果表明,润目灵组方中金丝桃苷、木犀草苷和绿原酸成分含量的提高对于干眼症的治疗具有积极的作用。
本次研究采用的Schirmer试验可直观比较样本泪液的分泌情况,是评价干眼症模型的经典方法。进行Schirmer试验时可预先进行眼表麻醉并清除多余的泪液,这样可提高实验的重复性,但表面麻醉对于泪液分泌是否具有影响尚不明确。本实验未采取眼表麻醉,而是通过手动闭合兔眼睑来减少眨眼所导致反射的泪液产生,因此可能会导致测量数据偏高[18]。
荧光素钠染料是评估眼表状况最简单和最常用的技术之一。荧光素能够染色死亡或垂死的上皮细胞,并作为细胞死亡或损伤的标志物。通过比较染色评分可以看出,经润目灵方治疗后染色评分降低,说明眼表损伤得到修复,但不能推断其作用方式是直接修复角膜损伤还是通过抑制炎症发生来促进眼表进行自我修复。此外,针对局部应用染料来评价眼表的作用机制缺少研究支持,同时从定性的角度来看,仅凭荧光强度和染色面积评判损伤情况较为主观,应用主观定量评分技术进行一致的诊断评估和比较可能缺乏严谨性[19]。因此,荧光素钠染色目前只能作为一种评判的辅助手段,而非主要指标。
MUC5AC是一种在结膜杯状细胞中分泌并聚合形成凝胶的黏蛋白,结膜杯状细胞是润滑和保护眼表黏蛋白的主要来源[20]。由于黏蛋白的分泌减少所引起的眼表润滑不良,可能会导致泪膜的不稳定。免疫荧光的结果进一步说明滴加苯扎氯铵会影响结膜杯状细胞,导致MUC5AC的分泌减少,光学显微镜下也证实了这一点,受损眼表可直观看到上皮细胞的坏死、增生和基质变薄。而润目灵组方对角膜和结膜的修复具有促进作用,同时会增加黏蛋白的表达,保护眼表。
本实验通过测定TNF-α和IL-6的表达水平,说明干眼症模型兔泪腺及房水中含有较高的炎症因子表达水平,印证了干眼症与炎症具有一定的相关性。P-JNK/JNK、P-P38/P38、P-P65/P65及TNF-α表达结果显示,与模型组相比,原方组与考察组的兔眼角膜中JNK/P38通路的相关蛋白表达降低,提示干眼症的发生与炎症通路激活具有相关性,滴加苯扎氯铵形成的干眼症是由于破坏眼表黏蛋白层,在眼表形成高渗环境,激活了JNK/P38通路,导致NF-κB的磷酸化以及基质金属蛋白酶(MMPs)的产生,引起促炎症因子的活化,使炎症因子TNF-α转化为活性形式,形成眼表炎症。由于炎症的存在,结膜杯状细胞受损,影响泪膜稳定性,眼表水分过度蒸发形成干眼症。
综上所述,润目灵组方能够治疗苯扎氯铵诱导的干眼症模型,其作用机制是通过抑制JNK/P38通路发挥抗炎效果,并在干眼症的发病过程中发挥免疫调节作用。

