PI-RADS v2.1 中DWI 评分和ADC 值与前列腺癌Gleason 分级分组的相关性
杨 聪,田荣华,康嗣如,邹语嫣,刘绪纶,缴春悦
1.锦州医科大学孝感市中心医院研究生培养基地,湖北 孝感 432000;2.武汉科技大学附属孝感医院磁共振室,湖北 孝感432000
前列腺癌是男性常见恶性肿瘤,常伴淋巴结转移和骨转移等[1-2]。目前,被广泛接受的Gleason 分级分组(Gleason Grade Groups,GGG)以预后为基础将前列腺癌划分为5 个等级,其中Gleason 评分用于评价前列腺癌恶性程度。有研究发现,前列腺癌穿刺活检标本与根治性前列腺切除术术后大体标本的Gleason评分存在偏差,导致临床医师在治疗方案的制订上产生困惑[3-4]。由于大量早期前列腺癌患者无明显症状,且穿刺活检具有一定缺点,因此探寻无创、灵敏、简便且可重复性高的诊断工具或方法规范分期并确诊非常重要。MRI 检查具有多方位、无辐射及对前列腺各带和周围结构组织分辨力高等优势,在前列腺癌的诊断、评估病灶的侵袭转移情况和活检前风险分级中具有重要作用[2,5]。DWI 在前列腺癌中的应用价值也受到广泛关注。本研究旨在探讨前列腺影像报告和数据系统2.1 版(prostate imaging reporting and data system,PI-RADS v2.1)中DWI 评分与GGG是否一致,以及ADC 值与GGG 的相关性,通过DWI评分和ADC 值实现对前列腺癌的高效评估,从而减少不必要的有创操作。
1 资料与方法
1.1 一般资料
选取2019 年6 月至2021 年6 月在湖北省孝感市中心医院行前列腺MRI 检查的126 例患者,其中良性病变32 例(良性病变组),年龄48~83 岁,平均(68.61±7.44)岁;前列腺癌94 例(前列腺癌组),年龄54~86 岁,平均(71.07±7.22)岁。
纳入标准:①患者均采用同一设备、线圈、扫描序列和参数;②临床、影像及病理资料(具有穿刺活检及GGG 结果)完整且MRI 图像质量良好的前列腺癌(前列腺腺泡腺癌)或前列腺良性病变(前列腺增生和/或高级别上皮内瘤变)。排除标准:①病理科医师难以区分良恶性;②MRI 可疑病变与术后对应穿刺位置无法匹配者;③MRI 检查前6 周内接受过前列腺有创操作或放化疗等治疗;④MRI 检查禁忌证(如幽闭恐惧症等)患者。
1.2 仪器与方法
采用Siemens 3.0 T 超导MRI 扫描仪、18 通道相控阵体线圈。患者取仰卧位,以正中矢状面与耻骨联合上方1 cm 的交叉点为线圈中心,用腹带固定。检查前30 min 患者排尿排便,尽量不带导尿管,以免影响图像质量。扫描范围包括前列腺全层及精囊。各序列扫描参数见表1。
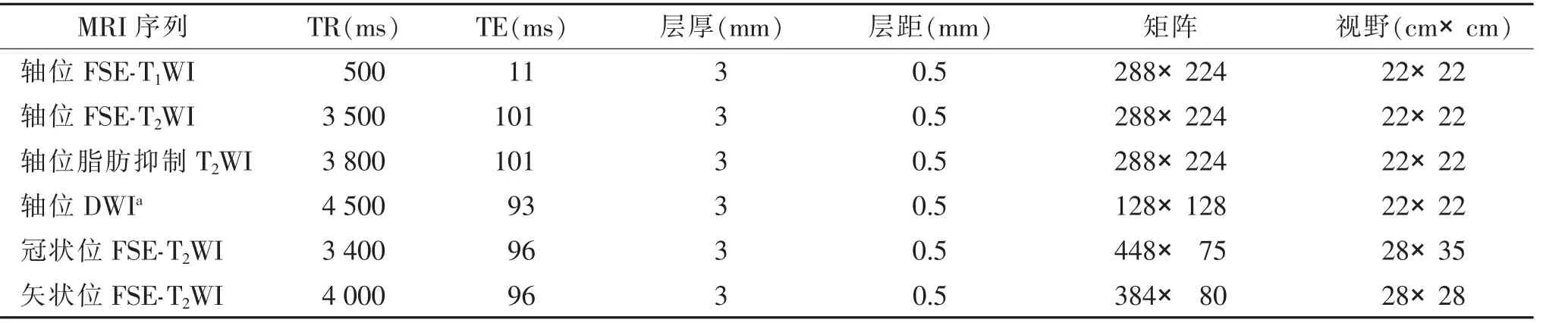
表1 MRI 各序列扫描参数
1.3 图像与数据处理
将采集图像导入Siemens 工作站,由2 位(具有10 年以上泌尿系疾病诊断经验,均经过PI-RADS 应用培训)MRI 诊断医师对符合条件的图像进行后处理、诊断并评分。ROI 均在DWI(b=800 s/mm2)图上逐层勾画,注意避开尿道、钙化灶、射精管、血管、精囊等。如遇多灶性前列腺癌或Gleason 评分不同时,对最高评分病灶进行勾画。
1.4 病理检查
采用经直肠超声引导下前列腺12 针系统穿刺活检,用局麻药从前列腺基底部浸润麻醉至尖部。前列腺被划分为12 个区域,每个区域各穿刺1 针并行病理学检查,有可疑病灶或出现MRI 异常区域需加穿1~2 针。要求精确记录每针穿刺的具体位置和进针深度,由病理医师分析结果并出具报告。
1.5 GGG 与DWI 评分标准
1.5.1 前列腺癌的GGG 根据病理结果将前列腺癌GGG 分 为5 组:GGG1,Gleason 评分≤6 分;GGG2,Gleason 评分7分(3+4分);GGG3,Gleason 评分7 分(4+3 分);GGG4,Gleason 评分8 分(包括4+4,5+3 和3+5 分);GGG5,Gleason 评分9 和10 分(包括5+5,4+5 和5+4 分)[3]。组别越高,分化程度越低(主要评分+次要评分=Gleason 评分,主要评分指>50%肿瘤细胞所处的GGG 组别,次要评分指<50%肿瘤细胞所处的GGG 组别,只有1 个组别的评分时加倍)。
1.5.2 DWI 评分标准 根据PI-RADS v2.1,制订DWI评分标准(表2)。

表2 DWI 评分标准[6]
1.6 统计学分析
2 结果
2.1 2 组ADC 值比较
b=800 s/mm2时,32 例良性病变的ADC 值为(1.198±0.147)×10-3mm2/s,94 例前列腺癌为(0.829±0.088)×10-3mm2/s,良性病变高于前列腺癌,差异有统计学意义(t=12.355,P<0.05)。
2.2 前列腺癌组的DWI、ADC 图表现(图1~3)
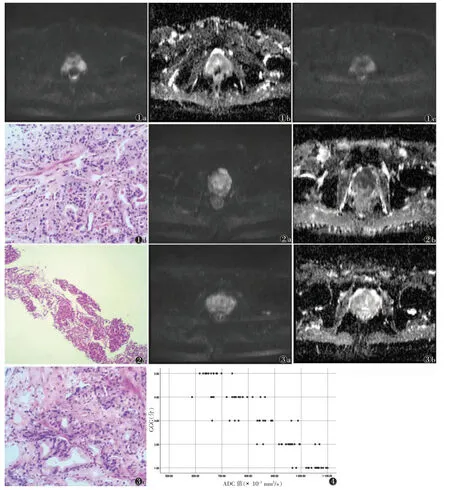
图1~3 前列腺癌MRI及病理图像 注:图1 患者,男,69 岁,多灶性前列腺癌,前列腺特异性抗原(PSA)为18.73μg/L;DWI(b=800s/mm2)示前列腺左侧外周带病灶呈明显高信号(图1a),ADC图呈中度低信号,病灶最大径为1.12 cm,DWI 评分为3 分,前列腺影像报告数据系统2.1 版(PI-RADS)3 分(图1b);DWI(b=1 500 s/mm2)示双侧外周带呈中度高信号(图1c);病理图像为前列腺腺泡癌(Gleason 评分4+3=7 分),左体内、左体外、左底内、左底外、右底内、右底外、右体内、右体外未见肿瘤组织,归为Gleason 分级分组3 组(GGG3),与DWI 评分预测相匹配(图1d)。图2 患者,男,72 岁,多灶性前列腺癌,PSA 为25.53 μg/L DWI(b=800 s/mm2)示前列腺双侧移行带和外周带多发病灶呈明显高信号(图2a);ADC 图呈明显低信号,最大径病灶位于外周带,为0.61 cm,DWI 评分为4 分,PI-RADS 4 分(图2b);病理图像示腺体分化不良,基底细胞消失,癌细胞侵犯固有肌层,前列腺腺泡癌(Gleason 评分4+4=8 分),右底内良性前列腺组织,归为GGG4,与DWI 评分预测相匹配(图2c)。图3 患者,男,77 岁,局灶性前列腺癌,PSA 为19.76 μg/L;DWI(b=800 s/mm2)示前列腺右侧外周带病灶呈楔形轻度高信号(图3a);ADC 图呈楔形低信号,最大径为0.47 cm,故DWI 评分为2 分,PI-RADS 2 分(图3b);病理图像为前列腺腺泡癌(Gleason 评分3+3=6 分),左体内、左体外、左底内、左底外、右底内、右底外、右尖内、右尖外前列腺良性增生,归为GGG1,与DWI 评分预测不一致(图3c)图4 前列腺癌组的ADC 值与GGG 相关性分析散点图 注:ADC 值与GGG 呈负相关(rs=-0.935,P<0.05)
①当b 值取800 s/mm2时可见左侧外周带病灶,DWI 呈结节状明显高信号,ADC 图呈中度低信号;当b=1 500 s/mm2时可见双侧外周带病灶,DWI 呈结节状中度高信号。②多灶性前列腺癌36 例,DWI 呈多发结节样或楔形中度/明显高信号,ADC 图呈中度/明显低信号;其中前列腺包膜受侵14 例,精囊腺受侵3 例,膀胱受侵10 例,神经血管束受侵8 例。③局灶性前列腺癌58 例,DWI 呈结节样高信号,ADC 图呈轻度/中度/明显低信号;其中前列腺包膜受侵13 例,精囊腺受侵5 例,膀胱受侵14 例,神经血管束受侵9 例。
2.3 前列腺癌组DWI 评分与GGG 的一致性分析
前列腺癌组的DWI 评分与GGG 行Kappa 一致性检验显示,两者一致性较好(K=0.717,P<0.001);表明DWI 评分对前列腺癌GGG 具有较好的预测价值(表3,4)。

表3 94 例前列腺癌患者DWI 评分与GGG 对照 例

表4 94 例前列腺癌患者DWI 评分对GGG 的预测价值%
2.4 前列腺癌组ADC 值与GGG 的相关性
b=800 s/mm2时,94例前列腺癌患者ADC 值为(0.829±0.088)×10-3mm2/s,与GGG 呈负相关(rs=-0.935,P<0.05)(图4)。
3 讨论
前列腺癌的个性化治疗基于肿瘤侵袭性、分期和复发风险等,是最常见的癌症之一[7]。早期诊断前列腺癌是提高患者生存率的关键,而更精确的风险分层将使个性化治疗成为可能。GGG 被逐渐认为是前列腺癌病理分级的可靠标准,主要由腺体分化程度决定分值大小,能够提示前列腺癌的恶性程度、进展及转移情况,便于评估预后,为治疗方案的选择和拟定提供依据[8-9]。如Gleason 评分6 分的患者患前列腺癌的概率较低,因此主动监测疾病的进展情况对该类患者具有重要意义。直肠超声引导下穿刺活检是目前确诊前列腺癌的主要影像学手段,但其敏感度和特异度均不高,前列腺癌的诊疗方案也存在缺陷,易造成漏误诊。2019 年发布的PI-RADS v2.1使数据采集技术和图像解释报告系统趋于标准化[10]。
我国2020 版前列腺癌诊疗指南中关于前列腺癌的检查方法首先推荐前列腺特异性抗原(PSA)和MRI[11]。但PSA 水平由于受年龄、尿潴留、前列腺增生、导尿管等因素的影响尚存争议。MRI 技术发展迅速,DWI 的诊断优势大多体现在ADC 上,通过ADC可评估不同病灶在DWI 图像上的信号强弱[12-14]。本研究b 值选择0、800 s/mm2,在确保DWI 和ADC 图像质量的前提下,使大部分患者可耐受扫描时长。PI-RADS v2.1 认为目前对最佳b 值的选择尚未达成一致,部分患者加行b=1 500 s/mm2的DWI 序列,可发现不同b 值对多灶性前列腺癌的诊断或具有重要意义,但该结论尚需大量病例和更多不同b 值研究进一步证实。
3.1 前列腺癌与前列腺良性病变的MRI 表现及ADC 值分析
本研究回顾性分析94 例前列腺癌及32 例前列腺良性病变患者的临床资料发现:①前列腺癌的T2WI 表现为外周带的高信号区内出现低信号病灶,DWI 呈局灶性或多灶性高信号,ADC 图呈低信号。前列腺癌中前列腺包膜受侵27 例,T2WI 上可见包膜周围脂肪间隙消失、包膜不规则增厚或腺体局限性突出;精囊腺受侵8 例,可见T2WI 上精囊局限性低信号、壁增厚或精囊角消失;膀胱受侵24 例,可见前列腺与膀胱壁连接紧密,局部膀胱壁破坏,肿块形成;神经血管束受侵17 例,可见神经血管束的局限性不对称增粗。②前列腺增生主要是腺体增生,少数以间质增生为主,这种组织细胞结构差异和细胞内外间隙及结构变化的特点导致少部分前列腺增生结节DWI 呈高信号,易误诊为前列腺癌,但通过后处理得到的ADC 值可鉴别。本研究发现良性病变组(32 例)ADC 值明显高于前列腺癌组(94 例),差异有统计学意义(P<0.05),可能与前列腺增生组织不是前列腺癌的前体,而是由正常前列腺腺体组织和间质构成有关,前列腺增生的细胞是正常上皮和平滑肌细胞,细胞间隙正常,水分子随意运动,未明显受限。
3.2 前列腺癌ADC 值与GGG 的相关性分析
本研究中ADC 值与GGG 呈负相关,即ADC 值越大,GGG 越低,恶性程度越高,预后越差,与Ingole等[15-16]研究结果一致。其原因可能是随着前列腺癌恶性程度增加,癌细胞异型性加大,细胞体积缩小、排列紧密、增殖活跃、核浆比异常,缺乏正常腺上皮和腺体结构,细胞外生理需要的组织间隙受压变小,导致水分子随机无规则自由运动能力愈发受限等因素有关。
3.3 PI-RADS v2.1 中的DWI 评分与前列腺癌GGG的一致性研究
在PI-RADS v2.1 中,对DWI 评分描述性术语的解释在一定程度上受主观因素影响,且影像医师对影像学特征定义的描述也存在差异。为提高阅片者之间的一致性,本研究由2 位具有10 年以上泌尿系疾病诊断经验、均经过PI-RADS 应用培训的诊断医师对图像进行后处理并评分,最终分析得出DWI 评分,DWI 评分为1 分时诊断GGG1 的敏感度和阴性预测值最高(分别为90.0%、97.4%),DWI 评分为5 分时诊断GGG5 的特异度和阳性预测值最高(均为100.0%),DWI 评分为1 分时诊断GGG1 和DWI 评分为5 分时诊断GGG5 的准确率最高(均为95.9%)。PI-RADS v2.1 中的DWI 评分与GGG 之间存在较好的一致性(K=0.717,P<0.001)。表明PI-RADS v2.1中的DWI 评分对前列腺癌GGG 具有较好的预测价值,并进一步推测Gleason 评分或许能辅助临床提高GGG 的准确性和前列腺癌分级治疗决策的质量,从而减少不必要的有创操作,但该结论尚需统计更多病例进一步证实。今后需进一步改进PI-RADS 对前列腺癌的评估,减少主观因素影响带来的阅片差异。
综上所述,PI-RADS v2.1 中的DWI 评分和ADC值与前列腺癌GGG 具有一定相关性。利用PI-RADS v2.1 中的DWI 评分可较好地评估和预测GGG,具有良好的临床应用前景。本研究存在一定的局限性:由于纳入患者均需经病理活检证实为前列腺癌且进行了前列腺癌根治性手术,导致样本例数偏小;b 值偏小,高b 值是否优于常规b 值对DWI 评分的判定,尚存争议。在接下来的研究中,将联合多中心并增加样本量予以进一步验证,以增加临床环境的多样性和研究结论的普适性。

