茶菌人工复合菌剂构建和发酵性能分析
宋肖肖,张慧霞,刘斌杰,杨民和,王国红
(福建师范大学生命科学学院,福建 福州 350107)
茶菌又称红茶菌,是一种起源于中国并流传千年的传统发酵饮品,当前仍在世界各地流行,尤以北美、欧洲和东南亚为甚[1]。典型的茶菌以红茶和白糖为原料,通过以酵母菌和醋酸菌为主(有时也含有乳酸菌)的益生微生物群体自然发酵,经过7~15 d的发酵过程,在发酵液中产生细菌纤维素、有机酸、维生素和多酚类物质等功能性微生物代谢产物,形成一种酸甜可口、清爽宜人的饮料,并常常被认为具有助消化、解毒、抗氧化和抗癌等功能[2-3]。茶菌的自然发酵受微生物、原料、工艺和环境条件等因素的影响。共生微生物菌群(symbiotic culture of bacteria and yeasts,SCOBY)是影响茶菌发酵过程、发酵产物、营养价值和生理功效的主要因素[4]。不同地域的茶菌其发酵微生物不同,从世界上不同地区生产的茶菌样品中,已经分离获得了众多的菌株[3,5]。
茶菌一直以自然发酵和家庭饮用为主;近20年来,随着人们对天然、有机和健康饮食的追求,利用现代发酵技术规模化生产茶菌的探索逐渐增多[1,6]。参与传统茶菌发酵的微生物丰富多样,菌群复杂,加之生产环境开放,难以达到饮品的标准化生产和食品安全要求。因此,发酵剂成为制约茶菌大规模生产的“卡脖子”问题[7-8]。通过分离纯化自然菌群中的菌株,分析不同菌株在发酵过程的功能和菌株之间的相互作用关系,识别和筛选优势菌株和关键菌株,在此基础上混合、复配和组建人工复合菌剂,是当前传统食品发酵技术改良和创新的方向[9-11]。在茶菌的研究中,早在20世纪50—60年代,既有利用人工分离菌株模拟自然发酵的尝试[12],之后类似的研究工作逐渐增多[13-16]。进入21世纪后,茶菌研究在北美和欧洲成为有机和功能性饮料研究的热点,先后有多项研究探索茶菌人工发酵剂和发酵性能[16-17]。然而,目前尚未有利用人工发酵剂进行茶菌大规模生产的报道。
本课题组从福建省泉州市乡村获得一份茶菌样品,从中分离、纯化和保存了一批菌株[18]。应用其中的2 个酵母菌和2 个醋酸菌菌株,本研究以菌膜发生为指标,构建新型复合菌群,并通过单独培养和混合培养的比较,确定不同菌株对菌膜形成的作用;明确人工菌群发酵过程中发酵液酸度、还原糖、多酚类物质和香气成分的动态变化以及不同菌株组合对发酵的影响;经历多次继代培养后菌群的稳定性。以期能够构建相对稳定而又具有天然茶菌典型发酵性能的人工复合发酵剂,满足日益增长的市场需求。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌种
菌株C3(迈耶氏酵母Meyerozymasp.),菌株C5(长孢洛德酵母Lodderomyces elongisporus),菌株C6(驹形氏杆菌Komagataeibactersp.C6)和菌株J5(葡糖醋杆菌Gluconacetobactersp.J5)从红茶菌饮料分离获得[18]。各菌种于4 ℃冰箱保藏在福建师范大学生命科学学院微生物实验室。
1.1.2 培养基与试剂
醋酸菌培养基[19]:酵母浸膏10 g,蛋白胨5 g,无水葡萄糖50 g,琼脂20 g,蒸馏水1 L,灭菌20 min。冷却至55 ℃左右,加入体积分数2%无水乙醇和165 ℃干热灭菌2 h的CaCO310 g,分装、冷却后备用。酵母菌培养基[18]:酵母浸膏10 g,蛋白胨15 g,无水葡萄糖20 g,琼脂20 g,蒸馏水1 L;葡萄糖酵母(glucose yeast,GY)培养基[20]:葡萄糖50 g,酵母浸膏5 g,琼脂15 g,蒸馏水1 L;MRS(de Man,Rogosa and Sharpe)培养基[20]:蛋白胨10 g,牛肉浸膏5 g,酵母浸膏4 g,无水葡萄糖20 g,磷酸二氢钾2 g,柠檬酸三铵2 g,乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.05 g,琼脂15 g,吐温800.1%(V/V),蒸馏水1 L,pH 6.0~6.4。以上培养基配制好后分装,1×105Pa高压灭菌20 min。
红茶糖水发酵培养液:红茶6 g,白砂糖40 g。先用开水将所用器具、纱布等清洁荡洗;称取6 g红茶加开水(85~90 ℃)1 L浸泡5~10 min,用纱布过滤后去除茶渣,在茶汤中加入40 g白砂糖,搅拌混匀,冷却后备用。
儿茶素类化合物标准品如儿茶素(catechin,C)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表儿茶素(epicatechin,EC)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、没食子酸(gallic acid,GA) 美国Sigma公司;甲醇、三氟乙酸(色谱纯) 德国Merck公司;酵母浸膏、无水葡萄糖、亚硫酸钠、磷酸二氢钠、磷酸氢二钠、苯酚(均为分析纯) 国药集团化学试剂有限公司;蛋白胨(分析纯) 广东环凯生物科技公司;氢氧化钠、碳酸钙、无水乙醇(均为分析纯) 西陇化工股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯) 上海Macklin生化科技有限公司;邻苯二甲酸氢钾(分析纯) 天津福晨化学试剂厂;红茶茶叶、白砂糖 福建省福州市永辉超市;土壤基因组DNA提取试剂盒PowerSoil®DNA Isolation Kit 美国MoBio Laboratories公司。
1.2 仪器与设备
电子天平、Starter 2100 pH计 奥豪斯仪器(上海)有限公司;LRH-250 F 生化培养箱 上海一恒公司;紫外-可见分光光度计 北京普析通用仪器有限公司;PC-6 PLUS落地高速冷冻离心机 德国赛默飞世尔公司;LC-2030高效液相色谱仪 日本岛津公司;5977B气相色谱-质谱联用仪 安捷伦科技(中国)有限公司;Nano Drop 2000超微量分光光度计 德国赛默飞世尔公司;Qubit®2.0荧光核酸定量计 美国Life Technologies派克生物科技有限公司。
1.3 方法
1.3.1 菌株混合方式及培养条件
菌株C3和C5分别采用酵母菌液体培养基,菌株C6和J5采用GY液体培养基,接种后置于180 r/min摇床中28 ℃恒温培养。培养36~48 h后,各菌株均配成1×106个/mL的菌悬液,按4 个菌株单独培养(C3、C5、C6、J54 个处理)、两个菌株混合培养(C3C5、C3C6、C3J5、C5C6、C5J5、C6J5)、3 个菌株混合培养(C3C5C6、C3C5J5、C5C6J5、C3C6J5)和4 个菌株混合培养(C3C5C6J5)的方法分别进行单独或混合培养,以不接菌的红茶糖水发酵液作为对照。在250 mL三角瓶中装入150 mL红茶糖水培养液,每个菌株各取0.1 mL菌悬液单独或等比例混合接种,每个处理设置3 个重复,然后置于28 ℃恒温培养箱静置发酵培养[18]。以12 d为一个发酵周期,将发酵后的菌液按20%接种量再重新接入红茶液体发酵培养基培养,以此类推,对混菌发酵液进行传代培养。在培养至第6代时,观察发酵液的颜色、气泡、气味和是否产生菌膜等现象。其后,选择C3C5C6、C3J5C6、C5J5C6和C3C5C6J54 个菌株组合进行后续实验。
1.3.2 菌体生长动态
混合菌株组合于28 ℃恒温箱静置发酵培养,每隔24 h在无菌条件下取样5 mL菌液。用1 cm比色杯在600 nm波长处测定各组合不同生长时间培养液的OD600nm值,每个组合设置3 个重复,以相同条件下等量未发酵红茶糖水作为对照。以OD600nm值为纵坐标,培养时间为横坐标,绘制混合菌种组合的动态生长曲线。
1.3.3 发酵液生理生化指标测定
对各菌株组合发酵过程中发酵液的pH值、总酸含量和还原糖含量等指标进行动态监测。接种后每隔24 h在无菌环境下吸取发酵液5 mL,用Starter 2100 pH计测定发酵液的pH值,每瓶测3 次取平均值。参照酸碱滴定法测定发酵液总酸含量[14-15]。参照DNS法测定发酵液还原糖含量[18]。茶多酚含量测定参照GB/T 21733—2008《茶饮料》的方法进行[21]。
采用高效液相色谱法检测发酵液中儿茶素类化合物相对含量[22]。分别在发酵后第1、3、5、7天定时取样20 mL茶菌发酵液,9000 r/min离心5 min后取上清液,用0.22 μm的微孔滤膜过滤上清液,备用。
儿茶素标准溶液的配制:分别称取EC、EGC、ECG、EGCG、C、GA固体标准品(纯度>98%)各5 mg,用50%的甲醇溶液溶解并定容至5 mL,则以上6 种化合物的标准储备液质量浓度均为1 mg/mL。
色谱条件:色谱柱为Welch Ultimate XB-C18(4.6 mm×250 mm,5 μm);流动相A为0.05%三氟乙酸溶液,流动相B为甲醇;流动相洗脱梯度:流动相A、B流速均为0.5 mL/min。流动相梯度:0~13 min,90%~30% A、10%~70% B;13~19 min,30% A、70% B;19~20.5 min,30%~90% A、70%~10% B;20.5~25 min,90% A、10% B。柱温30 ℃;紫外检测器检测波长280 nm,检测器扫描范围200~380 nm;分析周期25 min,进样量10 μL。
1.3.4 挥发性成分分析[23]
1.3.4.1 顶空固相微萃取
混合菌群C3C5C6J5接种红茶糖水培养液作为处理组,未接菌红茶糖水培养液作为对照组,培养7 d后用顶空固相萃取法分别收集挥发性气体。将处理组发酵液和对照组的培养液10000 r/min离心2 min,取上清液然后进行抽滤,取8 mL发酵液置于20 mL顶空瓶中,加入2 g氯化钠,摇晃混匀制成饱和溶液,再于50 ℃用提前预热的磁力搅拌器搅拌5 min后,将老化处理后的DVB/CAR/PDMS固相微萃取头插入顶空瓶,萃取30 min。
1.3.4.2 气相色谱-质谱法分析
色谱条件:色谱柱为HP-Innowax(30.0 m×0.25 mm,0.25 μm);升温程序为50 ℃保温3 min,5 ℃/min上升到150 ℃保持10 min,再以6 ℃/min上升到230 ℃保持10 min;载气为氦气;柱流量为1 mL/min,进样量为1 μL,不分流。
质谱条件:电子电离源,电子能量为70 eV,离子源温度为230 ℃,检测电压为350 V,电流强度为0.2 mA,检测温度为230 ℃。采集模式为全扫描。
根据出峰时间与NIST质谱数据库数据的匹配度对气体成分进行定性(去除匹配度低于70%的数据),用色谱峰面积归一法定量求出各种气体成分的相对含量。
1.3.5 菌株人工分离培养
为分析和验证混合菌群C3C5C6J5连续转接6 代后菌群的稳定性和各菌株的大致含量,采用酵母菌培养基、醋酸菌培养基和MRS培养基,对培养7 d后的发酵液和菌膜样品,以稀释分离法分别进行分离纯化,统计各菌株数量(CFU/mL)[18]。
1.3.6 菌群宏基因组分析
1.3.6.1 DNA的提取
在红茶糖水培养液接种C3C5C6J5组合,连续转接至第6代,培养7 d后,取5 mL发酵液10000 r/min离心10 min,弃上清液获得菌体混合物,洗涤菌体3 次。然后用Power Soil®DNA Isolation Kit提取菌体混合物样本中的DNA,所得的DNA用超微量分光光度计检测其浓度、纯度(A260nm/A280nm)及含量,将符合宏基因组测序标准的DNA存放于-20 ℃冰箱保存。样品送生工生物工程(上海)股份有限公司分析。
1.3.6.2 基因组DNA片段化和文库构建
将得到的样本DNA片段化,使得最终打断的DNA片段大小控制在300~500 bp之间。建立1 个长度在500 bp左右的文库,使得初始DNA总量为300 ng,使用Elution buffer将文库中DNA质量浓度配制为3 ng/μL。将片段化的DNA进行浓缩回收,使用荧光核酸定量计Qubit®2.0对纯化后的DNA浓度进行检测。使用NEB Next®UltraTMDNA Library Prep Kit for Illumina®试剂盒对纯化后的DNA进行文库构建。样本测序数据量为10 G。
1.3.6.3 数据处理和测序分析
将宏基因组分析测得的原始数据使用FastQC软件对其进行质量评估,将带接头和低质量的序列进行去除,从而得到相对可靠序列。将通过质量控制的样本序列使用IDBA_UD软件进行拼接与组装,根据序列之间的组间关系获得长序列contigs,对多个拼接组装结果进行综合评定,对拼接效果最佳的序列进行开放阅读框预测,挑选长度大于100 bp的预测基因将其翻译成氨基酸序列。根据基因预测结果,使用CD-HIT软件去除冗余基因,获得样本的非冗余基因。采用Bowtie2软件对样本的质控序列和非冗余基因序列进行对比,获得同源序列,比较基因特征得到样本的物种分类信息。
1.4 数据分析
数据用SPSS 19.0 软件进行方差分析,采用GraphPad Prism 8.0.1和Excel作图,系统发育树由软件MEGA 6.0作图。
2 结果与分析
2.1 菌株混合培养及生物膜的形成
在静置培养条件下,不同菌株的单独培养、不同混合培养组合在红茶糖水培养液中培养至第3天均可见菌体浓度的增加。单独培养情况下,C3和C6生长快,菌体增加比较明显;C5和J5生长相对较慢,菌体增加不明显。C3和C5单独培养时,培养液中未见气泡产生,而C6和J5单独培养时产生气泡,特别是C6的发酵液中气泡明显。菌株J5在单独培养条件下产生絮状物。在不同菌株的组合中,凡是含有C6的组合,培养过程中均可见气泡产生。从培养后3 d开始,在C3单独或含有C3的菌株组合培养中,在发酵液的表面可见碎片状漂浮物(图1A);这些漂浮物易破碎,摇动后下沉。凡是含有J5的组合,均可见在发酵液表面生成完整而牢固的菌膜(图1B),不易破碎。

图1 不同菌株发酵后茶菌培养液表面形成的漂浮物Fig.1 Microbial pellicles formed on the surface of tea fungus fermentation broth
2.2 菌株混合培养生长动态
各菌株按等比例混合后,4 个不同菌株组合的菌体增长趋势基本一致(图2)。菌株组合C3C5C6J5启动生长的速度最快,培养后10 d一直保持较强的菌体增长势头;至发酵后第10天,菌液OD600nm值达到0.6254;发酵后第11天开始,菌液OD600nm值开始下降。发酵后2~5 d,组合C3C5C6的菌体数量直线上升,其后保持较快的增长速度,至发酵后第12天,菌液OD600nm值达到0.6663,与其他3 个菌株组合相比差异显著。在发酵后1~10 d,菌株组合C3J5C6的菌体数量呈波浪式增长,与其他3 个组合相比,整体上菌体增长速度较慢。组合C5J5C6在发酵后7 d菌体数量增长较缓慢,发酵后8~12 d生长速度加快。4 个菌株组合相比较,组合C3C5C6的菌体数量增长较快,生长后劲较强。
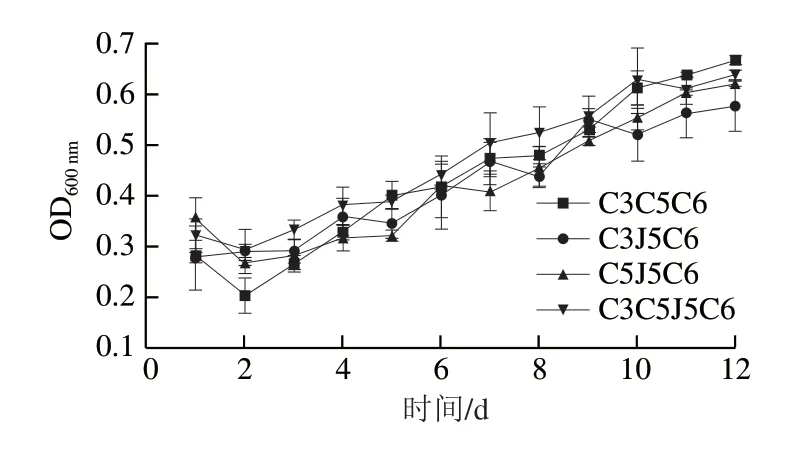
图2 发酵过程中菌体生长动态Fig.2 Dynamics of microbial growth
2.3 发酵液生理生化变化
2.3.1 发酵液还原糖含量变化
与不发酵的对照相比,4 个混合菌株组合在12 d的发酵期间,发酵液中还原糖含量均呈现逐渐上升的趋势(图3)。其中,组合C3J5C6发酵液中还原糖含量最高,与对照、组合C3C5C6、C5J5C6和C3C5C6J5的发酵液相比差异显著。在12 d的发酵过程中,组合C5J5C6和C3C5C6J5的发酵液中还原糖含量直线上升,趋势比较一致;而在发酵前6 d,组合C3C5C6发酵液中还原糖含量差异不显著;发酵后6 d,还原糖含量逐渐上升。
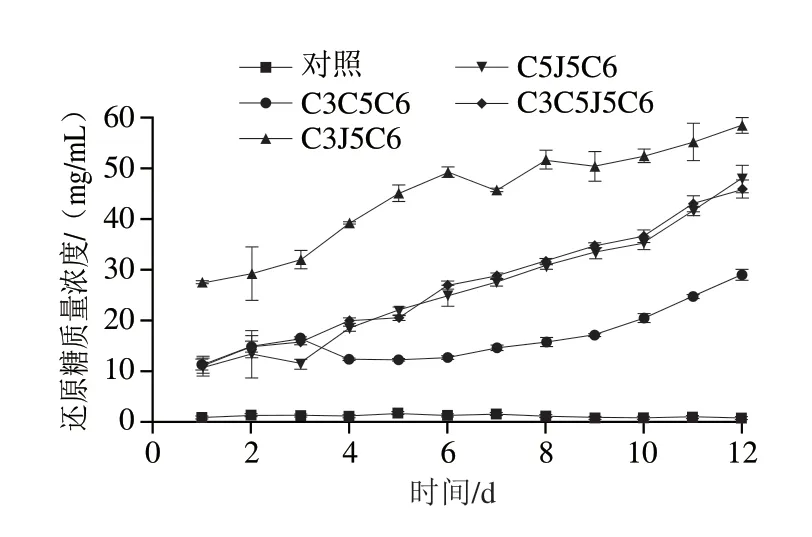
图3 发酵过程中还原糖含量变化Fig.3 Changes in reduced sugar content during fermentation
2.3.2 发酵液pH值和酸度变化
混合发酵过程中,不同菌株组合发酵液中pH值的变化情况见图4A。红茶糖水培养液的pH值保持在5左右。接种时由于加入20%的传代培养液,接种后培养液的pH值急剧下降,4 个不同菌株组合的初始pH值在3~3.3之间,显著低于对照。随着发酵进行,各组合的pH值进一步下降。在12 d的发酵过程中,组合C3J5C6发酵液的pH值从3.32降至3.01,显著高于组合C3C5C6、C5J5C6和C3C5C6J5。组合C5J5C6和C3C5C6J5发酵液的pH值变化基本一致;发酵后第11天发酵液的pH值最低为2.65。
不同菌株混合发酵有机酸(以乙酸计)随时间的动态变化曲线见图4B。红茶糖水培养液的总酸质量浓度在12 d内保持在0.16~0.21 g/L之间。与对照相比,各组合有机酸的含量随发酵时间的延长均逐渐升高。组合C3C5C6J5混合培养3 d后,发酵液中总酸含量快速增加;发酵至第12天时,发酵液总酸质量浓度达到3.43 g/L。发酵7 d后,组合C3J5C6发酵液总酸含量增长的趋势和组合C5C6J5基本相似,但显著低于组合C3C5C6J5。组合C3C5C6总酸含量的增速比较缓慢,酸度的变化幅度最小;发酵12 d后,组合C3C5C6发酵液的总酸质量浓度为1.88 g/L。
2.3.3 发酵液中总茶多酚含量变化
从发酵开始至发酵后8 d,对照组和各实验组总茶多酚含量均大幅度下降(表1)。从发酵后第8天开始,各处理和对照的发酵液中总茶多酚含量又有所升高,各处理之间的茶多酚含量差异不显著。综合分析混菌发酵全过程中茶多酚含量的变化,其中,对照组发酵前茶多酚质量浓度为0.7554 mg/mL,发酵12 d后质量浓度为0.32878 mg/mL,茶多酚减少量约为0.43 mg/mL。在整个发酵过程中,菌株组合C5J5C6中茶多酚含量下降最为明显,减少量约为0.45 mg/mL;其次为菌株组合C3C5C6和菌株组合C3C5C6J5,茶多酚减少量约为0.41 mg/mL,而菌株组合C3J5C6中茶多酚含量下降最少,减少量约为0.35 mg/mL。
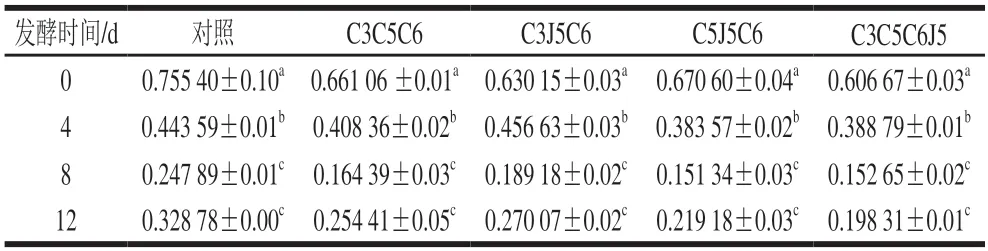
表1 不同菌株组合发酵后茶多酚含量变化Table 1 Changes in tea polyphenol content during fermentation with different microbial consortia mg/mL
2.3.4 发酵液儿茶素和GA含量变化
采用混合菌株组合C3C5J5C6考察发酵后不同时间儿茶素单体成分和GA的含量变化(表2)。在红茶糖水培养液中接入混合菌种初期(接种后1 h之内取样),发酵液中C、EC、ECG和EGCG的含量影响不显著,但EGC和GA的含量已显著下降。在对照组中,酯型儿茶素和非酯型儿茶素含量在前3 d均呈下降趋势,但非酯型儿茶素的下降量(0.72 mg/mL)比酯型儿茶素(0.1 mg/mL)更加明显;之后含量相对稳定。GA含量前3 d下降明显,3 d后逐渐回升。发酵组中,儿茶素类总含量从发酵后1~3 d下降明显;发酵后3~5 d快速回升,之后含量趋于稳定。酯型儿茶素(EGCG、ECG)发酵初期总量从0.60 mg/mL下降至0.51 mg/mL;之后稍有回升。非酯型儿茶素(EGC、EC和C)的含量在发酵初期同样呈现下降趋势,之后相对稳定。GA含量也呈现相似的变化趋势。
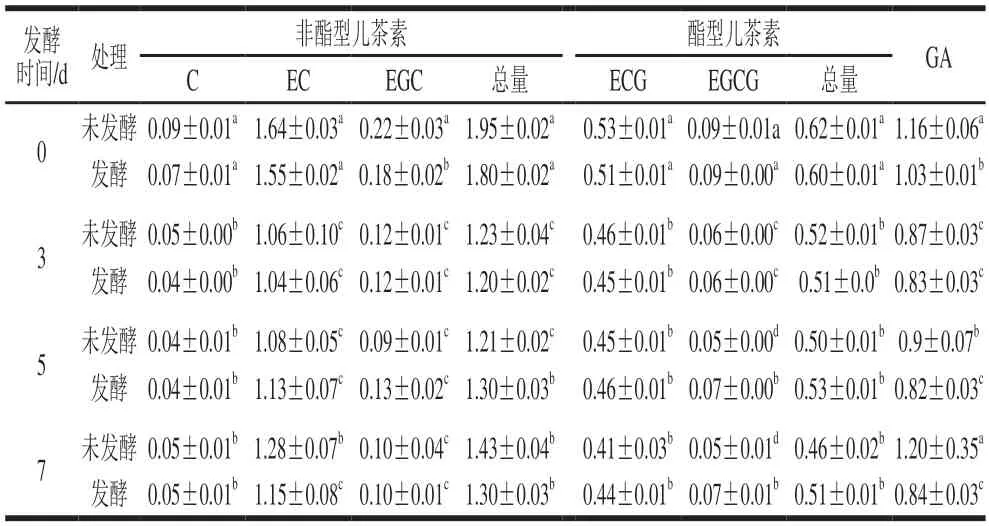
表2 菌株组合C3C5J5C6发酵后儿茶素和GA质量浓度变化Table 2 Changes in catechin and gallic acid contents during fermentation with the four-strain consortium mg/mL
2.3.5 发酵液挥发性成分含量分析
在混合菌株组合C3C5J5C6发酵后7 d取样,采用顶空固相萃取和气相色谱-质谱技术相结合分析发酵液挥发性成分(表3)。发酵组与未发酵组共检测出25 种挥发性成分,主要由酸类、酚类、酯类和醇类等化合物组成。未发酵组中共检测到13 种挥发性物质,其中酸类物质4 种,分别是壬酸(3.4566%)、3,7-二甲基-2,6-辛二烯酸(2.2362%)、癸酸(1.4932%)和辛酸(1.1988%);酚类1 种,2,4-二叔丁基苯酚(18.3608%);醇类6 种,分别是苯乙醇(11.6100%)、香叶醇(4.2933%)、苄醇(3.1791%)、糠醇(1.0943%)、2-乙基-2,6-己醇(0.5042%)和芳樟醇(0.4879%);酯类1 种(邻苯二甲酸二丁酯,0.5978%),醛类1 种(苯乙醛,1.6301%)。接菌发酵7 d后,共检测到挥发性物质23 种,其中酸类物质9 种,分别是3,7-二甲基-2,6-辛二烯酸(1.3470%)、壬酸(0.9800%)、癸酸(0.7276%)、肉豆蔻酸(0.7276%)、己酸(0.5648%)、辛酸(0.3799%)、反式-2-己烯酸(0.3589%)、丁酸(0.3445%)和月桂酸(0.1287%);酚类物质3 种,分别是4-乙基苯酚(16.8802%)、2,4-二叔丁基苯酚(5.8007%)和4-乙基-2-甲氧基苯酚(3.3871%);醇类物质6 种,分别是苯乙醇(7.7036%)、苄醇(0.9584%)、芳樟醇(0.5450%)、α-松油醇(0.3855%)、2-乙基己醇(0.2413%)和糠醇(0.1656%);酯类物质2 种,分别是二氢猕猴桃内酯(0.1923%)和γ-壬内酯(0.1789%);酮类物质1 种(香叶基丙酮,0.2086%),烯类物质1 种(2-莰烯,0.5272%),其他类型化合物2 种。

表3 菌株组合C3C5J5C6发酵后挥发性成分相对含量变化Table 3 Changes in relative contents of volatile components after fermentation with the four-strain consortium for 7 days
经过7 d发酵后,发酵液中挥发性物质的种类大幅增多。酸类物质总和为5.559%;与对照相比,癸酸、壬酸、3,7-二甲基-2,6-辛二烯酸和辛酸的含量均下降;新产生己酸、丁酸和月桂酸等短链有机酸。酚类物质种类增多,含量也显著增加。挥发性醇类物质总和从21.1688%下降至9.9994%,苯乙醇、香叶醇、苄醇和糠醇含量显著下降;其中苯乙醇含量下降幅度最大,达3.9064%,但是新产生α-松油醇。发酵后,新产生了γ-壬内酯、二氢猕猴桃内酯和香叶基丙酮。
2.4 菌群分析
混合菌株组合C3C5J5C6接种发酵后,在第1次移接的发酵液表面即可见形成菌膜。此后,按红茶菌常规的移接方法,经过6 个循环的移接,发酵液的气味、颜色和菌膜等特征基本稳定。
2.4.1 人工分离培养
采用酵母菌培养基、醋酸菌培养基和MRS培养基分别对菌株组合C3C5J5C6的发酵液和菌膜进行稀释分离,依照菌落形态和显微镜观察,大致可以区分为4 种酵母菌和3 种细菌(图5A)。与本实验室前期结果相比,菌株组合C3C5J5C6在红茶糖水培养液中经历6 次传接,第6次转接发酵7 d后,培养液中含有L.elongisporus(8.40×106CFU/mL)、木糖驹形氏杆菌(K.xylinus)(2.67×107CFU/mL)、Meyerozyma(2.33×106CFU/mL)和Gluconacetobacter(4.93×107CFU/mL);其他两种酵母菌均为假丝酵母属(Candida)的种类;另一种细菌为醋杆菌(Acetobacter)。在菌膜中只分离获得两种菌,分别为Meyerozyma(5.77×107CFU/mL)和Gluconacetobacter(5.33×105CFU/mL)。
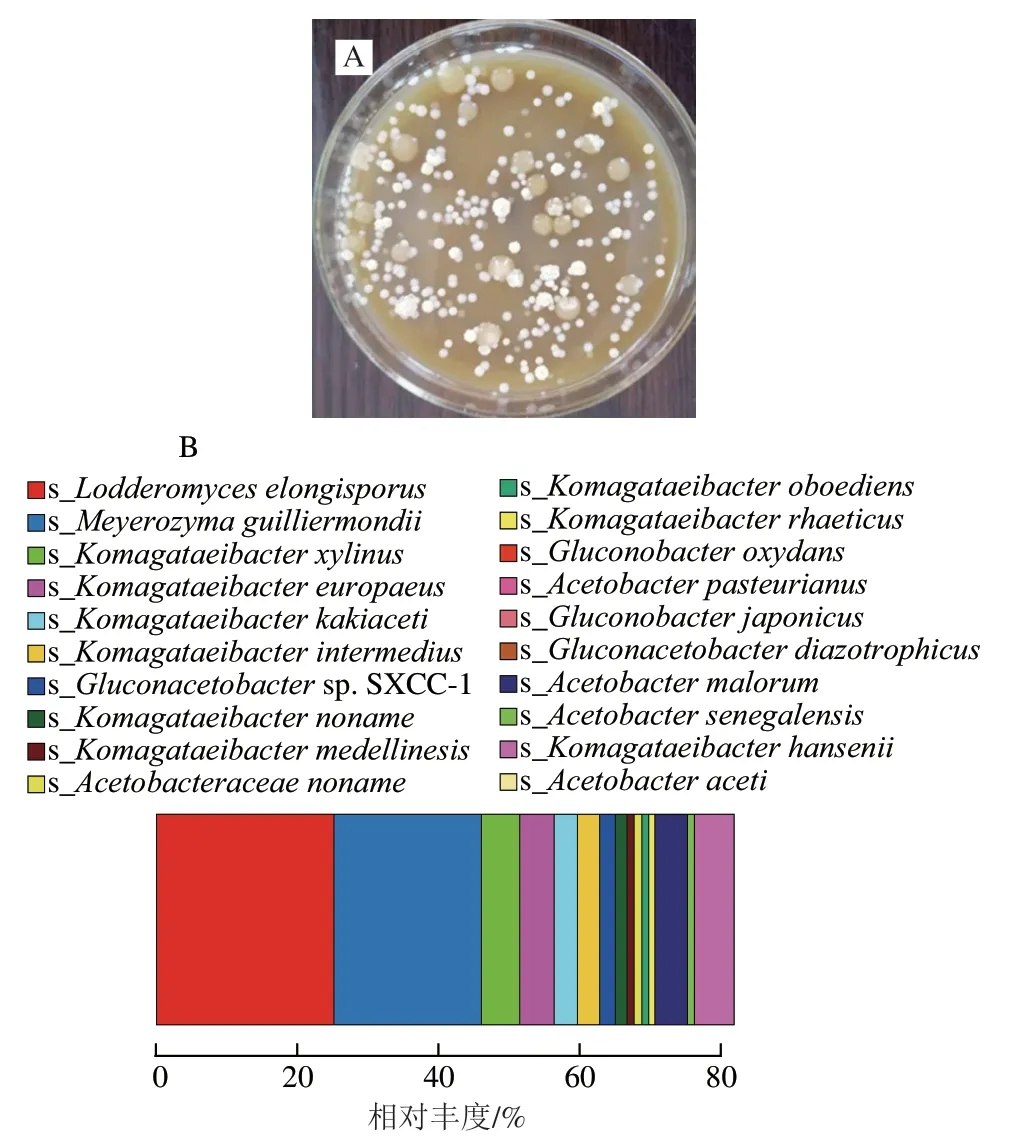
图5 菌株组合C3C5J5C6传代6 次后菌群结构Fig.5 Changes in microbial community structure of the four-strain synthetic consortium after six passages
2.4.2 宏基因组分析
通过同源序列对比,混合菌株组合C3C5C6J5的发酵液中优势酵母菌属为洛德酵母属(Lodderomyces),占总检测微生物的25.29%;其次为Meyerozyma和Candida,分别占比为21.56%和1.70%;其他的菌属如德巴利氏酵母属(Debaryomyces)和米勒酵母属(Millerozyma),占比均小于1%。优势细菌属为驹形氏杆菌属(Komagataeibacter),占总检测微生物的21.56%;其次为醋酸杆菌属(Acetobacter)、Gluconacetobacter、葡糖杆菌属(Gluconobacter)和醋酸杆菌科的1 个未命名属,分别占比为2.99%、2.37%、1.39%和1.15%。
在种水平上(图5 B),酵母菌优势种分别为L.elongisporus(占25.29%)和季也蒙迈耶氏酵母(M.guilliermondii)(20.92%),其他种均低于1%。细菌优势种分别为K.xylinus(占5.31%)、欧洲驹形氏杆菌(K.europaeus)(4.85%)、居间驹形氏杆菌(K.intermedius)(3.24%)、K.kakiaceti(3.25%),Komagataeibactersp.(1.71%)、K.medellinensis(1.20%)和Gluconacetobactersp.SXCC-1(占2.03%)。其他种占比均小于1%。
3 讨论
不同地域生产的茶菌参与发酵的微生物千差万别,是决定其风味、营养和生理功能的重要因素之一[24]。分析和解释菌群中菌株的不同类型、组成、功能和相互作用关系,是当今传统发酵食品工业化的重点科学问题[25-27]。经过长期的研究,茶菌微生物共生体(SCOBY)的主要组成在属级分类单元上已经比较清楚,主要包括酵母属(Saccharomyces)、酒香酵母属(Brettanomyces)、接合酵母属(Zygosaccharomyces)和Candida等菌属的酵母菌和Acetobacter、Gluconobacter和Gluconacetobacter的醋酸菌[4,6];但不同菌群所含有的种和菌株差异很大,其具体功能和相互作用关系依然不清楚[17,27]。菌株组合C3C5J5C6在红茶糖水中发酵培养6 代后,宏基因组分析显示菌株C5是优势菌株,占比为25.29%。在BLAST比对时,菌株C3的ITS序列相似性与M.caribbica和M.guilliermondii均在99%以上[18],难以区分;此次宏基因组分析显示M.guilliermondii占比为20.92%。醋酸菌包括Acetobacter、Gluconacetobacter和Komagataeibacter的细菌,相互之间亲缘关系密切,分类地位常有调整[18]。发酵剂C3C5J5C6中所包含的菌株在传代6 次后依然是优势菌株,特别是酵母菌菌株C5和C3,占比分别为25.29%和20.92%,居于绝对优势地位。因此,菌株组合C3C5J5C6在使用过程中稳定。由于茶菌的生产过程没有进行严格意义上的灭菌处理,因此也可能带进其他的微生物菌株。
已有的茶菌人工菌群构建均至少含有1 种酵母菌和1 种醋酸菌[12-17,19,22,28]。早期的研究依赖于人工分离和纯化技术,受培养基选择性的限制,能够分离获得的菌株有限,像醋酸菌这类微生物的分离纯化尤其困难[29],难以解释发酵液中菌群的全貌。如Hesseltine[12]和Kozaki等[13]均分离到多种酵母菌,但只分离获得1 种Acetobacter;利用纯化菌株混合培养产生菌膜,明确木糖醋杆菌(A.xylinum)是产生菌膜的关键菌株,不同酵母菌均可以起促进菌膜形成的作用。因此,Acetobacter(特别是A.xylinum)是必须的,而酵母菌可以选择不同菌株。随着菌株分离和菌群分析技术的发展,从茶菌中获得的菌株逐渐增多。应用从茶菌中分离的菌株、菌种保藏中心的保存菌株和商业菌株构建茶菌人工菌群的研究逐渐增多[14-15,22,28]。这些人工构建的菌群或没有形成菌膜,或没有将菌膜作为考察指标。细菌纤维素和菌膜是茶菌的典型特征,特别是菌膜,是决定静置培养条件下茶菌发酵环境的主要因素。采用从天然茶菌中分离的5 株醋酸菌、2 株乳酸菌和4 株酵母菌,Savary等[30]成功构建了一个能够产生菌膜的人工菌群,确定其中的4 个菌株是优势菌株;其中2 个醋酸菌菌株可以产生细菌纤维素和菌膜。通过4 个菌株在红茶糖水培养液中单独培养和不同混合培养的比较,本实验明确供试的4 个菌株中只有菌株J5可以产生完整的菌膜;菌株C6也是醋酸菌,但单独培养和与其他酵母菌混合均没有产生菌膜。
发酵过程中,4 个混合培养组合的菌体增长趋势基本一致,但发酵液pH值、总酸度、还原糖含量差异明显。这一结果与林娟[15]、Li Ruyi[19]和Nguyen[22]等的结果相似,说明发酵剂的菌种组成改变会显著影响整个共生体系的代谢和发酵液的化学成分[7]。菌株C3、C5、C6的糖利用能力和产有机酸能力存在差异[18];因此,和菌株J5以不同的方式混配时,存在不同的相互作用关系,发挥不同的功能。本研究不同菌株组合发酵后,发酵液中茶多酚、儿茶素和GA含量的变化与Wang Shuai[16]、汪鹏辉[18]等的结果不一致。发酵前期这些组分的含量明显下降,后期则逐渐回升。单独培养条件下,菌株C3、C5和C6发酵后对发酵液中茶多酚含量均有不同的提升效果[18],但C3C5C6J5组合后发酵液中含量下降,维持在0.5 mg/mL左右。这些差异可能与不同菌株及其组合的代谢能力相关。菌株组合C3C5C6J5发酵后,茶菌的挥发性物质种类和数量发生明显的变化,短链脂肪酸、酚类、醇类和脂类物质种类增多。总体变化趋势与之前的研究大致相似[1,30-31]。但是,由于用于发酵的原料、微生物、发酵工艺和环境条件的差异,风味物质的种类和含量差异很大。人体消化道适宜的pH值应不低于3;饮料要维持口感酸爽的滋味,总酸一般应维持在4~5 g/L之间[3]。比较4 个不同菌株组合的糖利用、pH值和有机酸产生情况,混菌组合C3C5C6J5发酵产生的茶菌液比较合适。今后,可以进一步研究茶菌中不同功能成分的阈值[19],综合分析有机酸、糖类、多酚类物质等不同功能成分对茶菌风味的影响,筛选出更为适合的菌株组合;也可以进一步优化发酵工艺,达到最优的发酵效果。
茶菌发酵是一个动态的过程。目前的茶菌发酵还是在开放条件下进行,从工业发酵的角度出发,人工混合菌群的稳定性需要加以关注[7,22,25]。依照茶菌典型的形态、风味和代谢产物,本研究成功构建了混合菌群C3C5C6J5。经驯化转接6 代以后,在这一人工混合菌群中,菌株J5是核心菌株,是生产纤维素和形成菌膜的主要菌株,而菌株C3、C5和C6是优势菌株。但是,菌株C3、C5、C6与菌株J5之间的相互作用关系,以及这种互作关系对茶菌发酵过程、功能成分和菌群稳定的影响,需要作进一步的研究。
4 结论
分离自红茶菌的C3、C5、C6和J5菌株中,菌株J5是生产细菌纤维素和促进菌膜形成的核心菌株。菌株J5和菌株C3、C5、C6混合构成一个稳定的人工发酵剂菌株组合,传代6 次后,4 个菌株在发酵液中依然占据优势。以红茶糖水为培养液,菌株组合C3C5C6J5在菌体生长、糖利用、有机酸产生和挥发性物质产生等发酵性能方面与天然的红茶菌发酵相似;但发酵后总多酚和儿茶素含量的变化与天然红茶菌发酵相比有差异。混合菌群C3C5C6J5的构建为茶菌发酵过程的优化、放大和工业化生产打下基础。

