酒酒球菌和酿酒酵母共接种发酵动力学模型建立
毛亚玲,李俊娥,于 静,杨 柳,祝 霞,2,杨学山,2,
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
苹果酸-乳酸发酵(malolactic fermentation,MLF)主要是在酒酒球菌(Oenococcus oeni)的主导下,将葡萄酒中的L-苹果酸转化为L-乳酸和CO2,可在降低酒体酸度、提高生物稳定性的同时赋予其独特风味和口感[1-2]。分离鉴定自葡萄酒原产地的本土O.oeni由于适应了产区的特定风土条件,更能够将酿酒葡萄的品质特征在发酵过程中充分表达,是酿造具有产区风格和典型性葡萄酒的有效方式[3]。然而,采用传统酿造工艺进行顺序接种MLF时,由于乙醇发酵(alcohol fermentation,AF)后的酒体乙醇体积分数较高、菌体可摄入的营养物质减少,O.oeni较难适应发酵环境,常常导致MLF迟滞甚至失败[4-5]。此外,游离SO2含量的降低使酒体抑菌效果减弱,较长时间的发酵进程增加了腐败微生物污染的风险[6]。将酿酒酵母(Saccharomyces cerevisiae)和O.oeni同时接种到葡萄汁中进行共发酵,在克服以上问题的同时还能减少总发酵时长,提升葡萄酒的生产效率[7]。Antalick等[8]研究发现,同时接种可以增加美乐葡萄酒酯类物质的含量。Jussier[9]、Massera[10]、Tristezza[11]等分别对霞多丽、马尔贝克、黑曼罗葡萄进行共发酵,发现同时接种不会抑制AF的进行,还会使葡萄酒果香气味更加浓郁。李俊娥等[12]研究表明,与传统顺序MLF相比,共发酵不仅缩短了发酵时长,而且挥发性化合物种类多,含量高,可赋予葡萄酒浓郁的花果香。赵现华等[13]研究表明,共发酵可以增加葡萄酒乳酸、脂肪酸和萜烯类等物质含量,丰富葡萄酒的风味结构,提高葡萄酒感官品质。
在共接种酿造过程中,由于S.cerevisiae和O.oeni之间可能存在拮抗作用,影响葡萄酒品质或导致发酵迟滞[14]。通过建立数学模型定量描述发酵动力学过程,可合理预测或控制微生物代谢活动,有助于更详细地了解发酵过程中重要参数的动态变化,降低失败的风险,被认为是本土菌株大规模生产应用前不可或缺的步骤[15-16]。研究者对沙棘酒[17]、山葡萄酒[18]、仙人掌果酒[19]、玛咖芒果复合酒[20]、莲雾果酒[21]等发酵过程中的S.cerevisiae数量、还原糖含量和乙醇体积分数变化分别建立动力学模型,结果表明Logistic、Boltzmann、SGompertz和DoseResp模型测定值和预测值之间均具有较好的拟合度,可以用来描述果酒发酵过程中S.cerevisiae菌株生长、底物消耗和产物生成变化的规律,对合理控制发酵过程及产品品质调控具有重大意义[22]。然而,针对S.cerevisiae和O.oeni共接种发酵过程中的动力学特征研究还十分欠缺。
本研究选取2 株筛选自甘肃河西走廊葡萄酒产区的本土O.oeniZX-1和MG-1菌株,分别与S.cerevisiaeVW和AW进行共接种发酵,以未进行MLF为对照,采用经典的Logistic、Boltzmann、SGompertz和DoseResp模型,对共发酵过程中S.cerevisiae生物量、乙醇体积分数、还原糖含量、O.oeni生物量及L-苹果酸含量的变化规律进行非线性拟合,建立S.cerevisiae和O.oeni共发酵动力学模型,旨在为工业化生产最优工艺控制和促进本土菌株的产业化应用提供理论基础和技术支撑。
1 材料与方法
1.1 材料与试剂
ZX-1、MG-1分离自河西走廊葡萄酒产区自然启动MLF葡萄酒,由甘肃省葡萄与葡萄酒工程学重点实验室鉴定,-80 ℃甘油管保存。其中ZX-1菌株在酿造过程中可以分泌较高的糖苷酶,有效提升葡萄酒的品种香气特征;MG-1菌株具有良好的发酵耐受性,具备商业化应用的潜力[23]。VW、AW均为商业活性酵母干粉,购自意大利Enartis公司。
L-苹果酸检测试剂盒 爱尔兰Megazyme公司;放线菌酮、氯霉素、果糖、纤维二糖、肌醇、盐酸吡哆醇、核黄素、盐酸硫胺、泛酸钙、对氨基苯甲酸、L-苹果酸、钼酸钠 上海源叶生物科技有限公司;葡萄糖、蛋白胨、酵母浸粉、盐酸半胱氨酸、酒石酸氢钾、MgSO4·7H2O、MnSO4·4H2O、柠檬酸、磷酸氢二铵、磷酸氢二钾、氯化锰、氯化锌、硼酸、琼脂、偏重亚硫酸钠 天津市光复精细化工研究所。
1.2 仪器与设备
AL104电子天平 梅特勒-托利多仪器有限公司;LDZX立式压力蒸汽灭菌锅 上海申安医疗器械厂;PHS-3C精密pH计 上海雷磁责任有限公司;HWS恒温水浴锅 上海一恒科学仪器有限公司;SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;SPX-150-II生化培养箱 上海跃进医疗器械有限公司;UV-6100紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 培养基的配制
本土O.oeni扩大培养采用酸性番茄培养基(acid tomato juice,ATB)[23]:葡萄糖10 g/L,酵母浸粉5 g/L,蛋白胨10 g/L,盐酸半胱氨酸0.5 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,番茄汁25%(V/V);固体培养基添加琼脂20 g/L、放线菌酮50 mg/L。使用1 mol/L NaOH溶液分别将液体培养基和固体培养基pH值调至4.8和5.0,121 ℃灭菌20 min。
S.cerevisiae计数培养采用酵母浸出粉胨葡萄糖琼脂培养基(yeast extract peptone dextrose,YPD)[24]:葡萄糖2 g/L、蛋白胨2 g/L、酵母浸粉1 g/L、琼脂20 g/L,添加10 mg/L氯霉素,121 ℃灭菌20 min。
1.3.2 模拟汁体系
模拟葡萄汁配制参考马腾臻[25]的方法。将微量元素配制成质量浓度为g/L数量级的母液,稀释1000 倍备用。模拟汁添加40 mg/L SO2(偏重亚硫酸钠计),使用NaOH调节pH 3.5。
1.3.3 菌株活化及模拟汁发酵
S.cerevisiae活化:分别称取适量VW、AW菌株干粉溶于10 倍体积的无菌水中,37 ℃恒温水浴20 min后,再添加10 倍体积的模拟汁,28 ℃恒温水浴10 min。
O.oeni活化:取-80 ℃甘油管保藏的本土O.oeni菌株ZX-1和MG-1,于ATB斜面培养基划线,28℃培养5~7 d后,挑取两环于灭菌后的ATB液体培养基中,于28 ℃生化培养箱中培养至对数期,备用。
接种量:S.cerevisiae和O.oeni的接种量均为1×106CFU/mL。20 ℃条件下进行发酵,还原糖低于4 g/L且L-苹果酸低于0.2 g/L时,结束发酵。实验设置3 个平行,结果取其平均值。
1.3.4 菌株接种方案
模拟汁AF(接种时间24 h)菌株接种方案如表1所示。

表1 不同菌株组合Table 1 Co-inoculations of O.oeni with S.cerevisiae
1.3.5 指标检测
1.3.5.1 菌株生物量测定
参照杨婷[26]的方法,分别采用YPD和ATB固体培养基对发酵过程中S.cerevisiae和O.oeni进行涂布计数。每隔24 h取发酵液1 mL于9 mL 0.85%生理盐水中,混匀后稀释至适当倍数,准确吸取0.1 mL稀释菌悬液分别涂布于添加10 mg/L氯霉素(用于抑制细菌生长)的YPD固体培养基、添加50 mg/L放线菌酮(用于抑制酵母生长)的ATB固体培养基。酵母菌28 ℃培养48 h后观察其菌落形成情况并计数,O.oeni28 ℃培养5~7 d后观察其形态并计数。菌落总数以菌落形成单位(CFU/mL)表示。
1.3.5.2 还原糖含量和乙醇体积分数测定
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》,采用斐林试剂和酒精计法测定发酵过程中还原糖含量和乙醇体积分数。
1.3.5.3L-苹果酸含量测定
参照试剂盒推荐说明进行操作,测定发酵酒样中L-苹果酸含量。
1.4 数据处理与分析
采用Origin 2019软件对数据进行统计与作图分析,选取合适的动力学模型对共发酵过程中S.cerevisiae生物量、还原糖含量、乙醇体积分数、O.oeni生物量和L-苹果酸含量变化情况进行非线性拟合,并选取拟合效果最佳的动力学模型对发酵过程中微生物代谢活动进行定量分析描述。
2 结果与分析
2.1 模拟汁发酵过程中S.cerevisiae活菌数、还原糖含量和乙醇体积分数变化趋势
由图1可知,与未MLF组E、F相比,共发酵过程中A、B、C和D处理组S.cerevisiae活菌数均有所降低,这可能是由于共接种模式下S.cerevisiae与本土O.oeni竞争性利用发酵环境中的营养物质,如碳源、氮源及其他微量元素等所致。在共发酵初期,发酵液中的S.cerevisiae细胞数较少,与VW相比,AW能较快适应发酵环境,活菌数略高,后期VW生长速率较AW快,但由于发酵液中营养物质的消耗致使VW更早进入衰亡期,且衰亡速度更快。2 株S.cerevisiae均经过1 d对发酵环境适应后即可快速生长,迅速进入对数生长期,发酵过程中不同处理组S.cerevisiaeVW和AW活菌数分别于4 d和5 d达到最大值,且无明显差异(A组:2.63×106CFU/mL;B组:2.60×106CFU/mL;C组:2.46×106CFU/mL;D组:2.40×106CFU/mL)。在发酵过程中,还原糖为S.cerevisiae生长提供其所需的能量,发酵体系中还原糖含量的变化趋势反映S.cerevisiae发酵能力的强弱[27]。随着S.cerevisiae细胞的增长,还原糖含量呈下降趋势,A和B处理组在2~5 d下降幅度最大,C和D处理组在3~7 d下降幅度最大,分别与S.cerevisiaeVW和AW生长量一致。A、B组和C、D组分别于8 d和10 d完成AF,还原糖含量分别为2.59、2.87、3.12、3.26 g/L,均低于对照组,说明早期阶段接入本土O.oeni未抑制AF的进行。乙醇为S.cerevisiae在发酵过程中转化糖类代谢而生成的产物[28],乙醇体积分数随发酵的进行逐渐升高,其中A和B处理组于发酵5 d后增幅较缓,在8 d达到最高,C和D处理组于发酵7 d后增幅变缓,在10 d达到最高,A、B、C和D处理组间乙醇体积分数无明显差异,分别为11.70%、11.60%、11.60%和11.40%。乙醇的生成几乎与还原糖的消耗和S.cerevisiae的生长呈对应关系。

图1 发酵过程中还原糖含量、S.cerevisiae活菌数和乙醇体积分数变化趋势Fig.1 Trends of reducing sugar content,viable yeast count and alcohol content during co-fermentation process
2.2 模拟汁共发酵过程中O.oeni活菌数和L-苹果酸含量变化趋势
如图2所示,在共接种模式下,由S.cerevisiae主导的AF和O.oeni主导的MLF几乎同步进行,本土O.oeniZX-1和MG-1与S.cerevisiaeVW和AW共发酵表现出良好的适应性,能够较快地触发MLF。如图2所示,ZX-1和MG-1生长趋势一致,表现出相似的发酵性能。在AF 24 h后接种本土O.oeni进行共发酵,4 个处理组菌体数量均于4 d分别达到最大值(A组:2.09×106CFU/mL;B组:2.13×106CFU/mL;C组:2.55×106CFU/mL;D组:2.61×106CFU/mL),5 d后进入衰亡期。随着MLF的进行,发酵液中L-苹果酸含量呈逐步下降趋势,A、B组和C、D组L-苹果酸质量浓度分别于发酵9 d和8 d降至0.2 g/L以下,降酸率分别为97.50%、96.67%、96.11%和95.28%,其中A组降酸能力最强。在由S.cerevisiae导致乙醇体积分数增加的过程中,2 株O.oeni生长量并未受到抑制,说明在共发酵过程的起始阶段,较低的乙醇体积分数更有利于O.oeni适应酒体环境,同时早期凋亡的S.cerevisiae细胞可为O.oeni提供氨基酸、维生素和丙酮酸盐等营养因子。菌株的个体差异表现为MG-1与S.cerevisiaeVW和AW共发酵过程中生物量均略高于ZX-1。
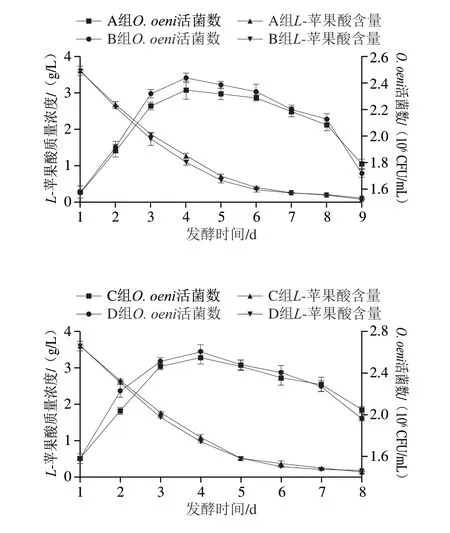
图2 共发酵过程中O.oeni活菌数、L-苹果酸含量变化趋势Fig.2 Trends of viable O.oeni count and L-malic acid content during co-fermentation process
2.3 模拟汁发酵动力学模型的建立
2.3.1S.cerevisiae生长动力学模型
由图1可知,AF初期体系营养物质充足,乙醇体积分数较低,S.cerevisiae处于生长期和稳定期,A、B组和C、D组分别于5 d和7 d后逐渐进入衰亡期,因此本研究拟对0~5 d(A、B组)和0~7 d(C、D组)时期S.cerevisiae生长情况进行非线性拟合。选用Logistic模型、Boltzmann模型和SGompertz模型对共发酵处理组S.cerevisiae数量变化进行拟合,拟合方程见表2。对比分析可得,4 个处理组拟合系数R2由大到小分别为Boltzmann模型>Logistic模型>SGompertz模型,Boltzmann模型能较好地模拟并预测共发酵过程中S.cerevisiae的生长情况,此结论与王少曼等[29]关于菠萝蜜果酒酿造过程中酵母菌数的拟合模型一致。
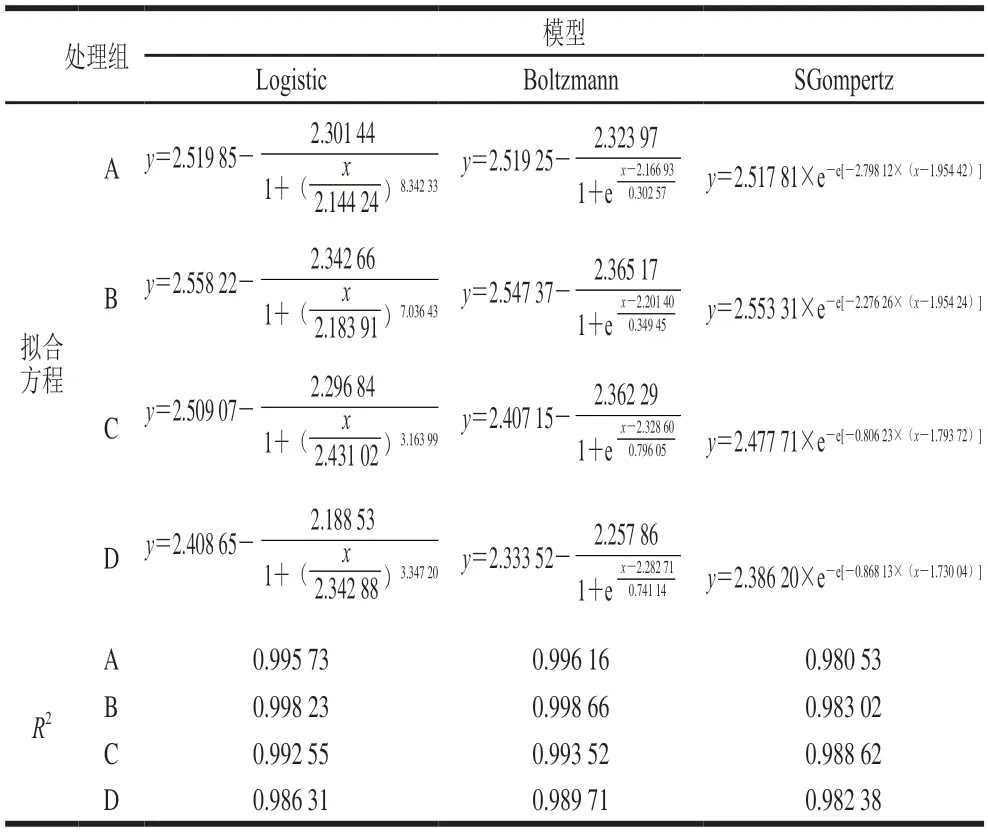
表2 S.cerevisiae动态变化的拟合方程及其拟合系数Table 2 Fitting equations with correlation coefficients for S.cerevisiae growth
如图3拟合曲线所示,S.cerevisiae在共发酵过程中生长曲线呈“S”型,在发酵0~1 d,2 株S.cerevisiae生长速率均较慢,处于生长适应期;VW和AW分别于2~4 d和1~5 d处于对数生长期,此时S.cerevisiae生长速率较快,乙醇体积分数逐渐增加。

图3 Boltzmann模型下S.cerevisiae生长拟合曲线Fig.3 Boltzmann models describing S.cerevisiae growth
2.3.2 乙醇生成动力学模型
共发酵模式下乙醇体积分数的动态变化拟合系数见表3。对比Logistic模型、Boltzmann模型和SGompertz模型拟合系数,4 个处理组均以Boltzmann模型拟合效果最好,拟合系数R2分别为0.99790、0.99860、0.99894和0.99964,表明该模型能够反映共发酵模式下乙醇的生成情况,与李侠等[30]对红枣酒产物拟合模型所选一致。

表3 乙醇生成量的拟合方程及其拟合系数Table 3 Fitting equations with correlation coefficients for alcohol production
由图4拟合曲线可知,在整个发酵过程中乙醇体积分数的测定值与预测值均有较好的拟合度。发酵1 d,4 个处理组乙醇体积分数增加均不明显,可能是S.cerevisiae生长较缓慢,还原糖利用率低,致使还原糖不能充分转化为乙醇[31]。发酵1 d后乙醇体积分数大幅度增加,与S.cerevisiae的生长同步进行,其中A、B处理组乙醇体积分数增加较C、D处理组快。发酵至6~8 d(A、B处理组)和7~10 d(C、D处理组),由于处于发酵后期,S.cerevisiae生长处于衰亡期,糖转化率降低,乙醇体积分数增加缓慢。

图4 Boltzmann模型下乙醇生成拟合曲线Fig.4 Boltzmann models describing alcohol content
2.3.3 还原糖含量变化动力学模型
还原糖含量动力学模型建立的拟合方程、拟合系数见表4。对比各拟合模型可得Logistic模型能较好反映4 个处理组还原糖含量的变化情况,拟合系数R2分别为0.99914、0.99946、0.99949和0.99917,此结果与张琪等[32]对黑加仑果酒发酵动力学研究中所选拟合方程一致。

表4 还原糖含量变化的拟合方程及其拟合系数Table 4 Fitting equations with correlation coefficients for reducing sugar content
由图5拟合曲线可知,还原糖的消耗与乙醇的生成呈对应关系,随着S.cerevisiae数量的增多,乙醇逐渐积累,还原糖含量下降,A、B组和C、D组分别发酵至8 d和10 d,4 个处理组酒体内还原糖质量浓度均下降至4 g/L以下,标志AF结束。

图5 Logistic模型下还原糖含量变化拟合曲线Fig.5 Logistic models describing reducing sugar content
2.3.4 本土O.oeni生长动力学模型
由图2可知,本土O.oeni菌株ZX-1和MG-1与S.cerevisiaeVW和AW共发酵分别于6 d和5 d后进入衰亡期,因此本研究拟对1~6 d(A、B组)1~5 d(C、D组)时期O.oeni生长情况进行非线性拟合。各动力学模型如表5所示,相比较于Logistic模型,Boltzmann模型和DoseResp模型均对O.oeniZX-1和MG-1数量变化能进行较好的描述,故选用Boltzmann模型和DoseResp模型对共发酵过程中O.oeni生长情况进行定量描述。

表5 O.oeni动态变化的拟合方程及其拟合系数Table 5 Fitting equations with correlation coefficients for O.oeni growth
由图6拟合曲线可知,O.oeni在共发酵早期能快速适应发酵环境进入对数生长期。A、B组和C、D组分别发酵至5 d和4 d时,由于在AF过程中乙醇逐渐积累增加了细胞膜的流动性,对O.oeni的生长有一定抑制作用[33],且酒体内大量精氨酸和其他氨基酸被消耗,O.oeni生长变的缓慢,随后进入稳定期。

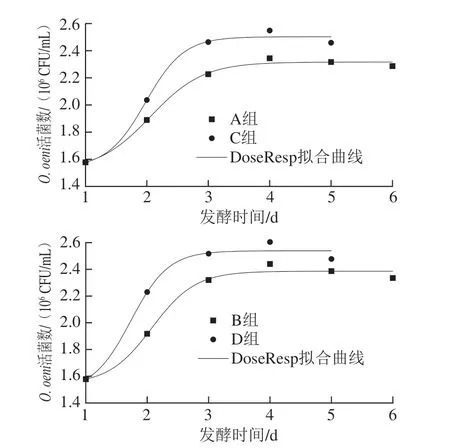
图6 Boltzmann模型和DoseResp模型下O.oeni数量变化拟合曲线Fig.6 Boltzmann and DoseResp models describing O.oeni growth
2.3.5L-苹果酸含量变化动力学模型
表6为共发酵过程中L-苹果酸含量变化的拟合方程和拟合系数。对比3 种拟合模型,4 个处理组Boltzmann模型和DoseResp模型拟合系数R2分别一致(A组:0.99915,B组:0.99951,C组:0.99913,D组:0.99984),高于对应的Logistic模型,均能较好反映共发酵过程中L-苹果酸含量的变化。

表6 L-苹果酸含量变化的拟合方程及其拟合系数Table 6 Fitting equations with correlation coefficients for L-malic acid content
L-苹果酸可使葡萄酒产生强烈的酸涩感,其在葡萄酒发酵期间含量的变化是衡量MLF是否完成的重要标志[34]。如图7拟合曲线所示,在共发酵过程中4 个处理组L-苹果酸的消耗与O.oeni的生长呈反向趋势。随着O.oeni数量的增长,L-苹果酸含量逐渐下降,在O.oeni对数生长时期,L-苹果酸含量下降速率较快,4 个处理组均于发酵5 d后L-苹果酸消耗速率较为缓慢,并分别于发酵9 d和8 d完成MLF。

图7 Boltzmann模型和DoseResp模型下L-苹果酸含量变化拟合曲线Fig.7 Boltzmann and DoseResp models describing L-malic acid content
3 讨论
采用模拟葡萄汁为发酵基质,以本土O.oeniZX-1和MG-1分别与S.cerevisiaeVW和AW进行共接种发酵。结果表明,不同菌株组合均能顺利完成AF和MLF,所选模型能较好描述共发酵动力学特征。O.oeni作为主导MLF的主要乳酸菌菌种,对葡萄酒生境具有较高要求。葡萄汁成分复杂,含有较多野生酵母和杂菌等抑制O.oeni生长的抑制因子[35]。而模拟葡萄汁因其成分简单,不仅可以满足微生物生长的需要,在排除其他微生物影响的同时,可以避免不同葡萄品种间理化指标差异的影响,且成本低廉,操作可控,有利于研究发酵机理和微生物的生长特性。段浩云等[36]利用模拟葡萄酒发酵体系,对筛选所得14 株乳酸菌进行耐受性分析实验,结果表明菌株G23与L42综合耐受能力最强。刘晓娇等[37]研究O.oeni在不同模拟酒中的降酸效果发现,O.oeni31MBR和SD-2a在96 h内降酸率达到90%以上。Nehme等[38]在模拟酒中发现在MLF 500 h时,O.oeniX降解了74%的L-苹果酸。
在共发酵过程中,A、B、C、D组S.cerevisiae活菌数均略低于对照组,这与Muñoz等[39]对丹娜葡萄汁进行共发酵的结果一致。该过程中由于受乳酸菌活性影响,酵母生长动力学和代谢活性降低。这一结果可能是由于早期接种发酵基质中较低的乙醇体积分数有利于本土O.oeni生长,造成了营养竞争,且本土O.oeni在生长过程中可能会释放β-1,3-葡聚糖酶,该酶会水解S.cerevisiae细胞壁,导致S.cerevisiae活菌数降低[40]。也有学者研究发现O.oeni对S.cerevisiae的生长没有影响,但会加速S.cerevisiae细胞的死亡,而S.cerevisiae细胞死亡速度的加快可能与O.oeni代谢产生的抑制因素有关[41]。此外,S.cerevisiae合成乙醇和中链脂肪酸的浓度和类型会抑制O.oeni的生长,且S.cerevisiae细胞内的阳离子蛋白也可能抑制MLF。然而,也有学者研究发现酵母的自溶活性在很大程度上影响葡萄酒中多肽、氨基酸和蛋白质等含氮化合物的浓度,而多肽(<1000 Da)对O.oeni的生长具有促进作用[42]。Tristezza等[11]对黑曼罗葡萄酒共发酵结果表明,菌株CL1能顺利完成MLF,而CL2则存在较高的L-苹果酸残留量,说明S.cerevisiae与O.oeni之间的相互作用与所选菌株有关。本研究4 个处理组还原糖消耗率和L-苹果酸降酸率均可达到95%以上,进一步说明本土O.oeniZX-1、MG-1和S.cerevisiaeVW、AW共接种可顺利完成AF和MLF。
共发酵过程中菌体生长、底物消耗和产物生成情况非线性拟合结果表明,Boltzmann模型对酵母菌生长和乙醇体积分数变化情况拟合效果较好,Logistic模型能较好反映还原糖含量的消耗变化。Boltzmann模型和DoseResp模型拟合系数R2相同,2种模型均能对共发酵过程中O.oeni生长和L-苹果酸的消耗情况进行拟合。李雪等[19]在仙人掌果酒发酵动力学研究结果表明,SGompertz、Logistic和DoseResp模型能较好反映发酵过程中酵母菌数、乙醇体积分数和还原糖含量变化。张琪等[32]研究发现,黑加仑果酒发酵过程中酵母菌数、乙醇体积分数和还原糖含量变化均以Logistic模型拟合效果最好。
近年来,越来越多的动力学模型被应用于指导酒类工艺放大生产。微生物菌株的发酵能力不仅与其自身生理机能有关,还受到发酵工艺、条件、过程控制等动力学规律的影响[39]。充分了解和掌握发酵过程中主要理化参数的变化趋势,选取适宜的发酵动力学数学模型,可较为准确地预测酿酒过程中关键指标的最终水平,对发酵菌株选择、工艺优化及工业化生产具有重要的指导作用[19]。在后续研究中,需要进一步通过葡萄酒酿造生产实践验证实验所建立动力学模型的适用性,深入探讨共接种发酵对酒体的品质影响,为定向酿造特色化葡萄酒、提升生产效率及促进本土菌株的产业化应用提供理论依据和技术支撑。
4 结论
综合分析发酵过程中底物消耗和产物生成的动态变化趋势结果表明,混菌发酵模式未明显抑制供试各菌株的生长和发酵性能,2 株本土O.oeni分别与商业S.cerevisiaeVW、AW共接种后均可顺利完成AF和MLF。不同接种处理组S.cerevisiae活菌数、乙醇体积分数、还原糖含量、O.oeni活菌数和L-苹果酸含量最佳线性拟合模型预测值和实测值拟合效果良好,可较为客观反映共发酵过程微生物生长和特定代谢物转化的动力学特征。研究结果有助于揭示共接种发酵过程中S.cerevisiae和O.oeni的演替变化规律,对葡萄酒酿造生产中相关主要指标的预测和工艺优化控制具有潜在的应用指导价值。

