副溶血性弧菌生物被膜动态形成机制的转录组分析
李安琪,石成龙,钱森和,王 洲,*,赵世光,3,刘 艳,薛正莲
(1.安徽工程大学生物与食品工程学院,安徽 芜湖 241000;2.安徽省工业微生物分子育种工程实验室,安徽 芜湖 241000;3.安徽工程大学宣城产业技术研究院,安徽 宣城 242000)
副溶血性弧菌(Vibrio parahaemolyticus)是一种革兰氏阴性嗜盐细菌,广泛分布于河口、海洋和沿海水域[1],也是全球范围内引起海产品相关肠胃炎的主要致病菌[2]。副溶血性弧菌感染多与食品安全有关,多发生在夏季,经常能从鱼、虾、扇贝等海产品中分离出来[3]。研究表明,副溶血性弧菌能形成生物被膜,且一旦形成很难清除[4]。细菌群体感应、外毒素、IV型分泌系统和鞭毛系统等与生物被膜的形成密切相关。生物被膜是由自身细菌分泌基质聚合物包裹的微生物群,它能够定植在生物和非生物表面[5]。被包裹的细菌能自己产生胞外聚合物(extracellular polymeric substances,EPS),如胞外多糖、胞外蛋白、脂质和核酸[6]。生物被膜的存在给公共卫生带来了极大的挑战,其原因是生物被膜通过EPS的作用保护菌体免受不良环境的侵害,生物被膜的存在能增强菌体抵抗紫外线[7]、抗生素[8]和其他外部压力高度耐受的能力[9]。
生物被膜的形成是一个复杂的过程,涉及细菌生理特性变化和多种基因调控。从以往研究可以知道,生物被膜形成大致分为5 个过程:可逆黏附阶段、不可逆黏附阶段、微菌落形成阶段、生物被膜成熟阶段、生物被膜解离阶段,解离后将进入下一个循环[10]。第1阶段:细菌菌毛和鞭毛加强了细菌与附着表面的相互作用[11],并且在范德华力和疏水相互作用可逆地附着在固体基质表面[12];第2阶段:细胞不可逆地依附在固体物质表面;第3阶段:附着的细菌逐渐繁殖聚集,构成微菌落,并伴随EPS的分泌[13];第4阶段:这些微菌落进一步发展成“蘑菇状”的三维立体结构[14],这是生物被膜成熟的标志;第5阶段:生物被膜出现孔洞,通过细胞自溶破坏基质以释放分散的细胞进入下一个循环[15]。总之,生物被膜的动态形成过程是一个无休止的循环。
目前对副溶血性弧菌生物被膜的研究主要集中在生物被膜形成条件和耐药性机制[16-17]。然而,细菌从浮游细胞状态向生物被膜状态的转化过程及其适应机制尚未阐明。因此,为了解细菌在生物被膜动态形成过程中基因表达的变化与生物被膜之间的关系,研究2 株生物被膜差异菌株的生理生化特性,并在此基础上对生物被膜形成前期和后期的生被膜菌进行转录组测序。本研究结果将有助于丰富副溶血性弧菌生物被膜形成机制研究,为生物被膜防控提供一定理论支撑。
1 材料与方法
1.1 菌株与试剂
副溶血性弧菌VP-0为实验室保存,ATCC 17802、LMG 16843、CATM 1807、MCCC11C 2691、MCCC1A14234均由中国海洋微生物菌种保藏中心惠赠;哈维氏弧菌ATCC BAA-1117购买于上海保藏生物技术中心,用于检测AI-2。
2216E液体培养基 青岛高科技工业园海博生物技术有限公司;结晶紫、苯酚、硫酸 上海国药集团化学试剂有限公司;Annexin V-FITC/PI试剂盒、BCA试剂盒生工生物工程(上海)股份有限公司;SYTO-9核酸染料美国Sigma-Aldrich公司。
1.2 仪器与设备
Multiskan FC型酶标仪 赛默飞世尔(上海)仪器有限公司;ZQZY-AS8摇床 上海知楚仪器有限公司;2100生物分析仪 美国Agilent公司;TCS SP8激光共聚焦显微镜(confocal laser scanning microscope,CLSM)德国Leica公司;F-4500荧光光谱仪 日本日立高新技术公司。
1.3 方法
1.3.1 菌株活化与培养
取一环甘油管中保存的菌体在2216E固体培养基中划线活化,37 ℃培养箱静置培养15~20 h。培养结束后,在无菌条件下挑取单菌落接种于2216E液体培养基中,200 r/min振荡培养备用。
1.3.2 改良微孔板法检测生物被膜
采用结晶紫法测定生物被膜的形成能力[18],并进行细微改动。具体方法如下:将过夜培养的菌液调整OD600nm=0.4~0.5,将200 μL菌液等分加入96 孔板中,于37 ℃分别静置培养到4、8、20、24、36、48、72、96 h(每个时间段重复8 个孔)。倒出孔中的培养物,用蒸馏水洗涤孔板两次,再置于干燥箱中干燥。每孔中加入等量的0.1 g/100 mL结晶紫溶液200 μL染色10 min,然后用蒸馏水冲去多余染料,烘干10 min,再用200 μL 95%乙醇溶液溶解15 min。使用酶标仪分别在570 nm波长处测定每个孔的吸光度,仅含培养基孔板和空白孔作为对照。
1.3.3 信号分子AI-2的检测
参照文献[19],用哈氏弧菌BB170测定信号分子AI-2活性。转接后的哈氏弧菌BB170在AB(autoinducer bioassay)培养基,于30 ℃振荡培养到OD600nm=1.5~2.0之间。并以1∶5000比例稀释后转接到新鲜的AB培养基中,得到稀释的哈唯氏弧菌BB170菌液。再吸取1 mL不同时期0.22 μm滤器过滤的副溶血性弧菌上清液、哈氏弧菌BB170上清液、AB培养基和2216E培养基,分别作为检测样品、阳性对照、阴性对照和介质对照,与9 mL哈氏弧菌BB170稀释液混合后加入灭菌后的试管中,振荡5 s后,于30 ℃培养箱培养6 h,测定荧光强度(U),每组样品均重复3 孔。用相对荧光强度表示AI-2信号分子浓度,计算公式如下[20]:阳性对照组相对荧光强度=阳性对照荧光强度值/阴性对照荧光强度值;实验组相对荧光强度=实验组荧光强度值/介质对照荧光强度值。
1.3.4 EPS检测
参考1.3.2 节方法培养生物被膜,吸取培养液8000×g离心10 min,收集上清液测定水溶性胞外多糖含量。具体步骤如下[21]:无细胞上清液加入3 倍体积无水乙醇,4 ℃沉淀过夜,8000×g离心后上清液,沉淀物溶解于无菌水中,用Sevag法脱蛋白,然后收集沉淀物用苯酚-硫酸法测定OD595nm值。
胞外蛋白测定参考文献[22],去除上清液的孔板用无菌水清洗干净,刮取生物被膜加入0.14 mol/L NaCl溶液混合超声,10000×g离心20 min,吸取200 μL上清液0.22 μm滤器过滤后用BCA试剂盒检测蛋白含量。
1.3.5 流式细胞仪检测
按照1.3.2节方法培养生物被膜,培养到不同时间(8、48、72、96 h)吸取菌液,4000×g离心10 min获得菌体,用0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)温和洗涤收集的菌体,轻轻摇匀。按照Annexin V-FITC/PI试剂盒标准操作进行染色,并在2 h内进行流式检测。
1.3.6 CLSM观察
培养到对数期的新鲜菌液置于无菌12 孔板中,放入无菌盖玻片,于37 ℃培养箱中静置培养48 h和96 h。培养结束后小心移除培养基用无菌PBS洗涤盖玻片,并加入2.5%的戊二醛溶液固定30 min。然后加入Syto-9置于暗室中染色15 min,再取出盖玻片再用PBS冲洗3 次,最后用CLSM进行观察[23]。
1.3.7 RNA的提取与样本检测
转录组测序工作委托北京诺和致源公司完成。通过对上述菌株生理特性的测定选取供试菌株ATCC 17802作为后续研究材料。将静置培养到8、48 h和72 h的生物被膜菌作为检测样本。用Trizol法提取RNA,并通过2100生物分析仪进行严格质控,精确无误地对RNA的完整性和含量进行检测。
1.3.8 文库构建与上机检测
质检合格获得的样品经处理,得到mRNA随机打断的短片段,并按照链特异性建库的方式建库[24],之后借助Illumina平台进行测序。
1.3.9 数据分析
对3 组样本93962274 条原始测序reads进行过滤,对样本的原始测序reads、有效reads、Q30和GC相对含量进行计算。并且,为了更好地探究3 个不同被膜菌在基因表达水平和通路上的差异,通过ClusterProfiler软件对差异基因集进行基因本体论(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
1.4 统计分析
采用SPSS 20.0统计软件进行统计分析。所有图形均通过Origin 2018绘制,实验重复3 次,3 个平行。数据以表示,P<0.05,差异显著。
2 结果与分析
2.1 生物被膜形成趋势
由图1A可知,实验所涉及的6 株供试菌株生物被膜的形成均先增加后减少,再增加到峰值又减少的趋势。可以基本判定0~12 h为可逆黏附阶段,12~48 h为不可逆黏附和微菌落形成阶段,48~72 h为成熟阶段,72~144 h为解离阶段。由图1B可知,生物被膜成熟期72 h时菌株ATCC 17802的成膜能力强于VP-0,且随着培养时间延长生物被膜开始解离,这与图1C结晶紫染色后的结果一致。副溶血性弧菌ATCC 17802和VP-0具有相似的成膜趋势,且静置培养72 h的成膜能力显著强于(P<0.05)其他菌株,可以作为后续研究材料。事实上,有研究发现,生物被膜的形成存在一定时间规律。丁文艳等[25]的研究中,副溶血性弧菌F29的生物被膜在48 h成熟,并在72 h发生脱落。除此之外,等在关于副溶血性弧菌生物被膜形成规律的研究中发现,这些结果不同的原因可能是由于菌株的不同和培养条件差异。

图1 生物被膜形成能力Fig.1 Biofilm formation ability
研究发现,细菌黏附在介质表面是生物被膜形成的先决条件,初始黏附作用促进了生物被膜的发育和成熟[26]。本研究菌株ATCC 17802在初始阶段的黏附性强于其他菌株,而表现出较强的生物被膜形成能力,这也为后期生物被膜的发育奠定了基础。在生物被膜形成的过程中,会逐渐产生成熟的生物被膜,部分细菌被包裹在具有复杂结构的细胞基质中,这种基质充当了稳定生物被膜结构的支架[27]。当外在氧气和营养物质等不充足时,生物被膜内部分细菌出现死亡,生物被膜厚度减少[28]。生物被膜解离后,细菌从基质脱落出来,成为浮游状态分散到环境中开始新一轮的黏附[29]。
2.2 信号分子AI-2检测结果
生物被膜形成过程受细菌群体感应途径调控[30]。群体感应是一种受细菌种群的密度调节基因表达的机制。当细菌密度增加到一定阈值时,细菌就会释放一种自诱导物AI-2。而随着环境中AI-2浓度的增加,相关基因随之表达。如图2所示,随着生物被膜的培养,两株被膜形成差异菌株的信号分子AI-2呈上升趋势,并且在72 h被膜成熟期达到最大值,生物被膜进入解离期时,AI-2浓度有所下降,这与生物被膜形成量趋势相一致(图1)。两株被膜差异菌株在信号分子AI-2在含量上没有显著差异。研究发现,AI-2能促进大肠杆菌和变形链球菌的生物被膜形成[31]。同样地,在本实验中两株菌生物被膜的形成趋势与各自AI-2变化趋势基本一致。张君怡等[32]的研究发现,单增李斯特菌上清液中的AI-2和生物被膜量随着培养时间的延长而增加,二者呈正相关性。这些结果与本研究结果一致,推测AI-2不仅与生物被膜形成有关,且变化趋势与生物被膜形成趋势存在一定相关性。

图2 信号分子AI-2动态检测Fig.2 Changes in content of signaling molecule AI-2
2.3 EPS分析
由图3可知,在本实验中,随着生物被膜的成熟,胞外多糖和胞外蛋白逐渐增多,并在被膜成熟期48~72 h含量迅速增加。此时ATCC 17802的胞外多糖和蛋白含量分别是VP-0的1.67 倍和2.3 倍。之后随着生物被膜的分解,两株供试菌胞外多糖和蛋白的含量均开始下降。由此可知,EPS的产生在生物被膜的成熟阶段起着最重要的作用。

图3 生物被膜EPS检测Fig.3 Changes in contents of extracellular polysaccharide and protein in biofilms
EPS能够介导细菌的表面黏附并保护细菌免受恶劣环境的影响[33]。其中胞外多糖最重要的功能之一是可作为胞外基质的基本结构元素,通过相互作用决定生物被膜的机械稳定性和黏附[34]。已有的研究表明,可溶性多糖经常被用作生物被膜中细胞的紧急外部能量库,甚至可以在不利的环境中提供能量[35]。而作为EPS另一个重要组分的胞外蛋白有助于生物被膜的形成和维持其结构的稳定性[36]。本实验也发现了胞外多糖和胞外蛋白与生物被膜形成的一致性。
2.4 细胞膜渗透性
Annexin V/PI双染法可以通过Annexin V和PI的不同特性进行渗透性检测,借助流式细胞仪可以清楚区分不同状态的细菌[37]。本实验中第1象限(AV-/PI+)和第2象限(AV+/PI+)为渗透性较高的细菌,PI能够顺利进入细胞膜并染色。第3象限(AV-/PI-)为正常细菌,第4象限(AV+/PI-)细菌磷脂酰丝氨酸有外翻,但细胞膜依然完整。
细菌渗透性的增加有利于EPS分泌。从图4可知,细胞膜的渗透性也发生改变,处在生物被膜形成期时(8、48、72 h)的两株供试菌株的细胞膜渗透性,均高于生物被膜解离期(96 h)。在生物被膜解离期细菌分泌EPS减少且部分细菌处于休眠状态,也因此细胞膜渗透性处于较低水平。在生物被膜形成期(8、48、72 h)成膜能力较强的ATCC 17802细胞渗透性高于成膜能力较弱的菌株VP-0。这也说明渗透性对生物被膜的形成具有重要作用,在生物被膜成熟期0~72 h保持较高的渗透性。



图4 Annexin V/PI双染法检测细胞膜渗透性Fig.4 Changes in cell membrane permeability detected by Annexin V/PI double staining
2.5 CLSM观察
副溶血性弧菌ATCC 17802和VP-0形成成熟生物被膜的CLSM如图5所示。可以看出,在48 h(图5A、B)成膜能力强的菌株ATCC 17802细菌较VP-0呈现更集聚集的状态。在成熟期(48~72 h)有大量菌体聚集分泌多糖和蛋白,并被胞外分泌物质包裹其中,抗逆性增强。随着生物被膜的解离,到96 h(图5C、D)时生物量有所减少,多糖和蛋白含量也随之减少。这与对生物被膜含量的检测结果相似,也进一步表明在生物被膜形成过程中,成膜能力强的菌株ATCC 17802黏附在介质表面的能力强于VP-0。

图5 CLSM观察生物被膜Fig.5 CLSM observation of biofilms
2.6 转录组分析
2.6.1 转录组数据质量分析
对93962274 条原始测序reads进行过滤,得到高质量有效reads共92506128 条(表1)。6 组样本的碱基测序精确度Q30值均达到95%以上,GC含量超过46%,说明测序错误较少且质量较高,可进行下一步分析。将转录组数据上传至NCBI数据库,登记号为PRJNA784512。

表1 转录组测序数据Table 1 Transcriptomic sequencing data
2.6.2 差异表达基因筛选及表达聚类分析
分别从48 h vs 8 h、72 h vs 8 h比较组中,筛选得到1061 个和802 个差异表达基因(P<0.05,|log2Fold Change|≥1),以静置培养8 h样本为对照时,48 h样本和72 h样本中,ATCC 17802基因表达上调分别为406 个和296 个,表达下调数量分别为655 个和606 个。72 h样本和48 h样本比较,差异表达基因共267 个,其中表达上调基因171 个,表达下调基因96 个(图6A)。结果表明,生物被膜成熟期(72 h和48 h)与生物被膜形成黏附期(8 h)相比较存在较大的基因差异,生物被膜形成受多种基因调控。
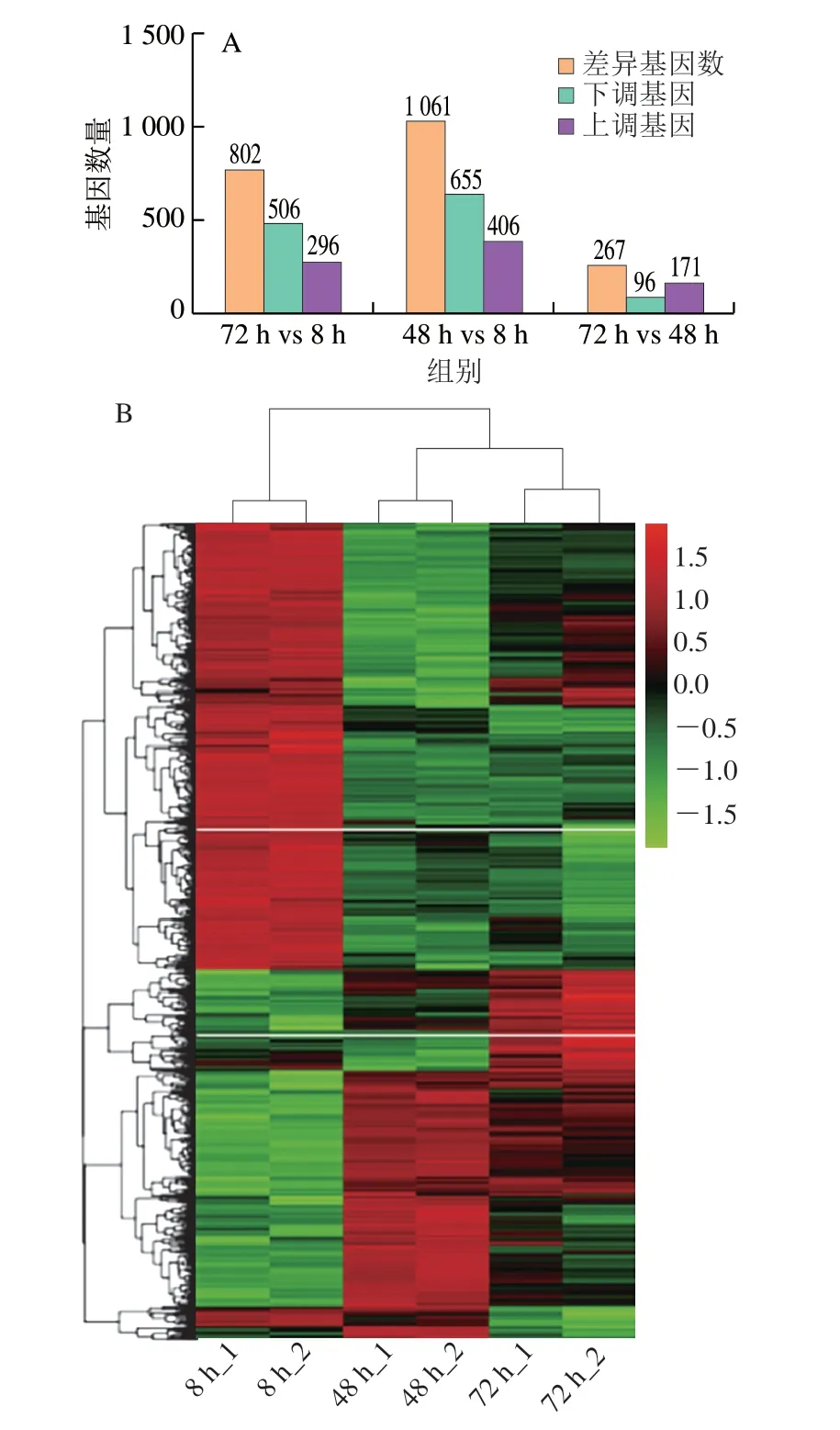
图6 生物被膜形成过程中差异基因表达情况Fig.6 Differential gene expression during biofilm formation
对基因表达值进行聚类分析,并对表达数据的行进行均一化处理。图6B表示差异基因FPKM(fragments per kilobase of transcript sequence per millions base pairs sequenced)归一化后的数值。可知RNA-Seq数据良好,3 个时间段基因表达差异明显,可进行后续基因注释分析。
2.6.3 生物被膜形成阶段差异基因的GO功能注释
将筛选到的差异基因注释到GO数据库,有助于对基因功能进行挖掘。GO富集分析以P<0.05、|log2Fold Change|≥1作为标准,将生物被膜形成前期(48 h vs 8 h)比较组的差异基因分别注释到生物学过程、细胞组分以及分子功能3 个大类(图7A)。48 h vs 8 h处理组注释差异基因到3 个大类,32 个亚类,在生物过程中注释的条目最多,其中涉及翻译、多组织过程、肽的合成、细胞酰胺代谢过程、ATP代谢过程、有机氮化合物生物合成过程和跨膜运输,多数表现基因下调;在细胞组分类别下,主要涉及细胞内的细胞质、细胞器以及核蛋白复合物,表现较多的差异基因,且多为下调;在分子功能类别中,核糖体结构成分、结构分子活性、质子跨膜转运蛋白活性、氧化还原酶活性等条目下表达差异基因数量较多,并表现基因下调特性。


图7 差异基因GO富集及功能注释Fig.7 GO enrichment and functional annotation of differentially expressed genes
在静置培养72 h后,生物被膜进入成熟后期,由图7B可知,72 h与48 h处理组比较,注释差异基因到3 个大类,14 个亚类,在生物过程类别中,氧化还原过程、α-氨基酸代谢过程、应激响应过程、蛋白质折叠、细胞稳态、种间互作等表现显著差异;在细胞组分类别中,仅外膜表现显著差异;而在分子功能类别中,丝氨酸型内肽酶活性、氧化还原酶活性、磷酸转移酶活性、羧酸酯水解酶活性等表现显著差异。
2.6.4 生物被膜形成阶段差异基因的KEGG代谢通路分析
结合KEGG数据库,对各实验组差异显著基因所参与的代谢通路进行了分析,结果如图8所示,分别以通路基因比值、富集基因数目、P值为指标,进行相关代谢通路的分析。在48 h与8 h处理组比较中,差异基因主要参与了核糖体、细菌分泌系统、氧化磷酸化、次级代谢产物的生物合成、不同环境下的微生物代谢、碳代谢等相关通路,共涉及22 种代谢通路;在72 h与48 h处理组的比较中,差异基因主要参与乙醛酸和二羧酸代谢、不同环境下的微生物代谢、碳代谢、丙酮酸盐代谢、脂肪酸代谢、ABC转运蛋白、群体感应等通路,共涉及22 种代谢通路。


图8 差异基因KEGG富集到的主要代谢通路Fig.8 Major KEGG metabolic pathways enriched with differentially expressed genes
2.7 生物被膜相关差异基因挖掘
为深入挖掘与生物被膜相关差异基因的变化,了解生物被膜动态形成过程中的差异,对富集的差异基因进行分析。FPKM是目前常用的基因表达水平估算方法[38]。基因表达量以FPKM表示,结果如表2所示。
生物被膜的形成与细菌群体感应信号分子的表达与识别有关,信号分子的合成与传递是微生物环境适应性的一种调节方式。在信号分子AI-2达到一定阈值时,会被膜上的受体识别,进而调控胞内一系列基因的表达[39]。由表2可知,本实验中可逆黏附期(8 h)AI-2大量合成,此时AI-2合成调控基因(luxS)高表达。当信号分子积累到一定阈值时,AI-2受体蛋白基因(luxQ和luxP)上调,并在被膜成熟后(72 h)下调。且细胞密度处于高水平时,opaR会大量表达与exsBAD-vscBCD启动子区相结合,此时在opaR作用下,T3SS分泌系统相关基因出现下调[40]。研究表明,T3SS分泌系统影响生物被膜的形成、运动性和细菌存活能力[41]。
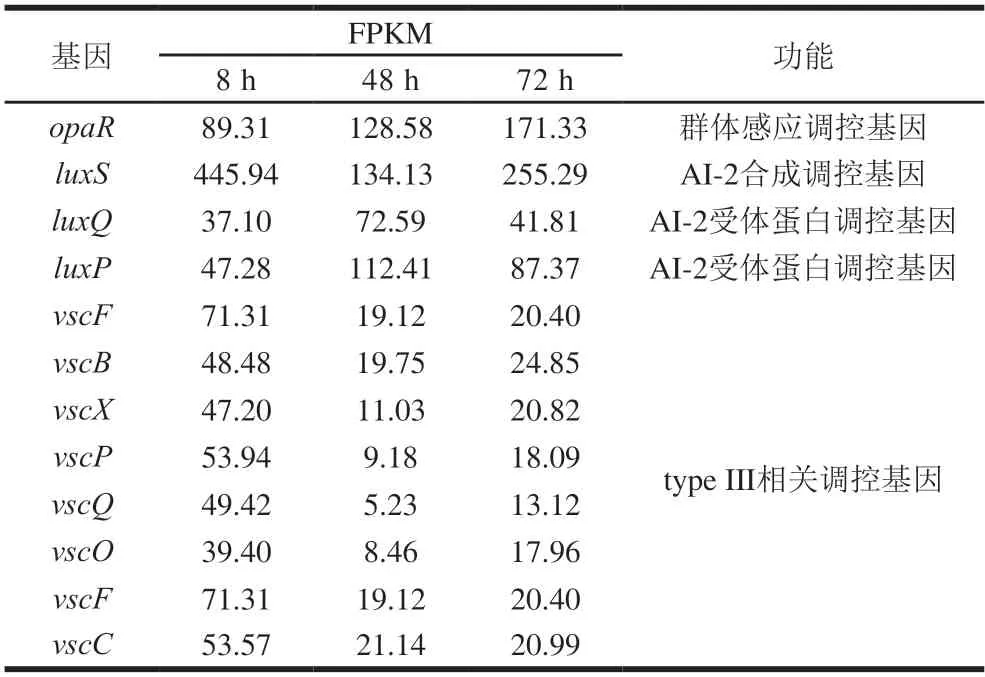
表2 生物被膜相关部分差异表达基因Table 2 Differentially expressed genes related to biofilm
2.8 能量代谢相关差异基因挖掘
糖酵解途径能将葡萄糖分解为两分子丙酮酸并提供能量,此过程分为准备阶段和放能阶段两个部分[42]。在生物被膜形成过程中,准备阶段的磷酸葡萄糖异构酶、磷酸果糖激酶和放能阶段的磷酸甘油酸变位酶、丙酮酸激酶均有一致变化,在可逆黏附(8 h)到生物被膜成熟前期(48 h)过程中,上述基因上调;在生物被膜成熟后期(72 h),上述基因表达下调(表3)。
在胞浆进行的戊糖磷酸途径能通过氧化葡萄糖得到6 分子CO2和12 单位强还原力的NADPH[43],其限速酶葡萄糖-6-磷酸脱氢酶编码基因在可逆黏附(8 h)到生物被膜成熟前期(48 h)过程中,基因上调,在生物被膜成熟后期(72 h)基因表达下调(表3)。
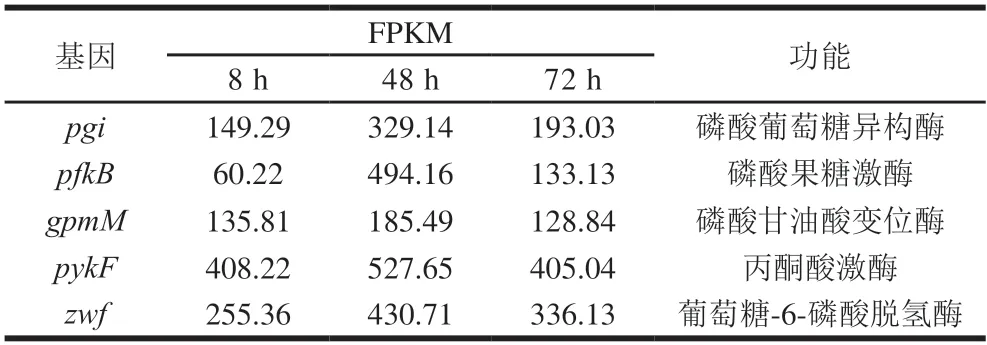
表3 能量代谢相关部分差异表达基因Table 3 Energy metabolism-related differentially expressed genes
糖酵解和戊糖磷酸途径能为机体提供还原能,推测在生物被膜可逆黏附期到成熟期过程中菌体需要还原能,用于合成大量蛋白质和多糖,所以调控基因上调。在成熟后期需求减少,相关基因下调,此时被膜成熟,细菌体内代谢减少,保存能量。
2.9 鞭毛合成相关差异基因挖掘
在许多细菌中,鞭毛介导的运动性在生物被膜形成的初始阶段发挥重要作用[44]。细菌需要借助鞭毛的作用,运动到固体表面增加其黏附和聚集,从而促进生物被膜的形成,在定植完成后,运动相关基因会关闭[45]。
如表4所示,在可逆黏附(8 h)到生物被膜成熟前期(48 h)过程中,鞭毛组装蛋白合成普遍下调,其中鞭毛反σ因子(flgM)表达量有所增加,鞭毛调控蛋白FlgM对鞭毛转录的2级和3级操纵子起到负调控作用[46],这些直接导致菌体运动能力减弱。

表4 鞭毛相关部分差异表达基因Table 4 Flagellum-associated differentially expressed genes
2.10 转运相关差异基因挖掘
转运蛋白大量存在于原核生物中,能借助ATP释放的能量协助多种物质进出细胞。对生物被膜菌形成过程中转运蛋白进行分析,表5展示了主要差异蛋白基因:麦芽糖转运蛋白(malK、malE、malF、malG)、精氨酸转运蛋白(artM、artQ、artP)和寡肽转运蛋白(oppB、oppC、oppD、oppF)。
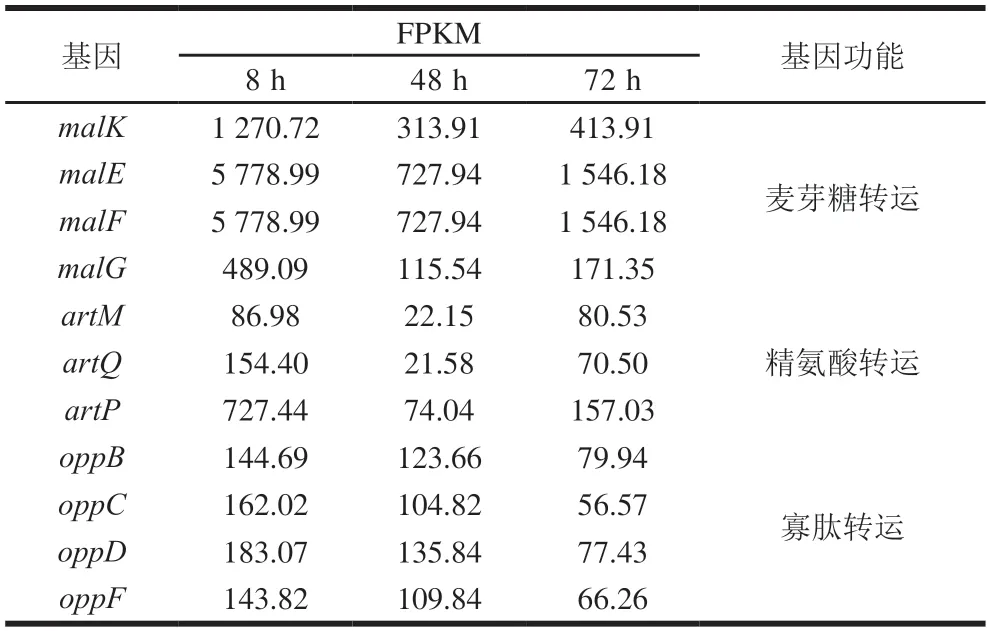
表5 转运相关部分差异表达基因Table 5 Transport-related differentially expressed genes
寡肽转运蛋白编码基因持续下调,而麦芽糖转运蛋白和精氨酸转运蛋白编码基因在可逆黏附期(8 h)到生物被膜成熟前期(48 h)过程中,基因表达下调,在生物被膜成熟后期(72 h)基因表达上调。而寡肽蛋白表达持续下调表明被膜菌对药物转运到胞内能力减弱,耐药性增强。
3 结论
有研究表明,细菌在不适宜环境中会通过分泌EPS形成生物被膜的形式将自身细菌包裹,生物被膜受多种基因调控,是一个复杂的动态过程[47]。生物被膜形成涉及细菌运动、黏附、EPS分泌和能量转换等多种变化。在此过程中,细菌的一系列生理生化变化和调控基因的变化是需要研究的重点。
本实验针对6 株副溶血性弧菌的生物被膜形成能力进行测定,筛选出成膜差异大的2 个菌株作为供试菌株。与成膜能力差的菌株VP-0相比,成膜能力较强的ATCC 17802菌株信号分子AI-2的释放量没有明显差异,胞外多糖和胞外蛋白的分泌量显著高于VP-0,细胞膜渗透性更高,且生物被膜成熟期细菌呈现更聚集的状态。
副溶血性弧菌ATCC 17802被膜菌转录组测序结果显示,处理组72 h vs 8 h、48 h vs 8 h和72 h vs 48 h差异基因分别为802(上调506,下调296)、1061 个(上调655,下调406)和267 个(上调96,下调171)。通过差异表达基因GO富集分析可知,生物被膜成熟期与黏附期比较,差异基因主要富集在化合物合成、蛋白质代谢过程中。差异基因注释到KEGG数据库显示,在48 h与8 h处理组比较中,差异基因主要参与了核糖体、细菌分泌系统、生物合成、不同环境下的微生物代谢和碳代谢等相关通路,共涉及22 种代谢通路;在72 h与48 h处理组的比较中,差异基因主要参与生物代谢、ABC转运蛋白和群体感应等通路,共涉及22 种代谢通路。
综上所述,在可逆黏附期(8 h)阶段,副溶血性弧菌通过AI-2的合成与累积,调节一系列级联反应。进入生物被膜成熟前期(48 h),其代谢增加,运动能力减弱,转运蛋白编码基因上调,EPS分泌增加;在生物被膜成熟后期(72 h),细菌代谢减少,寡肽转运蛋白基因下调,耐药性增加。这些研究结果为生物被膜形成机制的研究提供了一定理论支持。

