巨噬细胞PDHA1基因敲除对非酒精性脂肪性肝病小鼠肝细胞凋亡的影响*
王 梦, 孙 岳, 杨安宁, 宝 瑞, 畅思容, 李媛媛, 余梦雪, 刘志宏△
(1宁夏医科大学公共卫生与管理学院,宁夏 银川 750004;2宁夏医科大学基础医学院,国家卫生健康委代谢性心血管疾病研究重点实验室,宁夏 银川 750004)
随着遗传因素以及当今生活方式等因素的变化,非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)已成为一个全球性的公共卫生问题,全球有25%到30%的人口患有不同程度的脂肪肝[1]。NAFLD是在没有过量饮酒情况下发生的一系列肝脏疾病,从异位脂质储存形式的脂肪变性到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)的炎症和纤维化。NAFLD的特点是肝脏中脂质异常堆积。有研究表明,几种蛋氨酸代谢产物,包括S-腺苷蛋氨酸(S-adenosylmethionine, SAM)、S-腺苷同型半胱氨酸(S-adenosylhomocysteine, SAH)和同型半胱氨酸(homocysteine, Hcy),是肝脏脂质水平的关键决定因素[2]。与非NAFLD患者相比,NAFLD患者具有更高的SAM、SAH和Hcy水平及更低的SAM/SAH比值[3]。Hcy是一种含硫氨基酸,是半胱氨酸代谢过程中的重要中间产物,血浆Hcy水平升高造成高Hcy血症,随之会引起脂质代谢紊乱。肝脏是Hcy主要代谢场所,肝脏中的巨噬细胞在维持正常生理下的肝脏稳态以及在NAFLD向NASH的进展中促进炎症和介导纤维化方面发挥着重要作用。
肝脏巨噬细胞的代谢方式决定着其炎症表型,即促炎巨噬细胞依赖于糖酵解,而抗炎巨噬细胞的功能主要依赖于氧化磷酸化。丙酮酸脱氢酶E1 α1亚基(pyruvate dehydrogenase E1 subunit alpha 1, PDHA1)为丙酮酸脱氢酶复合体的关键E1亚单位,在糖酵解和三羧酸循环之间占据重要的位置。PDHA1基因缺乏导致线粒体功能障碍并促进糖酵解[4]。已有研究表明,丙酮酸脱氢酶复合物和乳酸脱氢酶是治疗急性肝功能衰竭的靶点[5]。SIRT3的缺失使高度赖氨酸乙酰化的PDHA1酶活性降低,导致细胞内乳酸积累,降低了巨噬细胞内pH值,从而调节巨噬细胞分泌NLRP3和IL-1β水平[6]。通过抑制丙酮酸脱氢酶激酶 1(pyruvate dehydrogenase kinase 1, PDK1)增强丙酮酸脱羧酶(pyruvate decarboxylase, PDC)活性来重编程癌症代谢,可增加对包括非小细胞肺癌在内的几种癌细胞系的抗癌作用,降低PDHA1活性会诱导肝癌细胞凋亡[7-8]。在NAFLD中,当肝细胞达到其脂质储存阈值时,脂毒性和肝细胞应激也会导致细胞凋亡[9]。但NAFLD中肝脏巨噬细胞PDHA1表达水平的变化能否影响肝细胞凋亡的发生,目前尚不清楚。因此,我们构建了巨噬细胞特异性PDHA1缺失小鼠,探讨巨噬细胞PDHA1对NAFLD中肝细胞凋亡的影响,为NAFLD的防治提供参考资料。
材料和方法
1 实验动物
6只SPF级雄性巨噬细胞特异性PDHA1敲除(PDHA1iΔMΦ/iΔMΦ)小鼠和 6 只同背景的雄性 C57BL/6J小鼠,6周龄,体重18~22 g,均购自北京唯尚立德科技有限公司[许可证号:SCXK(京)2016-0009],饲养于宁夏医科大学实验动物中心。
2 试剂与仪器
丙氨酸转氨酶(alanine aminotransferase, ALT)检测试剂盒(C010-2-1)和甘油三酯(triglyceride, TG)测试盒(A110-1-1)均购于南京建成科技有限公司;全蛋白提取试剂盒(KGP250)和BCA蛋白定量试剂盒(KGP902)均购于南京凯基生物有限公司;总RNA提取试剂盒(DP419)购于北京天根生化科技有限公司;Bax抗体(ab32503)、caspase-3抗体(ab184787)和β-actin抗体(ab8226)均购自Abcam;山羊抗小鼠抗体(ZB-2305)和山羊抗兔抗体(ZB-2301)均购自北京中杉金桥生物技术有限公司。
光学显微镜(型号:DM2000)购自Leica;分光光度计(型号:DS-11)购自DeNovix;酶标仪(型号:130412C)购自BioTek;实时定量荧光PCR仪(型号:qTOWER3G)购自Analytik Jena。
3 实验方法
3.1 实验动物饲养和分组 随机选取体重相近的雄性野生型(wild-type, WT)和PDHA1iΔMΦ/iΔMΦ小鼠各6只。将小鼠饲养于宁夏医科大学SPF级实验动物中心。环境相对湿度50%左右,温度(25±2) ℃,保证无菌环境。分笼给予2%高蛋氨酸饮食,喂养12周后进行后续试验。
3.2 动物取材与处理 将小鼠禁食12 h后,异氟烷吸入麻醉后,眼球取血,室温静置2 h,1 000×g离心15 min,取血清,取各组小鼠肝脏组织,一部分用4%多聚甲醛固定用于制备石蜡切片,一部分用OCT冰冻切片包埋剂固定后,液氮速冻,于-80 ℃保存,用于冰冻切片。剩余组织-80 ℃保存,用于后续实验。
3.3 小鼠基因型鉴定 剪取小鼠脚趾约0.5 cm放置入200 μL无菌EP管中,并标记对应耳标号。加入裂解液和蛋白酶K,55 ℃水浴过夜裂解,95 ℃变性后,10 000×g离心5 min,取上清为提取的DNA,分别加入Lyz2-Cre和PDHA1-flox基因上下游引物,用PCR仪扩增DNA片段,在进行琼脂糖凝胶电泳,将扩增后的DNA片段与DNA marker比较,Lyz2-Cre大小为749 bp,PDHA1-flox大小为297 bp。
3.4 小鼠骨髓细胞提取及骨髓来源巨噬细胞分化 分离取出小鼠的股骨,无菌条件下,放入含有75%酒精的细胞培养皿中,分离去除周围结缔组织,然后移入含有1× PBS的培养皿中清洗,最后再将其转移另一个含有1%双抗的DMEM的细胞培养液中。随后,用眼科剪去除股骨的两端,然后用含有2 mL DMEM细胞培养液的注射器,从骨其中一个断端冲洗骨髓细胞到10 mL离心管中,重复3次,1 000×g离心8 min,弃上清液。加入5 mL红细胞裂解液,吸管反复吹打,然后静置3 min。1 000×g离心8 min,弃上清液。加入5 mL DMEM细胞培养液重悬细胞,然后用40 μm细胞滤器过滤细胞。1 000×g离心 8min,弃上清液,重复3次。加入含有20 μg/L M-CSF、10%FBS和1%青-链霉素的DMEM细胞培养液重悬细胞,诱导骨髓细胞分化为巨噬细胞。细胞计数,调整细胞浓度至 1×109L-1[10]。
3.5 Western blot检测小鼠原代巨噬细胞中PDHA1蛋白表达 提取小鼠骨髓来源巨噬细胞全蛋白,紫外分光光度计测量蛋白浓度,并且统一蛋白浓度为5 g/L,每管蛋白加占比25%的上样缓冲液后,高温变性,每孔加入8 μL蛋白样品,进行SDS-PAGE。
3.6 小鼠血清Hcy和ALT水平检测 将每组组小鼠禁饮食12 h后,腹腔注射水合氯醛麻醉后,眼球取血,室温静置2 h,分离血清。将血清样本交于金域医学检验集团股份有限公司,应用全自动生化仪检测血清中Hcy和ALT水平。
3.7 苏木精-伊红(hematoxylin-eosin, HE)染色 取材后,将肝脏投入4%多聚甲醛中固定,固定成功后梯度酒精脱水,随后将置于二甲苯中以替换酒精。用已经融化好的石蜡包埋脱水透明的组织,待冷却凝固成块后,切片、展片、烤片。将包埋好的蜡块固定于切片机上,切成薄片,贴于载玻片上。使用二甲苯将石蜡切片进行脱蜡,然后再使用梯度酒精进行水化,以便染料可以进入组织。苏木精染料进行染色,蒸馏水冲洗切片洗去染料,再用0.1%盐酸乙醇进行分化,然后水洗去多余染料,伊红液染色,染色完成后用流水洗去多余染料。水洗完后用从低到高浓度的梯度酒精进行脱水。随后用二甲苯进行透明,用树脂进行封片,上镜观察拍照。
3.8 肝组织上清液中TG水平检测 称取肝组织,加入9倍体积的无水乙醇,冰浴条件下匀浆,1 000×g离心10 min,匀浆介质用无水乙醇提取,取上清液。采用微板法,在96孔板上按照测试盒说明书进行操作后,37 ℃温箱孵育10 min后,酶标仪测定波长510 nm的吸光度,代入标准曲线公式算得肝组织中TG含量。
3.9 肝组织上清液中ALT检测 称取肝组织,加入9倍体积的生理盐水,冰浴条件下匀浆,1 000×g离心10分钟,取上清液,生理盐水稀释到适宜浓度。采用微板法,在96孔板上按照测试盒说明书进行操作后,酶标仪测定波长510 nm的吸光度,代入标准曲线公式算得肝组织中ALT活性[11-12]。
3.10 凋亡指标的检测 (1) qRT-PCR:提取肝脏组织总RNA,并逆转为cDNA。通过Primer Bank官网设计目的基因引物。Bax的上游引物序列为5'-AGACAGGGGCCTTTTTGCTAC-3',下游引物序列为5'-AATTCGCCGGAGACACTCG-3';caspase-3的上游引物序列为5'-CTCGCTCTGGTACGGATGTG-3',下游引物序列为5'-TCCCATAAATGACCCCTTCATCA-3。以cDNA为模板,实时荧光定量PCR扩增目的基因。(2) Western blot:提取小鼠肝组织总蛋白,统一蛋白浓度为5 g/L,高温变性后,每个蛋白样本均上样8 μL进行SDS-PAGE。电泳结束后300 mA恒流转膜2 h,2%的脱脂奶粉封闭2 h,分别用Bax和caspase-3特异性Ⅰ抗4 ℃孵育过夜,用PBST洗膜,洗3次,每次10 min。后用HRP标记的Ⅱ抗孵育2 h,同上洗膜3次,发光液孵育后,取出PVDF膜于凝胶成像分析仪上进行曝光分析,以β-actin为内参照,Image Lab对Bax与β-actin、caspase-3与β-actin灰度的比值进行分析比较。
4 统计学处理
使用GraphPad Prism 6.0统计软件进行数据分析。实验数据以均数±标准差(mean±SD)表示。两组间均数比较采用t检验;多组间均数比较采用方差分析。以P<0.05为差异有统计学意义。
结 果
1 小鼠基因鉴定结果
通过PDHA1flox/flox小鼠与Lyz2-Cre+/-小鼠交配得到7只子代幼鼠,剪取小鼠脚趾并裂解提取DNA,PCR分别扩增Lyz2-Cre和flox基因,琼脂糖凝胶电泳进行基因鉴定,Lyz2-Cre目的条带大小为749 bp,flox目的条带大小为279 bp,第1、3、4、5、6、7号小鼠鉴定为PDHA1iΔMΦ/iΔMΦ小鼠,见图1。
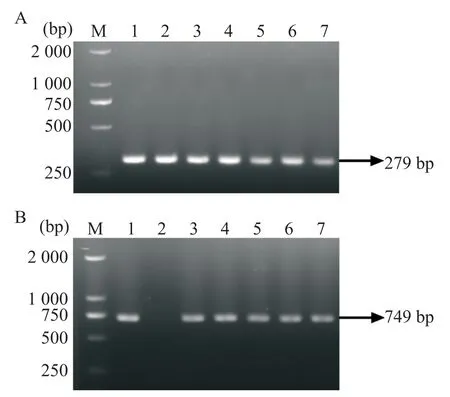
Figure 1. Identification of mouse model with macrophage PDHA1 conditional knockout. A: PDHA1-flox gene locus identification result; B: Lyz2-Cre gene identification result. M: DNA marker; 1, 3, 4, 5, 6 and 7:PDHA1iΔMΦ/iΔMΦ.图1 巨噬细胞PDHA1条件性敲除小鼠模型的基因鉴定
2 小鼠骨髓来源巨噬细胞中PDHA1蛋白表达水平
Western blot结果显示,PDHA1iΔMΦ/iΔMΦ小鼠骨髓来源巨噬细胞中PDHA1蛋白表达水平显著低于WT小鼠(P<0.01),见图2。由上述结果可见,我们已成功构建PDHA1条件性巨噬细胞敲除小鼠模型。
3 小鼠血清Hcy水平比较
高Hcy饮食后,WT+Hcy组血清Hcy水平高于正常饮食组,且巨噬细胞PDHA1特异性敲除后,血清Hcy水平比WT组升高(P<0.05),见图3。由此可见,小鼠高Hcy血症模型构建成功。
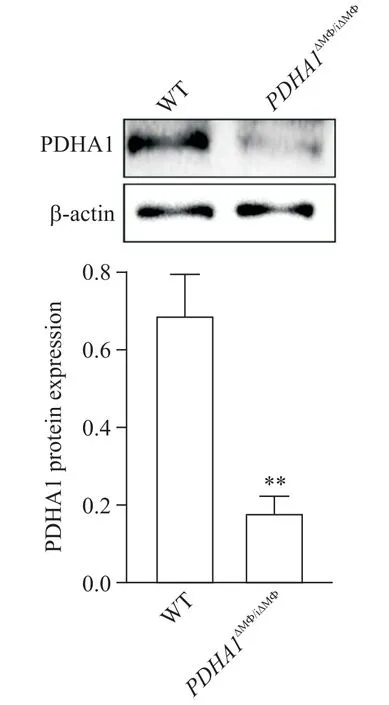
Figure 2. Verification of PDHA1 conditional knockout in mouse macrophages. The protein expression of PDHA1 in bone marrow macrophages was detected by Western blot. Mean±SD. n=6. **P<0.01 vs WT group.图2 小鼠巨噬细胞PDHA1条件性敲除的效果验证
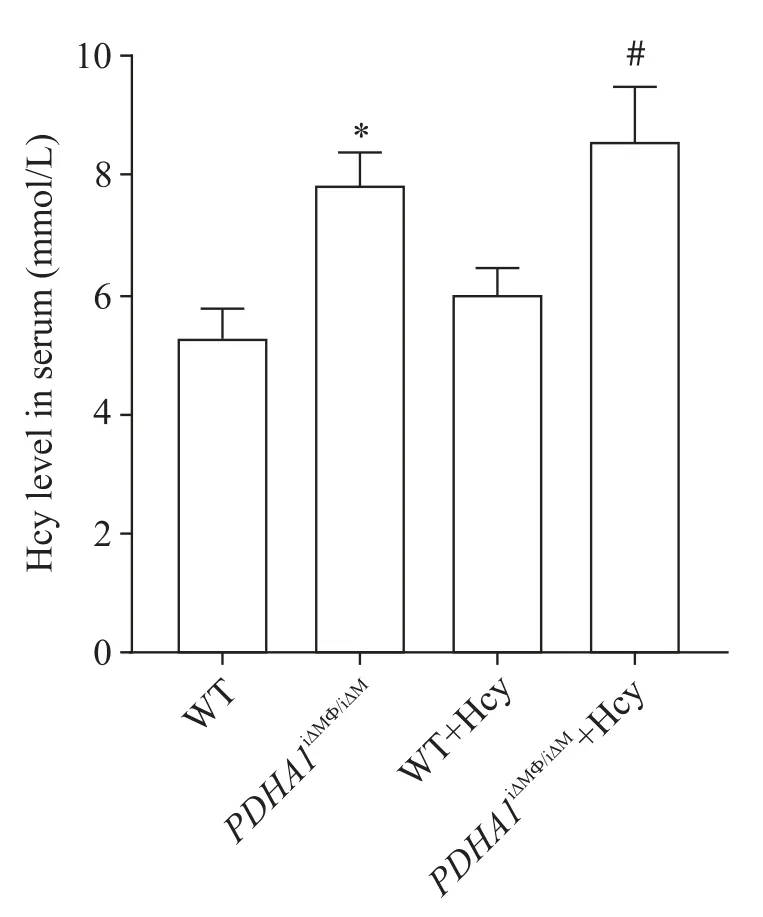
Figure 3. The serum level of Hcy in mice. Mean±SD. n=6. *P<0.05 vs WT group; #P<0.05 vs WT+Hcy group.图3 小鼠血清Hcy水平比较
4 小鼠肝组织TG水平比较
在给予12周高Hcy饮食后,WT+Hcy组和PDHA1iΔMΦ/iΔMΦ+Hcy组小鼠肝组织上清液 TG 浓度显著高于给予普通饮食的WT组和PDHA1iΔMΦ/iΔMΦ组(P<0.05),见图4。
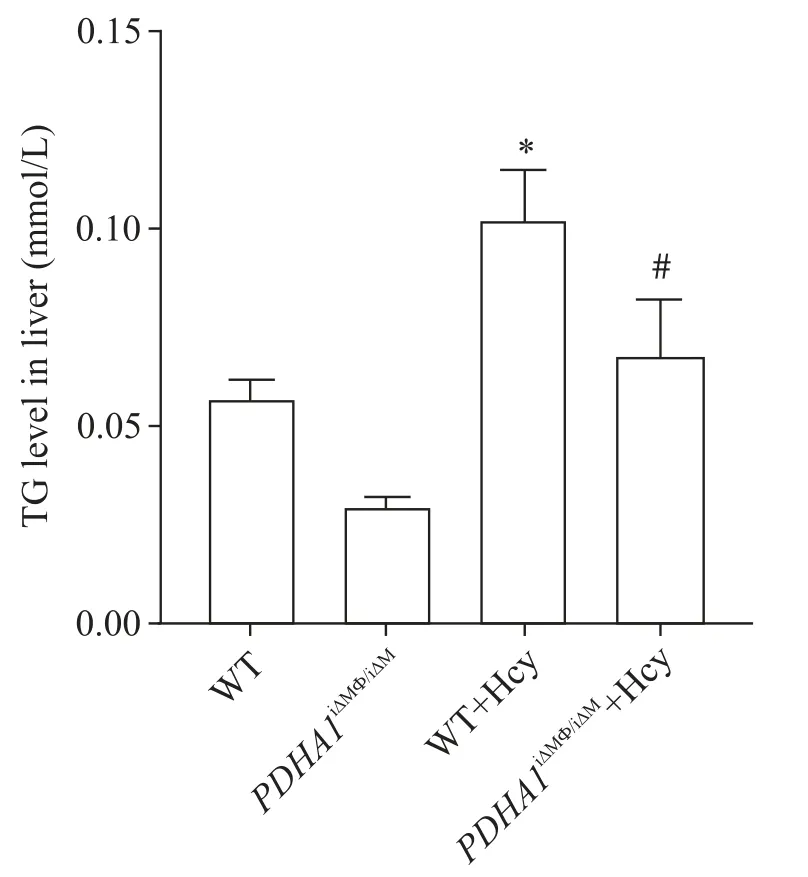
Figure 4. The concentration of TG in the liver tissue supernatant of mice. Mean±SD. n=6. *P<0.05 vs WT group; #P<0.05 vs PDHA1iΔMΦ/iΔMΦ group.图4 各组小鼠肝组织上清液中TG浓度
5 小鼠肝脏血清及肝组织ALT水平比较
在给予 12 周高 Hcy饮食后,PDHA1iΔMΦ/iΔMΦ+Hcy组小鼠血清及肝组织上清液中ALT水平均高于WT+Hcy组(P<0.05),见图5。
6 小鼠肝组织切片HE染色结果
WT正常饮食组小鼠,肝细胞排列整齐,结构正常;与WT正常饮食组相比,高Hcy饮食导致小鼠肝组织内肝细胞排列紊乱,且有脂肪空泡出现及少量炎性细胞浸润;与WT正常饮食组小鼠相比,PDHA1iΔMΦ/iΔMΦ正 常 饮 食 组 小 鼠 肝 窦 排 列 较 紊 乱 ;PDHA1iΔMΦ/iΔMΦ组小鼠经高 Hcy饮食饲养后,肝小叶结构被破坏,且有大量脂肪空泡,中央静脉周围有大量炎性细胞浸润,有肝细胞发生坏死,见图6。
7 肝组织中Bax和caspase-3的mRNA表达水平
qRT-PCR 结果显示,正常饮食下,PDHA1iΔMΦ/iΔMΦ组与WT组相比Bax和caspase-3的mRNA表达水平无显著差异(P>0.05);但经过高Hcy饮食饲养后,PDHA1iΔMΦ/iΔMΦ+Hcy 组较 WT+Hcy组 Bax和 caspase-3的mRNA表达水平均显著升高(P<0.05),见图7。
8 肝组织中Bax和caspase-3的蛋白表达水平
Western blot结果显示,正常饮食下,PDHA1iΔMΦ/iΔMΦ组与WT组相比Bax和caspase-3的蛋白表达水平无显著差异(P>0.05);但经过高Hcy饮食饲养后,PDHA1iΔMΦ/iΔMΦ+Hcy组 Bax和 caspase-3蛋白表达水平均显著升高(P<0.05),见图8。
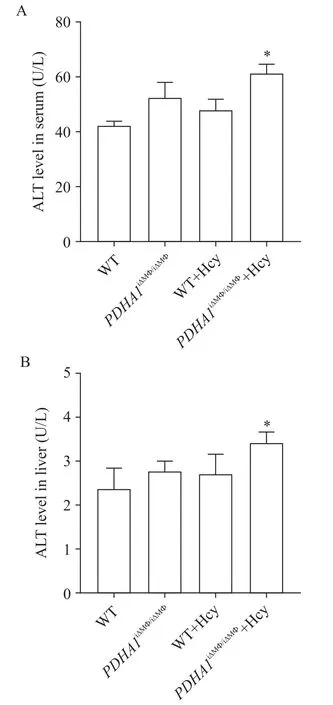
Figure 5. The ALT levels in serum(A) and liver tissue (B) of the mice. Mean±SD. n=6. *P<0.05 vs WT+Hcy group.图5 小鼠血清及肝组织中ALT水平
讨 论
NAFLD已逐渐成为主要的慢性肝病和严重的全球健康负担,影响高达25%的世界人口。在中国,2018年NAFLD患病率达到32.9%,发病率大幅上升。NAFLD的特征是肝脏中脂肪沉积过多伴部分组织损伤或炎症,最终导致肝硬化和与之相关的终末期肝病和肝细胞癌的风险。肝脏作为蛋氨酸和脂质代谢的主要部位,几种蛋氨酸代谢产物,包括SAM、SAH和Hcy,是决定肝脏脂质水平的关键因素[3]。
蛋氨酸代谢在肝细胞中高度活跃,且血清蛋氨酸及蛋氨酸代谢产物的水平影响着肝脏蛋氨酸的代谢活性[13]。因此,血清蛋氨酸代谢产物可作为肝脏蛋氨酸代谢的指标[14]。本研究观察到给予高蛋氨酸饮食后,巨噬细胞特异性PDHA1敲除小鼠血清蛋氨酸代谢中间产物Hcy水平升高,而Hcy升高导致细胞脂质代谢发生改变,促进肝脏脂肪堆积,从而使肝组织上清液TG水平升高[15]。因此,巨噬细胞PDHA1特异性缺乏可进一步加重NAFLD中肝脏脂质堆积,使肝脏结构被破坏,发生损伤,影响其功能。
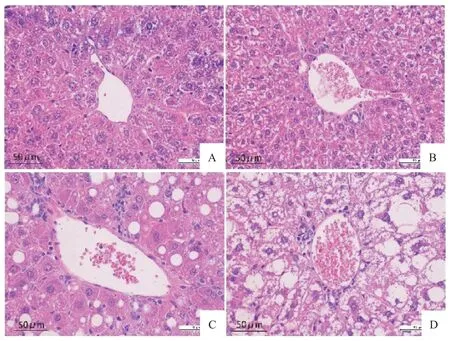
Figure 6. Pathomorphological changes of mice liver tissue sections (scale bar=50 μm). In WT group (A), the liver structure was normal. The arrangement of hepatic sinusoids in PDHA1iΔMΦ/iΔMΦ group (B) was disordered. In WT+Hcy group (C), a number of fat vacuoles and inflammatory cells infiltrated the mouse liver tissue. In PDHA1iΔMΦ/iΔMΦ +Hcy group (D), the hepatic lobule structure was destroyed and some hepatocytes were necrotic.图6 小鼠肝组织病理形态学的变化
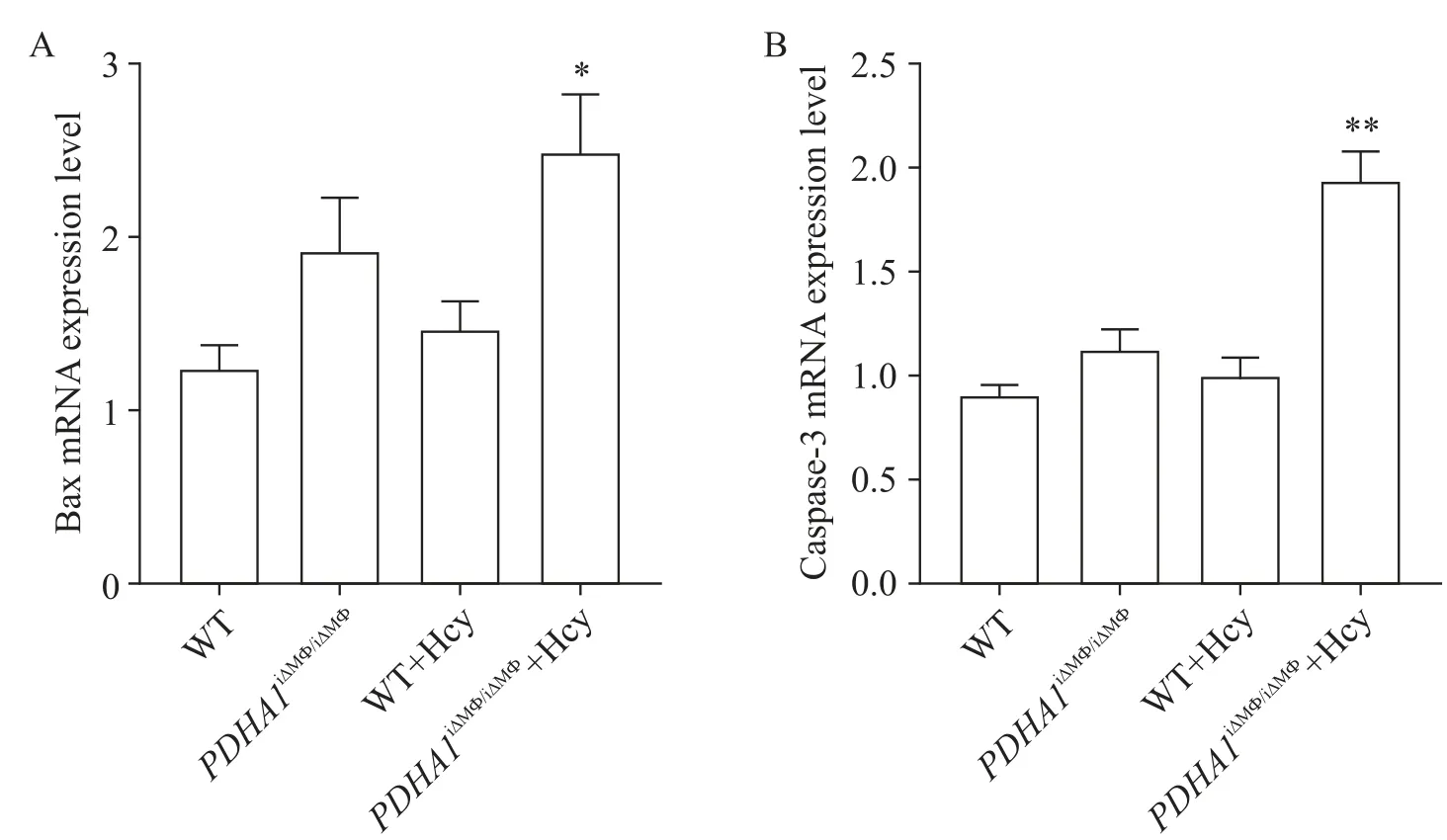
Figure 7. The mRNA expression levels of Bax (A) and casepase-3(B) in mouse liver tissues were detected by qRT-PCR. Mean±SD. n=6. *P<0.05, **P<0.01 vs WT+Hcy group.图7 小鼠肝脏组织中Bax和caspase-3的mRNA表达水平比较
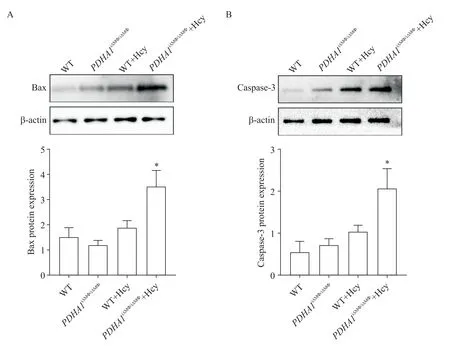
Figure 8. The protein expression levels of Bax (A) and casepase-3 (B) in mouse liver tissues were detected by Western blot. Mean±SD. n=6. *P<0.05 vs WT+Hcy group.图8 小鼠肝脏组织中Bax和caspase-3蛋白表达水平比较
在NAFLD的多因素发病机制中,肝细胞脂毒性和免疫介导的炎症都起着关键作用。一些免疫细胞在疾病发生发展过程起重要作用,如肝星状细胞的激活是应激或凋亡的肝细胞和巨噬细胞发出信号的结果[16]。在其中,巨噬细胞是调控NAFLD发展的重要细胞亚群[17-18]。通过上述结果,我们观察到,巨噬细胞PDHA1基因特异性敲除后给予高Hcy饮食,血清及肝组织上清液中ALT水平均升高,即肝脏损伤加重。而相同的巨噬细胞可能具有不同的功能,取决于局部组织环境,而糖代谢重编程是影响微环境的主要因素之一[19]。PDHA1是丙酮酸脱氢酶复合体的关键E1亚单位,在细胞能量代谢过程中起着重要的作用[20]。有研究证明,通过耗尽PDHA1使乳酸堆积诱导NLRP3炎症小体激活[21]。而炎症激活将刺激巨噬细胞发生表型转换,已有研究用体外实验将极化的人和小鼠巨噬细胞重新编程,然后进行条件培养液实验,诱导凋亡,比较巨噬细胞表型转换前后的人和小鼠肝细胞抗凋亡能力[22]。通过检测,我们观察到在NAFLD小鼠模型中,巨噬细胞PDHA1特异性敲除后,可引起凋亡相关标志物表达增加。因此,我们将继续探寻抑制巨噬细胞中PDHA1表达,是否通过调节巨噬细胞表型转变,使巨噬细胞功能发生变化,从而导致肝细胞发生凋亡。
综上所述,小鼠肝脏巨噬细胞中PDHA1的缺失可通过促进高Hcy饮食诱导的NAFLD中肝细胞的凋亡,这为进一步研究高Hcy诱导的NAFLD的发病机制提供了参考资料。

