缺血预处理通过抑制铁死亡减轻大鼠肺缺血-再灌注损伤*
盛小飞, 王淑远, 王新雨, 王肖婷, 田云娜, 宋正阳,徐俊鹏, 刘秀洁, 王万铁△
(1杭州市临安区第一人民医院消化内科,浙江 临安 311300;2温州市人民医院呼吸内科,浙江 温州325000;3温州医科大学缺血-再灌注损伤研究所,浙江 温州 325035)
肺缺血-再灌注损伤(lung ischemia reperfusion injury, LIRI)是肺移植、肺溶栓治疗、心脏外科手术和心肺复苏后综合征等疾病中常见的引起不良后果的危险因素。肺极易受到损伤,尽管在外科治疗和免疫抑制方面取得了进展,但肺移植的结果是所有实体器官移植中最差的。肺移植的成功受限于高比例的原发性移植功能障碍,这是由于缺血-再灌注(ischemia-reperfusion, IR)损伤所致,其特征是强烈的氧化应激介导的组织损伤[1]。以往研究表明,氧化应激是引起脂质过氧化的主要病理机制之一,也是铁死亡的特征之一[2-3]。脂质活性氧(reactive oxygen species, ROS)积累是铁死亡的标志性特征。
缺血预处理(ischemia pre-conditioning, I-pre-C)作为一种经典的保护缺血-再灌注损伤的治疗手段,有着明确的效应,但其机制一直未被明晰[4]。本研究从铁死亡角度出发,初步探讨铁死亡是否在早期参与LIRI以及I-pre-C是否通过抑制铁死亡发挥保护效应,为I-pre-C保护LIRI研究提供一种新的参考见解,对后续LIRI保护药物的开发提供新的靶点。
材料和方法
1 实验材料
6~8周龄SPF级雄性SD大鼠,购自北京维通利华实验动物科技有限公司,许可证号为SCXK(浙)2020-0184。所有大鼠都被置于恒温和恒湿的条件下,昼夜循环12 h,并自由获得食物和水。实验前,大鼠被禁食过夜。所有动物实验均经温州医科大学实验动物中心机构动物伦理与使用委员会批准。丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione,GSH)及组织铁检测试剂盒均购自南京建成生物工程研究所;BCA蛋白浓度测定试剂盒、RIPA裂解液、Triton X-100和Wester blot Ⅰ抗稀释液均购自碧云天生物技术研究所。
2 实验动物分组与处理
将实验大鼠进行随机分组4组:(1)对照(control)组:无特殊处理,术中仅暴露左肺,但不进行血流阻断和再灌注,此组作为阴性对照组;(2)肺缺血-再灌注30 min手术组(IR组):进行大鼠左肺门阻断30 min后再灌注30 min,再灌注后麻醉状态下处死大鼠;(3)铁死亡抑制剂去铁胺(deferoxamine, DFO)组(IR+DFO组):术前1 h 腹腔注射100 mg/kg DFO,再进行大鼠肺缺血-再灌注手术(同IR组);(4)I-pre-C组:进行大鼠左肺门阻断前,夹闭左肺门5 min再灌注5 min,重复3次后,再进行左肺门夹闭30 min后再灌注30 min。
3 实验方法
3.1 检测肺损伤相关指标GSH、MDA和组织铁按照试剂盒所提供的说明书所述步骤进行操作。
3.2 肺组织病理学观察 将大鼠肺组织固定在4%多聚甲醛固定24~48 h,然后流水冲洗过夜,进行常规脱水、包埋入块、制备组织切片,厚约5 μm,再进行HE染色,于荧光显微镜观察获取免疫荧光图像,由ImageJ量化;处死小鼠并用预冷的PBS(pH 7.4)漂洗肺脏,取出部分肺组织并在含有2.5%戊二醛的0.1 mol/L PBS(pH 7.4)中浸泡过夜,使用振动刀将目标组织切成50 μm厚的切片,选定区域在1%四氧化锇中后固定1 h,在分级乙醇系列中脱水,并嵌入环氧树脂中,聚合在80 ℃下进行24 h,切割超薄切片(100 nm),用醋酸双氧铀和柠檬酸铅染色,并在JEM2000EX透射电子显微镜下观察。
3.3 肺组织超氧阴离子水平检测 冷冻肺脏切片(8 μm)置于玻片上,用二氢乙啶(dihydroethidium,DHE)在37 ℃的黑暗容器中孵育30 min。PBS冲洗3次后,荧光显微镜观察并采集图像,由ImageJ软件量化。
3.4 Western blot检测肺组织酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long chain family member 4, ACSL4)、转铁蛋白受体 1(transferrin receptor 1, TFR1)、铁蛋白重链 1(ferritin heavy chain 1, FTH1)和谷胱甘肽过氧化物酶 4(glutathione peroxidase 4, GPX4)蛋白水平 150 mg肺组织经研磨机研磨后,加入900 μL含PMSF的RAPI裂解液(VPMSF∶VRAPI=1∶100),研磨结束后每隔10 min漩涡15 s,置于冰上,共3次。用BCA蛋白浓度检测试剂盒检测所收集的上清液的蛋白总浓度,酶标仪测量吸光度。将测量好的蛋白样品以每孔10 μg的蛋白上样量进行SDS-PAGE,并转膜至PVDF膜后将其置于5%脱脂牛奶中室温下摇床封闭1 h。加Ⅰ抗,4 ℃过夜孵育,第2天取出PVDF膜,TBST漂洗5 min×4次后,加Ⅱ抗于室温下孵育2 h后,TBST漂洗5 min×4次。配制化学发光液,将漂洗后的PVDF膜置于曝光仪中,滴加发光液,利用荧光化学发光成像系统进行曝光。
4 统计学处理
采用GraghPad Prism 9.0统计软件进行数据分析。所有的计量资料均以均数±标准差(mean±SD)表示。多组样本间的比较应用单因素方差分析(oneway ANOVA),两两比较首先进行正态性检验,根据方差齐性检验结果选择不同组间比较方法,方差齐性,选择Student-test,方差不齐选择Mann-Whitney-U-test。P< 0.05为差异有统计学意义。
结 果
1 铁死亡参与了大鼠LIRI
Western blot结果显示,与control组相比,IR组TFR1和ACSL4水平上升,SLC7A11、FTH1和GPX4水平下降;与IR组相比,DFO能够显著降低TFR1和ACSL4的水平并且增加SLC7A11、FTH1和GPX4的水平(P<0.01),见图1。
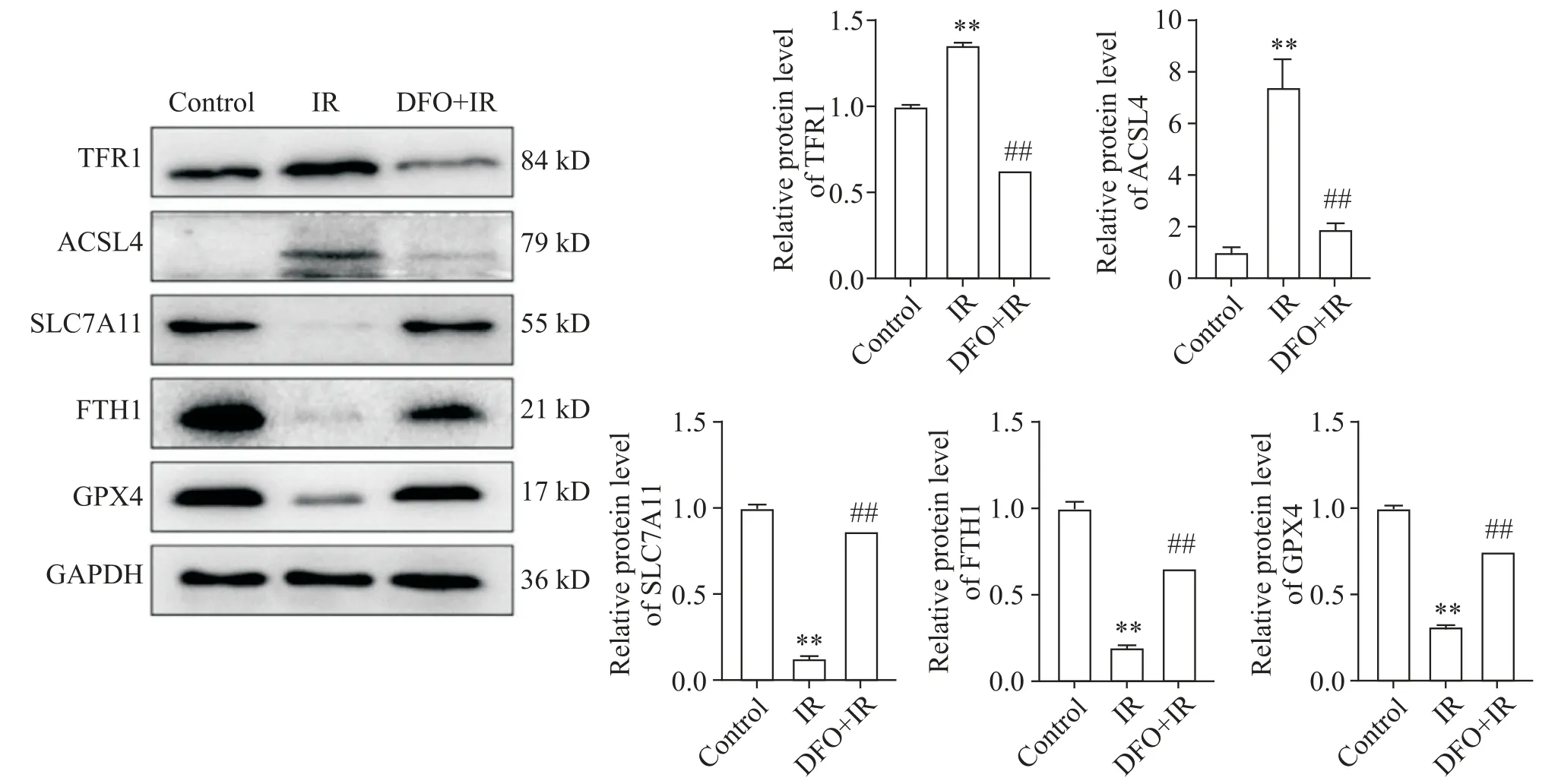
Figure 1. TFR1, ACSL4, SLC7A11, FTH1 and GPX4 protein levels in the lungs of rats in each group. Mean±SD.n=5. **P<0.01 vs control group; ##P<0.01 vs IR group.图1 各组大鼠肺部TFR1、ACSL4、SLC7A11、FTH1和GPX4蛋白水平
2 抑制铁死亡可有效缓解大鼠缺血-再灌注引起的肺损伤
二氢乙啶(dihydroethidium, DHE)染色结果提示,IR能够引起大量ROS的产生,但可被DFO抑制,并具有统计学意义(P<0.01),见图2A、B;透射电子显微镜结果显示,IR组线粒体外膜破裂,线粒体嵴减少,DFO组线粒体较IR组线粒体形态更完整,见图2A。
3 缺血预处理对缺血-再灌注损伤大鼠肺铁死亡相关指标的影响
与control组相比,IR组MDA和Fe水平升高,GSH水平下降(P<0.05);与IR组相比,I-pre-C降低了大鼠肺脏MDA和Fe水平,同时GSH水平回升(P<0.05或P<0.01),见图3。
4 缺血预处理可有效缓解大鼠缺血-再灌注引起的肺损伤
HE染色显示,与IR组相比,I-pre-C能抑制缺血-再灌注引起肺脏结构的紊乱、肺泡破损以及红细胞聚集,见图4A;DHE染色可见,与IR相比,I-pre-C能够抑制IR引起的ROS产生(P<0.01),见图4A、B。
5 缺血预处理抑制大鼠肺缺血-再灌注引起的铁死亡
Western blot结果显示,与IR组相比,I-pre-C能够显著降低TFR1和ACSL4的水平,并且增加SLC7A11、FTH1和GPX4的水平(P<0.01),见图5。
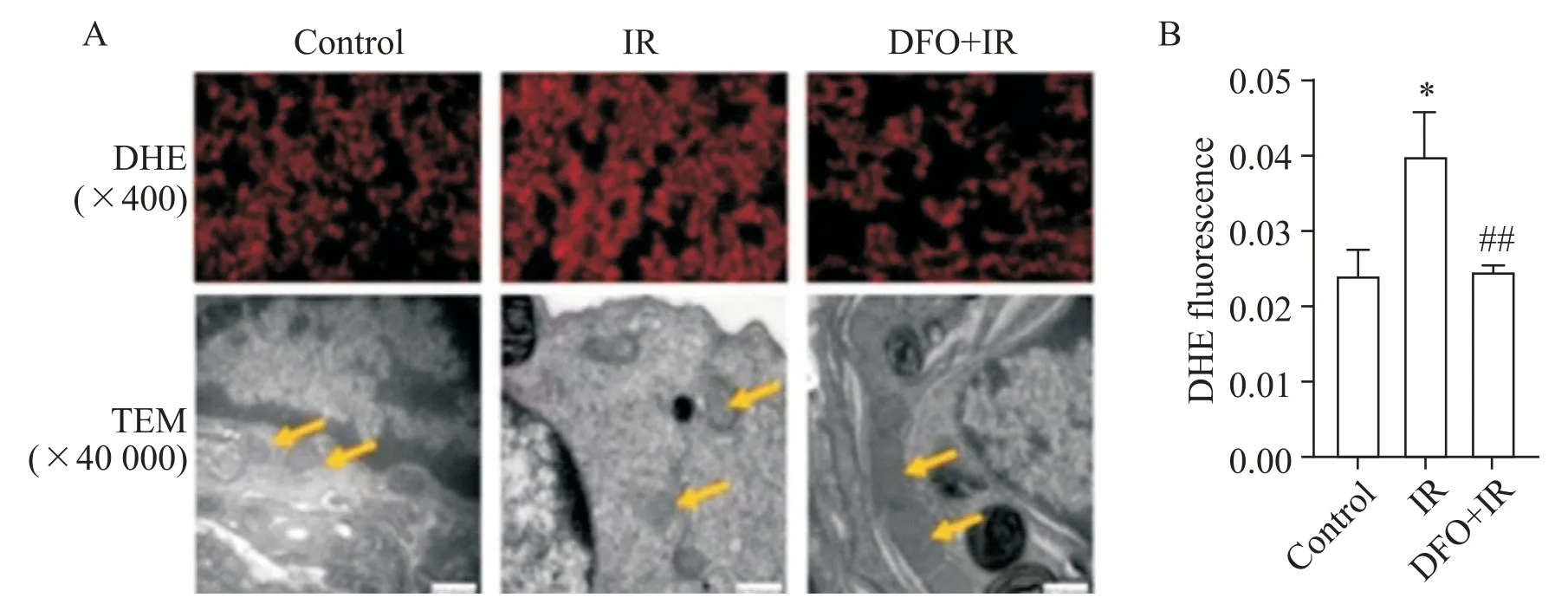
Figure 2. Dihydroethidium(DHE) staining and transmission electron microscope (TEM) of rat lung tissue in each group (A) and DHE statistical results (B). Mean±SD. n=5. *P<0.05 vs control group; ##P<0.01 vs IR group.图2 各组大鼠肺组织DHE染色和透射电子显微镜观察
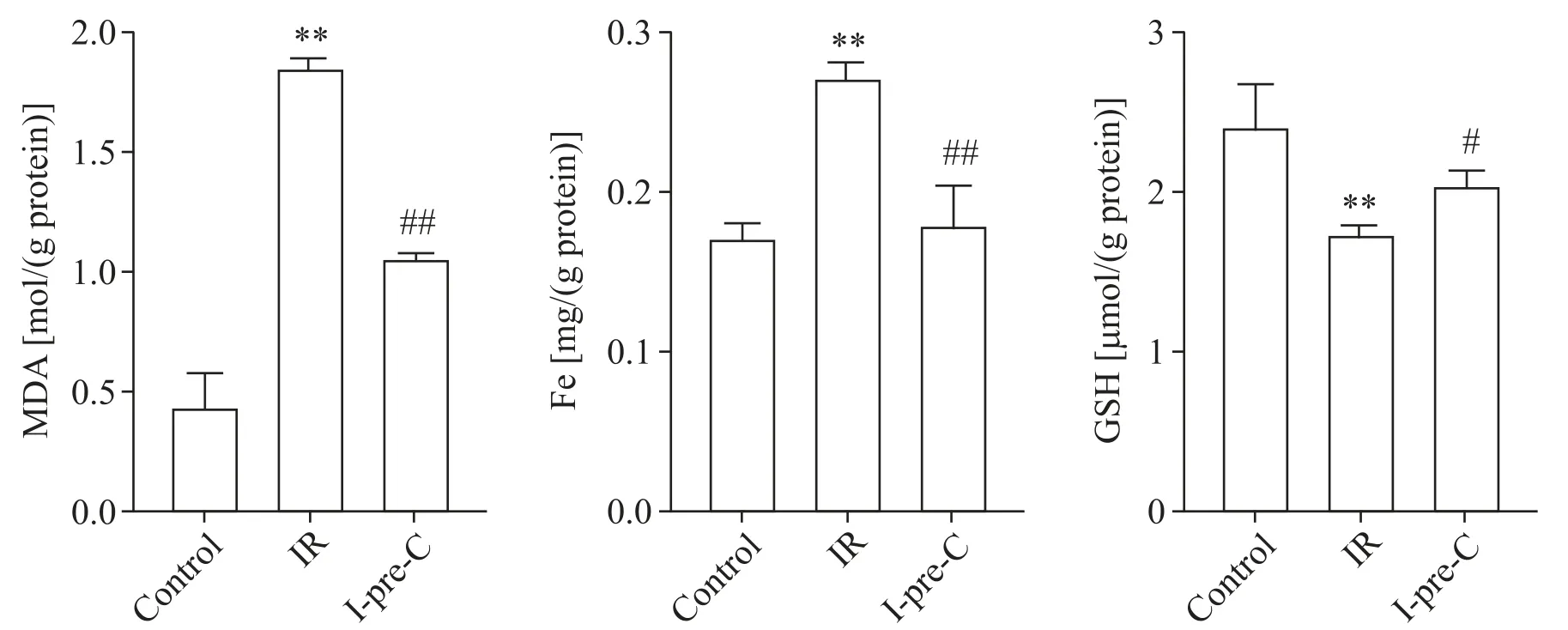
Figure 3. MDA, Fe and GSH levels in lung tissue of rats in each group. Mean±SD. n=5. **P<0.01 vs control group; #P<0.05, ##P<0.01 vs IR group.图3 各组大鼠肺组织MDA、Fe和GSH水平
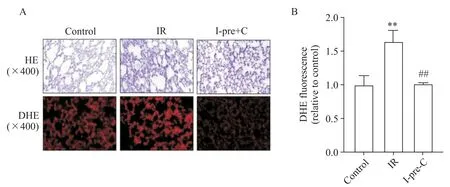
Figure 4. The HE and dihydroethidium (DHE) staining of rat lungs in each group (A) and DHE staining statistical results (B).Mean±SD. n=5. **P<0.01 vs control group; ##P<0.01 vs IR group.图4 各组大鼠肺部HE和DHE染色结果
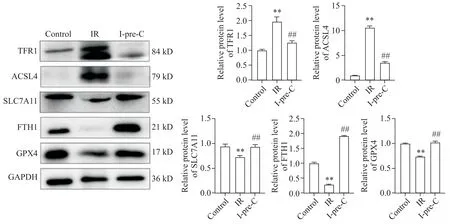
Figure 5. The protein levels of TFR1, ACSL4, SLC7A11, FTH1 and GPX4 in the lungs of rats in each group. Mean±SD. n=5. **P<0.01 vs control group; ##P<0.01 vs IR group.图5 各组大鼠肺部TFR1、ACSL4、SLC7A11、FTH1和GPX4蛋白水平
讨 论
LIRI是一种急性肺缺血-再灌注引发的临床常见病,如心肺复苏、肺移植、单肺通气、心肺旁路和肺栓塞[5-7]。LIRI是一种急性无菌性肺损伤,发病率高,发病机制复杂,涉及多种途径和病理生理氧化应激损伤,钙超载、内质网应激损伤、炎症损伤、自噬和凋亡等[8-9]。铁死亡是一种依赖铁的、p53介导的、非凋亡形式的细胞死亡,其部分通过促进致死性脂质ROS 的积累来介导其作用[10-11],它涉及多种人类疾病,其抑制作用可有效减轻I/R诱导的肾功能衰竭和心脏损伤实验模型中的临床症状[12-13]。氧化应激的介质,包括GPX4,已被确定为铁死亡的抑制剂,影响GPX4功能的机制可脏器影响功能和活力。谷胱甘肽、谷胱甘肽GSH是铁死亡过程中氨基酸代谢的核心物质,由半胱氨酸、谷氨酸和甘氨酸合成[14]。胱氨酸进入细胞后被还原为半胱氨酸,参与GSH的合成。GPX4是清除脂质氧自由基的重要酶。一旦GPX4被激活,GSH可以将有毒的脂质过氧化氢还原为无毒的脂质醇,表明GSH是一种重要的保护性代谢物,可防止铁死亡。研究发现,GPX4表达下调的细胞对铁死亡更敏感,而GPX4表达上调则抑制铁死亡。RSL3是一种铁死亡诱导剂,直接作用于GPX4并抑制其活性,从而降低细胞的抗氧化能力并积累ROS,导致铁死亡。本实验结果表明,DFO组线粒体较IR组线粒体形态更完整,与IR组相比,DFO+IR组MDA水平降低,GSH水平回升,DFO能够显著降低TFR1和ACSL4的水平并且增加SLC7A11、FTH1和GPX4的水平,这些结果提示抑制铁死亡能够有效缓解缺血-再灌注引起的肺损伤。
目前的研究对于I-pre-C的信号转导途径有了初步的认识。在大鼠实验中,I-pre-C使部分基因上调以对抗氧化应激,包括Hadhsc、Prdx4、Fabp4和Hsp73,同时也抑制部分促炎症基因的表达,如Egr-1、Dusp1和Dusp6[15-18]。此外,部分独立激酶(如p38 MAPK)在缺血处理中的作用尚待深入研究[14]。I-pre-C是在组织缺血前采取的多个循环短暂的缺血/再灌注处理的干预措施。本实验应用在肺缺血-再灌注前,给予3个周期的5 min缺血、5 min再灌的I-pre-C对LIRI进行干预。本实验结果显示:与IR组相比,光镜下显示I-pre-C组大鼠肺间质的水肿减轻,毛细血管轻度扩张,肺泡内红细胞渗出较少,炎症细胞浸润较少,肺泡较完整,I-pre-C降低了大鼠肺脏MDA和Fe水平,GSH水平回升,同时I-pre-C能够显著降低TFR1和ACSL4的水平并且增加SLC7A11、FTH1和GPX4的水平。我们从I-pre-C的大鼠身上获得的数据显示出了对LIRI诱导的铁死亡的保护作用。
综上所述,铁死亡参与了大鼠的LIRI;抑制铁死亡能够有效缓解缺血-再灌注引起的肺损伤;I-pre-C可通过抑制铁死亡从而减轻LIRI。这些发现为研究LIRI和I-pre-C保护机制提供了重要的证据,也为进一步的机制研究提供了数据参考。

