Piezo1在不同周龄ApoE-/-小鼠中的表达水平及对血管内皮功能的作用*
宋月月 , 刘佳丽 , 刘德坤 , 阚东方 , 李运伦 ,2, 杨雯晴 ,3△
(1山东中医药大学,山东 济南 250335;2山东中医药大学附属医院,山东 济南 250000;3山东省心血管病中医精准治疗工程实验室,山东 济南 250335)
动脉粥样硬化(atherosclerosis, AS)是一种慢性炎症性疾病,是引发心血管疾病的一个重要危险因素[1]。血管内皮细胞构成了从心脏到毛细血管的整个循环系统,AS始于内皮细胞的损伤,伴随着动脉内脂质沉积、平滑肌细胞和纤维基质增生等病变,发展形成斑块。血管内皮细胞功能障碍是以舒张功能减弱、促炎状态和血栓形成为特征变化,被认为是AS的重要病理学特征[2]。血流对血管壁产生的剪切应力,直接作用于血管内壁的内皮细胞,使血管内膜局部受损并促进斑块形成,被认为是与AS发生及斑块破裂的关键力学因素[3-4]。Piezo1是一种机械敏感性非选择性阳离子通道蛋白,且在血管内皮细胞中广泛表达,在机械力与生物信号转导中起关键作用[5-6]。研究表明,机械敏感性离子通道Piezo1可被剪切应力刺激,诱导创造促血栓形成和抗纤溶的微环境[7],另外,Piezo1通过影响一氧化氮(nitric oxide,NO)的生物利用度,从而影响细胞因子分泌,降低血管舒张力,促进AS形成[8]。然而在AS的进展过程中Piezo1对内皮细胞功能的作用尚未见明确报道。本研究通过ApoE-/-小鼠与Piezo1基因敲除的ApoE-/-小鼠模型,观察AS进展过程中Piezo1的表达变化情况及Piezo1敲除对ApoE-/-小鼠AS血管内皮细胞功能的影响。
材料和方法
1 实验材料
雄性SPF级ApoE-/-小鼠与雄性SPF级C57BL/6J小鼠各24只,体质量(24.0±1.5) g,8周龄,购自北京维通利华实验动物技术有限公司,许可证号为SYXK(鲁)2017-0022。8周龄SPF级Piezo1flox/floxCdh5-Cre+/ApoE-/-(以下简称Cre+)小鼠与Piezo1flox/floxCdh5-Cre-/ApoE-/-(以下简称Cre-)小鼠,体质量(23.0±1.0) g,由山东中医药大学李静老师惠赠。所有小鼠饲养于山东中医药大学实验动物中心屏障环境设施内,环境温度(22±2) ℃,环境湿度(50±5)%环境,12 h明暗交替。分笼饲养,每笼5只,自由摄食饮水。
2 主要药品与试剂
油红O购自北京鼎国昌盛生物技术有限责任公司(7BE10110);HE染液套装(ZH203004)、Masson染液套装(ZH195206)、EVG染液套装(G1042)、EDTA抗原修复液(G1206)、CY3-TSA(G1223)、自发荧光淬灭剂(G1221)、DAPI(G1012)及抗荧光淬灭封片剂(G1401)均购自武汉赛维尔生物科技有限公司;Piezo1兔多克隆抗体(5939-/-AP)购自 Proteintech;CD31鼠单克隆抗体(ab9498)购自Abcam;苯肾上腺素(LRAB7786)购自西格玛奥德里奇(上海)贸易有限公司;乙酰胆碱(acetylcholine, ACh; 917N011)购自北京索莱宝科技有限公司;小鼠内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)酶联免疫吸附测定试剂盒(E-EL-M0456c)、前列腺素I2(prostaglandin I2, PGI2)酶联免疫吸附测定试剂盒(EEL-0022c)、内皮素 1(endothelin-1, ET-1)酶联免疫吸附测定试剂盒(E-EL-M2730c)及血栓素A2(thromboxane A2, TXA2)酶联免疫吸附测定试剂盒(E-EL-0057c)均购自武汉伊莱瑞特生物科技股份有限公司;2× SYBR Green qPCR Mix(AH0104-C)和SPARK-script II RT Plus kit(AG0304-B)均购自思科捷生物技术有限公司。
3 实验仪器
DMT620多通道血管张力测定仪(DMT);立体荧光显微镜(Leica);酶标仪(BioTek);正置光学显微镜(Nikon);全自动生化分析仪(桂林优利特医疗电子有限公司);实时荧光定量PCR仪(Roche)。
4 动物分组及干预方法
小鼠适应性喂养一周后,根据实验目的将不同周龄24只C57BL/6J小鼠分为正常对照组,24只ApoE-/-小鼠分为模型组;Piezo1基因敲除小鼠分为Cre+组和Cre-组,每组10只。各组小鼠均给予高脂饲料,连续喂养12周。
5 标本采集
不同周龄小鼠于造模后第12、14、16和18周禁食不禁水12 h,以2%戊巴比妥钠麻醉小鼠,各组6只;Cre+和Cre-小鼠于20周以2%戊巴比妥钠麻醉小鼠,各组10只,腹主动脉取血,1 301×g离心15 min,取上层血清,分装于1.5 mL离心管中,放置-80 ℃冻存以备用。
取血完毕后,迅速打开胸腔,充分暴露心脏及胸主动脉,快速进行心脏灌注,灌注完毕后,快速分离心脏至髂总动脉分叉处的动脉血管,取出放入生理盐水中冲洗干净,并剔除主动脉上残余的脂肪组织及结缔组织,取部分组织浸泡于4%多聚甲醛中固定待检,部分组织冻存于-80 ℃冰箱中备用于后续实验。
小鼠处死后,迅速取出其胸主动脉,置于充有纯氧的4 ℃的PBS缓冲液中,小心将其周围结缔组织剔除,剪成约2 mm长的血管环。
6 主要方法及检测指标
6.1 病理组织学染色 大体油红O染色[9]:小心剥离主动脉,剔除周围组织,取完整主动脉,置于4%多聚甲醛固定48 h,PBS浸洗2次,油红染液中浸染60 min,直至斑块呈红色,血管壁白色,清洗拍照,以病变面积与主动脉面积之比评价AS程度。HE染色[10]:置于4%多聚甲醛中的血管固定5 d,脱水、石蜡包埋。腹主动脉样本切成5 μm切片,苏木精和伊红染色,用光学显微镜观察。Masson染色[11]:石蜡切片脱蜡至水,Masson复合染色液染色5 min,水洗后加磷钼酸染色5 min,擦干切片表面水分,加苯胺蓝染色5 min,水洗,加分化液分化2次,脱水封固。光学显微镜下观察。Movat染色[12]:取石蜡切片脱蜡水化,Bouin溶液固定20 min,水洗2 min。Verhoeff染液染色15 min,10%三氯化铁水溶液分色,水洗。切片放入碱性乙醇10 min,放入1%阿尔辛蓝水溶液内15 min,水洗。1%冰醋酸溶液5 min,水洗。藏红花液和酸性品红液按1∶1比例染色2 min,水洗。放入5%磷钨酸溶液10 min,水洗。乙醇脱水,二甲苯透明封片。
6.2 血脂指标检测 取小鼠血清,严格按照试剂盒说明操作,采用全自动生化分析仪检测甘油三酯(triglyceride,TG)、血 清 总 胆 固 醇(total cholesterol,CHOL)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)及低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)水平。
6.3 小鼠血清中eNOS、PGI2、ET-1及TXA2检测 取小鼠血清,严格按照ELISA试剂盒说明操作,将稀释好的样品以及标准品加入酶标板中,并设空白孔进行对照,加入抗体孵育,洗涤后加入显色液进行反应20 min后加入终止液,酶标仪以450 nm检测吸光度(A)值,绘制标准曲线,计算样品浓度。
6.4 小鼠离体主动脉环张力检测 实验方法见参考文献[13],将血管环水平悬挂于恒温浴槽内,恒温浴槽内不断通入100% O2,加入5 mL、37 ℃ PSS液,并保持温度在36.8~37.2 ℃。稳定约60 min,期间每隔20 min换Krebs液1次,60 mmol/L KCl重复刺激2次,检测血管活性。去氧肾上腺素(phenylephrine, Phe)1 μmol/L收缩达稳态时加入10 μmol/L ACh,检测内皮完整性,用不同浓度的ACh刺激血管,用PowerLab数据采集分析系统检测血管环张力变化。
6.5 血管细胞活力检测 活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色的结晶,这种结晶的量与活细胞的量呈正相关[14]。取一段新鲜小鼠胸主动脉,失活处理作为空白对照。将各组血管分别加入MTT液,于37 ℃的温箱中孵育1 h,取出血管置于DMSO中洗脱细胞内的蓝紫色结晶,多功能酶标仪于570 nm下读取吸光度(absorbance,A),包括各组血管洗脱液A值(Ax)及空白对照组A值(A0)。称取各组血管段的重量(Mx;单位:mg)。结果以单位重量的A值表示,即(Ax-A0)/Mx[15],A值越大,细胞活力越强。
6.6 免疫荧光检测 切片脱蜡至水,于EDTA抗原修复缓冲液中进行抗原修复,冷却后,PBS洗涤3次,每次5 min,用组化笔圈住组织,放入3%过氧化氢溶液,室温下避光孵育25 min,洗涤甩干,滴加BSA,5%山羊血清封闭30 min。加入CD31和Piezo1 Ⅰ抗4 ℃孵育过夜,洗涤,在圈内滴加与Ⅰ抗相应种属的HRP标记的Ⅱ抗覆盖组织,室温下孵育50 min,洗涤,滴加CY3-TSA,室温避光孵育10 min,TBST洗涤3次,每次5 min。切片置于EDTA抗原修复缓冲液中加热处理,在圈内滴加DAPI染液,室温避光孵育 10 min,洗涤,在圈内加入自发荧光淬灭剂5 min,流水冲洗10 min,用DAPI抗荧光淬灭封片剂封片。荧光显微镜下观察并采集图像。
6.7 Piezo1mRNA水平的检测 小鼠处死后,取小鼠主动脉组织,加入1 mL的Trizol试剂,研磨机研磨组织,萃取主动脉组织的总RNA,将总RNA逆转成cRNA,4 ℃保存。使用荧光定量PCR试剂盒,通过LightCycler 480 II进行检测,反应条件:94 ℃ 2 min;94 ℃ 10 s,60 ℃ 20 s,共 40 个循环。采用 2-ΔΔCt法计算目的基因的相对表达量。引物序列见表1。
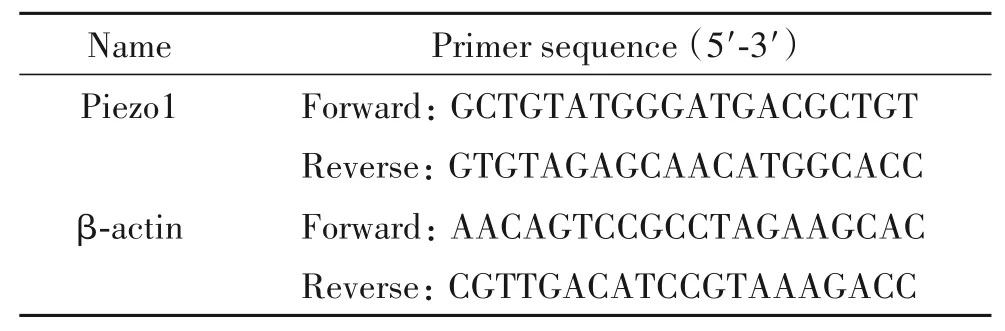
表1 real-time PCR引物序列Table 1. Sequences of the primers for real-time PCR
7 统计学处理
采用SPSS 25.0软件对数据进行分析。正态分布的计量资料以均数±标准误(mean±SEM)表示,多组计量资料比较采用单因素方差分析,组间两两比较采用t检验,内皮细胞功能与Piezo1表达的相关性分析符合正态分布,采用Person相关检验。以P<0.05为差异有统计学意义。
结 果
1 高脂饲料喂养不同时长的ApoE-/-小鼠AS进展及Piezo1的表达变化
1.1 小鼠主动脉病理染色分析 首先我们对高脂饲料喂养不同时长的小鼠主动脉病理状况进行了观察。主动脉全长油红O染色显示(图1A),正常组小鼠主动脉管壁光滑、平整,呈半透明状,未见明显斑块;高脂饲料喂养12周后,模型组小鼠主动脉弓部开始出现明显的红染脂质斑块,胸主动脉区域存在散在粥样斑块,且随着喂养时间的延长,可在主动脉弓及血管分叉处看到较明显的点状和斑片状斑块突向管腔,边界较清。考虑到主动脉总体面积存在个体差异,故我们对从斑块面积占主动脉总面积比例方面进行主动脉斑块严重程度评价,结果如图1B所示,与高脂饲料喂养不同时长的正常组小鼠相比,模型组小鼠主动脉斑块面积随时间延长显著增加(P<0.01)。
小鼠主动脉根部斑块石蜡切片的HE、Masson和Movat染色结果显示(图2),正常组小鼠可见主动脉根部三瓣膜及血管中内膜连续、平滑,无纤维性增厚,随着喂养时间的延长未见粥样硬化斑块的出现,血管结构正常。高脂饲料喂养12周后模型组小鼠可见明显粥样斑块沉积,斑块内胶原含量增多,随喂养时间延长管腔逐渐狭窄,斑块面积显著增大,胶原纤维含量增多。
1.2 血清脂质含量测定 分别于高脂饲料喂养的第12、14、16及18周检测小鼠血脂含量,检测到模型组小鼠TG、CHOL、HDL-C及LDL-C含量显著高于正常组(P<0.01),但不同时点之间小鼠血脂变化不显著(图3)。
1.3 小鼠血清中eNOS、PGI2、ET-1及TXA2检测 为评价AS发展过程中小鼠内皮功能的变化,我们检测了eNOS、PGI2、ET-1及 TXA2的变化(图4)。结果显示,高脂饲料喂养的第12、14、16及18周模型组小鼠血清中eNOS和PGI2表达显著低于正常组小鼠(P<0.01),ET-1和TXA2表达显著高于正常组小鼠(P<0.05)。且随着周龄的增加,小鼠血清中eNOS和PGI2逐渐降低,ET-1和TXA2逐渐升高。
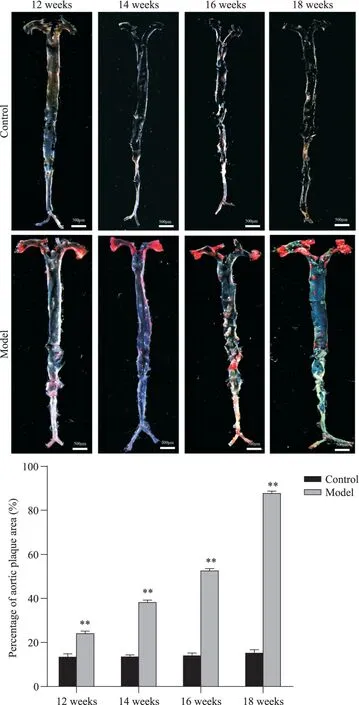
Figure 1. Aortic plaque in mice fed with high-fat diet for different time (oil red O staining, scale bar=500 μm). Mean±SEM. n=3.**P<0.01 vs control group.图1 高脂饲料喂养不同时长小鼠主动脉斑块情况
1.4 斑块组织中内皮细胞完整性与Piezo1的表达为进一步观察高脂饲料喂养不同时长的小鼠斑块组织中内皮细胞完整性与Piezo1的表达变化,我们对主动脉斑块组织进行了CD31与Piezo1荧光染色。通过图5可见,正常组小鼠主动脉血管内皮细胞完整,而ApoE-/-小鼠随着高脂干预时间的延长小鼠主动脉CD31表达下调,血管内皮细胞完整性受损,出现缺失。与正常组相比,ApoE-/-小鼠Piezo1的表达显著升高,但随着高脂干预时间的延长而逐渐减弱。结果显示ApoE-/-小鼠主动脉斑块组织中Piezo1的含量较正常小鼠增多,但随着小鼠周龄的延长,Piezo1的含量显著减少(P<0.01),小鼠主动脉组织中Piezo1 mRNA的表达也呈现同样的变化趋势(图6)。
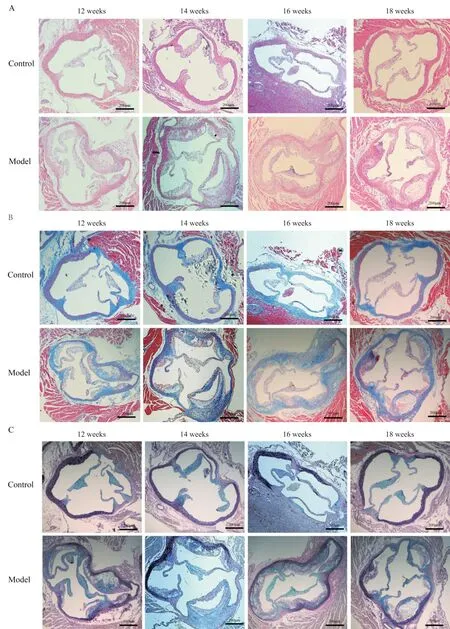
Figure 2. Pathological staining of aortic root in mice fed with high-fat diet for different time(scale bar=200 μm). A: HE staining;B: Masson staining; C: Movat staining.图2 高脂饲料喂养不同时长小鼠主动脉根部病理染色
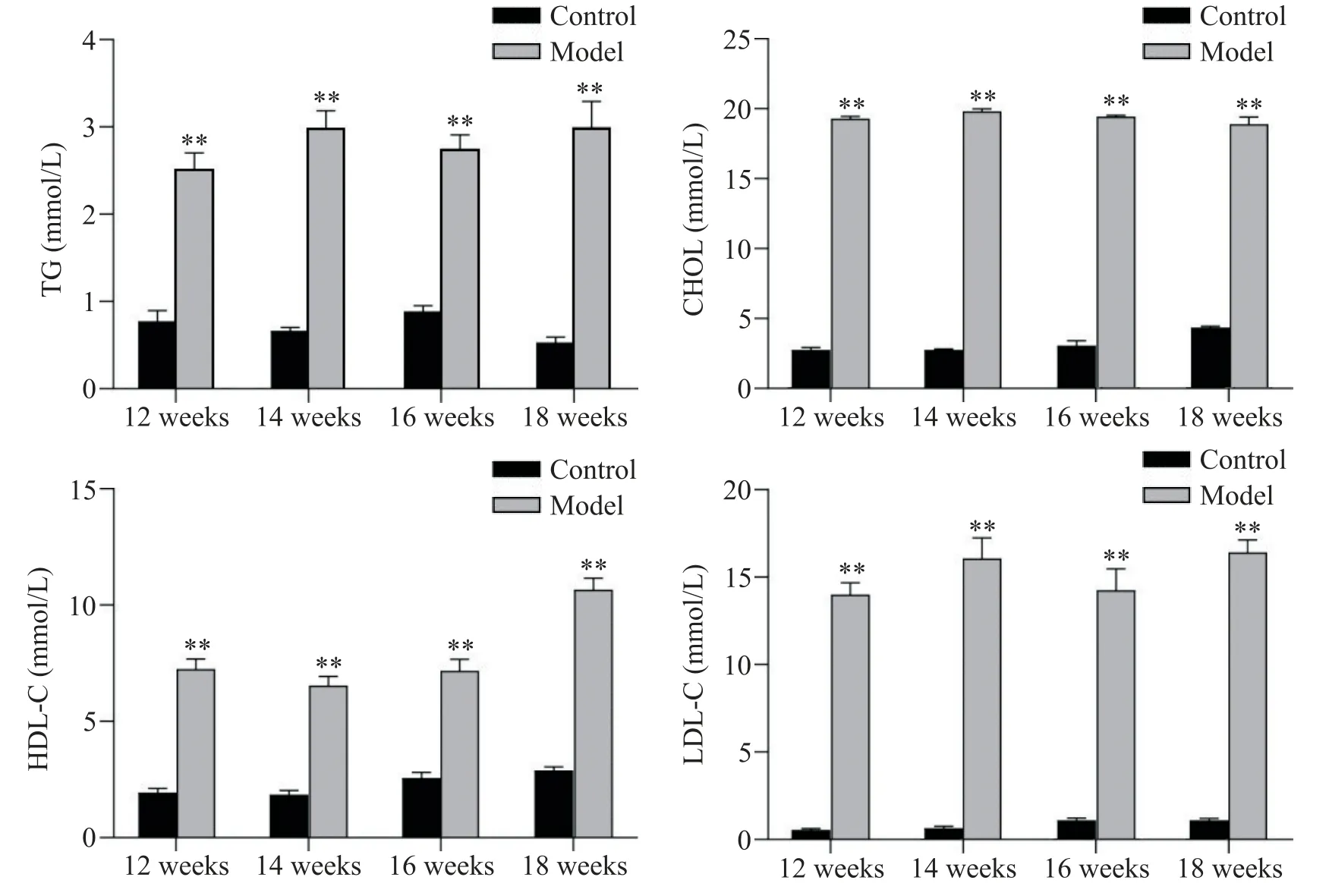
Figure 3. Changes of TG, CHOL, HDL-C and LDL-C in mice fed with high-fat diet for different time. Mean±SEM. n=6. **P<0.01 vs control group.图3 高脂饲料喂养不同时长小鼠TG、CHOL、HDL-C及LDL-C的变化
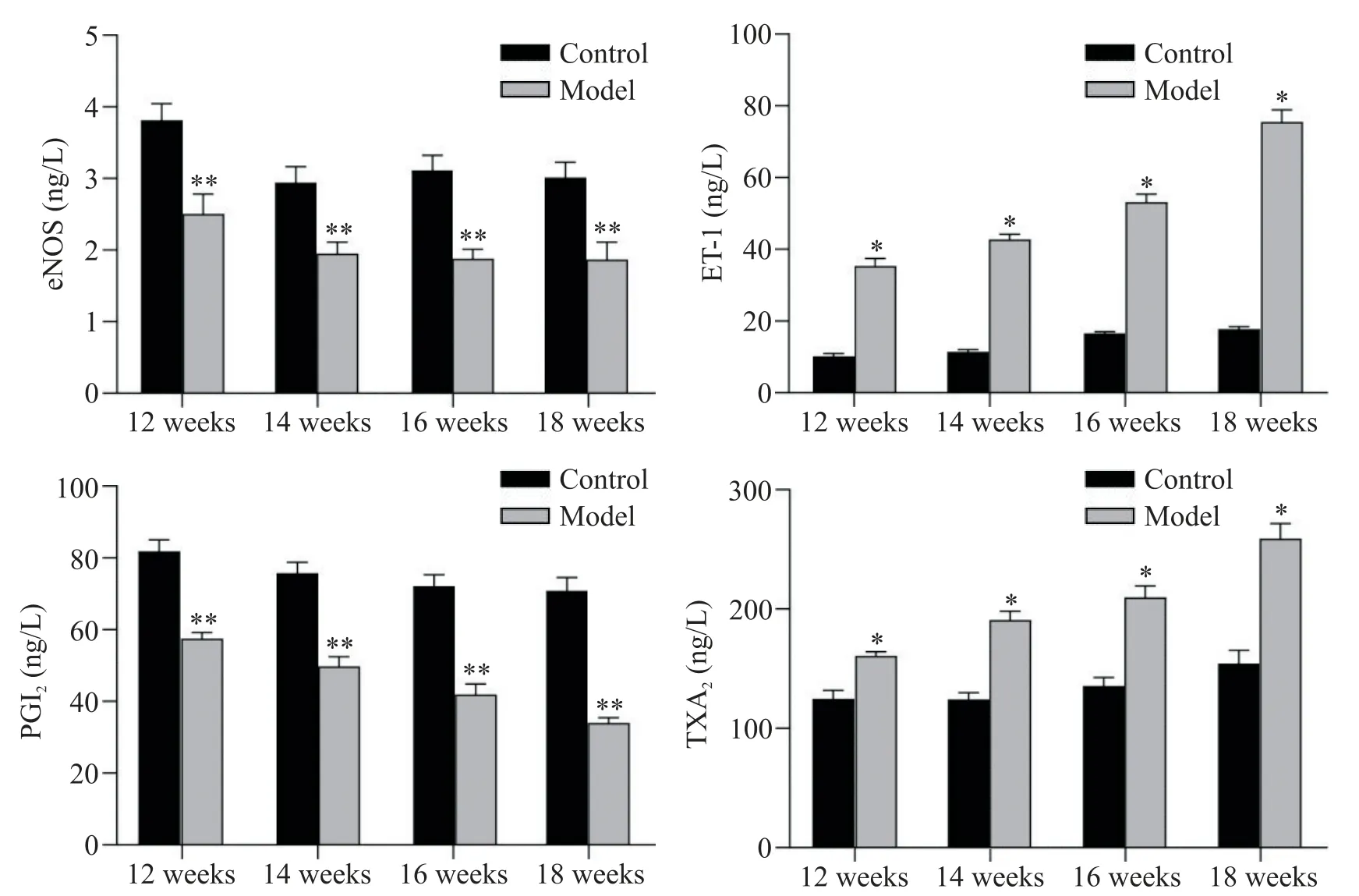
Figure 4. The levels of eNOS, PGI2, ET-1 and TXA2 in serum of mice fed with high-fat diet for different time. Mean±SEM. n=6. *P<0.05, **P<0.01 vs control group.图4 高脂饲料喂养不同时长小鼠血清中eNOS、PGI2、ET-1和TXA2水平
1.5 内皮细胞功能与Piezo1表达的相关性分析为了解AS进展过程中小鼠内皮细胞功能与Piezo1表达相关性情况,我们对小鼠血清中eNOS、ET-1、PGI2及TXA2的含量与Piezo1 mRNA水平进行相关性分析(图7)。结果显示小鼠Piezo1 mRNA水平与eNOS含量呈正相关(r=0.975,P<0.01),与ET-1含量呈负相关(r=-0.889,P<0.01)、与PGI2含量呈正相关(r=0.977,P<0.01),与 TXA2含 量呈 负 相关(r=-0.973,P<0.01)。
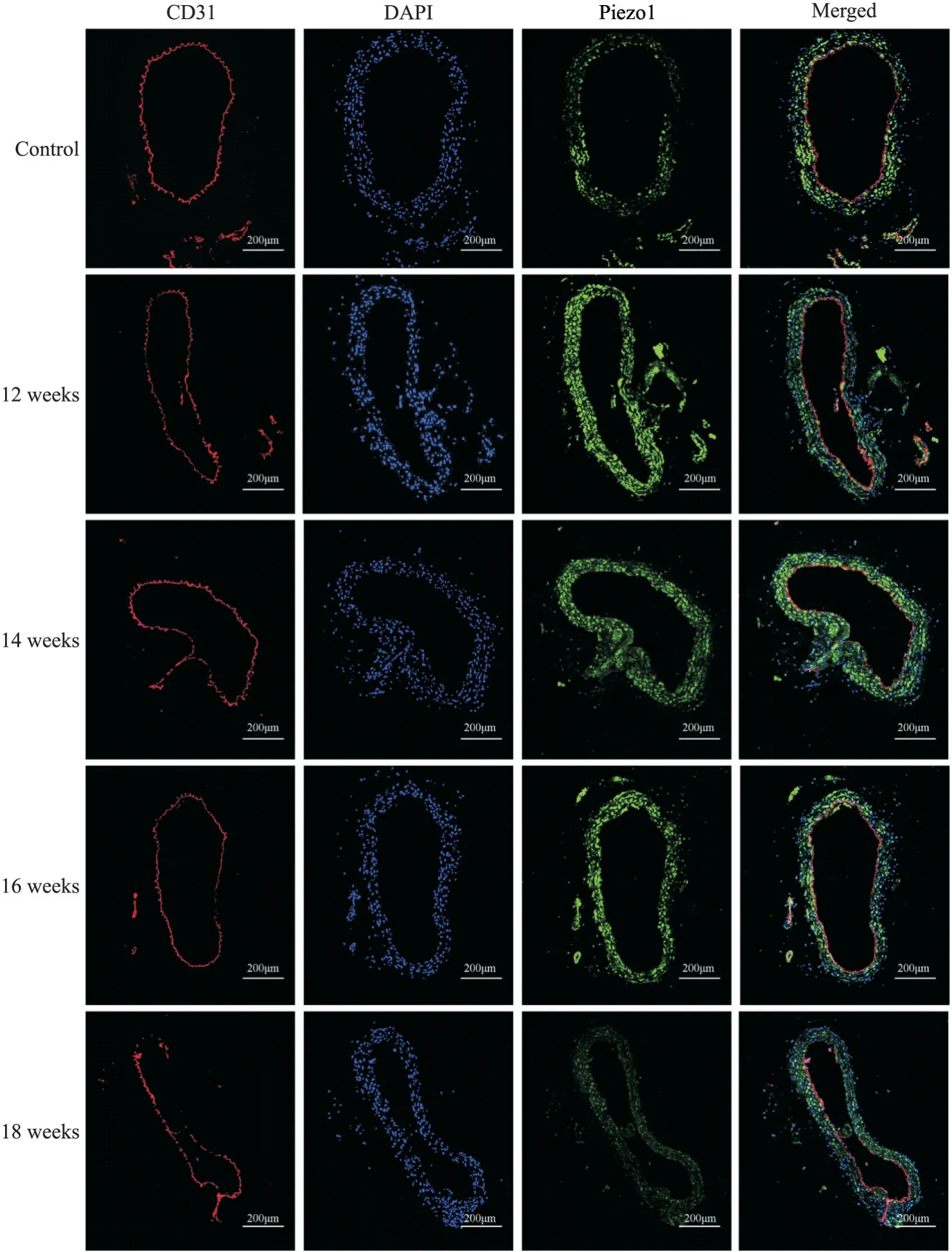
Figure 5. Immunofluorescence staining of mouse aorta. The scale bar=200 μm.图5 小鼠主动脉免疫荧光染色
2 Piezo1敲除对AS小鼠血管内皮功能的影响
2.1 小鼠主动脉病理染色分析 为进一步明确Piezo1敲除对小鼠主动脉斑块形成的影响,对小鼠主动脉进行大体油红O染色(图8A),可见脂质斑块在大体油红O中被染成红色。对Piezo1敲除的ApoE-/-小鼠主动脉斑块的面积进行观察,如图8B所示,与Cre-模型组小鼠相比,Cre+模型组小鼠主动脉斑块面积显著减少(P<0.01)。
为观察Piezo1敲除对ApoE-/-小鼠主动脉根部斑块的影响,对小鼠主动脉根部斑块石蜡切片进行HE、Masson和Movat染色,观察斑块面积、胶原纤维和弹力纤维含量变化。结果显示(图9),Cre-模型组小鼠与Cre+模型组小鼠均可见明显粥样斑块沉积,与Cre-模型组小鼠相比,Cre+模型组小鼠主动脉根部斑块的相对管腔面积减小(P<0.01),斑块内胶原纤维含量减少(P<0.01),弹力纤维含量有所增加(P>0.05)。
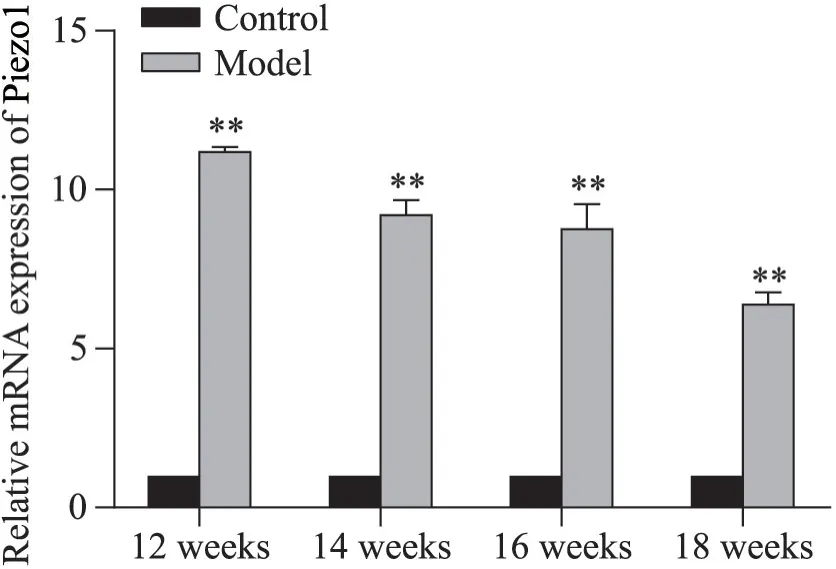
Figure 6. The mRNA expression of Piezo1 in mouse aorta. Mean±SEM. n=3. **P<0.01 vs control group.图6 小鼠主动脉Piezo1的mRNA表达水平
2.2 小鼠血管内皮功能变化 为评价Piezo1敲除对ApoE-/-小鼠内皮功能的变化,我们检测了eNOS、PGI2、ET-1和TXA2的变化、血管细胞活力以及小鼠离体主动脉环张力情况,从而评价Piezo1敲除后是否会加重小鼠血管内皮的损伤。结果显示与Cre-模型组小鼠相比,Cre+模型组小鼠血清中eNOS和PGI2含量显著减少(P<0.05,P<0.01),TXA2含量显著增加(P<0.01),ET-1变化不显著(P>0.05)(图10)。小鼠血管细胞活力检测显示(图11),Cre+模型组的A值显著低于Cre-模型组,细胞活力减弱(P<0.01)。离体主动脉环实验结果显示(图12、13),与Cre-模型组相比,利用单剂量Phe诱导主动脉收缩反应时,Cre+组小鼠主动脉环的收缩功能显著比Cre-组低;利用单剂量Phe诱导主动脉收缩,累计剂量ACh诱导主动脉舒张反应时,Cre+模型组小鼠主动脉环的舒张作用受到了显著的抑制(P<0.05)。
2.3 小鼠主动脉斑块组织中血管内皮细胞完整性的变化 为进一步观察Piezo1敲除对ApoE-/-小鼠内皮细胞完整性的影响,我们对主动脉斑块组织进行了CD31与Piezo1荧光染色。通过图14可见,与Cre-模型组相比,Cre+模型组主动脉CD31表达下调,血管内皮细胞完整性受损,出现缺失。
讨 论
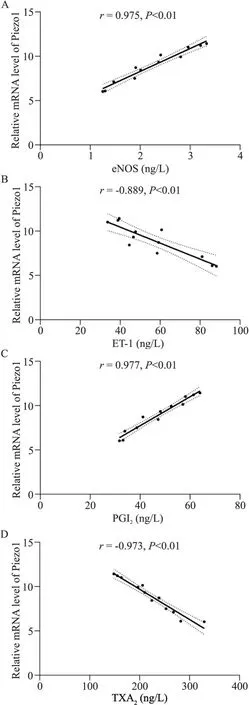
Figure 7. Correlation analysis between Piezo1 and functional indexes of mouse endothelial cells. A: correlation analysis between Piezo1 and eNOS; B: correlation analysis between Piezo1 and ET-1; C: correlation analysis between Piezo1 and PGI2; D:correlation analysis between Piezo1 and TXA2.图7 Piezo1表达与小鼠内皮细胞功能指标间的相关性分析
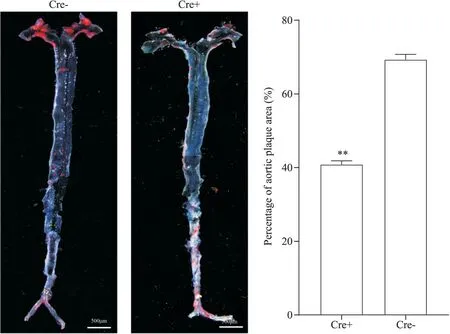
Figure 8. Effect of Piezo1 knockout on aortic plaque in ApoE-/- mice (oil red O staining, scale bar=500 μm). Mean±SEM. n=3. **P<0.01 vs Cre- group.图8 Piezo1基因敲除对ApoE-/-小鼠主动脉斑块的影响
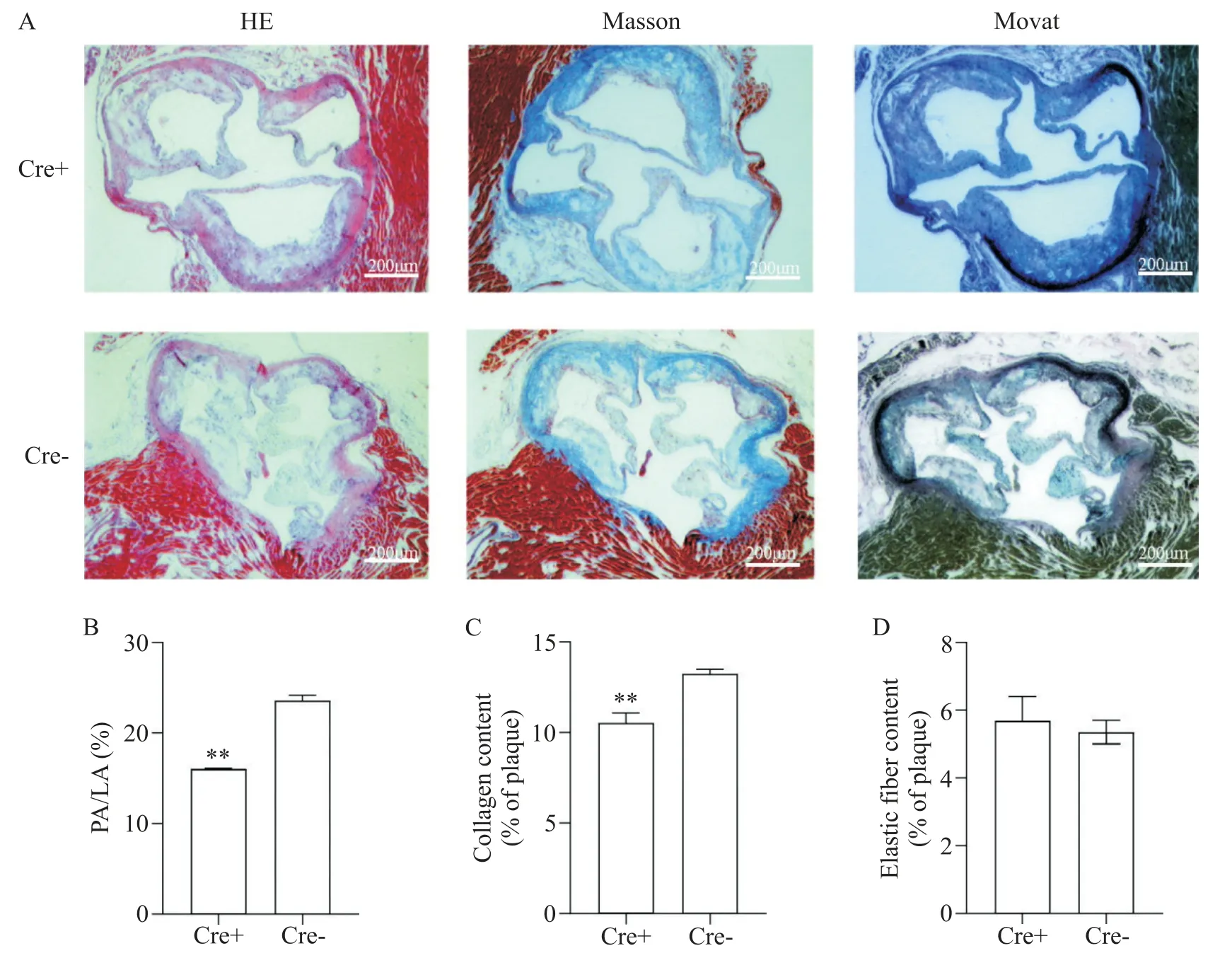
Figure 9. Pathological staining of aortic root in ApoE-/- mice with Piezo1 knockout. A: HE, Masson and Movat staining(scale bar=200 μm); B: relative lumen area of aortic plaque(PA: plaque area; LA: lumen area); C: collagen fiber; D: elastic fiber. Mean±SEM. n=3. **P<0.01 vs Cre- group.图9 Piezo1基因敲除对ApoE-/-小鼠主动脉根部病理染色的影响
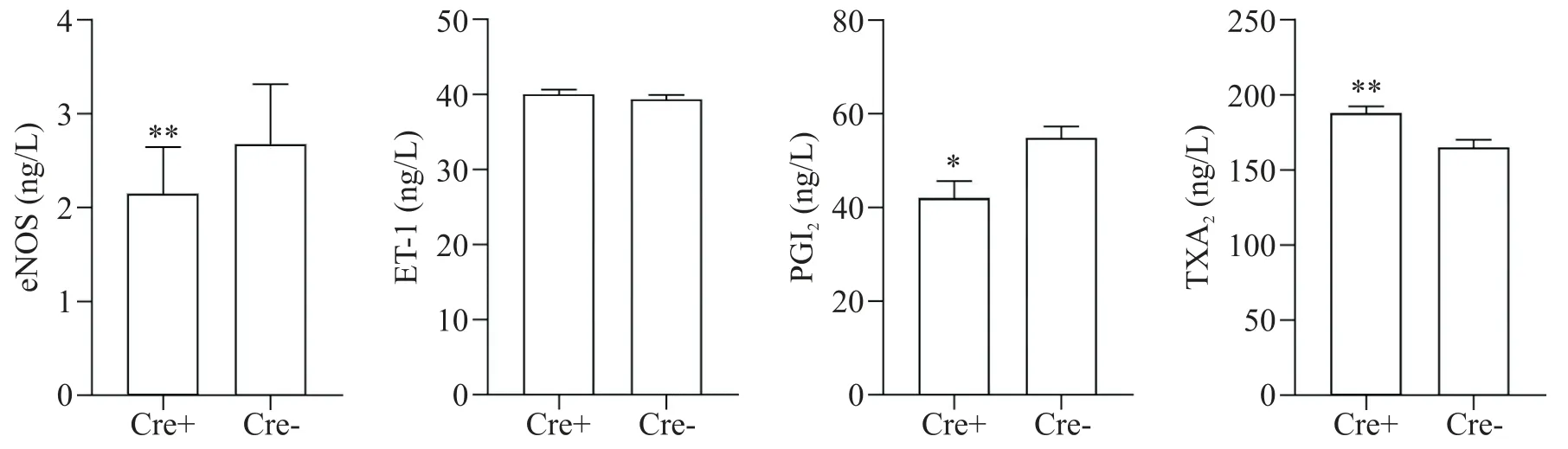
Figure 10. Effect of Piezo1 knockout on serum eNOS, PGI2, ET-1 and TXA2 levels in mice. Mean±SEM. n=10. *P<0.05, **P<0.01 vs Cre- group.图10 Piezo1敲除对小鼠血清中eNOS、PGI2、ET-1及TXA2水平的影响

Figure 11. Vascular cell viability in mouse thoracic aorta. The cell viability in Cre+ group was decreased. In addition, the viability of vascular cells in Cre+ mice was lower than that in Cre- mice under the same conditions. Mean±SEM. n=6. **P<0.01 vs Cre- group.图11 小鼠胸主动脉血管细胞活力
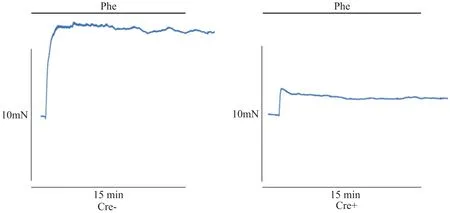
Figure 12. Tension in isolated mouse aorta preconstriction.图12 小鼠离体主动脉预收缩的张力
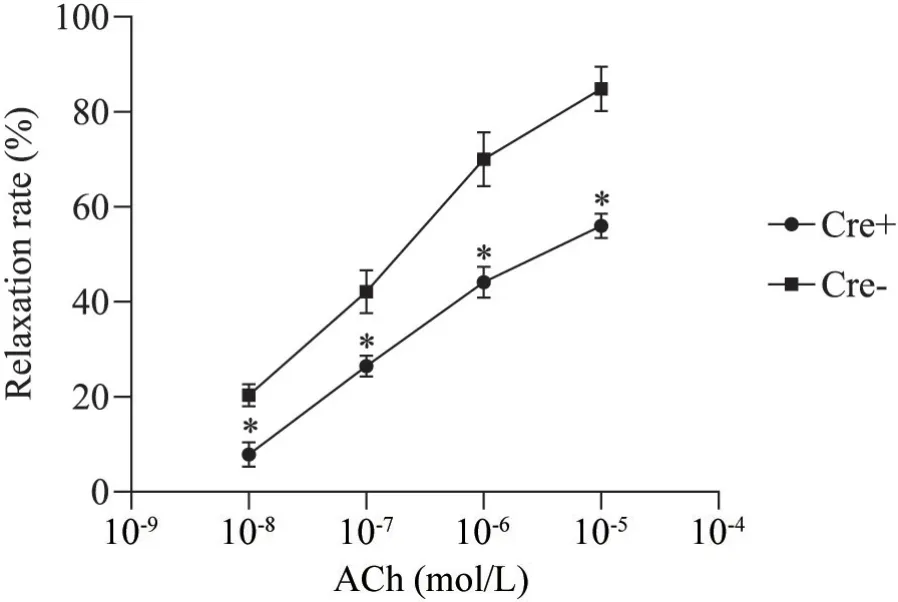
Figure 13. Tension in isolated mouse aorta relaxation. Mean±SEM. n=4. *P<0.05 vs Cre- group.图13 小鼠离体主动脉舒张的张力
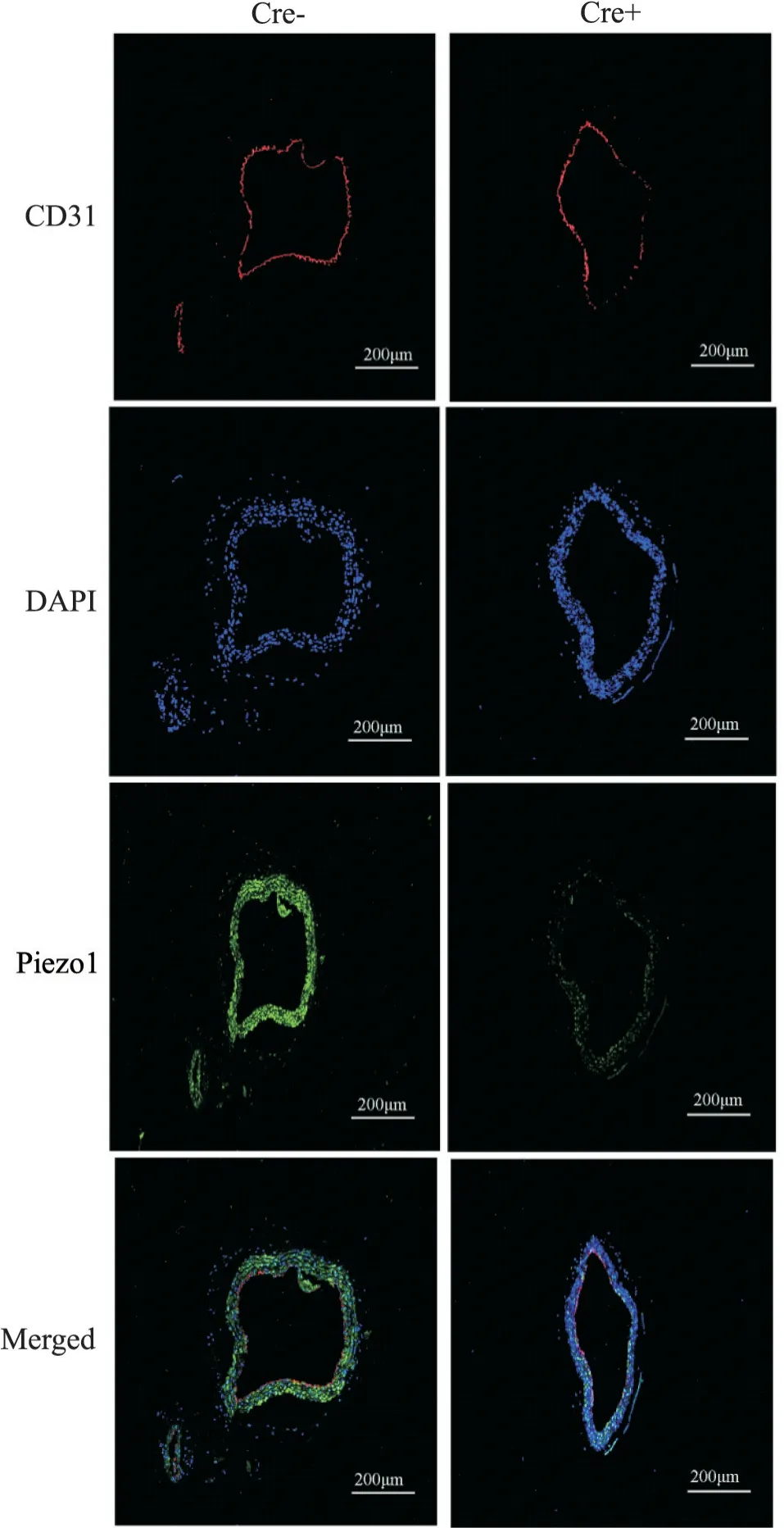
Figure 14. Expression CD31 and of Piezo1 in aorta of Cre- and Cre+ mice detected by immunofluorescence staining(scale bar=200 μm).图14 小鼠主动脉免疫荧光染色
AS是动脉内膜层形成的粥样性斑块,大动脉管壁的功能障碍是AS性心血管疾病的重要病理因素[16]。血管内皮细胞主要构成心血管系统的血管内壁,作为血管系统的最内层,参与液体之间的渗透交换过程,同时参与细胞中的物质转运和信息交换[17]。内皮细胞在不同病理因素刺激下,包括高胆固醇血症、衰老、氧化应激反应以及感染性因素等,导致血管内皮细胞的结构和功能发生非适应性改变,从而影响血管内皮细胞调节止血/血栓平衡、血管局部张力、氧化还原平衡以及急性和慢性炎症反应之间的平衡的正常生理功能[18-19]。内皮细胞在基础水平上产生NO有助于调节血管舒张和保持血管内膜的非血栓形成行为,血管内皮细胞损伤时,eNOS分泌下调从而降低NO的合成。ET-1表达上调会降低eNOS的表达和活化[20],导致血管的防御功能下降,诱导脂质沉积、细胞增殖和炎症细胞跨内皮转移[21-23],PGI2和TXA2是血管内皮细胞释放的血管活性物质,PGI2/TXA2的失衡是影响血管壁张力的重要因素[24-25]。血脂升高导致脂质沉积,动脉壁中有毒脂蛋白降解产物的积累增加,内皮细胞明显受损,这种损伤会促进AS进程[26-27]。本研究通过构建高脂饲料喂养不同时长的小鼠模型,检测到小鼠血脂升高,AS程度随周时增加逐渐加重,内皮细胞功能损伤也逐渐加重,小鼠血清中的eNOS、ET-1、PGI2和TXA2表达出现紊乱。提示ApoE-/-小鼠随着周时延长,AS程度逐渐加重,血管内皮功能的损伤逐渐加重。同时,我们检测发现ApoE-/-小鼠Piezo1的表达较正常小鼠显著增加,但随着周时的增长,Piezo1的表达逐渐减低,提示AS进展过程中Piezo1表达的减少对小鼠血管内皮功能有一定的损伤作用。
机械敏感性离子通道蛋白Piezo1是内皮细胞膜上对机械刺激敏感的传感器[28]。内皮细胞功能障碍表现在主动脉内壁的弯曲或分叉处,血流产生的机械力刺激直接作用于管壁内层内皮细胞,刺激Piezo1诱导内皮细胞周转和衰老,氧化应激增加,改变细胞形态及细胞间的蛋白组织[29-30]。Piezo1是血管发育的重要因素, Piezo1的缺失会导致在妊娠中期小鼠胚胎发育出现血管重构缺陷。Piezo1在小鼠发育的血管内皮细胞中广泛表达,机械和生化刺激能触发Piezo1介导的Ca2+内流,从而激活基质金属蛋白酶-2和膜型1基质金属蛋白酶,协同促进新生血管生成[31]。在AS的发展过程中,Piezo1参与了剪切应力诱导的内皮细胞Ca2+内流和细胞排列[32-33],诱导ATP释放,内皮释放ATP被认为是机械传导信号级联的关键上游步骤[34-35],随后在下游信号通路激活导致AKT和eNOS磷酸化,Piezo1是eNOS诱导NO形成、诱导血管扩张以及维持基础血压所必需的[36]。Piezo1在血管内皮细胞中表达缺失或降低,会导致细胞剪切应力的反应缺陷,使血管内皮细胞呈排列不规则的多角型,分泌缩血管活性物质、促血管内皮增殖和凋亡的活性物质等,损伤血管内皮细胞[37-39]。本研究为探讨Piezo1在AS进展中与内皮功能变化的关系,通过成功构建了Piezo1flox/floxCdh5-Cre+/ApoE-/-小鼠,观察到敲除Piezo1后能影响小鼠主动脉脂质斑块的形成,血清中eNOS、PGI2和TXA2含量变化显著,血管张力显著降低,细胞活力损伤加重,提示Piezo1的缺失会导致小鼠血管内皮细胞功能逐渐损伤,因而Piezo1在ApoE-/-小鼠的发生发展过程中具有重要作用。
综上所述,本研究通过高脂饲料喂养不同周时的ApoE-/-小鼠,观察到AS进程中小鼠血管内皮细胞损伤程度逐渐加重,Piezo1表达增加,且Piezo1表达随周时的延长而逐渐降低,提示Piezo1表达情况与小鼠血管内皮损伤程度有较强的相关性;进一步研究ApoE-/-小鼠内皮细胞敲除Piezo1后,发现小鼠内皮功能出现障碍,对AS发生发展产生一定的影响,提示小鼠内皮细胞Piezo1的缺失会促进AS的进展。本研究证明了Piezo1在ApoE-/-小鼠内皮功能中的重要作用,Piezo1的异常表达会影响AS的进展,以Piezo1为靶点采取治疗措施或将成为治疗AS的新方向。但在疾病早期或进展阶段如何通过调控Piezo1来延缓甚至逆转AS的病理进程仍需进一步探索。

