银丹心脑通软胶囊通过抑制CaN/NFATc3信号通路改善球囊损伤所致大鼠颈动脉血管内膜增生
丁瑞雪,伍红瑜,李意奇,高 杨,夏 文,杨丹莉
(遵义医科大学1.药学院;2.基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099;3.现代苗药创制技术国家地方联合工程研究中心,贵州 安顺 561000)
随着人口老龄化不断加剧,冠心病已成为人类死亡的首要原因。经皮冠状动脉介入术(Percutaneous coronary intervention,PCI)是治疗冠心病的主要方法,但PCI术后血管内膜增生率高达20%~40%,严重影响患者预后效果[1]。研究表明,炎症免疫反应是PCI术后血管再狭窄的关键因素,始终贯穿于血管内膜增生的发生发展中[2]。银丹心脑通软胶囊(Yindan Xinnaotong capsule,YDXNT)是银杏叶、丹参、灯盏细辛、山楂、绞股蓝、三七、艾片、大蒜8味药物组成的中成药,具有调节免疫、抑制炎症反应、改善血管内皮功能等作用[3-5]。课题组前期研究发现YDXNT减轻球囊损伤所致大鼠颈动脉血管内膜增生[3,5]。临床研究表明,YDXNT治疗6个月后可明显降低冠状动脉微血管性心绞痛患者血浆白介素-1β(Interleukin-1β,IL-1β)和C-反应蛋白(C-reactive protein,CRP)浓度,减轻炎症反应[4]。有趣的是,钙调神经磷酸酶(Calcineurin,CaN)/活化T细胞核因子(Nuclear factors of activated T cell,NFAT)信号通路通过上调炎症免疫反应,促使血管平滑肌细胞(Vascular smooth muscle cell,VSMC)表型转换、增殖及迁移,继而导致血管内膜增生[6]。然而,YDXNT是否能通过调控CaN/NFATc3信号通路减轻球囊损伤所致大鼠颈动脉血管内膜增生尚不清晰。本研究利用球囊导管术损伤大鼠颈动脉血管,建立血管内膜增生模型,以探究YDXNT是否可能通过调控CaN/NFATc3信号通路改善大鼠颈动脉血管内膜增生。
1 材料与方法
1.1 主要药品与试剂 银丹心脑通软胶囊由贵州百灵企业集团制药股份有限公司提供(国药准字Z20027144);IL-1β抗体(货号:A1112,ABclonal公司);TNF-α抗体(货号:17590-1-AP,Proteintech公司);MCP-1抗体(货号:66272-1-lg,Proteintech公司);CaN抗体(Ab3673,Abcam公司);NFATc3抗体(bs-2952R,北京博奥森生物技术有限公司);山羊抗小鼠/兔(Alexa Fluor 488/594)IgG(货号:SA00013-1/2/4,Proteintech公司);DAPI(货号:c0065,北京索莱宝科技有限公司);2F Fogarty(0.67 mm)球囊导管(美国edwards lifescience公司)。
1.2 仪器 TP1020组织脱水机(德国Leica Biosystems公司);EG1150石蜡包埋机(德国Leica Biosystems公司);自动染色机(LEICA AUTOSTAINER XL公司);BX53+DP80正置荧光显微镜(日本Olympus公司)。
1.3 实验动物造模及分组给药 18只雄性SD大鼠,体重310~320 g,购买于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004。于SPF级动物房适应性喂养1周,腹腔注射2 %的戊巴比妥钠溶液麻醉SD大鼠,将SD大鼠固定于手术台上,剃除其颈部皮毛。参照文献[7]建立大鼠颈动脉血管内膜增生模型。假手术组不进行球囊送入与扩张。将球囊损伤后的大鼠按照随机数字表法分为模型组(Model,n=6)和YDXNT给药组(YDXNT,n=6)。同时以假手术组(Sham,n=6)作为空白对照。YDXNT组灌胃1.0 g/kg YDXNT混悬液,Model和Sham组灌胃等体积双蒸水,1日1次,连续14 d。本实验遵守实验动物福利与伦理有关准则。动物伦理委员会批准号:ZMUER 2018-2-232。
1.4 实验方法
1.4.1 HE染色观察大鼠颈动脉血管的病理学变化 给药14 d,常规麻醉SD大鼠,在其颈部剪一切口,充分暴露左颈动脉并迅速取出,用预冷的PBS冲洗干净,取血管中部于4 %的甲醛溶液中固定24 h,常规脱水,包埋,制备血管组织切片。将血管组织切片进行常规脱蜡后进行HE染色,用正置显微镜下观察血管病理学变化。使用Image Pro Plus软件对观察到的颈动脉血管图像进行定量分析,使用面积计算工具计算内弹力板围绕面积(Internal elastic lamina area,IELA)、外弹力板围绕面积(External elastic lamina area,EELA)、新生内膜面积(Neointimal area,NIA)、中膜面积(Media area,MA)。MA =EELA-IELA。分析大鼠颈动脉血管NIA,NIA/MA,NIA/IELA变化。
1.4.2 免疫荧光技术检测大鼠颈动脉血管新生内膜的CaN、NFATc3、IL-1β、TNF-α、MCP-1蛋白表达将血管组织切片进行常规脱蜡,柠檬酸盐修复液进行热抗原修复,PBS洗3次×5min;37 ℃山羊血清封闭1 h;一抗孵育CaN(1∶50)、NFATc3(1∶50)、IL-1β(1∶50)、TNF-α(1∶50)、MCP-1(1∶50),4 ℃孵育20 h,37 ℃复温30 min,PBS洗涤3次×5 min;37 ℃孵育山羊抗小鼠/兔(Alexa Fluor 488/594)二抗(1∶100)1 h,PBS洗涤3次×5 min;室温孵育10 min DAPI染核,PBS洗涤3次×5 min,用防荧光淬灭封片剂封片;用正置荧光显微镜观察大鼠颈动脉血管新生内膜中蛋白表达情况,并拍照记录。用Image-Pro Plus 6.0软件计算大鼠颈动脉血管新生内膜组织中蛋白的平均荧光强度。
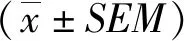
2 结果
2.1 YDXNT对球囊损伤后大鼠颈动脉血管病理学变化的影响 由HE染色可见,Sham组无新生内膜;与Sham组相比,Model组血管内膜增厚明显增加,管腔狭窄,成模率100 %;与Model组相比,YDXNT组血管内膜厚度明显降低,管腔增大,结果提示,确证YDXNT可以改善球囊损伤所致大鼠颈动脉血管再狭窄(见图1)。
A:HE染色代表性图片(标尺= 100 μm);B: NIA的统计结果;C: NIA/MA的统计结果;D:NIA/IELA的统计结果;与 Sham组比较,P<0.05;*:与Model组比较,P<0.05。图1 YDXNT对球囊损伤后大鼠颈动脉血管病理学变化的影响
2.2 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中CaN蛋白表达的影响 采用免疫荧光技术检测大鼠颈动脉血管新生内膜CaN蛋白表达情况,结果提示,与Sham组相比,Model组CaN蛋白表达明显升高,主要表达于颈动脉血管新生内膜中(P<0.05);与Model组相比,YDXNT组颈动脉血管新生内膜中CaN蛋白表达明显降低61.5%(P<0.05,见图2)。
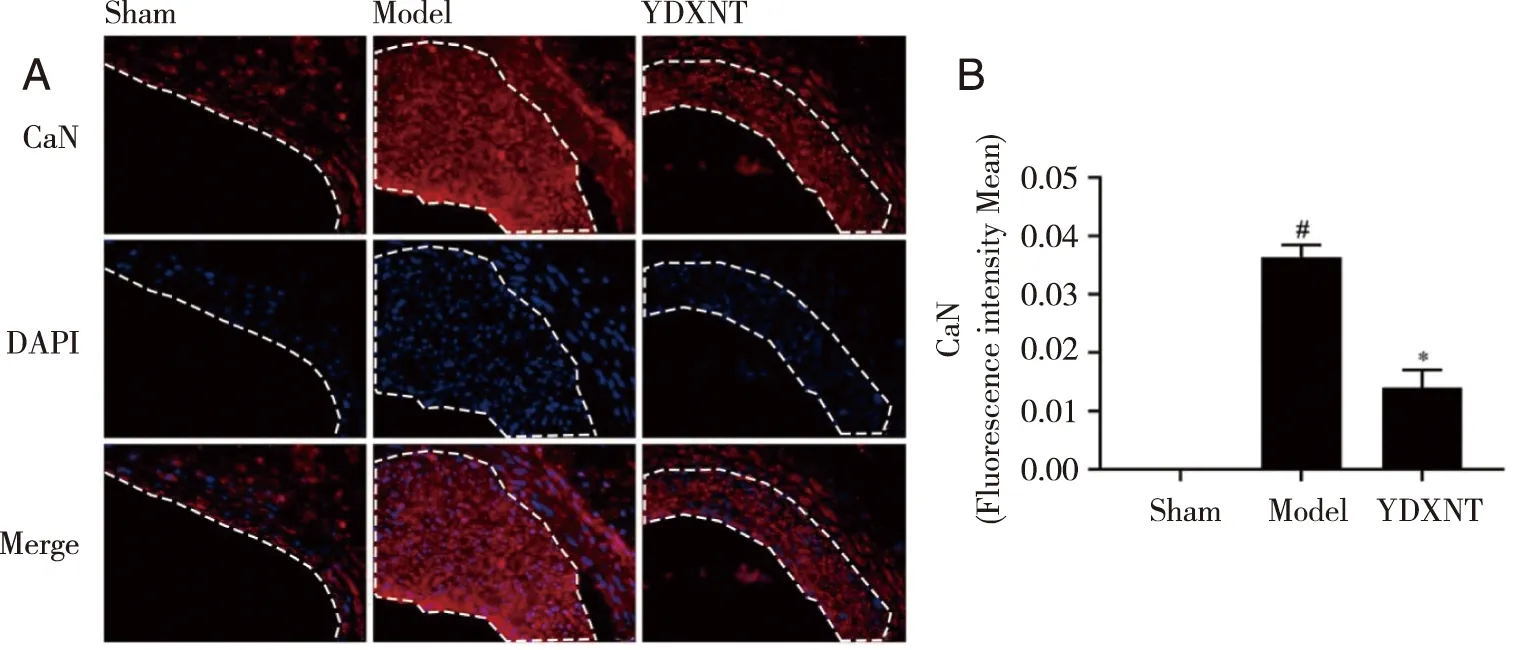
A:免疫荧光技术检测各组大鼠血管新生内膜中CaN的代表性图片,新生内膜为虚线所圈处(标尺= 20 μm);B:免疫荧光技术检测各组大鼠血管新生内膜中CaN平均荧光强度的统计结果;与Sham组比较, P<0.05;*:与 Model组比较,P<0.05 。图2 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中CaN蛋白表达的影响
2.3 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中NFATc3蛋白核转位的影响 NFATc3以未激活的磷酸化状态存在于细胞质,CaN激活后使NFATc3脱磷酸化转位进入细胞核。用免疫荧光技术检测大鼠颈动脉血管新生内膜NFATc3核转位情况,结果提示,与Sham组相比,Model组颈动脉血管新生内膜中NFATc3蛋白核转位明显增多(P<0.05);与Model组相比,YDXNT组颈动脉血管新生内膜中NFATc3蛋白核转位明显减少52.4%(P<0.05,见图3)。
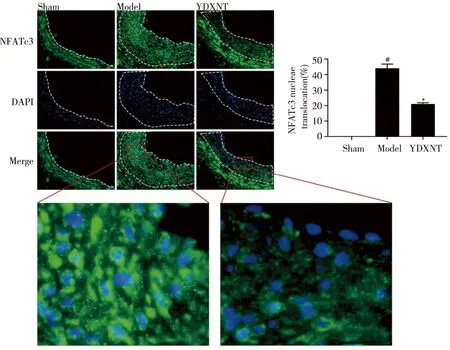
A:免疫荧光技术检测各组大鼠血管新生内膜中NFATc3蛋白的代表性图片,新生内膜为虚线所圈处(标尺= 20 μm);B:免疫荧光技术检测各组大鼠血管新生内膜中NFATc3蛋白核转位百分比的统计结果;C:免疫荧光技术检测各组大鼠血管新生内膜中NFATC3蛋白的局部放大代表图;与 Sham组比较,P<0.05 ;*:与 Model组比较, P<0.05。图3 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中NFATc3蛋白核转位的影响
2.4 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中IL-1β蛋白表达的影响 免疫荧光技术检测大鼠颈动脉血管新生内膜IL-1β蛋白表达情况,结果提示,与Sham组相比,Model组颈动脉血管新生内膜中IL-1β蛋白表达明显升高(P<0.05);与Model组相比,YDXNT组颈动脉血管新生内膜中IL-1β蛋白表达明显降低61.3%(P<0.05,见图4)。
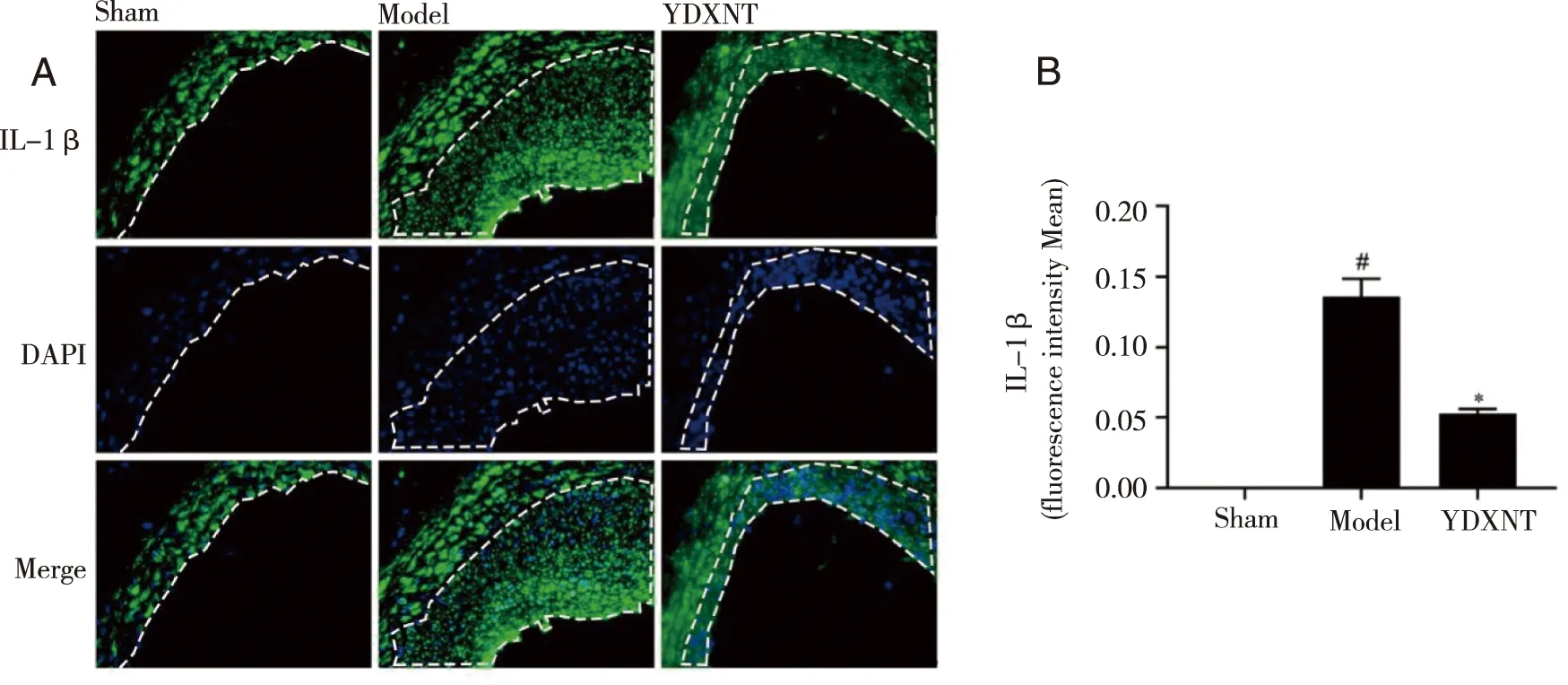
A:免疫荧光技术检测各组大鼠血管新生内膜中IL-1β的代表性图片,新生内膜为虚线所圈处(标尺= 20 μm);B:免疫荧光技术检测各组大鼠血管新生内膜中IL-1β平均荧光强度的统计结果;与 Sham组比较,P<0.05 ;*:与 Model组比较,P<0.05。图4 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中IL-1β蛋白表达的影响
2.5 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中TNF-α蛋白表达的影响 免疫荧光技术检测大鼠颈动脉血管新生内膜TNF-α蛋白表达情况,结果提示,与Sham组相比,Model组颈动脉血管新生内膜中TNF-α蛋白表达明显升高(P<0.05);与Model组相比,YDXNT组颈动脉血管新生内膜中TNF-α蛋白表达明显降低36.6%(P<0.05,见图5)。
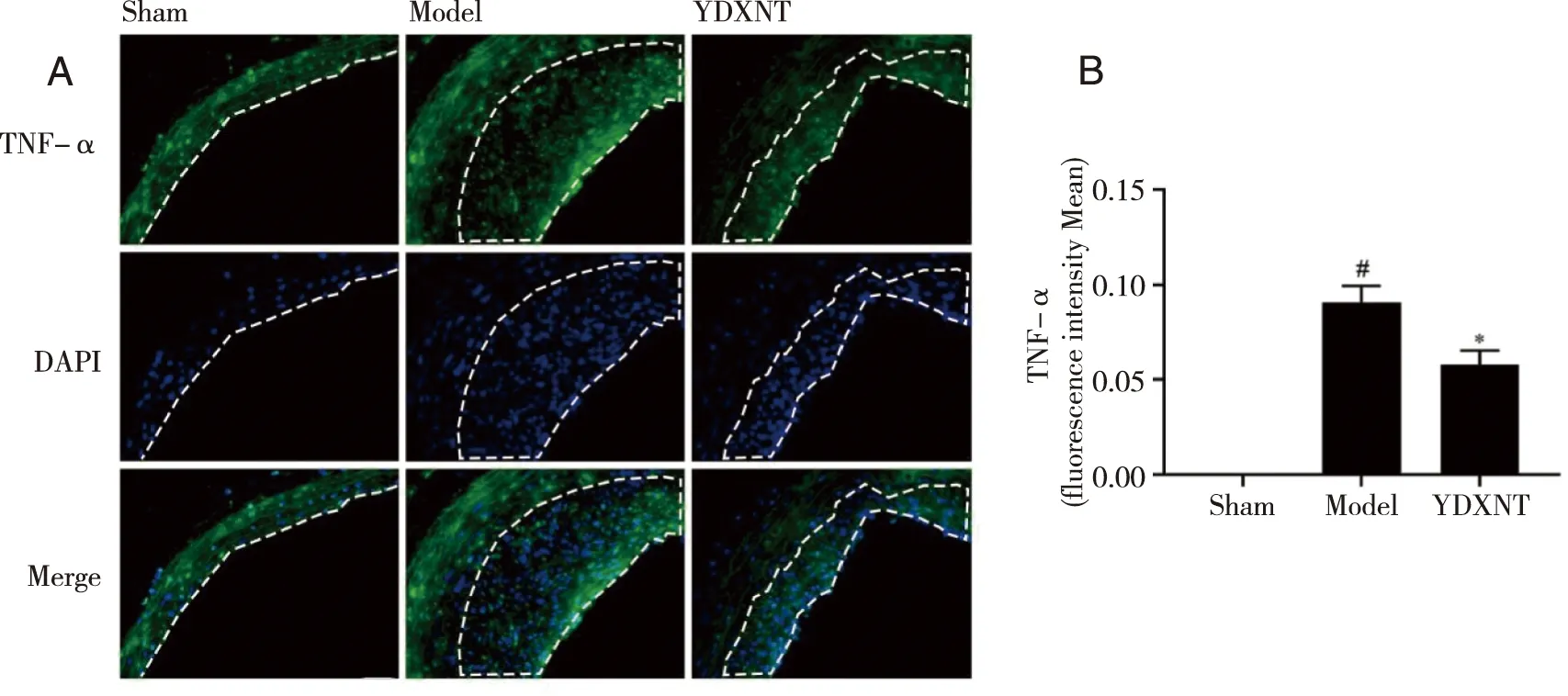
A:免疫荧光技术检测各组大鼠血管新生内膜中TNF-α的代表性图片,新生内膜为虚线所圈处(标尺= 20 μm);B:免疫荧光技术检测各组大鼠血管新生内膜中TNF-α平均荧光强度的统计结果;与 Sham组比较,P<0.05 ;*:与 Model组比较,P<0.05 。图5 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中TNF-α蛋白表达的影响
2.6 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中MCP-1蛋白表达的影响 免疫荧光技术检测大鼠颈动脉血管新生内膜MCP-1蛋白表达情况,结果提示,与Sham组相比,Model组颈动脉血管新生内膜中MCP-1蛋白表达明显升高(P<0.05);与Model组相比,YDXNT组颈动脉血管新生内膜中MCP-1蛋白表达明显降低64.1%(P<0.05,见图6)。
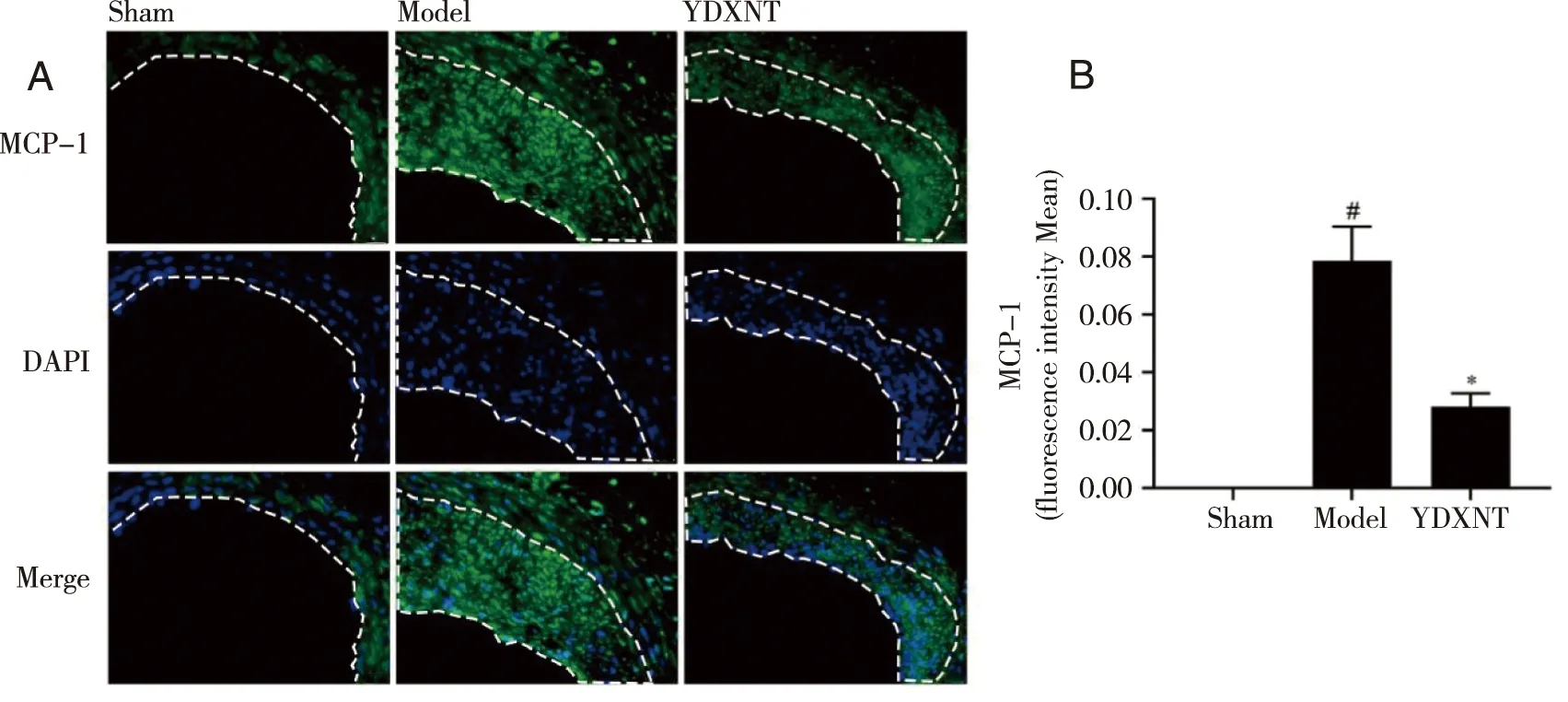
A:免疫荧光技术检测各组大鼠血管新生内膜中MCP-1的代表性图片,新生内膜为虚线所圈处(标尺= 20 μm);B:免疫荧光技术检测各组大鼠血管新生内膜中MCP-1平均荧光强度的统计结果;与 Sham组比较,P<0.05;*:与 Model组比较,P<0.05。图6 YDXNT对球囊损伤后大鼠颈动脉血管新生内膜中MCP-1蛋白表达的影响
3 讨论
球囊导管术损伤所致大鼠颈动脉血管内膜增生模型是研究PCI术后血管内膜增生的经典模型,具有创面小、操作简单、造模时间短、成功率高等优点,且在球囊损伤后第14天时血管内膜增生最明显[7]。因此,本研究采用以上方法建立大鼠颈动脉血管内膜增生模型。课题组前期研究发现,0.5 、1.0 g/kg的YDNXT均可以抑制该模型的颈动脉血管新生内膜形成,而1.0 g/kg的YDNXT疗效更佳[5],因此,本研究选择1.0 g/kg的YDNXT进行后续研究。本研究HE染色结果显示,模型组颈动脉血管新生内膜形成,管腔狭窄,提示该动物模型建立成功;给予YDXNT后,球囊损伤所致颈动脉血管新生内膜的增生得到明显减轻,颈动脉管腔增大,确证YDXNT可改善球囊损伤所致大鼠颈动脉血管内膜增生。
PCI术后血管内膜增生发生再狭窄的机制涉及内皮损伤、血栓形成、血管平滑肌细胞增殖、迁移、表型转换、细胞外基质沉积和炎症反应等[8]。当血管内皮损伤后,血小板聚集并合成和释放多种炎症因子,引起局部炎症反应,促进血管平滑肌细胞增殖、迁移,诱导新生内膜形成,导致血管再狭窄的发生[9]。因此,抑制炎症反应是改善血管内膜增生的重要策略之一。
CaN/NFAT信号通路在血管内皮损伤、调节免疫功能以及炎症反应中发挥重要作用[10-11]。CaN是一种Ca2+/钙调素依赖性蛋白磷酸酶,在血管内皮组织中高表达,对Ca2+浓度较为敏感。当血管内膜受损后,胞浆Ca2+水平升高激活CaN,进而使NFAT脱磷酸化转位进入细胞核调控炎症免疫因子(如IL-1β、TNF-α、MCP-1)等下游靶基因的转录与翻译[12]。而CaN调控的NFAT转录因子主要包括:NFAT1(NFATc2)、NFAT2(NFATc1)、NFAT3(NFATc4)、NFAT4(NFATc3)。Zhang等[13]研究发现,miR-137可以通过激活CaN/NFATc3通路促进模拟微重力大鼠脑血管平滑肌细胞的去分化和增殖。李晓云等[6]研究发现,在腹主动脉血管再狭窄大鼠模型中,CaN和NFATc3 mRNA表达水平较高且血清中MCP-1表达水平也升高。在本研究中,Model组CaN蛋白表达水平升高,NFATc3蛋白核转位明显增多,给予YDXNT后,CaN蛋白表达水平降低,NFATc3蛋白核转位明显减少。结果提示YDXNT可能通过抑制CaN/NFATc3信号通路改善大鼠颈动脉血管内膜增生。
IL-1β是重要炎症因子,在PCI术后血管再狭窄中发挥重要作用。IL-1β水平增加可以促进血管内皮细胞释放粘附分子,也可以促进单核细胞趋化蛋白-1(Monocyte chemoattractant protein-1,MCP-1)合成,导致VSMC表型转换、迁移、增殖,进一步促进血管异常新生内膜形成,最终导致血管再狭窄[14]。TNF-α是一种重要炎性介质,主要由单核巨噬细胞产生,参与血管再狭窄的形成过程[15]。MCP-1主要在血管内皮细胞、血管平滑肌细胞以及成纤维细胞中分泌和合成,通过激活和趋化单核细胞和巨噬细胞迁移到血管内皮损伤部位,参与并加速血管内膜异常增生[16]。研究发现,银丹心脑通软胶囊通过降低冠心病不稳定型心绞痛患者血清中CRP、IL-6和TNF-α表达水平,减轻炎症反应改善动脉粥样硬化程度[17]。李晓云等[6]研究发现,在腹主动脉血管再狭窄大鼠模型中,血浆MCP-1表达水平明显增高。本研究中,Model组颈动脉血管内膜IL-1β、TNF-α、MCP-1蛋白表达明显增多,给予YDXNT后,其IL-1β、TNF-α、MCP-1蛋白表达明显降低。
综上所述,YDXNT可以通过抑制CaN/NFATc3信号通路,减轻炎症反应,改善球囊损伤所致大鼠颈动脉血管内膜增生。

