细胞核评分联合超声特点对术前甲状腺穿刺不确定性结节的分类
何淑蓉,高 侃,王飞亮,汪梦鸽,陈荣明,戴维德,陈 岚,刘东戈
超声检查时检出的甲状腺结节大多数为无临床意义的良性结节[1]。超声评估后对高危结节施行超声引导下细针穿刺(fine needle aspiration, FNA)是术前诊断分流最常用且经济有效的方法。Bethesda甲状腺细胞病理学报告系统(the Bethesda system for reporting thyroid cytopathology, TBSRTC)的建立为甲状腺FNA诊断提供了标准化的诊断术语和形态学标准[2]。三种“不确定”细胞学诊断:包括意义不明的非典型细胞/滤泡性病变(atypia of undetermined significance/ folicullar lesion of undetermined significance, AUS/FLUS)-TBSRTC Ⅲ级、滤泡性肿瘤/可疑滤泡性肿瘤(follicular neoplasm/ suspicious for a follicular neoplasm, FN/SFN)-TBSRTC Ⅳ级和可疑恶性肿瘤(suspicious for malignancy, SUS)-TBSRTC Ⅴ级,仍占所有甲状腺FNA的20%~30%[2-3]。近年来,许多学者围绕如何降低这部分不确定性诊断的比例开展研究,力争在术前明确诊断,减少不必要的重复穿刺及诊断性手术[4-8]。超声及细胞学评估操作简便易行,不需要增加额外的医疗成本。本研究旨在确定超声特征结合细胞学评分是否有助于对FNA诊断不确定结节的术前分流。
1 材料与方法
1.1 病例资料回顾2018年12月~2022年4月北京医院经超声引导下行甲状腺FNA,按照2017版TBS诊断系统诊断为“不确定”的病例合计802例:TBSRTC Ⅲ级346例(6.2%),Ⅳ级150例(2.7%),Ⅴ级306例(5.5%),占同期甲状腺FNA的14.3%(802/5 590)。其中行甲状腺切除术有组织病理学随访结果的有119例。本研究获得北京医院/国家老年医学中心/中国医学科学院老年医学研究院伦理委员会批准。
1.2 超声学特征及TI-RADS分类上述病例均采用高分辨率超声检查,参照Kwak等[9]的TI-RADS诊断标准进行评估分类。由2名具备10年以上甲状腺超声检查经验的超声科医师回顾性分析超声图像,按照甲状腺结节纵横比、晕环征消失、形态不规则、微钙化、低回声、实性结节、结节内血流、最大径≥4 cm和单一结节等9个特征观察记录,当评估不一致时协商达成共识。
1.3 细胞形态观察及评分甲状腺结节穿刺由超声科医师在超声引导下操作,采用25G针头常规穿刺3针,2针穿刺制成4~5张传统涂片,前2针的针头冲洗液及第3针穿刺物注入液基保存液(ThinPrep PreservCyt Solution)。视保存液中细胞量的多少,按需制成1~3张液基薄片。所有涂片经95%乙醇固定,行HE或巴氏染色后由2名专业细胞病理学医师显微镜下确认诊断。镜下观察每个入组病例的涂片时,按照结构特征(乳头状结构、微滤泡结构及细胞重叠拥挤)和细胞核特征[包括大小(核增大)、核轮廓异常(核膜不规则、核沟和核内包涵体)及核染色质特征(核淡染)]共8个特征观察记录并评分,寻找有诊断价值的特征进行综合评分。
1.4 统计学分析所有数据采用SPSS 26.0(IBM Corp. Armonk, NY, USA)软件进行统计学分析。应用χ2检验或Fisher精确概率检验比较良性组与恶性/低危组之间9个超声特征及8个细胞学特征的分布差异,非参数Mann-WhitneyU检验判断两组相比超声评分及核形态评分差异。利用受试者工作特征(receiver operating characteristic curve, ROC)曲线和ROC曲线下面积(area under curve, AUC)评估两者的诊断准确性。计算约登指数(Youden’s index),确定两者的最佳诊断临界值(即Cut-off值)。以此Cut-off值为基础,通过交叉列联表(Crosstabs)评估两者作为诊断标志物的正确率、特异性、敏感性、阳性预测值(positive predictive value, PPV)和阴性预测值(negative predictive value, NPV)。利用Logistic回归及ROC曲线分析比较超声特征评分、细胞学评分及两者联合的诊断准确性。P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征本组119例甲状腺结节中,细胞学诊断TBSRTC Ⅲ级50例,Ⅳ级15例,Ⅴ级54例。其中女性92例,男性27例,中位年龄47岁(范围25~75岁)。结节中位最大径0.6 cm(范围0.2~4.5 cm)。手术切除后组织学诊断为甲状腺乳头状癌91例,恶性潜能未定的滤泡性肿瘤7例,滤泡细胞癌3例,具有甲状腺乳头状癌核特征的非浸润性滤泡性肿瘤2例,透明变梁状肿瘤1例,未分化癌1例;腺瘤样增生结节6例,滤泡性腺瘤2例,结节性甲状腺肿伴乳头状增生2例,桥本甲状腺炎4例。组织学诊断为恶性和低危肿瘤归类为恶性/低危组(合计105例),其余14例归类为良性组。
2.2 超声学特征及TI-RADS分类良性组超声TI-RADS分类4a类4例,4b类3例,4c类6例,5类1例。恶性/低危组超声TI-RADS分类3类2例,4a类6例,4b类14例,4c类51例,5类32例。超声特征评估显示:12例良性结节纵横比≤1,6例晕环征消失,6例呈现不规则形态,10例结节内可见血流信号;恶性/低危组中,59例结节纵横比>1,84例晕环征消失,86例结节形态不规则,30例结节内可见血流信号,两组相比差异有统计学意义(P=0.003、0.007、0.003和0.004)。虽然微小钙化、低回声、实性结节、单发及结节最大径<4 cm更常见于恶性/低危组,但与良性组相比,差异无统计学意义(图1~3,表1)。

图1 A. 甲状腺右叶中上部可见一极低回声结节,大小2.8 mm×4.1 mm,边界欠清,形态欠规则,纵横比>1,结节内未见点状强回声;B. CDFI:结节内探及明显血流信号。TI-RADS分类:4c。组织病理学证实为甲状腺乳头状癌,滤泡亚型 图2 A.甲状腺左叶中上部可见一极低回声结节,大小9.4 mm×8.1 mm,边界尚清,形态规则,边缘可见不规则晕环,部分晕环征消失;B. CDFI:结节内探及明显血流信号。TI-RADS分类:4c。组织病理学证实为甲状腺乳头状癌,经典型 图3 A.甲状腺右叶中上部可见一极低回声结节,大小5.1 mm×7.7 mm,纵横比>1;B. 显示边界不清,形态不规则。TI-RADS分类:4c。组织病理学证实为甲状腺乳头状癌,滤泡亚型 图4 A.滤泡上皮细胞部分重叠,排列成微滤泡结构,核增大,细胞学诊断为可疑滤泡性肿瘤,TBSRTC Ⅳ级,巴氏染色。组织病理学证实为具有甲状腺乳头状癌核特征的非浸润性滤泡性肿瘤;B.滤泡上皮细胞排列成片,细胞核大小不一,部分细胞核核膜不规则,可见纵行核沟,细胞学诊断为意义不明确的细胞非典型性病变,TBSRTC Ⅲ级。组织病理学证实为恶性潜能未定的滤泡性肿瘤;C.滤泡上皮细胞排列成片,细胞大小略有不同,核膜光滑,核淡染,细胞学诊断为意义不明确的细胞非典型性病变,TBSRTC Ⅲ级。组织病理学证实为甲状腺乳头状癌,滤泡亚型
上述除结节最大径≥4 cm之外的8项超声学特征,每项计数1分,每个病例评分0~8分。统计结果显示,恶性/低危组的超声特征评分高于良性组(Mann-WhitneyU=356.0,Z=-3.198,P=0.001);ROC曲线分析显示AUC为0.758(95%CI=0.637~0.879,P=0.002)。计算约登指数显示评分的最佳Cut-off值为4.5,≥5分判定为恶性/低危,反之为良性。此时依据超声特征评分诊断甲状腺恶性/低危肿瘤的正确率为68.1%,敏感性为66.7%,特异性为78.6%,PPV为95.9%,NPV为23.9%(表2)。
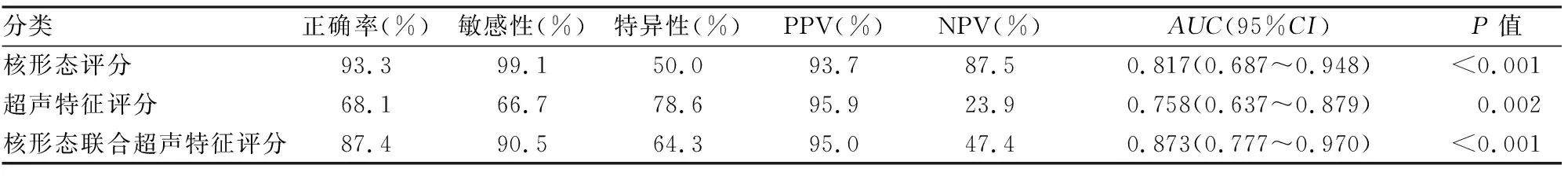
表2 核形态、超声特征及两者联合评分的诊断准确性评价
2.3 细胞学观察与评分良性组中,8例可见细胞重叠拥挤,2例可见乳头状结构,4例可见微滤泡结构;恶性/低危组中,上述结构异型分别占37.1%、2.9%和10.5%,两组相比差异无统计学意义(P>0.05)。细胞核异型包括核增大、核膜不规则、核沟、核内包涵体及核淡染,在恶性/低危组中分别占79.0%、49.5%、81.0%、37.1%和66.7%,高于良性组(64.3%、42.9%、35.7%、0、21.4%),且两组核沟、核内包涵体及核淡染三项特征差异具有统计学意义(P=0.001、0.013、0.001,图4,表1)。
按照简化的核形态评分,即核大小异常(核增大),核轮廓异常(核膜不规则、核沟和核内包涵体)及核染色质异常(核淡染),每项各占1分,每例评分0~3分。统计结果显示,恶性/低危组的简化核形态评分高于良性组(Mann-WhitneyU=268.5,Z=-4.349,P<0.001);ROC曲线分析显示AUC为0.817(95%CI=0.687~0.948,P<0.001)。计算约登指数显示细胞核形态评分的最佳Cut-off值为1.5,≥2分判定为恶性/低危,反之为良性。此时依据简化的核形态评分诊断甲状腺恶性/低危肿瘤的正确率为93.3%,敏感性为99.1%,特异性为50%,PPV为93.7%,NPV为87.5%(表2)。
2.4 联合超声学特征及简化核形态评分Logistic回归及ROC曲线分析显示,联合简化核形态及超声特征评分,其AUC为0.873(95%CI=0.777~0.970,P<0.001),诊断正确率为87.4%,敏感性为90.5%,特异性为64.3%,PPV为95.0%,NPV为47.4%。上述结果提示两种评分联合诊断的准确性(0.873,95%CI=0.777~0.970)高于单独使用核形态评分(0.817,95%CI=0.687~0.948,P=0.092),但差异无统计学意义;亦高于单独超声学特征评分(0.758,95%CI=0.637~0.879,P=0.047,图5),差异有统计学意义。

图5 简化核形态评分,超声评分及联合检测的ROC曲线图及ROC曲线下面积
3 讨论
FNA诊断不确定的甲状腺结节是临床医师重要的挑战之一。行诊断性手术的TBSRTC Ⅲ、Ⅳ级结节中,术后组织病理学证实仅14.4%~32.1%为恶性,而TBSRTC V级中也有25.1%为良性[10]。近年的研究显示分子检测虽然能够为诊断提供更客观的信息,但即便是最具诊断意义的BRAF V600E突变在不确定结节中的检出率也仅为21.3%,在TBSRTC Ⅲ、Ⅳ和Ⅴ级的检出率分别为12.8%、3.6%和49.7%[5]。因技术特殊及设备要求高,分子检测在很多基层医院难以开展。采用简单易行的分流诊断方法,是临床及细胞病理学医师关注的焦点。
超声检查作为甲状腺结节首选的影像学检查手段,在临床诊疗决策中具有重要的应用价值。受美国放射学会乳腺影像报告和数据系统(Breast Imaging Reporting and Data System, BI-RADS)启发,各国学者及协会相继建立了甲状腺的TI-RADS[9,11-14]。超声特征与病理学的关系也受到学者们的关注。国内一项关于超声TI-RADS的组织病理结构影响因素研究,揭示超声表现与组织病理结构本质是一一对应的关系,间质广泛显著纤维化是导致超声分类较高的最大的组织病理学影响因素[15]。北京医院超声科通常采用的是较早建立、参数少易于操作的Kwak等[9]的TI-RADS分类,再结合相关临床信息及结节大小决定是否进行超声引导下FNA。一些研究表明:重复超声危险分层,结合细胞学分级和(或)其他如分子检测、临床信息等,有助于预测FNA不确定结节的恶性程度[7,16-17]。最近,意大利解剖病理细胞协会及国际病理学会意大利分会,基于一项来自41个研究、包含近30 000个甲状腺结节的大型荟萃分析,制定了一个涉及临床、超声及细胞学共13个参数的CUT评分系统[8],其中超声参数包含了纵横比、晕环征消失、形态不规则、微钙化、低回声、实性结节、结节内血流、最大径≥4 cm以及单一结节共9项特征。本研究以上述9项超声特征为观察指标,显示在良性组与恶性/低危组之间存在差异,其中纵横比>1、晕环征消失、边界不规则、结节内血流信号4项的差异具有统计学意义。超声的广泛应用使得许多甲状腺结节能够早期被发现。国内并未限定行超声引导下FNA结节的最大径,仅强调“对于最大径<5 mm,特别是位置特殊,穿刺困难的结节,FNA可由或在细针穿刺经验丰富的医师指导下实施”[18]。因此本组绝大部分病例结节<1.0 cm,中位最大径0.6 cm(范围0.2~4.5 cm),这或许是恶性/低危组中无结节内血流信号的病例占比高的原因。本研究去除了结节最大径≥4 cm,保留了其他8项超声特征,为了便于日常操作,采用计数法而非CUT评分的权重法进行超声特征评分。统计结果显示,恶性/低危组的评分高于良性组,将5分设定为临界值,其诊断甲状腺恶性/低危肿瘤的正确率为68.1%,具有较高的特异性(78.6%)和PPV(95.9%),但敏感性(66.7%)不高,NPV(23.9%)低,提示单独使用超声特征评分在FNA不确定结节中仍会漏检部分阳性病例。
Nikiforov等[19]于2016年开发并验证了一种简化的核诊断评分方案。在此基础上,其他学者也提出了类似的细胞学评分系统用于辅助诊断[20-21]。除了细胞形态的变化外,排列结构异常也是FNA诊断不确定结节的依据。2017版TBS建议使用细胞异型、结构异型等词语对AUS/FLUS进行亚分类[2]。因此,本研究选择了上述3项结构及5项细胞核形态共8个特征来比较两组间的差别。结果发现:乳头状结构、微滤泡结构及细胞重叠拥挤这三项结构异型在两组间差异无统计学意义,而细胞核形态的5项特征在恶性/低危组的比例高于良性组,其中核沟、核内包涵体及核淡染在两组间差异有统计学意义,这与文献报道结果略有不同[20-21]。几乎所有的研究数据均提示细胞核异型对诊断恶性肿瘤更有意义,因此很多学者建议依据细胞和结构异型对TBSRTC Ⅲ、Ⅳ级划分亚组,细胞核异型亚组的恶性危险度(risk of malignancy, ROM)更高,对其管理应较其他亚组更积极[8,22-25]。为了易于掌握和统一,本研究制定了简化的细胞核3分制评分系统。以2分为临界值,统计分析显示其诊断甲状腺恶性肿瘤的正确率为93.3%,与超声特征评分相比,具有较高的敏感性(99.1%)和NPV(87.5%),但特异性低(50%)。虽然可以有效排除阴性病例,但单独使用仍可能有一半良性病例被过度诊治。
无论是超声评分还是细胞核评分都简单、易操作,两者各有优势,且都已包含在标准诊断检查中,不会增加额外的医疗成本。联合超声特征及核形态评分,与单独评分相比,其敏感性(90.5% ∶99.1%、66.7%)和PPV(95.0% ∶93.7%、95.9%)都保持在高水平,但特异性未提高(64.3% ∶50.0%、78.6%);诊断准确性高于超声评分(87.4% ∶68.1%)、略低于核形态评分(87.4% ∶93.3%),后者可能是本研究恶性/低危组病例数远多于良性组所致。ROC曲线分析显示,两种评分联合诊断的准确性(AUC=0.873)高于单独核形态评分(AUC=0.817,P=0.092)或超声学特征评分(0.758,P=0.047),且与超声特征评分相比差异有统计学意义。
本研究为单一机构的回顾性分析,存在一定局限性。首先,存在样本选择偏差,未纳入未在北京医院行手术切除的不确定结节。其次,TBSRTC Ⅲ~Ⅴ级恶性肿瘤的真实发生率未知,并非每例FNA不确定结节都有组织病理学证实。绝大部分患者采取了定期超声随访观察的策略,一部分患者更换了就诊医院,导致本研究仅14.8%病例获得了组织学证实,这其中仅11.8%(14/119)为良性结节。两组数据分布不均衡也会影响最终统计结果。此外,甲状腺恶性肿瘤绝大部分为滤泡细胞肿瘤,特别是甲状腺乳头状癌,因此无论是超声还是细胞核特征研究均是针对甲状腺滤泡细胞肿瘤,特别是甲状腺乳头状癌的预测。上述评分是否适用于其他少见类型的甲状腺肿瘤,还有待扩大样本以及多中心数据进一步验证。
综上所述,联合超声特征及细胞核形态评分是指导不确定甲状腺结节临床管理的有用工具,但在特异性方面有一定的局限。因此还需要更多的研究,联合不同参数综合评价来提高术前诊断的准确性,实现对患者的最佳治疗决策,减少患者的损伤和医疗资源的浪费。

