健康与患黑胫病烟株根内AMF多样性和群落结构差异分析
李秋桦,尹 敏,裴 妍,陈 秀,任 禛**,夏体渊,徐胜光
(1.昆明学院 农学与生命科学学院 云南省高校生物炭工程研究中心,云南 昆明 650214;2.云南大学 医学院,云南 昆明 650091;3.昆明学院 医学院,云南 昆明 650214)
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)为球囊菌亚门,是土壤中生物量最大、作用最显著的有益真菌,可以侵染80%以上的陆生植物[1],对植物的生长生理、营养吸收以及土壤生态系统的调节具有重要作用[2].AMF群落多样性及物种组成受多种因素影响,宿主、地理位置以及环境因子等都会使AMF类型发生变化[3].董甜等[4]对长白山4种赤杨根际AMF群落多样性进行探究发现,不同品种赤杨根内AMF具有一定的宿主专一性,在4个品种中AMF多样性存在差异.曹敏等[5]发现重庆地区不同种植基地的茅苍术根际AMF群落结构不同.蔡晓布等[6]发现土壤活性有机碳含量会显著影响植物AMF的发育、分布与侵染.目前关于病原菌侵染对植物AMF群落多样性的影响鲜有报道.AMF在植物抗病方面具有巨大潜力,在植物根际与病原菌竞争生态位点是其提高植物对土传病害抗性的重要机制之一[7],然而土传病害的存在有可能影响AMF对宿主的侵染,进而影响AMF对植物的功能作用.进一步探明AMF-植株-土传病害间的相互关系,可为AMF在缓解植物土传病害方面的应用奠定基础.烟草(Nicotiana tabacumL.)是茄科烟属植物,在经济作物中占有重要地位.AMF可与烟草建立互惠共生体[8],其在烟草生长生理方面具有积极作用,同时部分AMF可以缓解烟草病害.Subhashini等[9]研究发现,AMF可以与腐霉属产生竞争关系,占据侵染位点,从而提高烟草抗病能力.刘先良等[10]在烟草中分别接种两类AMF菌剂(Glomus intraradices和Glomus mosseae),结果发现两种菌剂均可缓解烟草青枯病的发生.Giovannetti等[11]对烟草根腐病研究发现,接种Glomus monosporum后可以提高烟草对根腐病的抵抗能力,因此AMF在烟草抗病方面具有积极作用.目前AMF在农作物中的抗病应用仍处于起步阶段,尚未突破对其大规模纯培养的技术难题,同时AMF的防病效果会受到pH、温湿度以及土壤养分状况等因素条件的影响,且在生产中这些条件难以控制,这些因素极大地限制了AMF在农作物抗病方面的开发与利用[12-13].寄生疫霉(Phytophthora nicotianae)是诱发烟草黑胫病的主要土传病害,其病原菌可以通过厚垣孢子和休眠菌丝在发病区域长期存在,并且依靠土壤和病残体进行传播,危害严重且难以根治[14].鉴于AMF在土传病害防治方面的作用,探究烟株根内AMF-土传病害-根际土壤间的相互作用具有重要意义.研究以云南烟草主栽品种K326和云烟87作为研究对象,对两个品种健康与患黑胫病烟株根内AMF侵染特征进行探究,分析感染黑胫病对烟株根内AMF侵染率和群落多样性的影响,为进一步摸清AMF与烟株共生关系建立的影响因素奠定基础.
1 材料与方法
1.1 样本采集样本采集时间为2020年8月,供试烟草品种为K326和云烟87,由云南省烟草公司红河州分公司橄榄坡烟草绿色防控示范基地提供,该地区海拔约1 451 m,地理坐标为103°27′34″E,24°22′35″N,种植K326和云烟87的烟田之间距离约200 m.在K326烟田(病情指数约为38.86%)中随机选择3株健康烟株和3株患黑胫病烟株,健康与患黑胫病烟株如图1所示,重复烟株间距离5~10 m.取出完整烟株后,立刻带回实验室,对烟株根及根际土壤进行采集,首先将附着在根的根际土壤抖落至密封袋中保存备用,之后对烟株根部进行清洗,保存备用.健康烟株(K326-JK)标记为K326-JK-1、K326-JK-2和K326-JK-3;患病烟株(K326-B)标记为K326-B-1、K326-B-2和K326-B-3;云烟87(病情指数约为42.67%)根系和根际土壤取样方法同K326,健康烟株(Y87-JK)标记为Y87-JK-1、Y87-JK-2和Y87-JK-3;患病烟株(Y87-B)标记为Y87-B-1、Y87-B-2和Y87-B-3.样品存放于-80 ℃备用.

图1 健康与患黑胫病烟株Fig.1 Health and black shank tobacco
1.2 土壤理化性质检测对样品土壤进行理化性质的监测:pH值采用pH计进行测定;有机质测定采用重铬酸钾法;土壤全氮测定采用凯氏定氮法;碱解氮测定采用碱解扩散法;土壤全磷测定采用高氯酸-硫酸法;速效磷测定采用碳酸氢钠浸提-钼锑抗比色法;土壤全钾测定采用碱溶-原子吸收分光光度计法;速效钾测定采用乙酸铵-火焰光度计法.
1.3 菌根侵染状况和土壤孢子密度测定菌根侵染状况采用Koske等[15]的方法进行检测,将烟株根部剪成1 cm的根段放入试管中,加入2.5%的KOH,煮沸1 h后倒掉碱液加10% H2O2漂白30 min,自来水冲洗后加1%盐酸酸化1 h,之后加入0.05%的曲利苯蓝在90 ℃水浴20 min.取出浸泡于乳酸甘油中脱色12 h,取出根段制片镜检.将数据输入Mycocalc软件,对菌根侵染数据进行计算.土壤孢子密度测定采用湿筛-倾析法和蔗糖离心法进行分离,在解剖镜下观察统计.
1.4 根部样品测序称取烟草根部样品各2 g,用75%乙醇灭菌1 min后浸泡在3% NaClO中消毒2 min,最后用去离子水洗干净,置于无菌研钵中,加入适量液氮,研磨成粉末.采用CTAB法[16]对烟草根部总DNA进行提取;运用巢式PCR扩增AMF 18S rRNA基因部分片段,PCR反应采用1×T3 Super PCR Mix(擎科生物),按照说明书对样品及引物进行添加,反应体系为25 μL,第1轮引物为AML1(5′-ATCAACTTTCGATGGTAGGATAGA-3′)和AML2(5′-GAACCCAAACACTTTGGTTTCC-3′),第2轮引物为AMV4-5NF(5′-AAGCTCGTAGT TGAATTTCG-3′)和AMDGR(5′-CCCAACTATCCC TATTAATCAT-3′),PCR扩增程序均为95 ℃预变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,循环35次;72 ℃延伸10 min.扩增产物送至美吉生物公司进行Illumina Miseq高通量二代测序;并根据测序结果进行分析.
1.5 数据处理使用fastp软件对原始测序序列进行质控,并应用FLASH软件进行拼接;使用UPARSE软件,根据97%的相似度对序列进行OTU聚类并剔除嵌合体,并选取每个中最长的OTU序列作为代表序列;利用RDP classifier对每条序列进行物种分类注释,比对maarjam081/AM数据库,设置比对阈值为70%;利用Mothur(version v.1.30)软件计算样品α多样性指数;偏最小二乘法判别分析应用R语言mixOmics包中plsda分析和作图;Venn图使用R语言工具统计和作图;使用Excel 2003软件对各分类单元数据进行统计;采用SPSS 22.0对数据进行统计学分析;应用Canoco 4.5软件对实验结果进行RDA分析.
1.6 序列登录K326-JK-1、K326-JK-2、K326-JK-3、K326-B-1、K326-B-2、K326-B-3、Y87-JK-1、Y87-JK-2、Y87-JK-3、Y87-B-1、Y87-B-2和Y87-B-3上传在NCBI SRA数据库中的登录号分别为SRR13091087、 SRR13091086、 SRR13091083、SRR13091082、 SRR13091081、 SRR13091080、SRR13091079、 SRR13091078、 SRR13091077、SRR13091076、SRR13091085、SRR13091084.
2 结果与分析
2.1 土壤理化性质烟株土壤理化性质分析见表1.整体来看,两个烟草品种根际土壤pH值均呈酸性,其中K326健康土壤酸性最强,达到5.41.各烟草品种根际土壤有机质含量为中等水平,而云烟87患病样品中的含量更为丰富.所有样品根际土壤的全氮质量比差异不显著,但K326患病土壤样品的碱解氮质量比最高,显著高于其它样品.土壤磷质量比结果表明,K326健康样品质量比最高,并显著高于云烟87患病样品;K326健康样品根际土壤钾质量比亦最高,其全钾质量比显著高于其它样品.
分析健康与患病样品根际土壤间理化性质差异,从根际土壤的全磷和速效磷质量比的结果可以看出(表1),两个烟草品种患病样品均明显低于健康样品,其中云烟87患病样品中全磷质量比显著低于健康样品,表明感染黑胫病可降低烟草根际土壤磷质量比.此外,K326患病样品土壤碱解氮质量比显著高于健康样品,但其全钾和速效钾含量均显著低于健康样品,而云烟87患病烟草根际土壤pH值和全钾质量比均显著高于健康样品,可见感染黑胫病对土壤全钾质量比的影响与烟草品种相关.
2.2 烟草根内AMF侵染状况及土壤孢子密度对烟株根部内生菌根的侵染状况进行检测,可以发现两个品种健康和患病烟株根内均存在AMF的侵染(表2),侵染率均达到70%以上.其中K326健康烟株侵染率最高,达到82.22%;云烟87患病烟株侵染率最低,仅为70%.整体来看,两个烟草品种健康和感病植株根内间菌根侵染率、侵染强度和丛枝丰富度均无显著差异,但患病烟草样品AMF的侵染状况低于健康烟草样品.此外,孢子密度结果表明(表2),K326和云烟87健康样品孢子密度均高于患病样品,此变化趋势与菌根侵染状况结果相一致.根据结果可以推测,由于病原菌与AMF在烟株根内和根际土壤中竞争生态位点,影响到烟株根际土壤AMF孢子的单位量,进而降低其对烟株根内的侵染.K326和云烟87健康及患病植株根系内AMF的侵染水平均未达到显著水平,可能是因为在病原菌侵染之前,AMF对烟株根系的侵染已达到较高水平,占据了稳定的生态位,导致后面病原菌侵染对根内AMF的变化影响较小.

表1 K326、云烟87健康和患病样品根际土壤理化性质Tab.1 Physicochemical properties of rhizosphere soil from healthy and diseased samples of K326 and Yunyan87

表2 K326和云烟87健康和患病样品AMF侵染率与孢子密度Tab.2 Colonization rate and spore density of AMF from healthy and diseased samples of K326 and Yunyan87
2.3 烟株根部AMF高通量测序结果分析
2.3.1 序列统计分析 K326健康、K326患病、云烟87健康和云烟87患病烟株根部高通量测序结果经过质控并去除嵌合体后(表3),分别获得的原始序列为64 285、70 561、71 911条和71 742条,排除线粒体和叶绿体干扰后得到的有效序列分别为62 938、68 947、70 524条和70 142条,按照97%相似性进行归类后分别获得629、592、620和727个OTUs.其中,云烟87健康烟株根内测得的AMF有效序列数最多,K326健康烟株根内AMF有效序列数最少,云烟87患病烟株根内AMF的OTUs高于其它样品,K326患病烟株根内AMF的OTUs最低.从整体来看,云烟87根内AMF的有效序列和OTUs数量均高于K326.根据Shannon指数稀释曲线(图2)可以看出,当测序深度大于10 000时,所有样品的稀释曲线逐渐趋于平行,表明测序数量足够,种群多样性不再变化,测序结果可真实地反映烟草根内AMF群落组成.
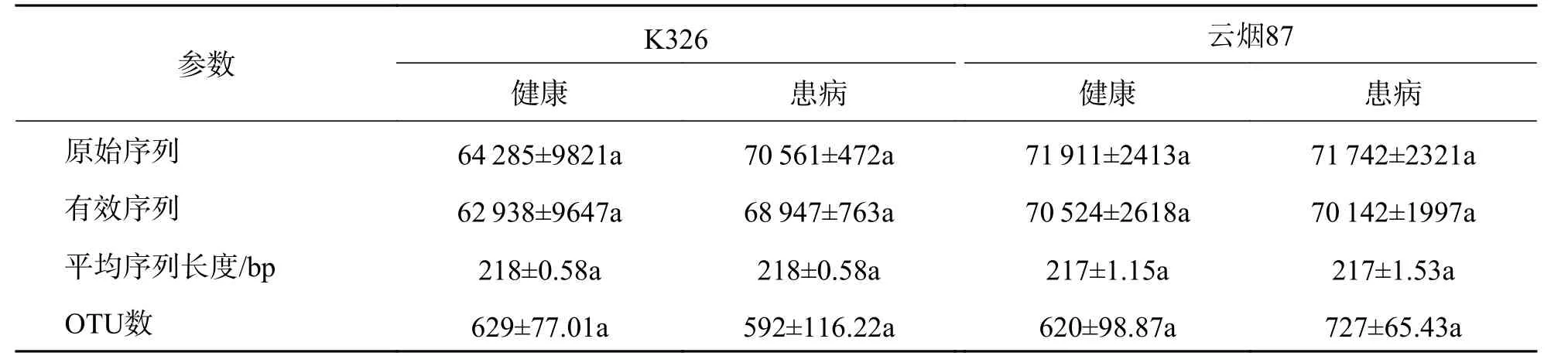
表3 K326和云烟87健康和患病样品根内AMF群落测序数据统计结果及相关序列指数Tab.3 The statistical results of sequencing data of AMF community in roots between healthy and diseased samples of K326 and Yunyan87

图2 Shannon指数稀释曲线Fig.2 Shannon index dilution curve
2.3.2 烟草根内AMF多样性指数分析 多样性指数结果(表4)表明各烟草样品根部AMF的Ace、Chao、Shannon和Simpson指数均无显著差异.云烟87患病样品AMF的Ace和Chao指数最高,说明其根内AMF较为丰富,K326健康样品AMF的Shannon指数最高,Simpson指数最低,说明其根内的多样性最高.总体来看,云烟87品种的AMF丰富度较高,多样性较低,K326样品的AMF多样性较高而丰富度较低.同时各个样品中AMF的OTU覆盖率(Coverage)均高于99%,说明本次测序结果可靠.
2.3.3 烟草根内AMF群体聚类分析 基于偏最小二乘回归模型对样本进行PLS-DA(partial least squares discriminant analysis)分析.如图3所示,在不同品种中患病与健康烟株AMF群落存在差异,且K326与云烟87健康烟株的AMF群落有较高的相似性,感病烟株根内AMF群落相似性较高.
2.3.4 烟草AMF种群归类分析 排除不可归类的类型后对AMF种群组成进行统计(表5),发现烟草根内AMF均为Glomeromycetes(球囊菌纲).在目水平,AMF归属于4个目,包括Archaeosporales(原囊霉目)、Diversisporales(多孢囊霉目)、Glomerales(球囊霉目)和Paraglomerales(类球囊霉目);在科水平,AMF归属于5个科,包括Archaeosporaceae(原囊霉科)、Diversisporaceae(多孢囊霉科)、Gigasporaceae(巨孢囊霉科)、Glomeraceae(球囊霉科)和Paraglomeraceae(类球囊霉科).

表4 多样性指数统计Tab.4 Diversity index statistics

图3 烟株根内AMF群落聚类分析Fig.3 The cluster analysis of AMF community in root of tobacco.
对两个品种烟株健康和患病样品AMF种群在属水平上进行归类,如图4所示,排除不可归类的类型后在各个样品中丰度水平前3的AMF均为Paraglomus(类球囊霉属,33.73%~57.86%)、Glomus(球囊霉属,26.42%~54.41%)和Diversispora(多孢囊霉属,11.59%~21.29%),但相对丰度不同.此外,云烟87健康烟株中Glomus占比高于Paraglomus,其余样品均为Paraglomus占比高于Glomus.Gigaspora和Scutellospora仅存在于K326健康烟株中,分别占比4.46%和0.39%.可见,不同品种烟株根内AMF类型存在差异,患病与健康烟株根内AMF类型亦存在差异.
2.3.5 烟株根内AMF的OTU分析 通过OTUs聚类绘制的Venn图(图5)可较为直观地看出烟株根内AMF的OTUs组成情况.所有样品中共存在1 655个OTUs,其中共有的OTUs为558个,占比为33.72%.云烟87患病烟株根内独有的OTUs较多,约占全部的12.93%;其次为K326和云烟87健康烟株,分别占比8.04%和7.92%;患病的K326烟株根内独有的OTUs较少,约占全部的7.67%.整体来看,云烟87所含AMF的OTUs多于K326,在K326中健康烟株所含OTUs高于患病烟株,而云烟87中患病烟株存在的OTUs高于健康烟株.

表5 烟株根内 AMF 种群组成统计Tab.5 The AMF population composition in tobacco root

图4 AMF在属水平的相对丰度Fig.4 Relative abundance ratio of AMF at genus level
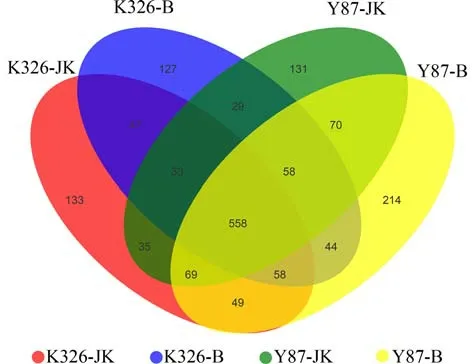
图5 K326和云烟87健康与患病烟株之间独有和共有的OTU数Fig.5 The number that unique and shared OTUs between healthy and diseased tobacco strains of K326 and Yunyan87
2.4 土壤理化性质对烟草AMF的影响应用冗余度分析(redundancy analysis,RDA)可探究烟草根际土壤理化性质与AMF侵染特征的相关性.根际土壤理化性质对AMF多样性指数影响的冗余分析结果显示(图6(a)),第1排序轴解释信息量达70.3%,第2排序轴解释信息量达11.7%.从整体来看pH为AMF多样性的主要影响因子,其次为全氮和有机质.相关性结果表明土壤全磷、速效磷、全钾和速效钾质量比与Shannon和Chao指数呈正相关,其它指标与两指数均呈负相关.其中,全磷、速效磷对Shannon指数影响较大,而全钾和速效钾对Chao指数影响较大.全氮、碱解氮、有机质和pH与群落多样性Simpson指数呈正相关,其它土壤指标与之呈负相关;碱解氮、有机质和pH与均匀度Ace指数呈正相关,其它指标与其呈负相关.可见,根际土壤理化性质对AMF多样性指数产生影响,但不同土壤理化指标对各AMF多样性指数影响并不一致.
根际土壤理化性质对烟草AMF侵染状况影响的冗余分析见图6(b),两轴累积解释信息量达69.8%.从整体来看全钾为AMF侵染状况的主要影响因子,其次为速效磷和全磷.相关性结果表明全氮、碱解氮、有机质和pH值与AMF侵染率(F)呈正相关,其它土壤指标与之呈负相关;全氮、全钾、速效钾、全磷和速效磷均与菌根侵染密度(M)和从枝丰富度(A)呈正相关;pH和全磷含量与土壤孢子密度呈正相关,其余根际土壤性质均与其为负相关.综上,根际土壤理化性质与土壤中的AMF孢子密度及烟草根内的AMF侵染状况均存在一定的相关性,但其对AMF的侵染状况的影响更为明显.

图6 烟株根际土壤理化性质对AMF多样性(a)、侵染状况(b)和属水平相对丰度(c)影响的RDA分析Fig.6 RDA analysis about effects of physical and chemical properties of tobacco rhizosphere soil on AMF diversity(a) infection status (b) and relative abundance at genus level (c)
根际土壤理化性质对烟草AMF在属水平相对丰度影响的结果见图6(c).从整体来看速效钾为AMF属水平相对丰度的主要影响因子,其次为全钾和速效磷.相关性结果表明Diversispora与速效钾和碱解氮呈正相关,与其它土壤理化性质呈负相关;Glomus与速效磷、全磷和有机质呈正相关;Archaeospora与全磷、速效磷、pH和有机质呈正相关;Gigaspora和Scutellospora与全钾、全氮、pH、全磷、速效磷和有机质呈正相关,与速效钾和碱解氮呈负相关;Paraglomus与有机质呈负相关,与其它指标均呈正相关.可见烟草AMF的群落组成与土壤理化性质密切相关,其中土壤中钾含量影响最为明显.
3 讨论
3.1 烟株根内存在丰富的AMF资源AMF作为一种寄生真菌,可以通过与植物根部结合在土壤中形成庞杂的菌丝网络,使植物对土壤营养物质的吸收更加具有优势[17].AMF在提高烟草生长生理以及抗病抗逆方面具有巨大潜力[18-20],探究烟株根部AMF类型具有重要意义,但目前对烟草AMF多样性的研究相对较少.李昕竺[21]使用DGGE法对烟草根部AMF多样性进行检测,共获得28个AMF类型.本实验室先前应用分子克隆文库构建法对4个烟草品种根部AMF多样性进行调查,共检测到21个OTUs[22],其中云烟87、K326分别检测到9个和8个OTUs.目前已有研究采用传统分子生物学手段在烟草根内只获得较少的AMF类型,但本研究采用高通量测序技术对烟草K326和云烟87根内AMF多样性进行检测分析,发现了极为丰富的AMF资源.在两个烟草品种根内共得到1 655个OTUs,其中,在K326中发现了1 240个OTUs,在云烟87检测到1 348个OTUs.可见,应用高通量测序技术可打破传统分子生物学手段的局限,检测到更多的AMF类型.同时与K326相比,云烟87根内AMF种类更为丰富,这与本实验室先前研究结果相一致[22].此外,本研究所测得的OTUs在可归类的分类阶元中归属于1纲4目5科6属.整体来看,在本研究的烟草根部样品中,排除不可归类的AMF,Paraglomus相对丰度最高,占总AMF的42.56%;其次为Glomus,占比39.64%,该结果与先前报道的Glomus为烟草优势AMF类型的结果并不同[21-22],这可能与不同检测方法敏感度不同有关.
3.2 患 病 与 健 康 烟 株 间 的 根 际 土 壤 和 根 内AMF存在差异植株根部在受到病原菌侵染时AMF可与病原物产生强烈竞争,阻碍病原菌进入植株[23],同时病原菌的存在有可能对AMF孢子及其对植物根部的定殖产生影响.本研究结果表明,K326和云烟87健康烟株根际土壤孢子密度高于患病烟株,这可能由于患病植株根际土壤中存在大量的病原菌,这些病原菌可与AMF孢子争夺生存空间及营养物质[24],导致AMF的生存环境受到破坏,进而降低了AMF的孢子数量.本研究进一步发现,患病烟株根内AMF的菌根侵染率和菌根侵染密度明显下降,推测可能的直接原因除与根际土壤中AMF孢子密度降低相关外,还与病原菌入侵根部与AMF竞争生态位点相关[25],在双重直接因素影响下导致AMF对患病烟株根部的定殖下降.
此外,本研究还证实,感染黑胫病会改变烟株根内AMF的侵染类型.一方面,烟株患病后根内AMF的OTUs数量会发生变化,K326中健康烟株所含有的OTUs高于患病烟株,而云烟87健康烟株所含类型低于患病烟株,感染黑胫病对烟株根内AMF种类数量的影响与烟草品种有关.另一方面,患黑胫病亦会引起烟株根内AMF类型发生改变,在K326健康烟株根内存在Gigaspora和Scutellospora的AMF,而患病烟株并未检测到;云烟87的健康烟株与患病烟株根内AMF最主要属类型出现不同,健康烟株主要属为Glomus,而Paraglomus为患病烟株的主要属.非常有趣地是,本研究发现尽管患病对K326和云烟87根内AMF带来的影响不一致.但在群体聚类分析中发现,两个品种的健康植株根内AMF群落结构具有较高的相似性,推测患病后可改变了烟草根圈微生态环境,导致根内AMF群落结构发生改变.可见,在植烟大田中,土传病害-烟株根内-AMF之间的关系较为复杂.本研究只能初步证实,感染黑胫病能够改变烟株根际的AMF孢子密度及其对烟株的侵染特征,引起烟株根内AMF群落结构发生变化,但在烟株根圈黑胫病及AMF之间存在着怎样的动态关系?哪些AMF在烟株遭受黑胫病侵袭后能还能更好地侵染根部?以及感染黑胫病是否影响到AMF对烟株的抗病能力还有待进一步证实.
3.3 土壤理化性质对烟株根际和根内AMF产生影响AMF作为土壤习居菌,主要存在于植物根内及根际土壤中,与土壤环境关系密切,其孢子密度及其对植物的侵染水平受到多种因素的影响,其中土壤养分的影响最为重要[26].本研究发现,土壤全钾质量比是影响AMF孢子密度及对烟株侵染状况的主要驱动因子,其次为速效磷质量比和全磷质量比.土壤中的全钾、速效钾、全磷和速效磷质量比均与菌根侵染密度和从枝丰富度呈正相关,且土壤全磷质量比与土壤孢子密度呈正相关.钾和磷同为土壤中的大量元素,但磷元素与AMF的关系更为密切[27].大量研究结果表明,土壤磷质量比过高往往会抑制AMF的生长、发育和功能[28],降低了AMF的根内侵染能力和根外菌丝密度[29].这与本研究结果不同,可能是本研究采样烟田土壤中的磷质量比背景值不高,未达到抑制AMF生长的上限.在一定范围内增加土壤全磷和速效磷含量可增加土壤中AMF的孢子密度,并能促进AMF与烟株形成更好地侵染.
植物根内AMF多样性及群落结构可受到宿主植物、土壤因子、地理位置以及气候条件等因素的影响[30],其中土壤理化性质的影响较为广泛[31].本研究发现土壤pH值对烟株根内AMF多样性影响最大,且与AMF多样性呈负相关.目前土壤pH值被认为是影响AMF多样性非常重要的土壤因子,受到越来越多研究者的关注.李雪静等[32]发现土壤pH是影响荒漠和草原生态系统AMF多样性的最主要驱动因子.代心灵等[33]研究认为土壤pH对内蒙古典型草原的AMF影响最为明显,可显著影响其群落结构.这些研究结果与本研究结果一致,均证实了pH在AMF生长和繁殖环境中的重要性.我们认为AMF可能是一类对酸碱环境比较敏感的微生物,pH值的高低可直接影响AMF孢子萌发、菌丝生长、孢子繁殖[34-35]以及种类分布[36].
植株AMF群落组成会受到土壤理化性质的影响,众多研究表明磷元素为AMF群落组成的主要影响因子.汪志琴等[37]对免耕覆盖栽培管理下的冬麦根部AMF研究发现,影响优势属丰度的土壤理化性质主要为土壤速效磷与全磷.王化秋等[38]对石山香根草的AMF研究发现,速效磷质量比是AMF群落的主要影响因子.但本研究与上述结果不同,发现速效钾是影响烟株根系AMF属水平相对丰度的主要影响因子,其次为全钾和速效磷.可见,钾与磷均为土壤中的大量元素,其对植物AMF群落的影响亦不可忽略.
3.4 土传病害对烟株AMF的影响与其改变土壤理化性质相关土壤理化性质与植物是否感病之间存在密切关系,土传病害会使土壤营养平衡失调[39].丁亚茹等[40]分析了四川凉山州成熟期健康与易感病烟田土壤理化性质差异,结果发现尽管全钾和速效钾指标在两种烟田土壤中无显著差异,但全钾和速效钾、全氮和速效氮等指标均表现为易感病烟田>健康烟田.陈海念等[41]研究结果表明,患病烟田土壤中的全氮和速效氮、全磷和速效磷、全钾和速效钾的含量均大于健康烟田.已有报道都认为对比健康烟田,感染病害可提升土壤的养分含量.本研究结果发现,两个品种健康与患病根际土壤的全氮与碱解氮含量均呈现患病>健康,这与上述研究结果一致.可能的原因是由于烟草黑胫病为维管束系统性病害,患病后烟株根部和茎基部的维管束坏死[42],氮元素无法从植株地下部运输到地上部,使得在患病土壤中残留量较大.
但对于磷和钾元素,本研究结果与上述报道并不一致.本文发现烟草K326和云烟87根际土壤的全磷和速效磷质量比均呈现为健康>患病,这与前人对烟田的研究结果相反.Bian等[43]报道感染根锈腐病使得人参根际土壤中全磷和速效磷质量比明显降低,这与本研究结果一致.同时,本研究还发现全钾和速效钾在两个品种患病与健康烟株根际土壤中虽存在显著差异,但在两个品种中表现不同,其中K326健康样品全钾和速效钾质量比显著高于患病样品,而云烟87则表现为健康低于患病.在感染根锈腐病人参的根际土壤中,其全钾和速效钾的质量比明显降低[43],这与本研究烟草K326的结果一致.可见,关于感病对植株根际土壤理化性质的影响并无定论.土壤-病害-植物间关系复杂,并且相关研究较少,但我们可以肯定的是植株感染病害与根际土壤养分含量关联密切,土壤养分含量的改变和失衡也可能是引发或加重植株病害的原因之一.
AMF在促进植物对磷素吸收方面具有积极作用,同时土壤中磷元素质量比与AMF的群落结构和丰度关联密切[44-46].本研究在RDA分析中表明土壤全磷和速效磷含量与菌根侵染密度和从枝丰富度呈正相关,且患病后烟株根内AMF侵染率下降,根际土壤孢子密度降低,可以推测烟株感染黑胫病可通过改变土壤中磷含量进而对根际和根内AMF产生影响.综上所述,由于土壤理化性质会影响AMF的多样性,烟株感染黑胫病可引发土壤理化性质发生改变,从而间接地对AMF群落产生影响.
烟草根际土壤富含丰富的AMF资源,病原菌和土壤理化性质均与AMF群落组成相关.烟株感染黑胫病会使土壤理化性质发生改变,进而对根内AMF多样性产生影响.可见,病原菌的侵染可直接或间接地影响AMF群落结构,同时AMF在烟草根内定殖亦会对病原菌产生一定地拮抗作用[47].深入研究AMF-土传病害-土壤理化性质-烟株根部的相互关系,可为后续AMF在缓解烟草土传病害方面的应用奠定基础.

