微波消解-火焰光度法测定植物中全钾
陶曙华 龚浩如 陈祖武


摘要:通过优化微波消解用酸种类、最高温度及保持时间等条件,建立微波消解-火焰光度计测定植物中全钾的新方法。结果表明,采用6 mL HNO3+2 mL H2O2酸系,微波消解最高温度160 ℃,保持时间15 min的优化消解方法,测定的检出限0.002 mg/g;测定两种植物标准物质的全钾含量均在其证书标准值范围内;测定水稻植株样品的全钾含量加标回收率97.5%~103.0%,相对标准偏差0.63%~2.27%。该方法适用于植物不同部位全钾的测定,操作简便安全,结果准确可靠。
关键词:微波消解;火焰光度法;植物;全钾
中图分类号:S132 文献标识码:A
文章编号:0439-8114(2019)10-0142-04
Abstract: A new method for the determination of total potassium in plants by microwave digestion-flame photometry was established by optimizing the conditions of digested acid, maximum digestion temperature and retention time of microwave digestion. The results showed that the optimal digestion condition was as follows:6 mL HNO3+2 mL H2O2 acid system, maximum digestion temperature 160 ℃ and retention time 15 min, and the detection limit was 0.002 mg/g. The results of the total potassium content of two plant reference materials determined by the optimal digestion procedure showed that the data was within the range of the certificate standard values. The recovery rates of total potassium contents of rice plant samples tested by the optimal digestion procedure were 97.5%~103.0% and the relative standard deviation was 0.63%~2.27%. The results suggested that this method is suitable for the determination of total potassium in different parts of plants, and the operation is simple and safe, and the result is accurate and reliable.
Key words: microwave digestion; flame photometry; plant; total potassium
鉀是植物生长必需的大量营养元素之一,在植物中以阳离子K+的形式存在,它在调节植物细胞渗透势方面起重要作用,也能激活许多参与呼吸作用和光合作用的酶[1],对作物的生长发育有不可替代的作用,因此在农业科学研究和农业生产中经常需要测定植物中钾元素含量。植物中钾的测定一般采用火焰原子吸收光谱法[2],还可以采用ICP-OES[3,4]、ICP-MS[5,6]等,在多元素测定时采用ICP等仪器准确快速,但这些仪器都比较昂贵,资金不雄厚的实验室难以购置。在仅测定钾、钠碱土元素时一般采用火焰光度计,火焰光度计是一种常用的化学分析仪器,广泛应用于国防工业生产、化学分析研究及医药产品开发等领域的分析测试,具有快速、简便等优点[7,8]。
测定植物钾含量的样品前处理一般采用H2SO4-H2O2湿消解[2],该方法是开放式消解,样品容易引入污染,消解时间较长,操作步骤繁琐,容易污染环境。20世纪70年代微波消解技术引入消解样品,起初运用此项技术并不成功,敞口的加热方式使得样品的测试十分不准确。80年代有研究者完善了微波消解技术,采用了封闭式的手段,在这样的封闭空间中避免了样品的挥发,使微波消解技术得到了长足的发展[9]。微波消解具有加热速度快、加热均匀、无温度梯度、无滞后效应、无污染、无损失等特点,在多种元素分析方面已得到广泛应用[10]。近年来,微波消解仪不断改进,国家对安全与环保日益重视,基于此,本研究进一步优化微波消解条件,用火焰光度计法测定植物中全钾的含量,并对该方法进行验证试验,以期为植物中钾含量的检测提供准确、安全、快速和环保的分析方法。
1 材料与方法
1.1 试验材料
供试样品:GBW10048芹菜标准样品,GBW10049大葱标准样品,由地球物理地球化学勘查研究所提供。水稻植株样品,由湖南省水稻研究所提供。
主要仪器:FP6410型火焰光度计(上海精密科学仪器有限公司),Mars6型微波消解仪(美国CEM公司),ELGA型超纯水机(莱特莱德北京纯水设备技术股份有限公司),AUX120型电子天平(日本岛津)。
主要试剂:浓硝酸、过氧化氢、氢氟酸、浓硫酸、硼酸均为国药集团化学试剂有限公司生产(500 mL装),分析纯。氯化钾为工作基准物质,天津市科密欧化学试剂开发中心生产。试验中所用的水均为去离子水。
标准使用液的配制:按GB/T602-2002的方法配制,将氯化钾于烘箱中110~120 ℃干燥2 h,冷却至室温精确称取1.906 8 g溶于水中,并移入1 000 mL容量瓶定容,此溶液为1 000 μg/mL的钾标准储备液。准确移取10 mL钾标准储备液,用水定容至100 mL,此溶液为100 μg/mL的钾标准使用液。
1.2 试验方法
1.2.1 样品的预处理 称取植物粉碎试样0.2 g(精确到0.000 1 g)于聚四氟乙烯罐中,加入一定量的酸系,通风柜中预消解30 min后旋紧盖子,放入微波消解仪中,通过试验确定微波消解酸系、最高温度及其保持时间等最佳消解条件。消解完成后赶酸,待消解罐中无黄色气体冒出时,取出冷却,而后全部转移至50 mL容量瓶中,用去离子水定容,待测,同时做空白试验。
1.2.2 标准曲线的绘制 准确吸取100 μg/mL钾标准使用液0.00、2.50、5.00、7.50、10.00 mL至50 mL容量瓶中,用去离子水稀释至刻度,即为0.0、5.0、10.0、15.0、20.0 μg/mL钾标准系列溶液。
1.2.3 样品的测定 根据FP6410型火焰光度计的工作条件,适当稀释待测样品溶液,以浓度直读方式测定标样,仪器自动进行校准曲线方程计算,以测定待测样品中钾的浓度。
1.2.4 数据处理 用Micorsoft Excel 2007进行数据分析。
2 结果与分析
2.1 微波消解条件的优化
建立对一种试样的微波消解方法,主要从5个方面去探讨[10,11],分别是样品的称样量、消解试剂选择、消解的功率、消解的最高温度及最高温度保持时间。称样量主要取决于试样的类型及待测元素含量的高低。本研究样品为植物粉碎样品,含有较多的有机成分,样品在消解过程中会产生较多的气体,故取样量不能太大,同时考虑到CEM公司的要求,有机样品不得超过0.5 g,本试验选择称样量0.2 g(精确至0.000 1 g)。微波消解功率有具体的要求,需要根据反应罐使用数量来选择,因此本研究仅从消解试剂、消解的最高温度及最高温度保持时间方面进行优化试验。
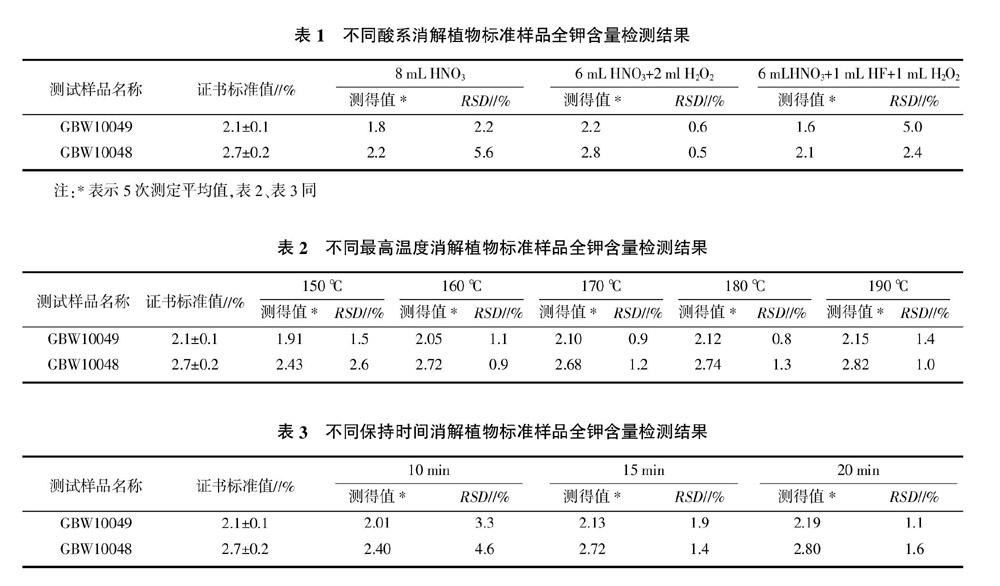
2.1.1 消解试剂的选择 关于微波消解所用试剂的报道很多,谭和平等[4]、代春吉等[10]、姜波等[12]、潘齐存等[13]提出采用HNO3-H2O2,梁冬丽等[14]提出采用HNO3-H2O2-HCl,许刚等[15]、聂根新等[16]提出采用HNO3-HClO4,杨敏文等[17]提出采用HNO3-HClO4-HCl-HF,加酸种类、剂量及消解方式各有不同。硝酸有很强的氧化性,可与许多金属形成易溶的硝酸盐,而且硝酸是良好的微波吸收体[10],经常用于微波消解;过氧化氢是一种弱酸性氧化剂,与硝酸共用可大大提高混合液的氧化能力;氢氟酸往往与其他酸一起用于分解含硅及硅酸盐的样品;高氯酸是强氧化性酸,与有机物反应迅速,有时有爆炸的危险,一般不用于微波消解;浓硫酸沸点高,有形成难于被破坏的炭化残渣的倾向,并且与碱土金属及铅等形成不溶解性化合物,这些沉淀有吸附损失,而浓盐酸的氧化性不强,所以一般不选用浓硫酸和浓盐酸做消解试剂[11]。本研究选择了3种酸系:HNO3、HNO3-H2O2、HNO3-H2O2-HF。酸的用量要根据样品的称量和消解的难易程度,以完成消解即可,同时根据仪器的要求,溶液量不少于8 mL,从环保和节约成本考虑用酸量选择8 mL。微波消解最高温度采用仪器推荐180 ℃,保持时间20 min,試验结果见表1。6 mL HNO3+2 mL H2O2消解的标准样品测得值均在其证书标值范围内,方法相对标准偏差(RSD)为0.5%~0.6%,符合试验要求。而HNO3、HNO3-H2O2-HF酸系消解的标准样品测得值低于证书标值范围,单独用HNO3消解可能消解不够完全,导致结果偏低;HNO3-H2O2-HF酸系从理论上增加HF可以分解植物样品中的硅酸盐,植物样品得到更充分的消解,而实际结果偏低,可能是酸的比例不合适、残留的HF没有中和完全、或者其他原因的影响,还有待做进一步的研究。
2.1.2 微波消解温度的选择 要使样品消解完全,微波消解程序中最高温度设置较为重要。消解温度过低会导致样品不完全消解,造成样品测定结果的精密度和准确度较差。消解温度过高会导致反应剧烈,产生大量的气体而使消解罐压力骤升,同时也造成不必要的能源浪费。本研究选择了150、160、170、180、190 ℃进行比较,酸系选择6 mL HNO3+2 mL H2O2,保持时间20 min,每个样品做5次重复,试验结果见表2。当消解温度设置在160 ℃温度时样品已消解完全,测定值在标值范围之内,160 ℃以上测得值差别不大,都在证书标准值范围内。从节能方面考虑,选择消解最高温度为160 ℃。
2.1.3 微波消解保持时间的选择 最高温度保持时间是微波消解的另一个重要因素,本研究选择了10、15、20 min进行比较,酸系采用6 mL HNO3+2 mL H2O2、消解最高温度180 ℃,试验结果见表3。保持10 min,样品检测结果低于标值范围,消解不完全;保持15 min的样品检测结果在标值范围内,消解完全;保持20 min的检测结果与15 min相差不明显。从节能和节省时间考虑,本研究选择最高温度保持时间15 min。
2.2 方法的验证
本试验选择6 mL HNO3+2 mL H2O2为消解试剂,消解温度设定为160 ℃,保持时间15 min,优化后的微波消解程序如表4。从方法的检出限、准确度、精密度和回收率来验证方法的可靠性。
2.2.1 方法的檢出限 使用优化后的消解程序重复测定样品空白溶液11次,取3倍标准偏差值为相应方法的检出限。重复测定结果的标准偏差为0.003 01 μg/mL,方法检出限为0.009 μg/mL, 当植株样取样量为0.200 0 g,定容体积为50 mL,火焰光度计法测定植物中钾的最低检出浓度为0.002 mg/g,满足试验要求。
2.2.2 方法的准确度和精密度 使用优化后的消解程序对GBW10048芹菜标准样品和GBW10049大葱标准样品分别进行了6次平行测定,结果见表5。样品测得值均在其证书标值范围内,方法相对标准偏差(RSD)为0.97%和1.10%,说明该方法具有较高的准确度和精密度,检测结果可靠。
2.2.3 样品的加标回收率 分别称取水稻根、茎、叶、穗样品各9份,按照本底值的0.8、1.0、1.2倍分别加入钾标准样品,每个处理做3个重复,使用优化后的微波消解程序测定钾含量,计算加标回收率见表6。钾的加标回收率为97.5%~103.0%,相对标准偏差为0.63%~2.27%,表明优化后的微波消解方法是准确可靠的。
3 结论
建立的微波消解技术解决了传统方法预处理时间长、样品容易污染、操作复杂等问题;使用火焰光度计检测成本较低、操作简单安全、结果准确。虽然前人运用微波消解测定植物中的钾做了一些研究[11-14],但鲜有对酸系进行对比试验,也鲜有对微波消解条件进行优化试验,本研究在前人的研究基础上,选择量少的酸系进行对比试验,且对微波消解条件进行了优化试验;试验样品也囊括了水稻植株的根、茎、叶、穗各个部位,有一定的代表性,为植物全钾的分析测试工作提供了一定的试验数据和理论依据。但植物样品种类繁多,是否所有样品可以按照这个方法进行检测还需做进一步的探索。
参考文献:
[1] LINCOLN T,EDUARDO Z.植物生理学[M].北京:科学出版社,2015.
[2] NY/T 2017-2011,植物中氮、磷、钾的测定[S].
[3] 胡友波,李东刚,孙长华,等.电感耦合等离子体发射光谱法分析小麦粉制品中的K、Na、Ca、Mg、A1、Ti[J].化学分析计量,2011,20(1):29-31.
[4] 谭和平,张玉兰,高 杨,等.微波消解-ICP-AES法测定茶叶中钾、钠、磷、硫、铁、锰、铜、锌、钙、镁方法研究[J].中国测试,2012,38(6):34-37.
[5] 陈福强.微波消解-电感耦合等离子体质谱法同时测定植物样品中的Cu、Pb、Zn、Cd、Ni、Cr、As、Hg[J].资源节约与环保,2017(7):41-42.
[6] 曹 璨,吴志刚.微波消解-ICP-MS法同时测定营养素补充剂中20种元素[J].分析仪器,2017(3):67-72.
[7] 雷震勇,孙国强.改进的火焰光度计控制系统[J].光学仪器,2013, 35(1):80-83.
[8] 张国民.影响火焰光度计稳定度的原因及解决方法[J].化学分析计量,1999,8(2):21-22.
[9] 高英华.微波消解技术在环境化学分析中的应用[J].生物技术世界,2016(5):50-51.
[10] 代春吉,董文宾.微波消解在测定食品中微量元素的应用[J].食品科技,2005(12):64-66.
[11] 刘灿平,方 亚.微波消解技术在元素分析方面的应用[J].安徽预防医学杂志,2003,9(4):252-253.
[12] 姜 波,姜国斌,刘长建,等.微波消解-AAS法分析银杏叶中金属元素[J].光谱学与光谱分析,2010,30(3):812-815.
[13] 潘齐存,周朝生,蔡景波,等.微波消解-空气乙炔火焰原子吸收分光光度法测定紫菜中11种微量元素[J].浙江农业科学,2014(10):1596-1598.
[14] 梁冬丽,梁宏合.微波消解-火焰光度法测定植物中全钾的研究[J].广西热带农业,2010(4):24-26.
[15] 许 刚,邢文会.微波消化技术在植物中测定微量元素的研究[J].中国卫生检验杂志,1999,9(4):250-253.
[16] 聂根新,罗林广,何宽信,等.微波消解-原子吸收法测定烟叶中铜铁锰锌钙镁钾含量[J].江西农业学报,2004,16(2):43-45.
[17] 杨敏文,葛明菊,马国芳,等.微波消解-火焰光度法测定叶片中钾和钠含量[J].光谱实验室,2002,19(6):800-803.

