三种促排卵方案在高龄合并卵巢储备功能减退不孕症中的应用比较
赵海君,张皙卉,陈静,卢静,张洪峰,常文亮
随着二孩和三孩政策实施、生活节奏加快,女性生育年龄不断延迟。35岁后女性生育功能迅速下降,常合并卵巢储备功能减退(diminished ovarian r eserve,DOR),出现卵子数量和质量下降,胚胎发育潜能降低。生殖领域常把女性年龄≥35岁称为高龄。高龄患者行体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)治疗时常有获卵少、可利用胚胎不足的情况,周期取消率高,治疗结局不理想[1-2]。目前尚无高龄导致生育功能衰退的特效治疗。开展个性化促排卵方案,最大限度地利用卵巢储备,是高龄不孕患者的最佳治疗策略[3]。对于DOR患者,临床常用的促排卵方案有微刺激方案和促性腺激素释放激素拮抗剂(gonadotropin releasing hormone antagonist,GnRHA)方案。近年来,高孕激素状态下促排卵(progestin-primed ovarian stimulation,PPOS)方案在高龄患者中应用增多。但哪种方案疗效最佳尚有争议。本研究回顾性分析高龄合并DOR患者行IVF/卵细胞质内单精子注射(intracytoplasmic sperm injection,ICSI)治疗周期资料,比较微刺激方案、GnRHA方案和PPOS方案一次药物刺激卵巢取卵后形成的胚胎进行移植后的治疗结局,探索高龄DOR患者最佳的促排卵方案。
1 对象与方法
1.1 研究对象选取2016年6月—2020年1月于邯郸市中心医院生殖医学科行IVF/ICSI助孕的高龄(35~43岁)DOR患者,共纳入186个周期。根据促排卵方案分为PPOS组(n=61)、微刺激组(n=65)和拮抗剂组(n=60)。纳入标准[4]:①抗苗勒管激素(anti-Müllerian hormone,AMH)<1.1 ng/mL;②基础卵泡刺激素(follicle-stimulating hormone,FSH)≥10 U/L;③双侧卵巢窦卵泡计数(antral follicle count,AFC)<7个,符合以上3条中的任一条。排除标准:①多囊卵巢综合征等内分泌疾病;②夫妻任何一方存在染色体异常;③合并子宫畸形、未经治疗的子宫内膜病变、严重的子宫腺肌病等影响IVF/ICSI妊娠结局的疾病;④合并全身性疾病。本研究获医院伦理委员会批准,患者及家属在治疗前均知情同意。
1.2 促排卵方案
1.2.1 PPOS方案 于月经来潮第2天开始口服地屈孕酮(达芙通,荷兰苏威制药有限公司)20 mg/d,并注射人绝经期促性腺激素(human menopausal gonadotropin,HMG,乐宝得,丽珠集团丽珠制药厂)150~225 U/d。定期检查血清性激素水平和卵泡直径,根据卵巢反应调整促性腺激素(gonadotropin,Gn)用量,直至人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)日。
1.2.2 微刺激方案 月经来潮第2~3天开始口服枸橼酸氯米芬(法地兰,塞浦路斯高特制药有限公司)100 mg/d,3 d后加用HMG,起始剂量150~225 U/d。根据卵巢反应调整Gn用量,持续用药至hCG日。
1.2.3 GnRHA方案 月经来潮第2~3天开始注射HMG 150~225 U/d,适时调整用量。当优势卵泡直径达14 mm或黄体生成素(luteinizing hormone,LH)>10 U/L或卵泡直径达12 mm且雌二醇(estradiol,E2)水平达1 101 pmol/L(300 pg/mL)时,皮下注射醋酸西曲瑞克(思则凯,Pierre Fabre Medicament Production,Aquitaine Pharm International)0.25 mg/d,直至hCG日。
1.3 取卵及IVF/ICSI-ET当主导卵泡发育至有1~2枚直径达18 mm,给予hCG(丽珠集团丽珠制药厂)5 000~10 000 U或重组hCG(艾泽,德国默克雪兰诺有限公司)250μg,36~38 h后行经阴道超声引导下穿刺取卵术。根据男方精子情况行IVF/ICSI授精,加入精子16~18 h后在倒置显微镜下观察卵子原核和极体,确认受精情况。正常受精第3天胚胎卵裂球数≥6个、细胞碎片比例≤25%的胚胎为可利用胚胎[5],其中有7~9个卵裂球、大小符合发育阶段、碎片<10%、无多核化的胚胎为优质胚胎[6]。微刺激组和拮抗剂组患者在取卵后3天常规行新鲜胚胎移植,若有以下情况之一则行全胚冷冻:①子宫内膜厚度≤6 mm;②hCG日孕酮水平>4.77 nmol/L(1.5 ng/mL);③宫腔积液或宫腔粘连;④患者合并其他全身症状不宜行新鲜胚胎移植。PPOS组均行全胚冷冻。冻融胚胎移植(frozenthawed embryo transfer,FET)采用激素替代周期、自然周期或促排卵周期等方案行内膜准备。新鲜胚胎移植及FET每次移植1~2枚胚胎,至少含1枚优质胚胎,术后均按常规给予黄体支持。所有移植患者均随访至妊娠结束。移植后28~35 d超声检查见妊娠囊者为临床妊娠,包括宫内妊娠和异位妊娠。妊娠28周后出生至少1个存活婴儿为活产。
1.4 观察指标①一般情况指标:记录女方年龄、不孕时间、体质量指数(body mass index,BMI)、AMH、基础FSH、基础LH,基础E2和AFC。②促排卵和胚胎情况指标:Gn时间、Gn用量、hCG日E2、hCG日LH、获卵数、成熟卵率、双原核(two pronucleus,2PN)受精率、2PN卵裂率、优质胚胎率和周期取消率。③妊娠结局指标:FET周期率、种植率、累积妊娠率和累积活产率。
计算公式:成熟卵率=成熟卵母细胞数/总卵母细胞数×100%;2PN受精率=2PN受精卵数/总卵母细胞数×100%;2PN卵裂率=2PN卵裂数/2PN受精卵数×100%;优质胚胎率=优质胚胎数/2PN卵裂数×100%;周期取消率=无可利用胚胎周期数(包括未取卵、未获卵等各种原因无可利用胚胎的周期)/促排卵周期数×100%,周期取消率的计算不纳入因全胚冷冻未行新鲜胚胎移植的周期;FET周期率=FET周期数/取卵周期数×100%;种植率=着床胚胎总数/移植胚胎总数×100%;累积妊娠率=累积妊娠周期数(包括取卵周期新鲜胚胎移植与FET后首次获得的临床妊娠)/取卵周期数×100%,剩余未达到妊娠,仍处于冷冻状态的胚胎不计入累积妊娠率;累积活产率=累积活产周期数(包括取卵周期新鲜胚胎移植与FET后首次获得的活产)/取卵周期数×100%。
1.5 统计学方法使用SPSS 25.0软件进行数据分析。符合正态分布的定量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析,多组间两两比较用LSD-t检验;不符合正态分布的定量资料以中位数和四分位数[M(P25,P75)]表示,组间比较及两两比较用Kruskal-WallisH检验。定性资料用例(%)表示,组间比较采用χ2检验或Fisher确切概率法,P<0.05为差异有统计学意义。组间两两比较采用Bonferroni法校正检验水准,校正后的检验水准α=0.017。
2 结果
2.1 一般情况比较3组患者的年龄、不孕时间、BMI、基础FSH、基础LH、基础E2、AMH和AFC比较,差异均无统计学意义(均P>0.05)。见表1。
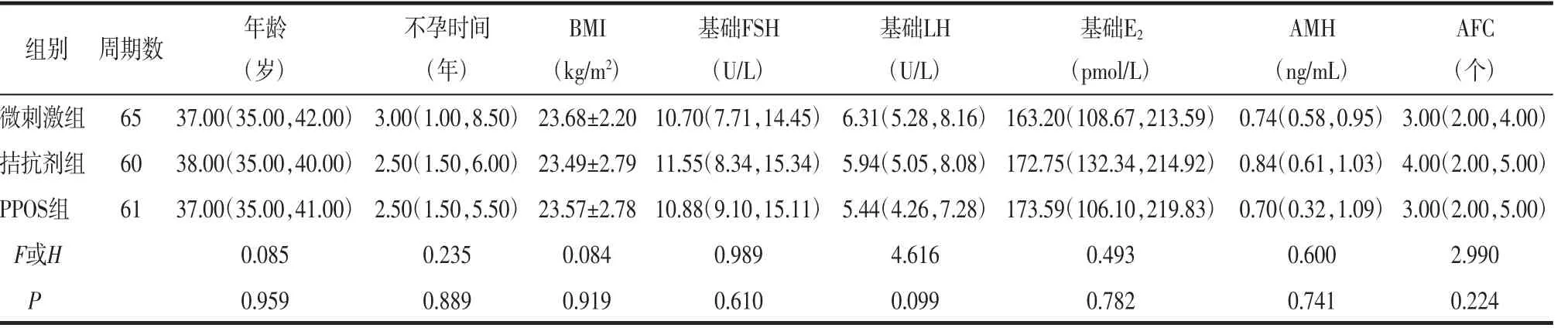
表1 患者一般情况比较
2.2 3组患者促排卵和胚胎情况比较3组Gn时间、Gn用量、hCG日E2水平、hCG日LH水平、获卵数、可利用胚胎数、优质胚胎数和周期取消率比较,差异均有统计学意义(均P<0.05);3组成熟卵率、2PN受精率、2PN卵裂率和优质胚胎率比较,差异均无统计学意义(均P>0.05)。进一步两两比较显示,与微刺激组相比,PPOS组和拮抗剂组Gn时间延长,Gn用量增加,hCG日E2水平升高,获卵数、可利用胚胎数和优质胚胎数增加,周期取消率降低(均P<0.05)。微刺激组hCG日LH水平较另外2组高,与拮抗剂组比较差异有统计学意义(P<0.05),与PPOS组比较差异无统计学意义(P>0.05)。见表2。
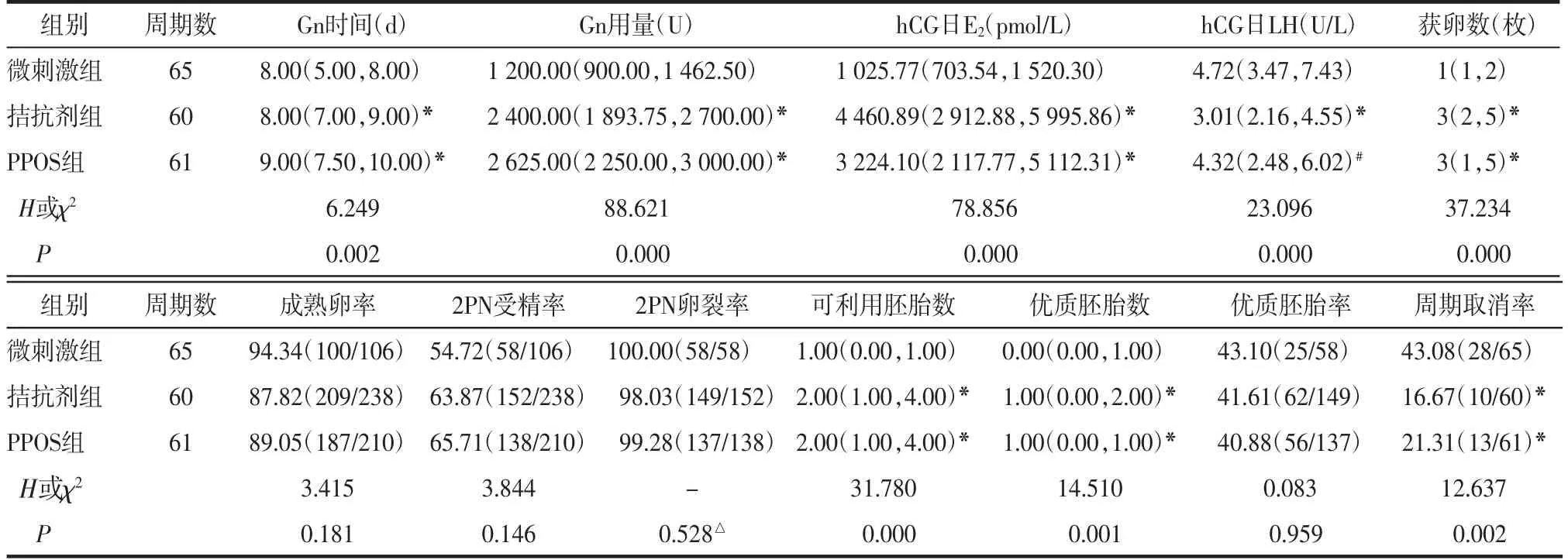
表2 3组患者促排卵和胚胎情况比较
2.3 3组患者临床妊娠结局比较3组FET周期率、累积妊娠率和累积活产率比较差异均有统计学意义(均P<0.05);3组胚胎种植率比较差异无统计学意义(P>0.05)。进一步两两比较显示,PPOS组FET周期率较另外2组升高,拮抗剂组FET周期率较微刺激组升高(均P<0.05)。与微刺激组比较,PPOS组和拮抗剂组累积妊娠率和累积活产率均明显升高,差异有统计学意义(均P<0.05)。见表3。
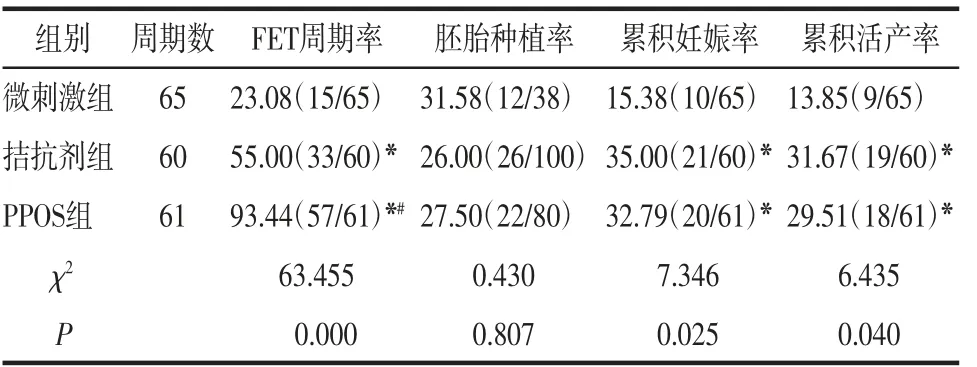
表3 3组患者临床妊娠结局比较 %(n/n)
3 讨论
3.1 DOR患者助孕现状DOR患者AFC减少,卵母细胞质量下降,IVF治疗中常出现卵巢低反应、卵泡生长不齐、未获卵及无可利用胚胎等情况,导致妊娠率低下[4]。研究显示DOR患者较其他患者IVF-ET活产率降低40%~50%[7]。女性在35岁之后流产率明显升高,从35岁时的约10%升高到44岁时的峰值65%;活产率明显降低,<35岁女性的每起始周期活产率为40.1%,>42岁女性为4.5%[8]。随着年龄增加,胚胎非整倍体率增加,胚胎-子宫内膜发育不同步增多,妊娠率降低,反复种植失败增多。卵母细胞采集时的年龄是FET周期生化妊娠的决定因素之一,分娩率也受到母体年龄的影响[9]。DOR妇女因胚胎染色体异常导致IVF流产率升高的风险可提早到32岁[10]。
3.2 DOR患者促排卵方案高龄DOR患者的最佳促排卵方案尚未明确。与传统激动剂方案相比,微刺激、拮抗剂和PPOS方案操作简单,周期较短,常用于DOR患者。微刺激方案采用枸橼酸氯米芬竞争性结合下丘脑垂体雌激素受体,阻断内源性雌激素对下丘脑垂体的负反馈调节,导致GnRH的分泌增多,增加垂体Gn的释放。拮抗剂方案在促排卵过程中内源性LH峰出现前直接给予GnRHA,其与GnRH受体结合快速抑制LH产生,避免早发LH峰导致的卵泡逃逸和黄素化[11]。PPOS方案由我国学者匡延平团队建立,通过早卵泡期外源性添加孕激素抑制垂体分泌的LH峰,达到控制性促排卵的目的[12]。本研究发现与微刺激方案相比,PPOS方案和拮抗剂方案临床结局显著改善,而两者之间临床结局相似。
3.3 3种促排卵方案优劣 Gn用量多并不一定能改善IVF-ET的临床结局。微刺激方案对卵巢刺激小,有助于获得质量最佳的可利用卵母细胞及胚胎。同时卵巢过度刺激综合征和静脉血栓栓塞发生风险降低,安全性提高。但微刺激方案没有垂体降调节过程,容易引起早发LH峰,导致卵泡逃逸、获卵数降低,因未获卵、无可利用胚胎所致的周期取消率增加,因此微刺激方案常需反复刺激卵巢,患者接受度下降[13]。与微刺激方案相比,拮抗剂方案可增加获卵数、胚胎数和新鲜胚胎种植率,同时降低周期取消率[14]。而在受精率、临床妊娠率和流产率方面,常规方案(长方案、短方案、拮抗剂方案)与微刺激方案之间并无显著差异[15]。与PPOS方案比较,DOR患者应用微刺激方案的获卵数和可移植胚胎数减少,周期取消率增加,Gn时间和Gn用量较少[16]。本研究也发现,与微刺激方案相比,PPOS方案和拮抗剂方案Gn时间延长,Gn用量增加,获卵数、可利用胚胎数及优质胚胎数增加,周期取消率降低。与微刺激方案相比,PPOS方案和拮抗剂方案有更多的冷冻胚胎用于后期FET,FET周期率明显升高。拮抗剂方案可选择新鲜胚胎移植或FET助孕,而PPOS方案只能通过FET助孕,因此PPOS方案FET周期率高达93.44%。从胚胎的利用效能来看,不管是新鲜胚胎移植还是FET,终极目的是胚胎移植后获得临床妊娠和活产。与微刺激方案相比,拮抗剂方案和PPOS方案均可获得较高的累积妊娠率和累积活产率,二者的胚胎利用效能相似。
3.4 PPOS方案和拮抗剂方案临床结局相似与拮抗剂方案相比,PPOS方案不能行新鲜胚胎移植,必须先行全胚冷冻。因此有研究建议,对于高龄DOR患者,可利用拮抗剂方案新鲜胚胎移植的优势,缩短达到妊娠的时间[17]。但也有研究认为PPOS方案能更好地控制早发LH峰,在成熟卵母细胞率、受精率及优质胚胎率方面表现更佳[18],同时现在成熟的胚胎冷冻、解冻技术,PPOS方案结合FET也是卵巢反应低下人群较好的选择。本研究显示,PPOS方案的获卵数、2PN受精率、2PN卵裂率、优质胚胎率、周期取消率与拮抗剂方案相似。PPOS方案虽不能行新鲜胚胎移植,但通过FET周期最终可达到与拮抗剂方案相似的累积妊娠率和累积活产率。
综上所述,本研究发现PPOS方案和拮抗剂方案均可使高龄DOR患者IVF/ICSI-ET治疗获得较好的妊娠结局,可以在DOR患者中酌情使用。本研究是回顾性分析且样本量偏小,需要扩大样本量进行多中心、随机对照研究,进一步探讨各促排卵方案的优劣。

