红托竹荪菌种快速分离培养基优化
陈 飞, 韩 冰, 于广峰, 钟丽娟, 柴林山, 郭玲玲
(辽宁省微生物科学研究院,辽宁 朝阳 122000)
红托竹荪(Dictyophorarubrovolvata)属真菌界担子菌亚门(Basidiomycotina)腹菌纲(Gasteromycetes)鬼笔目(Phallales)鬼笔科(Phallaceae)竹荪属(Dictyophora),是一种名贵食药两用真菌。因其外形有一层独特的形如伞状的菌裙,有“雪裙仙子”之称,被誉为菌中皇后。红托竹荪子实体和竹荪蛋中富含大量的氨基酸、蛋白质、维生素等营养物质[1-2],具有抗氧化、抗糖化、抗肿瘤、降血糖、抗衰老、抗疲劳和免疫调节等生物活性[3],口感清鲜脆嫩、风味独特,营养丰富,受到广大消费者的喜爱,有很高的经济价值和药用价值,自古就被列为“草八珍”之一[4-7]。随着红托竹荪市场需求的扩大,提高产量和提升品质成为红托竹荪产业面临的主要问题,而筛选高产优质的红托竹荪菌种是解决问题的有效方法[8-12]。本研究依据红托竹荪菌种生长过程营养需求,制备红托竹荪菌种快速分离培养基,并通过响应面法进行培养基优化,优化的红托竹荪菌种快速分离培养基不仅可以提高红托竹荪组织分离菌种生长速度,缩短时间、提高菌种分离效率,还可以满足红托竹荪菌种对淀粉、木质素、纤维素等营养需求,强壮红托竹荪菌丝,可根据培养菌丝过程中形成的透明圈大小判定菌种胞外酶产生能力,达到快速评价菌种质量的目的。
1 材料与方法
1.1 材料
1.1.1 菌种 菌种由红托竹荪(Dictyophorarubrovolvata)竹蛋组织分离获得,竹蛋采自辽宁蘑磨达食用菌科技有限公司工厂化栽培基地。
1.1.2 培养基 PDA培养基:马铃薯(去皮) 200.0 g,放入蒸馏水1 000 mL煮沸20 min,过滤,取滤液,蒸馏水补足1 000 mL,加入葡萄糖 20.0 g,琼脂 18.0 g,pH值自然;快速分离培养基:取大小为(0.3~0.5) cm ×(0.3~0.5) cm的1 kg木屑加入10 L蒸馏水,煮沸30 min,过滤得木屑水,将200 g土豆切片置于木屑水中,煮沸20~30 min,取滤液用蒸馏水按照实验要求补足用量;按试验设计,称取不同量的葡萄糖、全麦粉、玉米粉添加入培养基中,文火将18%琼脂粉融化后装入500 mL三角瓶中,装量为300 mL/瓶,121 ℃灭菌20 min,冷却至35 ℃,分装一次性培养皿(直径9 cm),冷却备用。菌种木屑培养料:将制备木屑水后收集的木屑按照粗木屑70%、细木屑15%、玉米粉10%、全麦粉5%配比(质量分数),含水量60%~65%配制红托竹荪木屑菌种培养料,将培养料装入500 mL玻璃菌种瓶中,装料至瓶口2~3 cm,用带有透气口的塑料瓶盖封口,121 ℃灭菌120 min,冷却后备用。
1.1.3 主要试剂与仪器设备 葡萄糖(分析纯,沈阳新兴试剂厂);琼脂(北京奥博星生物技术有限责任公司);木屑、全麦粉、玉米粉等购自辽宁蘑蘑达食用菌科技有限公司。生物安全柜(HFsafe1200,上海力申科学仪器有限公司);显微镜(Nikon EcLIPSE Ci,上海通灏光电科技有限公司);自动菌落计数分析仪(Shineso,杭州迅数科技有限公司);冰箱(BCD-649WADV,青岛海尔股份有限公司);立式高压蒸汽灭菌器(LDZX-75KBS,上海申安医疗器械厂);电热鼓风干燥箱(DHG-9240A,上海一恒科学仪器有限公司)。
1.2 方法
1.2.1 红托竹荪菌种分离 无菌条件下,用灭菌器具取(0.4~0.6) cm×(0.4~0.6) cm竹蛋内白色组织接种至红托竹荪菌种木屑培养基中,25 ℃培养30 d,取木屑菌种做为红托竹荪菌种快速分离培养基配方优化菌种[12-13]。
1.2.2 红托竹荪菌种快速分离培养基优化 选择葡萄糖(A)、全麦粉(B)、玉米粉(C)、木屑水(D)4个因素进行考察,每个因素取上限(+1)、下限(-1)2个水平,试验因素与水平设计见表1。以红托竹荪菌种菌丝生长速度为响应值,通过Design-Expert 8.0.6软件设计四因素三水平显著影响因素的Box-Behnken响应面试验[16-19],测定菌丝生长速度,对红托竹荪菌丝生长速度(mm/d)进行二次多元回归方程拟合,得到各因素与响应值之间函数关系的回归方程,根据生成响应面图确定最优的培养基配方(表2)。

表1 试验因素与水平设计

表2 Box-Benhnken 实验设计及结果
1.2.3 快速分离培养基验证试验 将按照Design-Expert 8.0.6响应面优化的红托竹荪菌种快速分离培养基与PDA培养基对比并进行木屑培养基培养试验,验证该方程拟合度。①快速分离培养基与PDA培养基对比试验:取1.2.1中红托竹荪木屑菌种块(0.3×0.3) cm ~ (0.5×0.5) cm,接种于PDA培养基、菌种快速分离优化培养基中,每皿培养基接种3个木屑菌种块,3个接种点呈等边三角形,接种点距离培养皿边缘0.8~1.0 cm,每种培养基3次重复,25 ℃恒温培养36
d[20],利用Shineso MF5&MF6数据分析平台,采用十字交叉方法测定菌落直径,按照菌丝生长速率(mm/d)=菌落平均直径(mm)/培养时间(d),计算不同培养基菌丝生长速度;在Nikon EcLIPSE Ci 显微镜20倍目镜40倍物镜条件下,利用NIS-Elements D数据平台观察菌丝状态及锁状联合,并用测微尺测定菌丝直径;在Shineso自动菌落计数分析仪白色底光下,观察菌落形态。②木屑培养基培养试验:取1.2.3①中同一个培养皿3个接种点接种到同一瓶木屑培养基中,利用划线法测定PDA培养基、快速分离培养基培养的菌丝在木屑培养基25 ℃恒温培养10 d的生长速度。木屑培养基菌丝生长速度(mm/d)=菌丝长度(mm)/培养时间(d)。
2 结果与分析
2.1 红托竹荪菌种快速分离培养基优化
2.1.1 模型建立及显著性分析 以红托竹荪菌丝生长的菌落直径为响应值,运用Box-Benhnken设计29 组试验。Box-Benhnken 试验设计及结果见表2。
用Design-Expert 8.0.6软件对表2的结果进行多元回归拟合,得到回归方程:Y=24.56+0.64A+0.82B+0.34C+0.90D+0.30AB+0.55AC-0.088AD-0.42BC+0.38BD-0.13CD-1.07A2-1.26B2-1.48C2-0.79D2。
该模型的决定系数R2=0.970 2,校正决定系数 AdjR2=0.940 3,说明实际值和预测值拟合度比较好。由表3可以看出,该回归模型P<0.000 1,表明此二次模型极显著,失拟项的P=0.383 1>0.05,模型失拟项不显著,说明无失拟因素存在,表明该模型在统计学上有意义。模型中 A、B、D、A2、B2、C2、D2的P<0.01,表明这些项对红托竹荪菌丝生长速度影响极显著。C的P<0.05,表明对红托竹荪菌丝生长速度的影响显著。

表3 Box-Benhnken 试验方差分析
从对红托竹荪菌丝生长速度影响分析看,一次项A、B、D均达到极显著水平,C达到显著水平影响,影响顺序为D(木屑水)>B(全麦粉)>A(葡萄糖)>C(玉米粉)。最后得到的优化培养基配方:葡萄糖20.71 g/L,全麦粉8.36 g/L,玉米粉8.07 g/L,琼脂粉18.00 g/L,木屑水1.06 L,预见25 ℃恒温培养,最大生长速度为0.62 mm/d。
2.1.2 响应面交互作用分析 通过Design-Expert 8.0.6软件,得到两因素交互作用的3D响应面曲线(图1)。可以看出两因素之间的交互作用时,其中一个因素固定,随着另一个因素的增加,红托竹荪菌丝生长速度均呈现先增加后降低的趋势。曲面倾斜度越大,越接近曲面顶端颜色愈深,表示作用越明显,说明相关两因素交互作用显著,曲面的变化相对平缓,说明相关两因素交互作用不明显。
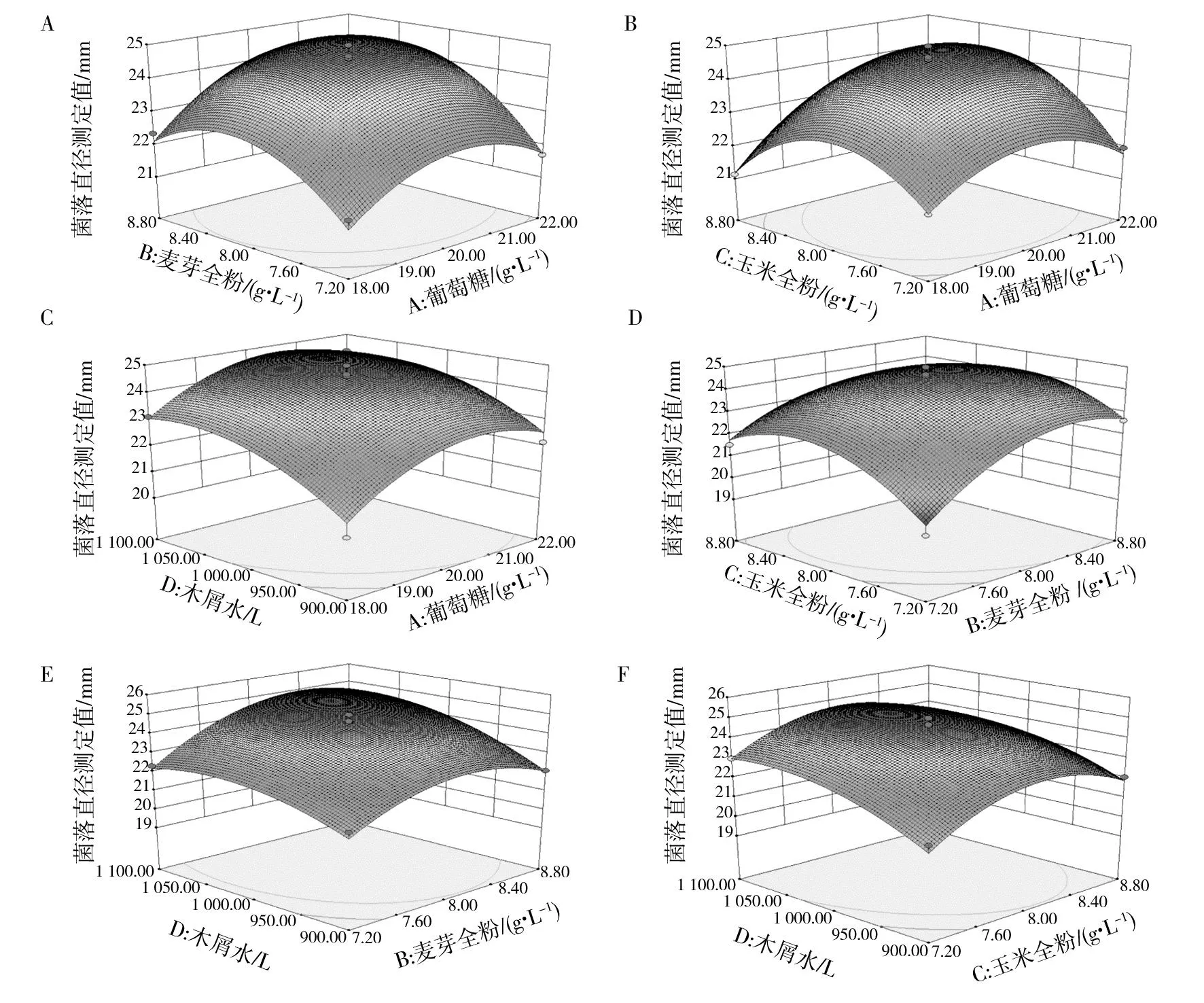
图1 快速分离培养基条件下的 3D 响应面图Fig.1 3D response surface curve under optimal fermentationconditionsA:A~B因素交互响应曲面;B:A~C因素交互响应曲面;C: A~D因素交互响应曲面;D:B~C因素交互响应曲面;E:B~D因素交互响应曲面;F: C~D因素交互响应曲面A:Response surface stereogram for factors of A and B; B:Response surface stereogram for factors of A and C;C:Response surface stereogram for factors of A and D; D:Response surface stereogram for factors of B and C;E:Response surface stereogram for factors of B and D; F:Response surface stereogram for factors of C and D
2.2 快速分离培养基验证试验
2.2.1 PDA培养基、快速分离培养基锁状联合观察及菌丝状态(菌丝直径)测定 在Nikon EcLIPSE Ci 显微镜20倍目镜40倍物镜条件下,利用NIS-Elements D数据平台观察菌丝状态及锁状联合,并用测微尺测定菌丝直径(图2、图3和表4)。图2和图3中“O”标记分别为显微观察菌丝锁状联合和菌丝直径测定结果。两种培养基培养的菌丝均可形成锁状联合;通过测微尺测定菌丝直径,快速分离培养基培养的菌丝直径均大于PDA固体培养基,菌丝平均直径增加66.25%。

图2 PDA培养基与快速分离培养基锁状联合显微观察结果Fig.2 Combined microscopic observation of PDA medium and rapid culture separation mediumA:PDA培养基; B:菌种快速分离培养基A:PDA medium; B:Rapid culture separation medium

图3 PDA培养基与菌种快速分离培养基显微菌丝状态对比图
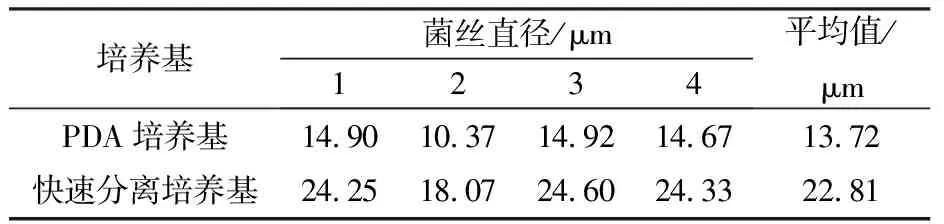
表4 PDA培养基与快速分离培养基的菌丝直径显微测定
2.2.2 PDA培养基、快速分离培养基菌丝生长速度测定 利用Shineso MF5&MF6数据分析平台,采用十字交叉方法测定菌落直径,按照菌丝生长速率=菌落平均直径(mm)/培养时间(d),25 ℃恒温培养36 d[20],计算不同培养基菌丝生长速度(表5)。根据菌丝生长速率=菌落平均直径(mm)/培养时间(d)计算PDA培养基与菌种快速分离培养基菌丝生长速度,PDA培养基0.45 mm/d,快速分离培养基0.6 mm/d,快速分离培养基菌丝生长速率提高33.33%。

表5 PDA培养基与菌种快速分离培养基平皿培养生长速度
2.2.3 PDA培养基、快速分离培养基培养菌落形态观察结果 在Shineso自动菌落计数分析仪白色底光下,观察菌落形态(图4),PDA培养基无透明圈形成,而快速分离培养基可以形成透明圈。

图4 PDA培养基与菌种快速分离培养基菌落形态(A)及透明圈(B)观察Fig.4 Observation of colony transparent circle in PDA medium and rapid isolation medium
2.2.4 木屑培养基菌丝生长速度测定结果 利用划线法测定PDA培养基、快速分离培养基培养的菌丝在木屑培养基中25 ℃恒温培养10 d的生长速度,分别为1.47 mm/d和2.12 mm/d(表6),快速分离培养基培养菌丝在木屑培养基中生长速度相比PDA培养基培养菌丝生长速度平均提高44.22%。

表6 两种培养基培养的菌丝在木屑培养基中培养10 d的生长速度Table 6 The growth rate of mycelia of 2 medium cultured in wood chips medium for 10 days
3 讨 论
食用菌菌丝生长不仅取决于菌种本身特性,还需要合适的培养条件,适合的培养基是提高菌种选育效率,提高菌种质量的基础[21]。红托竹荪与其他食用菌种类相比,生长较慢,生长周期长,原因可能是因为菌丝转接后,需要一定时间适应新的生长环境,即生长恢复期;适应新的环境后,营养物质丰富,菌丝快速生长,即生长旺盛期;待旺盛期后,营养物质减少,代谢产物的积累等导致菌丝活力减弱、生长速度逐渐下降[22]。
红托竹荪是木腐食用真菌,通过分解木质素等为自身的生长提供碳源、氮源[23]。为满足菌丝生长过程所需营养物质,使分离纯化菌丝快速适应生长环境,本研究将PDA固体培养基配制用水改为木屑水,同时在培养基内添加合适比例的全麦粉和玉米粉[24-25],培养基中含有的淀粉、纤维素、木质素等成分,在红托竹荪菌种生长过程中可刺激菌种分泌淀粉酶、纤维素酶、木质素酶等胞外酶,以维持胞外淀粉酶系、木质素酶系、纤维素酶系完整性[26-28],促进菌丝体旺盛生长,提高分离效率。本研究以菌丝生长速度、菌丝直径等为主要评价指标,通过响应面优化确定快速分离培养基最佳配方为葡萄糖20.71 g/L、全麦粉8.36 g/L、玉米粉8.07 g/L、琼脂粉18.00 g/L、木屑水1.06 L。优化的快速分离培养基菌丝直径平均增加66.25%,平皿培养菌丝日平均生长速度增加33.33%。将优化的快速分离培养基培养的红托竹荪菌种和PDA培养的红托竹荪菌种分别转接至相同配方的木屑培养基中,菌丝在木屑培养基中的生长速度明显提高,日平均生长速度增加44.22%,缩短了菌种生产周期,为提高红托竹荪菌种分离筛选效率奠定基础。另外,由于在培养基中形成透明圈[29-31],可根据透明圈大小判定菌种胞外酶产生能力,达到快速评价菌种质量,保障菌种质量的目的。

