沉默蜕皮激素受体对雌性中黑盲蝽生殖力的影响
黄星星, 郑宛莹, 薛 汇, 焦盼阳, 陈利珍
(华中农业大学植物科技学院, 昆虫资源利用与害虫可持续治理湖北省重点实验室,武汉 430070)
中黑盲蝽Adelphocorissuturalis属于半翅目Hemiptera盲蝽科Miridae,是我国棉花产区的一种重要害虫[1]。中黑盲蝽是杂食性昆虫,寄主范围广,主要有棉花Gossypium、大豆Glycinemax、苜蓿Medicagosativa等[2]。此外中黑盲蝽还可捕食棉蚜Aphisgossypii、烟粉虱Bemisiatabaci[3],以及小地老虎Agrotisipsilon、甜菜夜蛾Spodopteraexigua和棉铃虫Helicoverpaarmigera等昆虫的卵和幼虫[4-5]。
中黑盲蝽的生殖力受诸多因素的影响,如营养条件、寄主、温度等。用四季豆Phaseolusvulgaris单独饲养的中黑盲蝽,添加蜂蜜水饲喂后可增加其单雌产卵量和卵孵化率[6]。与取食苜蓿、大豆、常规棉和扁豆Lablabpurpureus的中黑盲蝽相比,取食四季豆和Bt棉的中黑盲蝽产卵量增加[7]。目前关于中黑盲蝽生殖调控的分子机制研究较少。研究发现脂肪酰辅酶A还原酶(fatty acyl-CoA reductase, FAR)在中黑盲蝽的生殖过程中发挥作用,干扰AsFAR基因后,雌虫卵巢挂卵量仅为对照组的64%、卵巢干重为对照组的54%、单雌产卵量是对照组的48%、卵孵化率减少72%,显著影响中黑盲蝽雌成虫的生殖力[8]。
蜕皮激素(molting hormone, 20E)在调节昆虫生殖中发挥重要作用,可以诱导脂肪体合成卵黄原蛋白(vitellogenin, Vg)[9]。在分子水平上,20E需要与蜕皮激素受体(ecdysone receptor,EcR)结合调控下游基因[10],而EcR需要与超气门蛋白(ultraspiracle, USP)形成异源二聚体才能与靶标基因上游的蜕皮激素响应元件(ecdysone response element, EcRE)结合[11]。家蚕Bombyxmori体内的核受体BmEcR和BmCFl(USP)形成异源二聚体后,与20E结合成为受体复合物,从而诱导E74、E75和BR-C等基因表达[12]。在埃及伊蚊Aedesaegypti中,20E受体复合物与20E受体复合物早期应答基因Board(Br)、E74编码的蛋白BR、E74b相互作用激活Vg的转录[13-14]。黑腹果蝇Drosophilamelanogaster体内EcR基因编码3种20E受体亚型,分别是EcR-A、EcR-B1和EcR-B2,不同亚型在不同发育阶段占主导地位[15]。埃及伊蚊中的EcR亚型AaEcR-B和AaEcR-A转录本对20E的敏感性存在显著差异,在其体内卵泡生成过程中具有不同的生理功能[16]。20E受体复合物早期应答基因Br、E74和E75的表达直接受20E受体复合物调控。E74属于E-twenty six(Ets)结构域转录因子家族,Ets蛋白已被证明是多细胞动物发育的关键因素,并在细胞增殖分化、组织发育以及昆虫发育等相关过程的基因转录调控中发挥重要作用[17]。E75基因在埃及伊蚊体内有3个亚型,分别是AaE75A、AaE75B、AaE75C。E75A是Vg表达的有效激活因子,而E75C是及时抑制该基因表达的关键。干扰E75A,可使Br-Z2表达量下降;而干扰E75B,则使Brc-Z2表达量上升[18]。在果蝇卵子发生过程中,E75、E74和Broad-Complex(BR-C)以发育时期特异性的方式表达,在E75突变的雌虫卵子发生中期出现卵子发育停滞和退化现象[19]。
中黑盲蝽是棉花上的一种重要害虫,但关于中黑盲蝽的生殖调控分子机制鲜有报道。在以往的研究中,昆虫生殖的分子调控机制主要包括昆虫保幼激素(juvenile hormone, JH)信号通路、20E信号通路和营养信号通路[20]。因此我们克隆了中黑盲蝽20E通路上的受体基因EcR和USP并进行了序列分析,同时使用RNAi方法研究EcR和USP对中黑盲蝽生殖的影响。为中黑盲蝽的生殖调控分子机制研究打下基础。
1 材料与方法
1.1 供试昆虫
中黑盲蝽采集于华中农业大学棉花基地,养殖方法参照陆宴辉等[21]的方法。饲养条件是温度(26±1)℃、相对湿度(75±5)%、光周期L∥D=16 h∥8 h。试虫养殖在塑料保鲜盒(20 cm×13 cm×8 cm)中,其中放入约0.3 cm宽的滤纸条,将中黑盲蝽接入后用医用纱布覆盖,防止逃逸。成虫的饲养:以四季豆为饲料并作为产卵基质,每隔2 d更换四季豆,保证饲料新鲜。四季豆使用前用0.5%的次氯酸钠溶液浸泡10 min,随后用流动的水冲洗30 min,晾干后存于4℃冰箱待用。若虫以绿豆Vignaradiata芽和鲜食甜玉米Zeamays为饲料饲养,每隔2 d更换绿豆芽和玉米。3龄之后每2 d添1次豌豆蚜。卵:将含有虫卵的四季豆室温条件下放置2 d, 2 d后和新鲜玉米(以防1龄若虫孵化后缺乏食物饿死)一起放入保鲜盒。
1.2 方法
1.2.1中黑盲蝽总RNA提取与cDNA反转录
采用TRIzol法提取中黑盲蝽成虫总RNA。提取的RNA经1%琼脂糖凝胶电泳检测条带完整性,并用Backman Coulter DU730测定RNA 浓度与OD值。提取的RNA于-80℃保存。使用Prime ScriptTMRT Master Mix(perfect real time)试剂盒将RNA反转录为cDNA。
1.2.2中黑盲蝽EcR、USP基因克隆
利用本实验室中黑盲蝽基因组和转录组数据库(数据未发表)设计引物(表1)克隆EcR和USP基因的ORF全长序列。PCR反应体系:cDNA 0.2 μL,10×LA PCR Buffer 2.0 μL,LATaq(5 U/μL)1.0 μL,dNTP Mixture(2.5 mmol/L)3.2 μL,正反向引物(10 μmol/L)各 0.4 μL,补充ddH2O至20 μL。反应条件为:95℃预变性3 min;95℃变性30 s,退火温度下反应30 s,72℃延伸2 min,循环30次;72℃延伸10 min,4℃保存。1%琼脂糖凝胶电泳鉴定PCR产物,溴化乙锭(EB)染色,紫外灯下观察电泳结果,切下目的条带,使用Omega凝胶回收试剂盒回收PCR产物。-20℃保存备用。
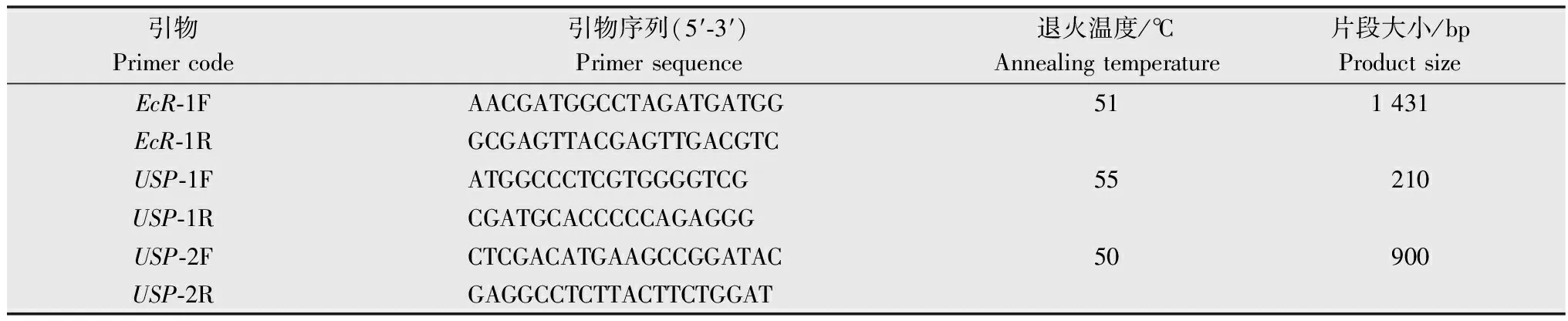
表1 中黑盲蝽EcR和USP基因克隆所用引物
取目的片段胶回收产物5 μL与1 μL Blunt载体于25℃连接10 min。重组载体转化感受态细胞T1 后,加入已灭菌的LB液体培养基至600 mL,37℃、150 r/min培养1 h。取200 μL菌液均匀涂布在氨苄抗性的LB培养基平板上,37℃过夜培养。经菌落PCR筛选出阳性克隆,送武汉擎科生物技术有限公司测序。
1.2.3中黑盲蝽EcR、USP基因序列分析
通过SMART(http:∥smart.embl.de/)预测蛋白结构域。使用MEGA 7.0软件,采用邻接法构建中黑盲蝽EcR和USP氨基酸序列与NCBI登录的其他昆虫同源序列的系统发育树,bootstrap为1 000。
1.2.4EcR、USP基因在中黑盲蝽不同发育阶段虫态、组织中转录水平分析
选取中黑盲蝽1~5龄若虫,1日龄雌、雄成虫,8日龄雌、雄成虫作为不同基因转录水平的样品,每处理3个生物学重复。解剖中黑盲蝽刚到达卵巢成熟期的8日龄雌虫,选取头、胸、卵巢、脂肪体和中肠为不同组织基因转录水平分析样品,每处理3个生物学重复。提取上述样品RNA并反转录获得cDNA。方法同1.2.1。
qPCR以EF1γ[22]为内参基因,根据已有的序列设计引物(表 2)。qPCR反应体系为SYBR PremixExTaqMix(2×)10.0 μL,10 μmol/L 上、下游引物各0.6 μL,cDNA模板 2.0 μL,ddH2O 6.8 μL;反应程序为:95℃,预变性30 s;95℃变性5 s,62℃复性延伸30 s,40个循环。40个循环后对扩增产物进行溶解曲线分析(60~95℃)和琼脂糖凝胶电泳,检测其特异性。每个反应设置3个技术重复。

表2 中黑盲蝽EcR和USP基因qPCR所用引物序列
1.2.5中黑盲蝽EcR、USP基因dsRNA合成
以1.2.1中含中黑盲蝽EcR、USP基因片段的感受态细胞T1为试验材料,用Omega Plasmid Mini Kit I提取含有目的片段的质粒。以该质粒为模板,利用特异性的dsRNA合成引物(表 3)进行PCR扩增,PCR体系和反应程序同1.2.2,1%琼脂糖凝胶电泳检测目标条带。利用酚氯仿抽提法纯化PCR产物,并用Backman Coulter DU730检测产物浓度和OD值。
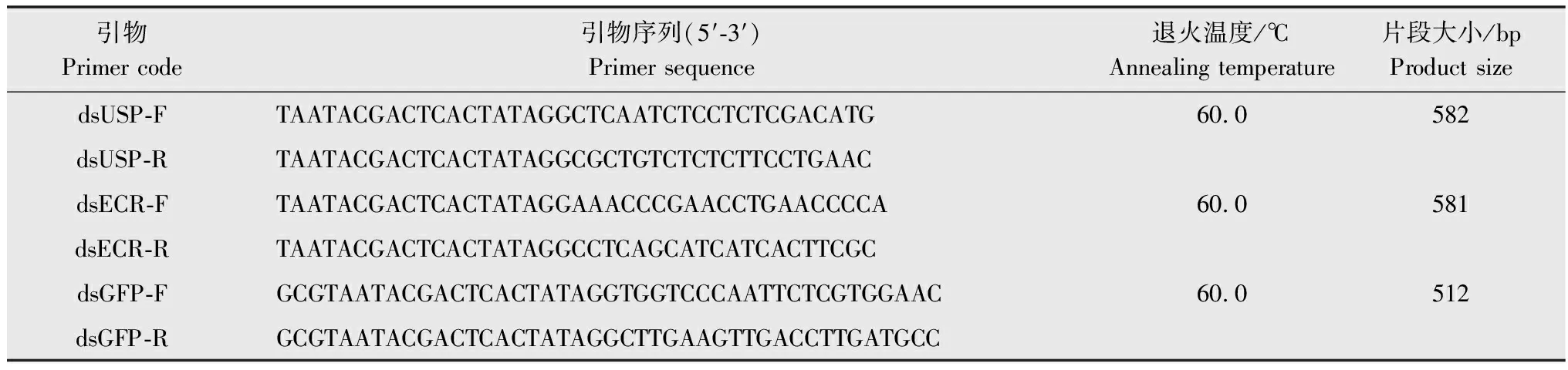
表3 本研究所用合成dsRNA的引物
以1 μg纯化产物为模板合成dsRNA。在反应体系中加入5×Transcription buffer 10 μL,ATP、CTP、GTP、UTP(100 mmol/L)各2 μL,RNA酶抑制剂1.5 μL,T7 RNA Polymerase(200 U/μL)0.5 μL,最后加入DEPC H2O至50 μL。37℃水浴4 h。在上述反应体系中加入DNase(1 U/μL)2 μL,10×Reaction buffer 6 μL,DEPC H2O 1.5 μL,37℃水浴1 h消化DNA模板,结束后用酚氯仿抽提法纯化dsRNA。用1%的琼脂糖凝胶电泳检测dsRNA质量,并用NanoDrop 2000检测产物浓度和OD值。dsRNA保存于-80℃备用。
1.2.6对中黑盲蝽USP、EcR基因进行RNA干扰
取羽化1 d内的中黑盲蝽雌成虫,通过显微注射仪Nanolater2010从后胸与腹部节间膜的最外侧将dsRNA注射到雌成虫体内,dsRNA浓度15 000 ng/μL,每虫注射100 nL,共注射1 500 ng。取注射dsRNA后第3、6、9、12、15、18天全虫提取RNA,通过qPCR检测基因转录水平的变化检测沉默效率,每组处理3头虫,每处理组3次生物学重复。
1.2.7RNA干扰后中黑盲蝽雌虫卵巢挂卵量和生殖力测定
中黑盲蝽雌虫卵巢内卵的数量统计:初羽化雌虫注射dsEcR和dsUSP,对照组注射相应量的dsGFP。分别解剖不同dsRNA处理后第10天的雌虫,每个处理解剖30头未交配雌虫。观察卵巢形态,拍照记录。统计卵巢内卵的数量,所有处理均进行3次生物学重复。
生殖力测定:初羽化雌虫注射dsRNA,对照组注射相应量的dsGFP。注射后的雌虫与初羽化的雄虫放入一次性塑料杯内交配,每塑料杯内含雌、雄成虫各1头。以新鲜的四季豆作为饲料和产卵基质,每3 d更换并统计四季豆上卵的数量。一旦发现雄虫死亡,立即补充新的性成熟的未交配雄虫。分别统计单雌产卵量和产卵前期,每处理共统计30对成虫,所有处理均进行3次生物学重复。
1.2.8数据分析
利用SPSS 17.0软件,中黑盲蝽EcR、USP基因在不同虫态、组织中转录水平分析用单因素方差分析,Tukey检验。RNA干扰后雌虫卵巢挂卵量和生殖力的差异显著性采用独立样本t测验。
2 结果与分析
2.1 中黑盲蝽EcR的序列特征
中黑盲蝽EcR基因的ORF序列全长为1 413 bp,编码470个氨基酸。通过预测得到的编码蛋白质分子量是53.65 kD,pI值为7.79。通过SMART网站分析EcR蛋白序列的功能结构域,结果表明该序列含有典型的类固醇核受体转录因子家族的蛋白结构。N端有核激素受体C4 锌指结构域(c4 zinc finger in nuclear hormone receptors, ZnF-C4),靠近C端有一个激素受体配体结构域(ligand binding domain of hormone receptors, HOLI)(图1a)。该蛋白氨基酸序列与半翅目绿盲蝽Apolyguslucorum相似度最高,达97.0%;与温带臭虫Cimexlectularius、大猿叶甲Colaphellusbowringi、褐飞虱Nilaparvatalugens和飞蝗Locustamigratoria的EcR蛋白氨基酸序列的相似度分别是81.9%、77.5%、72.7%和76.2%(图1b)。与其他19种昆虫一起构建的系统发育树中,其与半翅目昆虫的EcR蛋白聚在一起,并与绿盲蝽的EcR蛋白进化关系最近(图2)。

图1 中黑盲蝽EcR蛋白功能结构域与氨基酸序列比对
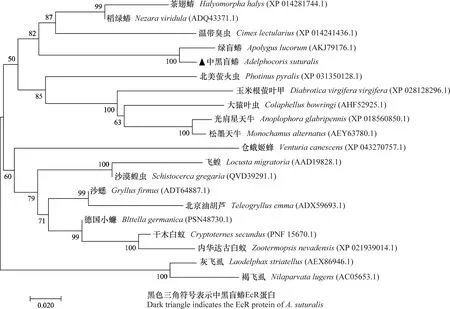
图2 中黑盲蝽EcR和其他昆虫同源序列系统进化树分析
2.2 中黑盲蝽USP的序列特征
中黑盲蝽USP基因的ORF序列全长1 209 bp,编码402个氨基酸。通过预测得到的蛋白质分子量是44.99 kD,pI值为7.94。通过SMART网站分析USP蛋白氨基酸序列的功能结构域,结果表明该序列含有典型的类固醇核受体转录因子家族的蛋白结构。N端有ZnF-C4结构域,靠近C端有一个HOLI配体结构域(图3a)。将该蛋白氨基酸序列与其他昆虫USP蛋白氨基酸序列进行比对,结果表明它与温带臭虫相似度最高,为82.7%;与德国小蠊Blattellagermanica、飞蝗、赤拟谷盗Triboliumcastaneum和家蚕Bombyxmori中的USP蛋白氨基酸序列的相似度分别是77.1%、79.9%、70.5%和52.7%(图3b)。与其他21种昆虫一起构建的系统发育树中,它与半翅目昆虫的USP聚在一起,并与温带臭虫的USP蛋白进化关系较近(图4)。
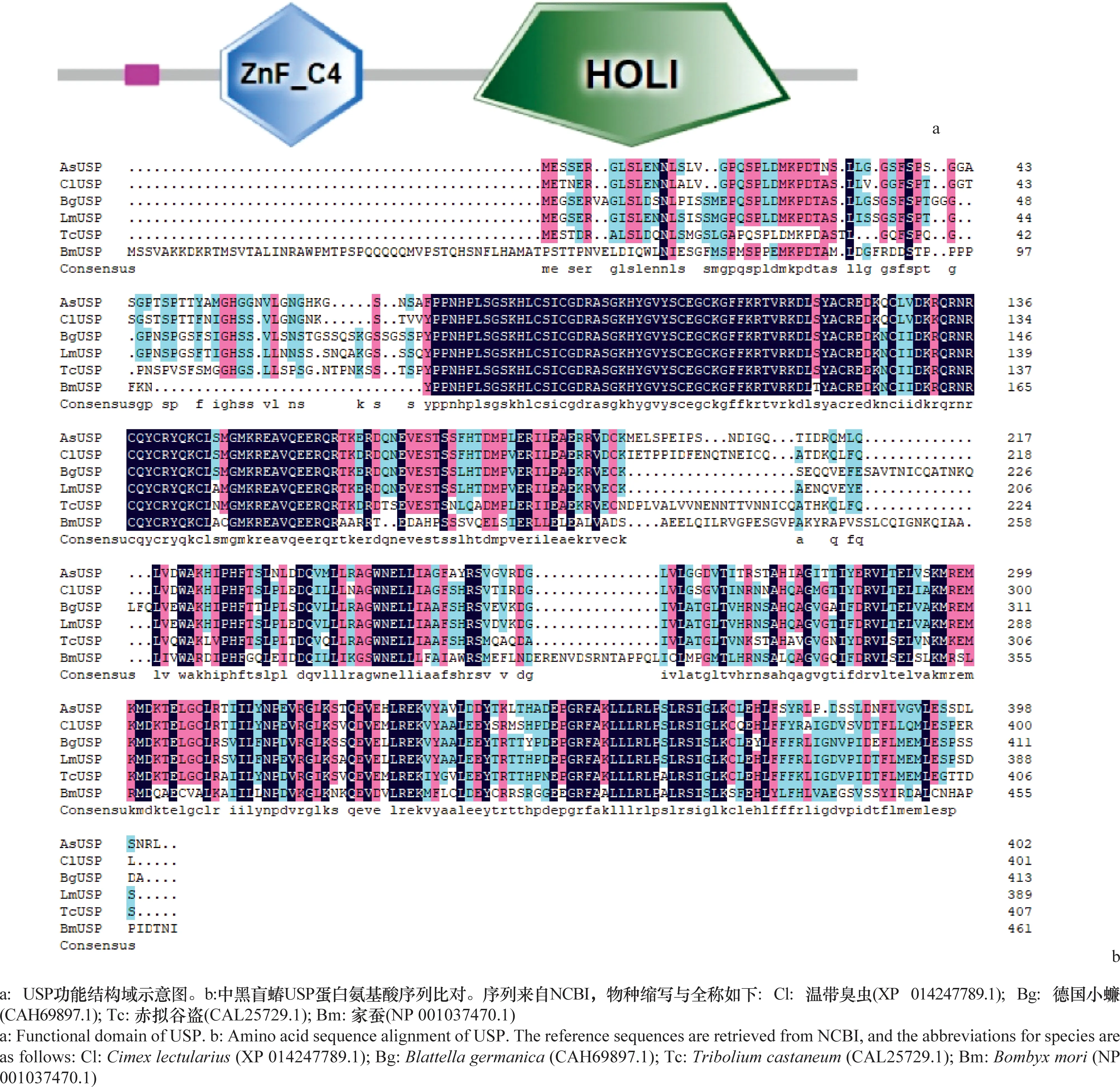
图3 中黑盲蝽USP蛋白功能结构域与氨基酸序列比对
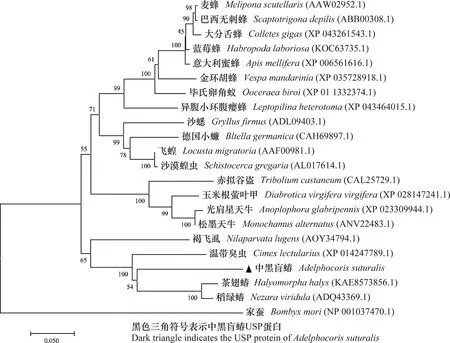
图4 中黑盲蝽USP和其他昆虫同源序列系统进化树分析
2.3 EcR、USP基因在中黑盲蝽不同发育阶段和组织中转录水平分析
通过qPCR对中黑盲蝽不同发育阶段和组织中的EcR、USP转录水平进行检测,结果显示EcR在8日龄雌、雄成虫中的基因转录水平最低,其次是5龄若虫;在3龄若虫和1日龄雌成虫中基因转录水平最高,分别是5龄若虫转录水平的3.38倍和3.41倍,其他龄期差异不显著(图5a)。EcR在卵巢刚进入成熟期时(8日龄)的不同组织中,在脂肪体中的基因转录水平显著高于其他组织,其次是头,在胸、卵巢和中肠中的基因转录水平无显著差异(图5b)。USP在刚羽化的1日龄雌、雄成虫中的转录水平显著高于其他龄期,分别是5龄若虫基因转录水平的8.96倍和6.25倍,在其他龄期中的基因转录水平无显著差异(图5c)。USP在8日龄雌成虫的头和脂肪体的基因转录水平最高,分别是卵巢中基因转录水平的3.67倍和3.42倍,在中肠中的基因转录水平最低(图5d)。
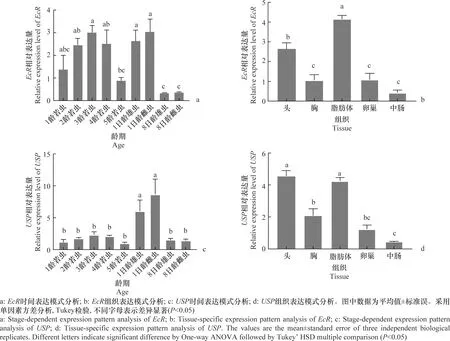
图5 中黑盲蝽EcR、USP的时空表达模式
2.4 dsEcR与dsUSP的沉默效率
1日龄雌成虫,注射dsEcR或dsUSP后,取第3、6、9、12、15、18 天的成虫。利用qPCR检测EcR或USP的转录水平变化,结果显示,干扰EcR后除第3 天外,6~18 d内的EcR基因转录水平均显著下降,沉默效率均在50%以上(图6a);干扰USP3~18 d内的USP基因转录水平均显著下降,沉默效率均在50%以上(图6b)。
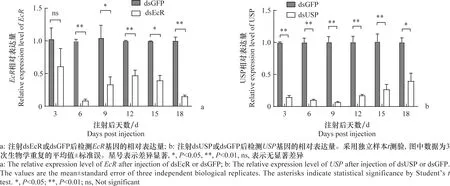
图6 EcR、USP沉默后基因表达量检测
2.5 EcR对中黑盲蝽生殖的影响
处理组中黑盲蝽卵巢的挂卵量显著减少,仅有对照组的31.5%(图7 a)。注射dsEcR或dsGFP后的1日龄雌成虫单独与雄成虫成对饲养,每3 d统计一次雌成虫产卵量并记录产卵日期。结果显示,处理组与对照组的产卵前期没有显著差异(图7b);单雌产卵量有极显著差异,处理组仅为对照组的19.6%(图7c);处理组产卵趋势与对照组基本一致,对照组7~9 d产卵量大幅增加,13~15 d达到产卵高峰,处理组整体卵量都比较少,10~12 d和16~18 d产卵量最多(图7 d)。
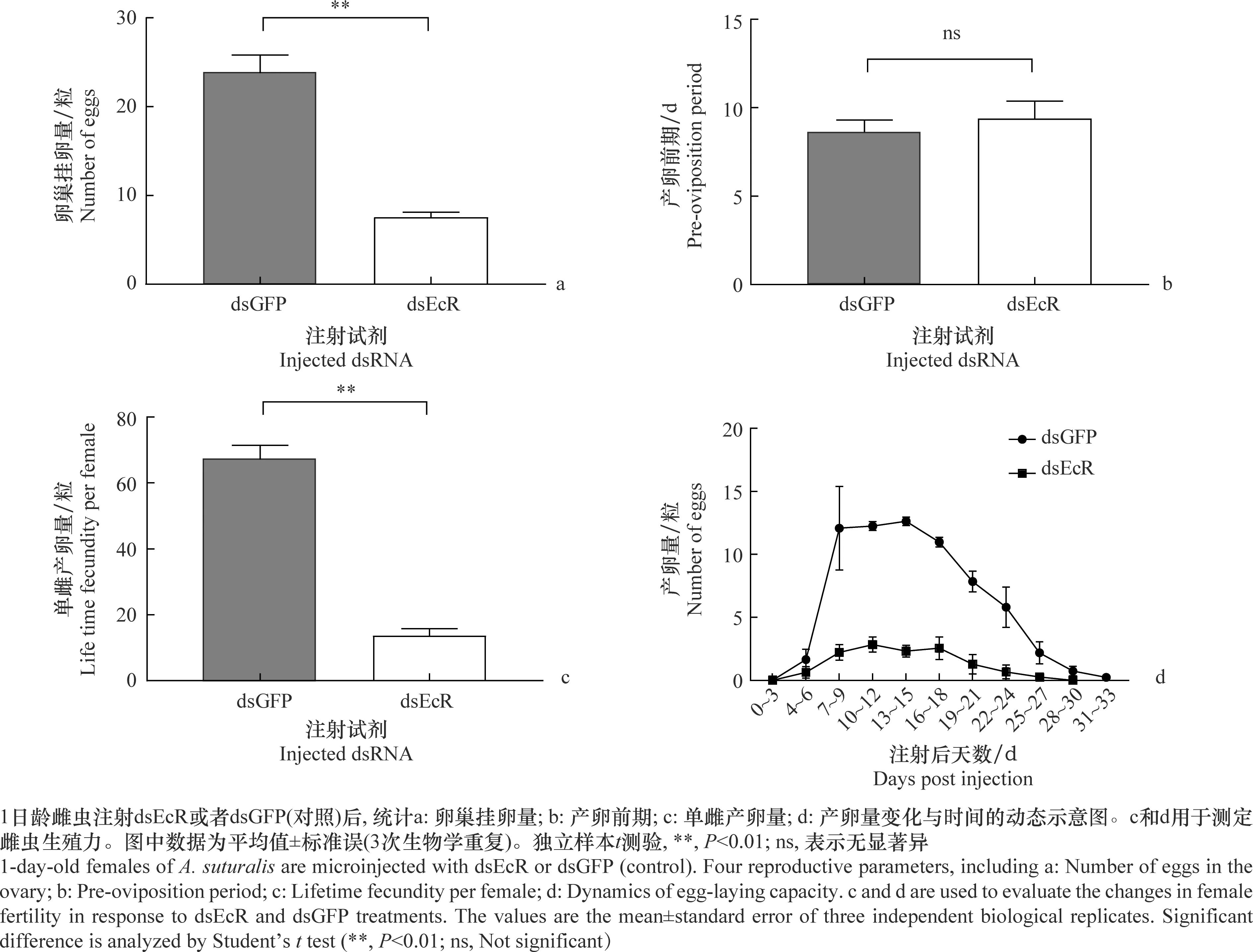
图7 干扰EcR的表达对中黑盲蝽雌虫生殖力的抑制
解剖注射dsRNA后第10 天的卵巢时发现卵巢内成型的卵较少,因此分别在注射dsEcR或dsGFP后第2、4、6、8、10、12、14、16天和第18 天解剖卵巢,观察其发育情况。从图8可以看出第4天对照组就有成熟的卵产生,第10天开始有大量卵产生。而处理组自14 d才开始有完整的卵产生,且量明显少于对照组。注射dsEcR使卵巢在发育过程中卵的产生推迟,卵的数量减少。
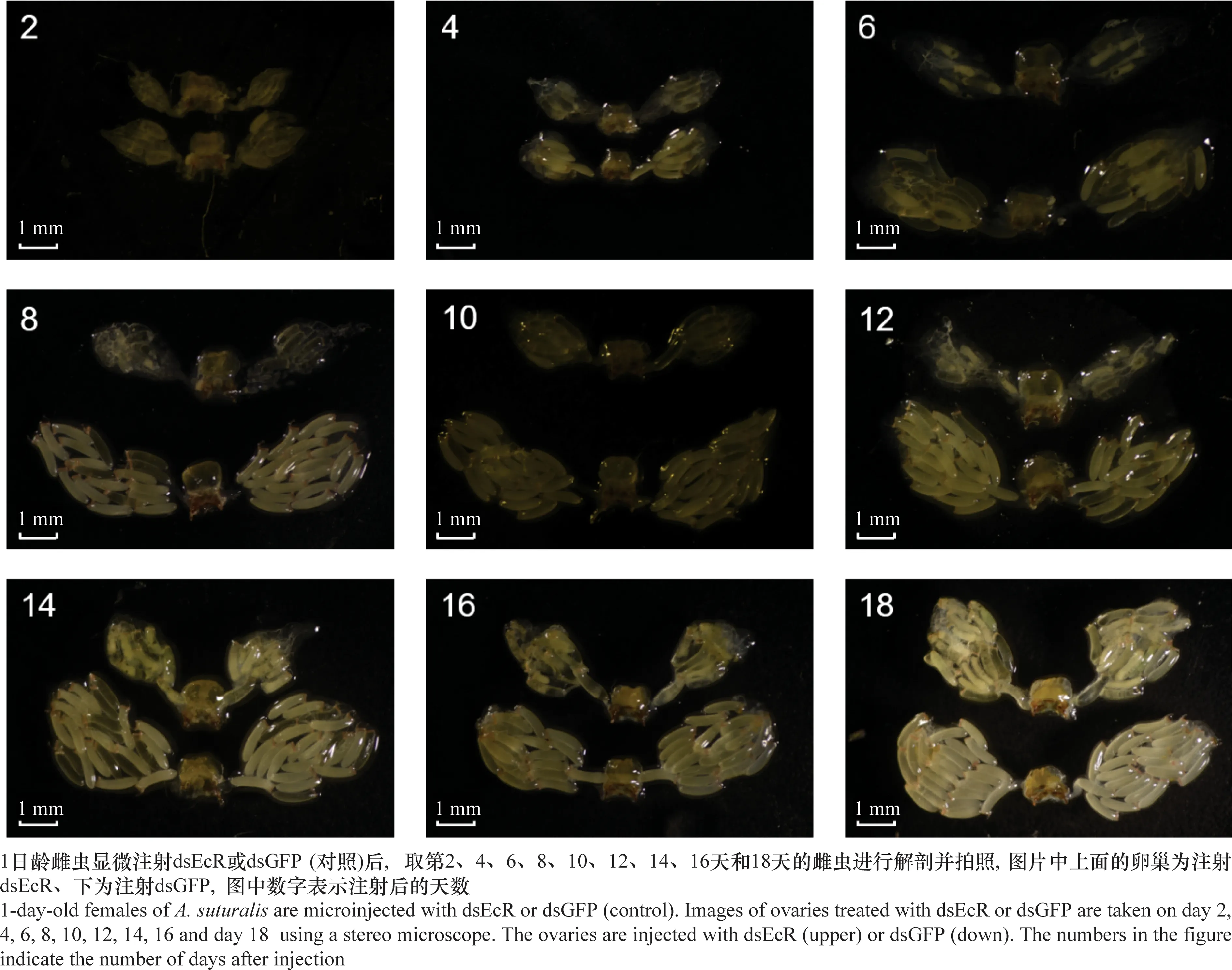
图8 沉默EcR后2~18 d中黑盲蝽体内卵巢发育情况
2.6 USP对中黑盲蝽生殖的影响
对1日龄雌成虫注射dsUSP或dsGFP后第10 天解剖雌虫并统计卵巢内的挂卵量。处理组的中黑盲蝽卵巢的挂卵量显著减少,与对照组相比减少13.4%(图9a)。注射dsUSP或dsGFP后的1日龄雌成虫与雄成虫成对饲养,每3 d统计1次雌成虫的产卵量并记录产卵日期。结果显示,处理组与对照组的产卵前期没有显著差异(图9b);单雌产卵量存在显著差异,处理组比对照组减少36%(图9c);处理组产卵趋势与对照组一致,7~9 d达到产卵高峰,之后缓慢下降,每3 d的卵量都比对照组少(图9d)。
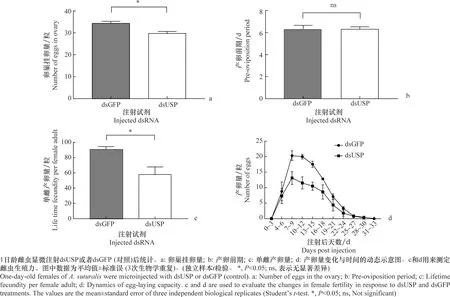
图9 干扰USP的表达对中黑盲蝽雌虫生殖力的抑制
2.7 EcR、USP对中黑盲蝽寿命的影响
注射dsEcR、dsUSP后的1日龄雌成虫与雄成虫成对饲养,每天记录存活情况。结果显示,注射dsGFP的中黑盲蝽(对照)与注射dsEcR的中黑盲蝽前9 d存活率一致,之后每天存活的数量均逐渐减少,但处理组中黑盲蝽存活率减少幅度更大(图10b)。成虫寿命有显著差异,处理组平均比对照组少5 d,表明沉默EcR会影响中黑盲蝽雌成虫的寿命(图10a)。注射dsGFP的中黑盲蝽(对照)与注射dsUSP的中黑盲蝽前5 d存活率一致,之后每天的存活率均逐渐减少,但处理组中黑盲蝽存活率减少幅度更大(图10d);成虫寿命有显著差异,处理组平均比对照组少2.4 d,表明沉默USP会影响中黑盲蝽雌成虫的寿命(图10c)。
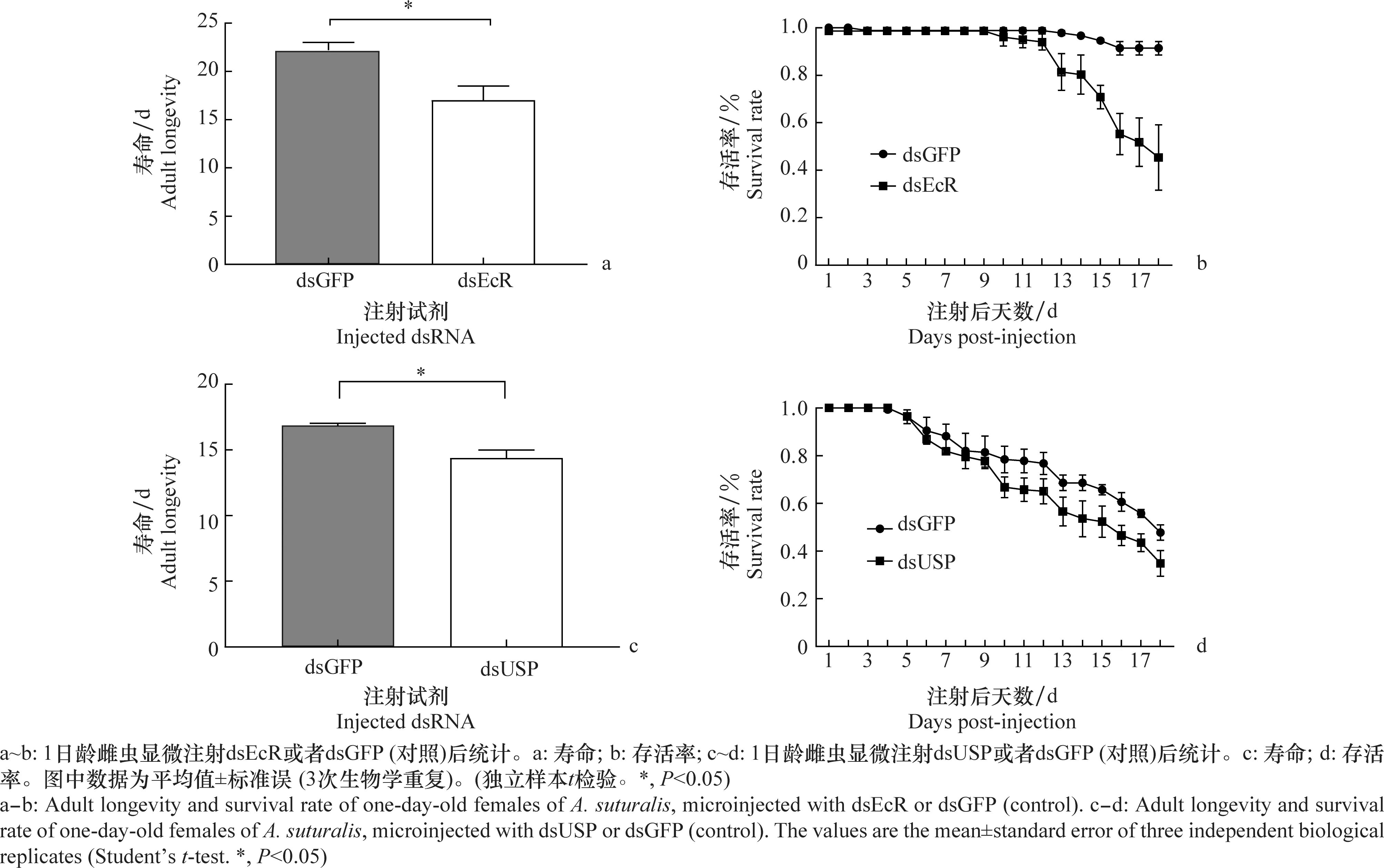
图10 干扰EcR、USP对中黑盲蝽寿命和存活率的影响
3 结论与讨论
20E受体EcR和USP有相似的结构域,通常由5个结构域组成,依次是拥有转录激活功能的A/B域(transactivation domain)、起到结合DNA作用的C域(DNA-binding domain)、能识别DNA并与DNA有高度亲和性的D域(linker domain)、负责结合配体的E域(ligand binding domain,LBD)和F域[23-25]。本研究预测的中黑盲蝽EcR和USP的蛋白序列中有2个功能结构域,分别是ZnF-C4结构域和HOLI配体结构域。锌指(zinc finger, ZnF)结构域是一组相对较小的蛋白质基序,包含多个指状突起,通过一个或多个锌离子(Zn2+)实现配位稳定[26-27]。ZnF-C4在核受体中的作用是结合基因组DNA上的特定位点从而激活下游基因的转录[28-29]。HOLI配体结构域也称为LBD。LBD除了能识别配体,还包含一个激活功能域(AF-2),对配体介导的核受体活性非常重要[30]。
USP和EcR在不同昆虫中的时空表达模式不同。在中黑盲蝽中,USP在刚羽化的1日龄雌成虫中的转录水平最高(图5c);在雌成虫刚到达卵巢成熟期(8日龄)时,USP在头和脂肪体中的转录水平最高,其次是胸和卵巢,在中肠中转录水平最低(图5d)。但是在梨小食心虫Grapholitamolesta中,GmUSP在肠道的转录水平显著高于头、马氏管、表皮和脂肪体[31]。EcR在3龄若虫和刚羽化的1日龄雌成虫中的转录水平最高(图5a)。卵巢刚到达成熟期的8日龄雌成虫不同组织中,EcR在脂肪体的转录水平显著高于其他组织(图5b)。在太平洋硕蠊Diplopterapunctata雌成虫中,DpEcR在咽侧体、卵巢和神经组织中高度表达,在脂肪体中的转录水平较低[32]。在10日龄蝗虫雌成虫的脂肪体内SchgrEcR转录水平最高[33]。在绿盲蝽成虫中也发现EcR在脂肪体和表皮中转录水平最高,在卵巢中转录水平最低[34]。昆虫的脂肪体是一种功能多样化的组织,在昆虫生殖过程中负责提供卵黄原蛋白前体(yolk protein precursor)[35]以及卵巢内卵成熟所需要的能量[36]。EcR在昆虫脂肪体内有许多功能,有研究表明EcR介导的蜕皮激素信号能抑制果蝇脂肪体内脂质的积累[37]。在家蚕中20E信号在诱导饥饿条件下激活脂肪三酰基甘油脂肪酶基因Brummer导致脂肪体内脂肪分解[38]。
本研究结果显示,干扰EcR和USP使中黑盲蝽雌成虫的单雌产卵量分别下降了80.4%和36%,卵子发育进度减缓。EcR和USP介导的20E信号可以控制卵巢发育早期生殖干细胞的分化[39-40]。在EcR突变的果蝇雌成虫卵巢中,缺少卵黄发生阶段的卵室;在卵黄发生早期(8期和9期)的卵室中,卵泡细胞减少,且营养细胞出现细胞核变小或破裂的现象[41]。10期卵母细胞中脂质的阶段特异性积累需要EcR通过促进脂质生成转录因子固醇调节元件结合蛋白(sterol regulatory element binding protein)的活化和控制LDL受体同源物LpR2的表达来诱导[42]。在10B期,EcR正向调控核内周期/基因扩增(E/A)开关[43]。EcR-B2是唯一一个在果蝇成熟卵泡细胞中起作用的EcR亚型,它介导了排卵所必需的20E信号[44]。EcR-B1亚型和USP共同介导了一个卵黄膜基因(vitelline membrane gene)VM32E的转录调控,该基因的产物是卵黄膜和绒毛膜内层的组成部分[45]。同时20E信号在昆虫排卵过程中需要基质金属蛋白2(matrix metalloproteinase 2)的激活[46]。
本研究结果显示,干扰EcR和USP使中黑盲蝽雌成虫的寿命分别减少了5 d和2.4 d。但有研究得出了完全相反的结果,EcR突变的果蝇雄成虫和雌成虫的平均寿命分别增加了40%~50%,生育能力没有下降[47]。自然界中寿命和繁殖力呈负相关是普遍存在的情况[48],如取食JH类似物的果蝇早期繁殖力增加但寿命缩短[49]。影响昆虫寿命的内在因素还有胰岛素样肽(insulin-like peptide)[50-51]、单磷酸腺苷依赖的蛋白激酶(AMP-activated protein kinase)[52]和雷帕霉素靶标(target of rapamycin)[53]等信号通路。因此干扰20E受体后中黑盲蝽寿命和生殖力同时降低的原因有待进一步研究,可能涉及与其他信号通路的相互作用。

