双香豆素诱导斜纹夜蛾卵巢细胞程序性死亡的机理研究
秦子昕, 邵雪花, 梁 赫, 温雪梅, 路 伟*
(1.新疆农业大学农学院,棉花教育部工程研究中心, 自治区农林有害生物监测与安全防控重点实验室, 乌鲁木齐 830052; 2.广东省农业科学院果树研究所, 农业农村部南亚热带果树生物学与遗传资源利用重点实验室, 广东省热带亚热带果树研究重点实验室, 广州 510640)
斜纹夜蛾Spodopteralitura(Fabricius)属鳞翅目Lepidoptera夜蛾科Noctuidae[1]。其幼虫可取食蔬菜、果树、烟草、棉花及其他作物的叶、花蕾、花及果实等[2-3],对我国农业生产构成重大威胁。目前,斜纹夜蛾等鳞翅目害虫的防控主要依靠化学农药[4],但部分化学农药毒性高、残留严重,施药后无法及时转运至嫩梢叶片,使得施药部位与害虫为害部位存在位差,需要频繁施药防控。化学农药的频繁使用,不仅对生物多样性造成了极大威胁,而且导致了害虫抗药性、农药残留超标、土壤板结、环境污染等诸多问题[5-7];此外,近年来化学农药的大量及不合理使用加大了斜纹夜蛾的选择压,对其防治效果日趋下降[8-9],故挖掘针对斜纹夜蛾等鳞翅目害虫的天然活性化合物具有重要现实意义。
香豆素(coumarin)又称香豆精、香豆内酯、1,2-苯并吡喃酮,广泛存在于自然界中,在芸香科、伞形科及桑科植物中含量较高,在豆科、兰科、木樨科、茄科和菊科植物中也有广泛分布,同时还是部分微生物代谢的主要产物[10-12]。近年来,香豆素因具有多种生物活性,已成为医药、农药等行业的开发研究热点。双香豆素(dicoumarin,DIC)属于香豆素类,也是一种1,2-苯并吡喃酮类化合物,最早作为一种抗凝血剂应用于医学。随着研究的深入,人们发现双香豆素还具有抗菌、抗炎、抗肿瘤、抗HCV、抗HIV、抗老年痴呆、抗疟疾、抗寄生虫、细胞毒性等多种生物活性[13-14]。
魏静等的研究表明,人肝癌细胞(Hep G2)对双香豆素表现出较强的敏感性,IC50为(3.19±0.68)μmol/L,且双香豆素对Hep G2细胞的抑制作用呈剂量和时间依赖性[15]。Mazumder等研究了一系列双香豆素衍生物的抗病毒活性,发现双香豆素衍生物NSC 158393对HIV-2、猫和猴免疫缺陷病毒整合酶具有良好的抑制活性,IC50为0.8~2.3 μmol/L[16]。Katsori等的研究显示,香豆素的物理化学性质与其生物活性强弱密切相关,在C3、C4和C7位置具有多种药效基团的合成香豆素已用于抗菌、抗病毒、抗癌、抗氧化、抗炎、抗真菌、抗类风湿性关节炎、抗晚期糖基化终产物(advanced glycation end products,AGEs)和抗痤疮活性研究[17]。Reddy等的研究表明,硫代香豆素、3-芳基-8-烯丙基-7-羟基-香豆素、三唑基香豆素和肽偶联香豆素甲酰胺的杂化物对哺乳动物癌细胞系表现出较好的细胞毒性和抗菌活性[18]。杨丽君等的研究显示,呋喃香豆素类和双香豆素类化合物具有良好的杀线虫活性,在病害防治方面也展现出广阔的探索价值[19]。
利用离体细胞进行毒性测定是一种稳定、高效、灵敏的检测方法,该方法具备耗药量少、灵敏、简便、周期短、适宜于快速筛选、试验条件易于控制、节约人工等优点[20-23]。故本文以斜纹夜蛾卵巢细胞系SL-221和双香豆素为研究对象,拟通过CCK-8法检测不同浓度下双香豆素对SL-221细胞的毒性,并采用流式细胞术测定该化合物对细胞周期、线粒体膜电位及细胞凋亡的影响;最后,利用实时荧光定量PCR技术探索营养信号通路(PI3K/TOR)上关键基因的表达情况。旨在从细胞水平上初步探讨双香豆素对SL-221细胞增殖的抑制活性及其作用机理,以期为双香豆素的开发利用提供理论基础,同时为斜纹夜蛾的生物防治提供新的思路。
1 材料与方法
1.1 供试药剂及细胞
双香豆素,分子式C19H12O6,分子量336.30,CAS号:66-76-2,由广东省农业科学院果树研究所资源与环境实验室提供,结构式见图1。印楝素购自西格玛奥德里奇(上海)贸易有限公司;佛手柑内酯、茴芹内酯、异茴芹内酯、异欧前胡素、甲氧基香豆素、柠檬油素、伞形花内酯、异牡荆黄素、番石榴苷、东莨菪苷、根皮苷、(-)-没食子儿茶素、(-)-表没食子儿茶素、(+)-表儿茶素、香叶木素7-O-beta-D-葡萄糖苷、(±)-儿茶精、(-)-儿茶素、槲皮素、没食子酸、没食子酸甲酯购自四川维克奇生物科技有限公司。斜纹夜蛾Spodopteralitura卵巢细胞SL-221,由广东省农业科学院果树研究所资源与环境实验室培养。

图1 双香豆素结构式
1.2 试验方法
1.2.1斜纹夜蛾卵巢细胞SL-211培养
将SL-211冻存管从液氮中取出,迅速投入37℃水浴使细胞融化,细胞融化后用酒精棉球擦拭冻存管表面以消毒,之后在超净工作台中将细胞液转入离心管,800 r/min离心3 min。去上清,加入1 mL SIM SF昆虫细胞培养基(含10%胎牛血清)重悬细胞,将细胞悬液接入培养瓶中,补足培养液至3 mL,放入27℃恒温培养箱培养。待细胞密度达到85%~90%时,弃去原培养基,加入3 mL新的SIM SF昆虫细胞培养基(含5%胎牛血清),用一次性吸管轻柔吹打细胞使其脱壁分散,并分装传代。之后每2 d传代细胞一次,定期观察记录细胞状态。
1.2.2CCK-8法检测化合物对斜纹夜蛾SL-211细胞的毒性
用Cell Counting Kit(简称CCK-8试剂盒,北京聚合美生物科技有限公司)检测双香豆素等21个酚类化合物对SL-221细胞的毒性。取对数生长期生长状态良好的SL-221细胞,用吸管将贴壁细胞轻柔吹打脱壁,并用SIM SF昆虫细胞培养基(含5%胎牛血清)调节细胞浓度至5×105个/mL。将细胞悬液接种于96孔板,每孔100 μL,置于27℃恒温培养箱培养过夜。用细胞培养级二甲基亚砜(dimethyl sulfoxide,DMSO)将供试化合物配制成母液。试验前用无血清SIM SF培养基将药液倍比稀释至0.781 25、1.562 5、3.125、6.25、12.5、25、50 μg/mL。弃去96孔板中原有培养基,分别加入不同浓度含药培养基,每个浓度4个重复。以含0.1% DMSO无血清培养基作为空白对照,相同浓度的印楝素作为阳性对照,置于27℃恒温培养箱孵育48 h。48 h后每孔加入10 μL CCK-8溶液,之后放入培养箱继续避光孵育2 h,用酶标仪测定450 nm处的吸光度,并按照公式计算细胞抑制率,细胞抑制率为50%的值即为IC50。
细胞抑制率=(A零加药-A加药)/(A零加药-A空白)×100%。
式中,A零加药表示含有细胞的培养基、CCK-8溶液、0.1% DMSO,无待测化合物的孔的吸光度。A加药表示含有细胞的培养基、CCK-8溶液、待测化合物的孔的吸光度。A空白表示含培养基、CCK-8溶液、待测化合物,无细胞的孔的吸光度。
1.2.3双香豆素处理后斜纹夜蛾SL-211细胞形态学观察
经CCK-8法筛选,双香豆素对SL-221细胞增殖活性的抑制率最高,选用双香豆素做后续机理研究。6 cm细胞培养皿中接种2 mL对数生长期的SL-221细胞悬液(细胞密度约为5×105个/mL),置于27℃培养箱培养24 h后吸去SIM SF培养基,更换为含有4 μg/mL双香豆素的新鲜细胞培养基。药剂分别处理细胞0、3、6、12、24、48 h,其中0 h为对照,于倒置显微镜下观察,并拍照记录细胞形态的变化。
1.2.4流式细胞术检测双香豆素对斜纹夜蛾SL-211细胞周期的影响
配制含1 μg/mL双香豆素的无血清SIM SF培养基备用。取对数生长期状态良好的SL-221细胞以5×106个/mL密度接种于6孔板中培养过夜。弃去原有培养基,加入含药培养基,以含0.1% DMSO无血清培养基为对照。27℃恒温培养箱分别孵育0、3、6、12、24、48 h后收集细胞,其中0 h为对照,每板设为1组,其中每孔对应1个处理时间,每个处理时间重复3组。采用DNA含量检测试剂盒(北京索莱宝科技有限公司)检测细胞各个时期DNA含量。用PBS洗涤细胞2次,70%乙醇固定细胞,4℃冰箱过夜。次日用PBS洗涤细胞2次,之后加入100 μL RNaseA溶液,37℃水浴30 min,再加入400 μL PI染色液4℃避光孵育30 min。完成后立即用流式细胞仪(BD FACS)在激发波长488 nm,发射波长617 nm处检测PI(红色)荧光,FlowJo软件统计分析G0/G1(DNA合成前期)、S(DNA合成期)、G2/M(DNA合成后期)的细胞数量。
1.2.5JC-1荧光标记法检测双香豆素对斜纹夜蛾SL-211细胞线粒体膜电位的影响
细胞处理方法同1.2.4。分别收集经1 μg/mL双香豆素处理0、3、6、12、24、48 h的细胞,其中0 h为对照,用PBS清洗细胞2次。按照线粒体膜电位检测试剂盒(JC-1,北京索莱宝科技有限公司)使用说明,加入1 mL JC-1染色工作液,37℃避光孵育30 min,后用JC-1染色缓冲液清洗细胞2次,1 mL JC-1染色缓冲液重悬细胞,流式细胞仪检测激发波长585 nm,发射波长590 nm处的PE(红色)荧光;激发波长515 nm,发射波长529 nm处FITC(绿色)荧光,并计算红绿荧光的相对比例来衡量线粒体膜电位的变化情况(红绿荧光的相对比例=红色荧光百分比/绿色荧光百分比)。
1.2.6Annexin Ⅴ-FITC/PI双染检测双香豆素对斜纹夜蛾SL-211细胞凋亡的影响
细胞处理方法同1.2.4。分别收集经1 μg/mL双香豆素处理0、3、6、12、24、48 h的细胞,其中0 h为对照,800 r/min离心3 min,用PBS清洗细胞2次。之后用Binding buffer重悬细胞,然后按照Annexin V-FITC/PI凋亡检测试剂盒(北京索莱宝科技有限公司)说明书加入5 μL Annexin Ⅴ-FITC染液与10 μL PI染液,室温避光双染细胞,流式细胞仪检测激发波长535 nm,发射波长615 nm处的PI(红色)荧光;激发波长488 nm,发射波长525 nm处的FITC(绿色)荧光,并用FlowJo软件分析细胞凋亡情况。
1.2.7RT-qPCR法检测双香豆素对斜纹夜蛾SL-211细胞相关基因表达情况的影响
采用RT-qPCR检测斜纹夜蛾卵巢细胞凋亡、细胞自噬相关基因(SL-Bcl-2、SL-PI3K、SL-TOR、SL-P53、SL-CytoC、SL-Atg8)的表达情况,以SL-Actin为内参基因。引物(表1)由生工生物工程(上海)股份有限公司合成。细胞处理方法同1.2.4,收集经1、2、4 μg/mL双香豆素分别处理0、3、6、12、24、48 h的SL-221细胞,其中0 h为对照,用TRIzol试剂提取细胞总RNA,反转录合成cDNA。利用Applied Biosystems实时荧光定量PCR仪进行扩增反应,体系(10 μL):cDNA 1 μL、2×M5 HiPer Real time PCR Super mix with Low Rox 5 μL、上、下游引物共0.5 μL,RNase Free ddH2O 3.5 μL。反应程序为:95℃预变性30 s;95℃ 5 s,60℃ 30 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。重复3次。通过RT-qPCR可以得到目的基因与内参基因的Ct值,Ct值表示荧光达到荧光阈值的循环数,Ct值与样本起始拷贝数的对数存在线性关系,即Ct值越小,起始拷贝数就越多,利用2-ΔΔCt(ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt试验组-ΔCt对照组)计算出不同处理时间下的SL-221细胞基因相对表达量。

表1 斜纹夜蛾生长发育相关基因 RT-qPCR 所需引物
1.3 数据分析
本试验结果均为3次以上重复试验统计获得,运用IBM SPSS Statistics 26软件分析数据,结果由平均值±标准差(SD)表示,各处理组所得平均值之间的差异通过单因素方差分析及Duncan氏多重比较进行检验评估,P<0.05表示在统计学上具有显著性差异。
2 结果与分析
2.1 CCK-8法检测化合物对斜纹夜蛾SL-211细胞的毒性
21个供试药剂中双香豆素对SL-221细胞的抑制活性最高[48 h抑制中浓度(IC50)为0.85 μg/mL],是阳性对照印楝素(48 h IC50为7.20 μg/mL)的8.47倍(表2)。在21个化合物中,柠檬油素、甲氧基香豆素、茴芹内酯、异欧前胡素、伞形花内酯也展现出良好的细胞抑制活性,其IC50分别为7.23、8.76、8.81、9.62、9.63 μg/mL。异牡荆黄素、根皮苷、没食子酸、没食子酸甲酯、东莨菪苷、(±)-儿茶精、异茴芹内酯、(-)-儿茶素、番石榴苷的细胞抑制活性次之,其IC50分别为10.24、11.64、11.81、12.44、13.12、15.73、17.05、17.21、18.38 μg/mL;佛手柑内酯、(+)-表儿茶素、槲皮素、(-)-表没食子儿茶素、(-)-没食子儿茶素、香叶木素7-O-beta-D-葡萄糖苷的细胞抑制活性较差。

表2 21种酚类化合物对斜纹夜蛾卵巢细胞SL-211的毒力
0.781 25、1.562 5、3.125、6.25、12.5、25、50 μg/mL双香豆素作用于SL-221细胞,48 h后细胞抑制率分别为49.00%、65.00%、68.94%、80.82%、91.60%、93.55%、95.13%(图2)。表明双香豆素对SL-221细胞具有良好的抑制增殖活性,且呈现浓度依赖性。
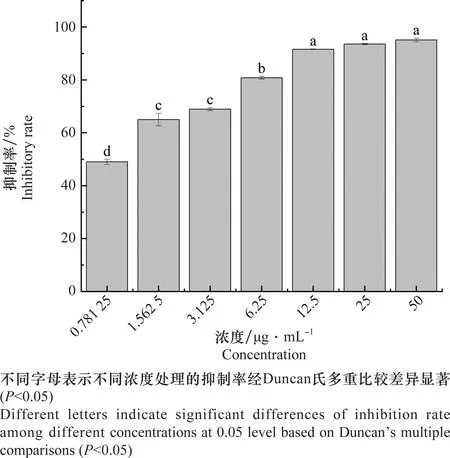
图2 双香豆素处理斜纹夜蛾卵巢细胞48 h的细胞抑制率
2.2 双香豆素处理后斜纹夜蛾SL-221细胞形态学观察
利用倒置显微镜观察4 μg/mL双香豆素处理SL-221细胞不同时间其形态的变化(图3)。结果显示,0 h时细胞外部形态饱满,细胞膜光滑通透,呈不规则圆形或梭形,贴壁生长状态良好;处理3 h和6 h时少部分细胞脱壁变圆,细胞膜光滑度减小;处理12 h后,细胞膜表面粗糙,出现肿胀细胞,细胞增殖受到抑制;处理24 h后,细胞不能贴壁生长,细胞膜破裂,出现凋亡小体;处理48 h后,细胞肿胀破裂,内容物溢出,凋亡小体增多,大量细胞死亡。通过形态学观察发现48 h内,随着药剂处理时间的延长,细胞凋亡现象趋于明显。由此可见,双香豆素对SL-221细胞增殖抑制作用呈现时间依赖性。
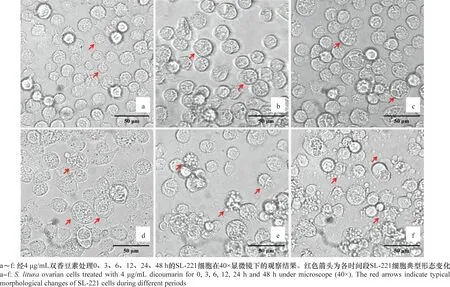
图3 双香豆素诱导的斜纹夜蛾卵巢细胞形态变化
2.3 流式细胞术检测双香豆素对斜纹夜蛾SL-221细胞周期的影响
经1 μg/mL双香豆素处理0、3、6、12、24、48 h的SL-221细胞的细胞周期分布情况见图4。处于不同细胞周期的细胞比例的统计分析结果见图5。处理48 h与0 h相比,G0/G1期的细胞比例由(46.37±2.61)%下降至(19.77±1.56)%,S期的细胞比例由(28.60±1.71)%下降至(20.90±5.87)%,而G2/M期的细胞比例由(24.73±2.11)%增加至(59.67±4.94)%。由此可见,双香豆素可诱导SL-221细胞的细胞周期阻滞在G2/M期。

图4 双香豆素处理不同时间斜纹夜蛾卵巢细胞细胞周期的分布情况
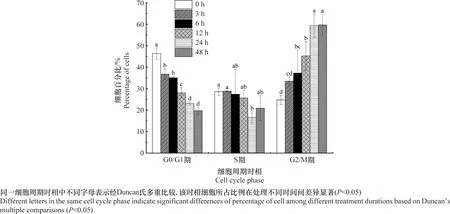
图5 双香豆素诱导的斜纹夜蛾卵巢细胞细胞周期阻滞分析
2.4 JC-1荧光标记法检测双香豆素对斜纹夜蛾SL-221细胞线粒体膜电位的影响
利用线粒体膜电位检测试剂盒(JC-1)和流式细胞仪检测双香豆素处理不同时间,SL-221细胞线粒体膜电位的变化情况(图6)。线粒体膜电位较高时,JC-1在线粒体基质中形成聚合物,呈红色荧光;而当线粒体膜电位较低时,JC-1为单体,呈绿色荧光,其变化情况统计结果见图7。1 μg/mL双香豆素处理3 h后细胞内的红/绿荧光比例与0 h相比显著降低(P<0.05),并随处理时间延长,线粒体膜电位持续降低。处理时间至48 h时,细胞内的红/绿荧光比例由0 h时的10.58降至0.04,下降了99.62%。由此表明,双香豆素能够明显降低SL-221细胞的线粒体膜电位。

图6 双香豆素对斜纹夜蛾卵巢细胞线粒体膜电位的影响

图7 双香豆素对斜纹夜蛾卵巢细胞线粒体膜电位影响情况的统计分析
2.5 Annexin Ⅴ-FITC/PI双染检测双香豆素对斜纹夜蛾SL-221细胞凋亡的影响
1 μg/mL双香豆素处理SL-221细胞0、3、6、12、24、48 h后,采用流式细胞仪检测FITC,PI通道荧光强度,获得处理不同时间下各类细胞的分布情况(图8)。其中左上象限(Q1)表示坏死细胞、右上象限(Q2)表示晚期凋亡细胞、右下象限(Q3)表示早期凋亡细胞、左下象限(Q4)表示正常细胞。经Annexin Ⅴ-FITC/PI双染统计各类细胞的比例(图9),可以看出,双香豆素处理48 h与0 h相比,正常细胞比例由(74.33±1.03)%降低至(25.90±6.61)%,早期凋亡细胞比例由(7.25±3.33)%增加到(23.37±4.34)%,晚期凋亡细胞比例由(14.49±5.06)%增加到(46.40±1.35)%。由此可见,双香豆素可诱导SL-221细胞凋亡,且细胞凋亡率与处理时间呈正相关。

图8 Annexin V-FITC/PI双染检测双香豆素诱导的斜纹夜蛾卵巢细胞凋亡
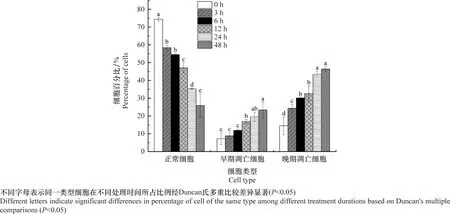
图9 Annexin V-FITC/PI双染检测双香豆素诱导斜纹夜蛾卵巢细胞凋亡情况的统计分析
2.6 RT-qPCR法检测双香豆素对斜纹夜蛾SL-221细胞相关基因表达情况的影响
进一步通过RT-qPCR法检测SL-221细胞凋亡、细胞自噬相关基因的mRNA表达情况。由结果(图10)可知,1、2、4 μg/mL双香豆素处理SL-221细胞3~48 h,SL-PI3K、SL-TOR和SL-Bcl-2基因表达量呈现下降趋势,且药物处理浓度越高,下降越明显。其中,处理48 h,SL-PI3K基因表达量分别较对照下调了86.42%、90.11%、93.36%;SL-TOR基因表达量分别较对照下调了98.08%、98.66%、98.81%;SL-Bcl-2基因表达量分别较对照下调了92.25%、97.69%、98.49%;SL-Atg8、SL-CytochromeC和SL-P53基因表达量呈现上调趋势。其中,处理48 h,SL-Atg8基因表达量分别较对照上调12.31倍、13.21倍、14.83倍;SL-CytochromeC基因表达量分别较对照上调了11.08倍、23.81倍、26.57倍;SL-P53基因表达量分别较对照上调了21.59倍、33.36倍、91.18倍。
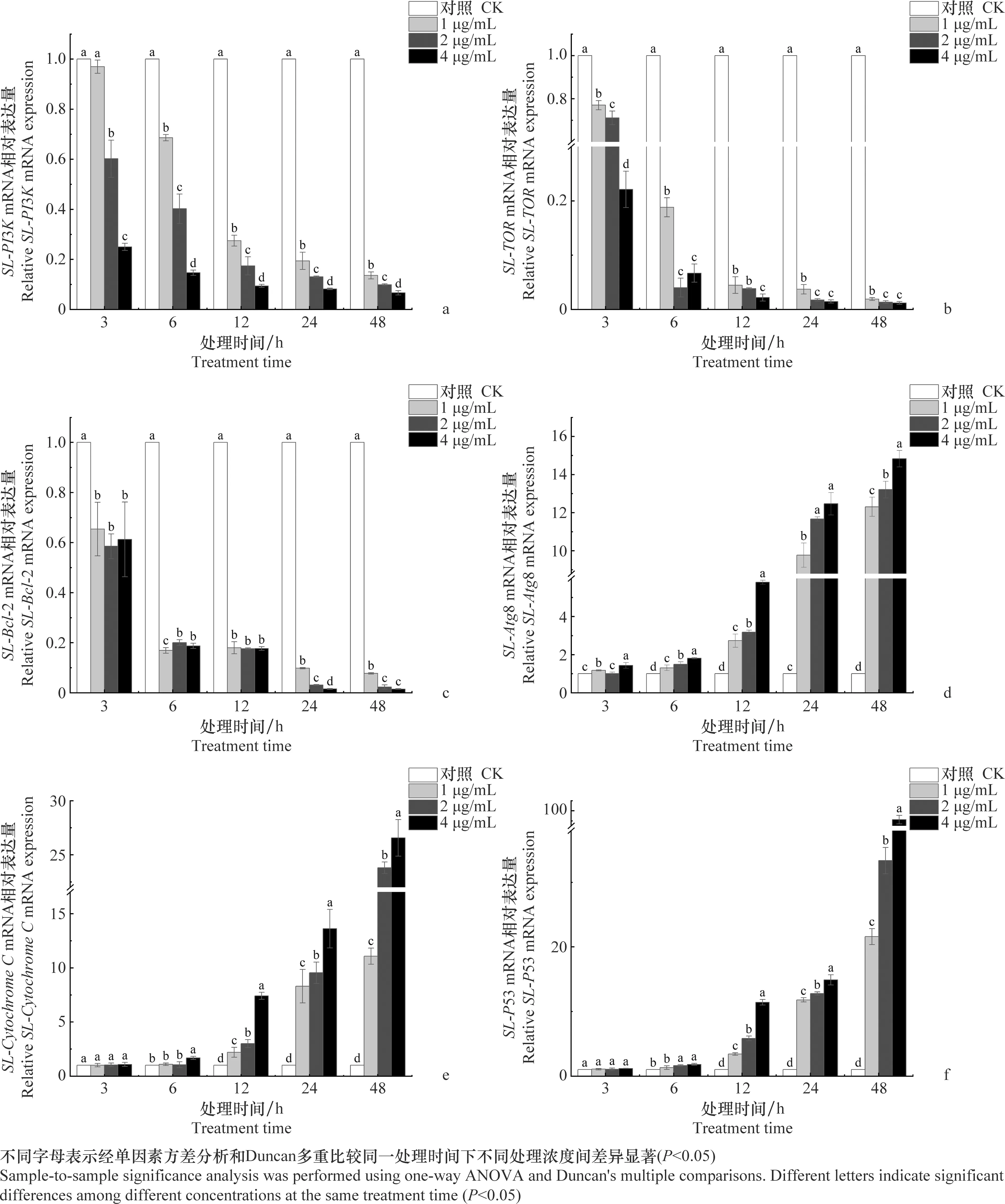
图10 不同浓度双香豆素诱导斜纹夜蛾卵巢细胞6种基因表达变化情况
3 结论与讨论
双香豆素最早因其具有干扰维生素K代谢循环的作用,在临床上被广泛用作抗凝血剂。已有研究表明,双香豆素在抗菌、抗炎、抗肿瘤、抗结核和抗精神病等方面具有良好活性,但针对农业害虫方面的研究却未见报道。本文以斜纹夜蛾卵巢细胞为靶标,研究双香豆素对细胞的毒力及相关作用机理,结果表明,双香豆素对斜纹夜蛾卵巢细胞具有良好的增殖抑制活性,IC50为0.85 μg/mL,其活性是阳性对照印楝素(IC50为7.20 μg/mL)的8.47倍,且抑制活性具有浓度依赖趋势,显示出优于印楝素的发展潜力;进一步通过流式细胞术检测发现双香豆素不仅阻断SL-221细胞周期,同时促使线粒体膜电位下降,诱导昆虫细胞凋亡。细胞周期是控制细胞生长的主要调控机制,由于正常细胞不断增殖,细胞总是处于G0/G1,S,G2/M连续的细胞周期中。在细胞周期的各阶段,细胞分别进行着DNA复制、蛋白质合成及细胞分裂等重要的生理活动。其中G2/M期主要进行DNA复制,DNA复制完成后细胞分裂并启动下一个细胞周期,经双香豆素处理的大多数细胞的周期停留在G2/M期,细胞无法进行正常有丝分裂,进而抑制了细胞的增殖。
PI3K在调控细胞增殖、分化和凋亡等多种细胞功能中发挥重要作用,PI3K可直接激活蛋白激酶B(protein kinase B,Akt)和TOR,导致其磷酸化,磷酸化后的Akt促使转录因子FOXO入核发挥转录活性,进而调控营养信号通路(PI3K/TOR)下游关键基因Atg8、P53及Bad等的表达,诱导细胞自噬(autophagy)与细胞凋亡(apoptosis)[24]。本研究发现,双香豆素诱导SL-221细胞的SL-PI3K、SL-TOR基因相对表达量显著下调,提示双香豆素能够抑制PI3K/TOR营养信号通路的信号传导,促进细胞自噬和凋亡的产生。细胞自噬和细胞凋亡是两种重要的细胞自我消化过程,在真核生物的进化过程中高度保守,又被称为程序性细胞死亡(programmed cell death,PCD),是为了维持内环境稳定,由基因控制的细胞自主有序的主动死亡过程[25]。线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)存在于线粒体内、外膜之间,细胞外源性损伤和自身衰老均可引起MPTP开放。在环境胁迫下,当MPTP不可逆地过度开放时,线粒体跨膜电位崩解,细胞色素C(Cyto C)等促凋亡活性蛋白释放至胞浆内促使细胞凋亡。在该过程中,线粒体膜电位下降是凋亡的早期表现,一旦线粒体膜电位损耗,细胞就会进入不可逆的凋亡过程[26-28]。目前已发现Bcl-2蛋白家族包括25种家族同源蛋白,其中抑制凋亡因子Bcl-2、Bcl-x和Bcl-w能阻止Cyto C从线粒体释放到细胞质,而促凋亡因子Bad、Bid和Bax可促进Cyto C从线粒体释放到细胞质,从而调控细胞凋亡[29]。本研究发现,双香豆素处理SL-221细胞48 h后,线粒体膜电位显著下降,且凋亡相关基因SL-CytoC、SL-P53上调,SL-Bcl-2下调,表明双香豆素可诱导SL-221细胞发生线粒体途径的凋亡。
综上,天然产物双香豆素对SL-221细胞的抑制活性优于印楝素,且原材料易获取,深入研究发现双香豆素可通过PI3K/TOR营养信号通路,诱导SL-221细胞自噬和凋亡,从而抑制细胞增殖,但其具体的调控机制及对虫体的生物活性仍需深入探讨。

