大灰藓低温响应的时间动态*
关易云,雷纯义,王倩,巫韬,刘蔚秋
1.广东省热带亚热带植物资源重点实验室/中山大学生态学院,广东深圳 518107
2.广东封开黑石顶省级自然保护区管理处,广东肇庆 526536
3.江西省林业科技推广和宣传教育中心,江西南昌 330038
自然环境中的水分、热量、光照和营养盐等因子处于波动中,当这种波动范围大于植物的最适生长范围时,植物即处于胁迫状态。温度胁迫是植物最常面临的环境胁迫之一,在遭遇温度胁迫时,植物代谢失衡将导致活性氧的积累以及膜稳定性的破坏,进而影响植物的生长、代谢和发育[1-2]。
植物在其演化过程中,形成一系列适应机制以度过不良环境。植物内源激素是植物重要的生长调节物质,脱落酸(ABA)、乙烯(ETH)、茉莉酸(JA)和水杨酸(SA)在胁迫条件下作为整合外部胁迫信号和内部代谢的信使,调节植物的胁迫响应,被定义为胁迫激素[3-4]。ABA 在植物胁迫响应中起着关键作用,ABA 积累可以激活一系列胁迫代谢的活性[4-6]。ETH、JA 和SA 常被认为主要与生物防御有关[7],但它们在非生物胁迫响应中亦具重要作用[8-9],而目前有关ETH、JA 和SA 对苔藓植物胁迫调节的研究很少[6]。抗氧化防御系统是植物重要的胁迫响应途径,在胁迫条件下抗氧化酶如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物歧化酶(POX)等的活性上升以清除体内过量的活性氧。温度胁迫亦可导致植物体内的渗透调节物,如脯氨酸、可溶性糖等含量上升,以应对非适宜温度导致的渗透胁迫[10]。苔藓植物的内源激素、抗氧化系统和渗透调节物均积极参与植物的低温响应过程[11-12]。
植物在由适宜温度向非适宜温度的转换过程中,会经历一个代谢调节过程,不同的代谢途径在此过程中会经历不同的变化,且这种变化与植物的种类、品种均密切相关[13-15]。另外,植物在经历温和的低温环境驯化后,常常会形成胁迫印记,使其可以更好地应对未来的同类或不同类胁迫[6,16]。了解植物在非最适温度条件下的代谢调整动态有助于人们深刻认识植物的胁迫适应策略,也有助于人们认识植物温度驯化及胁迫印记的建立机制[13,17]。
苔藓植物体型矮小、结构简单、缺少角质层和维管组织,但其种类繁多、分布广泛,为继被子植物之后的第二大陆生植物类群,同时其系统位置重要,研究苔藓植物胁迫响应特征可丰富人们对植物胁迫响应机制的认识,并为其保护提供理论依据。虽然对于苔藓植物低温胁迫的响应已经有一系列研究,但有关苔藓植物在低温响应过程中的时间动态尚未见报道,基于此,我们以广泛分布的大灰藓(Hypnum plumaeforme)作为研究对象,研究其在适宜温度环境(15~20 ℃)和非最适的温和低温环境(2~4 ℃,正常年份实验研究地黑石顶地区的最低温)条件下氧化胁迫及其生长调节特征,探讨大灰藓对低温响应的开启过程及其响应机理,并探讨苔藓植物中的胁迫记忆物质。
1 材料和方法
1.1 研究地概况
研究点位于广东省肇庆市封开县黑石顶自然保护区(23°25′~23°29′N,111°49′~111°55′E),属南亚热带湿润季风气候,根据位于保护区气象站的数据,保护区年均温度约19.5 ℃,最低月均温(1月或2 月)和最高月均温(7 月或8 月)分别为10.3~10.6 ℃和26.3~28.4 ℃;年降雨量1 740~2 096 mm,其中79%的降水集中在4~9月。
1.2 实验设计
在黑石顶自然保护区野外环境采集生长状况良好的大灰藓配子体植物材料,种于33 个30 cm×50 cm 的人工种植床内,种植密度模仿野外生长情况,种植床置于一林缘山谷中自然条件驯化1 周,驯化期间保持土壤湿润。驯化期间平均气温为16.3 ℃。驯化结束后,取3 个盆的样品作为起始(0 h)样品。剩余30 个种植盆平均放入两个光照培养箱中(每个培养箱15 盆,分别作为对照组和低温处理组),培养箱光周期均设置为12 h 黑暗/12 h光照,光照强度约为2 000 lx,其中低温处理组温度设置为2 ℃(黑暗)/4 ℃(光照);对照组温度设置为15 ℃(黑暗)/20 ℃(光照)。放入时先开始12 h光照处理,处理期间每天均匀喷水保持苔藓表面湿润,实验共持续276 h。在处理12、36、84、180 h以及处理结束时(276 h)分别取出3 个低温组和对照组种植盆,剪取苔藓植物上部2 cm 部分用于相关生理指标测定。为避免日周期的影响,每次取样时间均在光周期结束时进行。
1.3 生理指标测定
剪下的苔藓植物样品用蒸馏水反复冲洗干净后迅速用吸水纸吸干水分,立即置于液氮中贮存并于24 h内完成相关生理指标测定。
1.3.1 植物激素测定 取1.0 g 苔藓样品用7 mL
经预冷的PBS 缓冲液(pH=7.4)研磨,在4 ℃条件下提取1~2 h,4 000 r/min离心15 min后收集上清,离心管封口,-20 ℃冷冻保存。ABA、ETH、SA以及JA 含量采用ELISA 试剂盒(上海酶联生物科技有限公司,中国上海)测定。
1.3.2 丙二醛、过氧化氢及相关酶活测定 取0.5 g苔藓样品用7 mL 经预冷的提取缓冲液[0.1 mol/L pH 7.8的PBS缓冲液,内含0.1 mmol/L EDTA-Na2和φ=16%甘油]低温研磨提取,所得匀浆倒4 ℃条件下12 000 r/min离心5 min,取上清液待测。此提取液用于丙二醛(MDA)、过氧化氢(H2O2)、SOD(EC 1.15.1.1)、CAT(EC 1.11.1.6)和愈创木酚POX(EC 1.11.1.7)以及可溶性蛋白的检测。
MDA 含量采用硫代巴比妥酸(TBA)显色法[18]测定;H2O2含量用南京建成生物工程研究所(中国南京)试剂盒测定;可溶性蛋白含量测定采用考马斯亮蓝显色法[19]。SOD 和POX 活性分别采用氯化硝基四氮唑蓝(NBT)光还原法[20]和愈创木酚法测定[18];CAT活性根据李仕飞等[21]的方法改进后测定。
1.3.3 脯氨酸含量测定 称取1.0 g的苔藓样品用事先预冷的氨基酸提取液30 mL研磨提取,室温放置5 min后抽滤,滤液转入干净的三角瓶中,向三角瓶中加入5 mL 氯仿,6 mL 蒸馏水,摇晃混匀后转入50 mL离心管静置分层。待分层清晰后,收集上层水相,并向氯仿相加入φ=50%甲醇6 mL,摇晃混匀,待液体再次分层后取表面水相,与上一次分层水样合并,加蒸馏水补至40 mL,即得氨基酸提取液[22]。脯氨酸测定方法参考李绍军等[23]的方案。
1.3.4 可溶性糖含量测定 称取0.3 g 苔藓样品,用预冷的φ=80%乙醇20 mL 研磨提取,提取混合物于80 ℃水浴提取30 min。冷却后抽滤,滤液定容至50 mL,加入0.5 mL饱和碱式醋酸铅溶液,摇匀以沉淀蛋白质等杂质。沉淀充分后加入0.2 g 草酸钠以除去过量的铅离子,过滤即得到可溶性糖提取液。蒽酮比色法测定可溶性糖含量[18]。
1.4 数据统计方法
各指标在相同条件下不同取样时间的差异显著性采用单因素方差分析(ANOVA,LSD,P<0.05),同一取样时间不同温度处理间的差异显著性采用独立样本t-检验(P<0.05)。分析软件均为SPSS 23.0。
2 结果与分析
2.1 氧化胁迫
对照处理组在实验期间MDA含量无显著变化,而低温处理12 h 时MDA 含量略有上升(差异不显著),但此后MDA含量降低并趋于稳定(图1a)。
在实验期间,对照组H2O2含量略有波动,而低温处理组中H2O2含量波动幅度远大于对照,且整体水平略高于对照组,180 h 后对照组和低温组大灰藓的H2O2含量渐趋一致(图1b)。
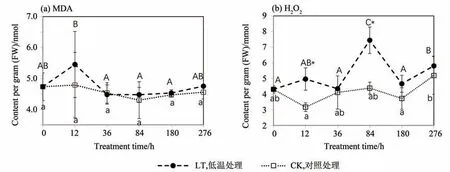
图1 温度处理276 h期间大灰藓体内丙二醛(MDA)和过氧化氢(H2O2)含量的动态变化(平均值±标准差,n=3)Fig.1 Dynamics of malondialdehyde(MDA),and H2O2 contents in Hypnum plumaeforme during the 276 h treatment(mean±S.D.,n=3)
2.2 抗氧化酶活性
实验处理初期低温组和对照组的SOD 活性均下降,但对照组至12 h 后逐渐上升,到180 h 时恢复至初始水平;低温组SOD 活性在36 h 时达到最低,此后逐渐回升,但始终低于初始值,亦低于对照组(图2a)。
实验处理期间CAT活性呈下降趋势,但低温组的CAT 活性整体略高于对照(图2b)。POX 活性在处理84 h之前呈明显的波动状态,低温组在处理实验12 h时显著上升,到36 h时降至初始水平,至84 h再次回升,对照组则表现出刚好相反的波动趋势;实验处理84 h后,对照组和低温组POX活性均呈下降趋势,且低温组POX活性高于对照组(图2c)。
2.3 相容性物质含量
实验期间,对照组和低温组大灰藓可溶性蛋白含量均呈下降趋势,两者间的差异相对较小(图2d)。
对照组的可溶性糖含量在实验期间较稳定,仅在处理12 h 时有小幅下降,而低温处理组可溶性糖含量在36 h 后大量积累,至84 h 达到峰值,较初始值升高64.49%,至276 h 时仍较初始值高40.94%。实验期间低温组可溶性糖含量整体高于对照组,特别是在84 h 后低温组可溶性糖含量大幅上升,远高于对照组(图2e)。
对照组脯氨酸含量在实验期间无显著变化,但低温处理组中脯氨酸含量持续降低,至180 h 后趋于稳定的趋势,在实验结束时(276 h)低温处理组中脯氨酸含量较初始值降低了40.11%(图2f)。

图2 温度处理276 h期间大灰藓体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物歧化酶(POX)活性以及可溶性蛋白、可溶性糖和脯氨酸(Pro)含量的动态变化(平均值±标准差,n=3)Fig.2 Dynamics of superoxide dismutase(SOD),catalase activity(CAT)and guaiacol peroxidase(POX)activities in Hypnum plumaeforme during the 276 h treatment(mean±S.D.,n=3)
2.4 激素含量
由图3 可见,所测定的4 种激素在实验期间表现出类似的动态特征:对照条件时激素水平整体波动较小,而在低温条件下,4 种激素在12 h 时含量大幅上升,此后下降,至36 h 时与初始值接近,之后逐渐升高并趋于稳定。至276 h 的实验结束时,低温处理组ABA、JA、SA和ETH含量较初始值分别上升22.9%、98.3%、70.4%和71.6%,且均显著高于同一时间对照组。

图3 温度处理276 h期间大灰藓体内脱落酸(ABA)、茉莉酸(JA)、水杨酸(SA)和乙烯(ETH)含量的动态变化(平均值±标准差,n=3)Fig.3 Dynamics of abscisic acid(ABA),jasmonates(JA),salicylic acid(SA)and ethylene(ETH)contents in Hypnum plumaeforme during the 276 h treatment(mean±S.D.,n=3)
3 讨 论
3.1 氧化胁迫响应
低温条件下,由于光系统受损,导致细胞内O2-、·OH 和H2O2等活性氧成分积累[24-25],但在其生长耐受阈值内,植物可通过多种途径清除过量的活性氧,抗氧化酶系统是清除活性氧的主要机制之一[26-27]。低温处理早期,不同物种或品种抗氧化系统变化格局明显不同[13-14]。
H2O2可作为信号分子调节细胞功能,但高浓度H2O2损害植物的细胞的完整性[28]。本研究中,低温处理大灰藓体内H2O2的含量在12 h 时显著高于对照,此后处于波动状态,显示在胁迫的过程中植物体内H2O2的积累和酶系统对其的清除处于动态调整过程中。MDA 是植物细胞膜过氧化的指标,显示植物细胞膜受损程度[29],在非最适温度条件下,植物体内MDA 含量在早期上升,但此后会逐渐下降[14-15],大灰藓MDA 含量在2 ℃/4 ℃温度条件下表现出相似的变化规律,在12 h 有小幅上升,但此后降至初始水平,显示大灰藓可通过自身调节较好地应对2 ℃/4 ℃的非最适生长温度。
SOD 作为抗氧化酶系统中第一步起作用的酶,在植物抗氧化胁迫中起着重要作用[30],但不耐寒植物在低温处理时SOD 活性可能降低[27],此前我们的研究亦显示,大灰藓和小金发藓在低温条件下SOD 酶活性均下降[11]。本研究中SOD 在低温前期迅速下降,且36 h 后一直明显低于对照,与此前的研究结果一致。另外,植物体内MDA 含量并未大幅上升,我们推测非酶活性氧清除系统参与了低温条件下活性氧O2-、·OH 的清除。CAT 和POX 是清除H2O2的主要酶系统。本研究中,对照组大灰藓在实验期间CAT 和POX 活性均表现出大的变化,可能与培养箱水湿条件与自然环境有一定差异有关。处理期间低温处理组CAT 活性整体高于对照组;低温处理组POX 活性在84 h 后高于对照组水平,显示苔藓植物中CAT 和POX 在低温条件下被激活参与H2O2的清除过程。
3.2 细胞渗透调节
低温条件下植物会因水分吸收受阻和细胞失水间接引起渗透胁迫[31],植物可以通过积累相容性物质,如可溶性蛋白、可溶性糖和脯氨酸等来增大细胞液浓度,以维持细胞渗透压及膜稳定性[32-33]。
可溶性糖不仅可作为重要的渗透调节物质,还能为细胞代谢提供碳源和底物[34],是植物渗透胁迫条件下普遍积累的细胞相容性物质之一。本研究中,低温组大灰藓体内可溶性糖在84 h 大幅升高至远高于对照,此后整体维持在较高水平,脯氨酸在处理期间大幅下降且远低于对照水平,而此前的研究显示大灰藓在1~3 ℃的低温处理条件下,脯氨酸含量呈上升趋势[35],显示大灰藓脯氨酸的温度响应较为复杂,其温度响应的敏感度和温度阈值尚需进一步研究。
3.3 抗逆激素调节
植物的低温响应是一个高度复杂精细的过程,在此过程中发生复杂的信号级联反应,而植物激素则往往是这些反应的信号物质[36]。ABA 可调控多种胁迫响应基因的表达,调节植物抗氧化活性及细胞相容性物种的积累[4,12,26],胁迫条件下苔藓植物体内ABA 含量亦大幅上升,为苔藓植物胁迫响应的重要调控激素[6],但不同物种植物在胁迫条件下JA、SA 和ETH 的变化存在一定的差异[6,37-39],表现出明显的物种分化。本研究中,低温处理大灰藓体内ABA、JA、SA和ETH含量变化的时间格局一致,均在12 h 时迅速上升,在36 h时显著下降,在84~276 h 期间稳定上升。我们推测大灰藓体内抗逆激素在低温处理的12 h 内迅速升高,以迅速调节其代谢通路应对低温环境,此后由于下游代谢物的积累对激素的含量产生负反馈调节导致激素含量降低,但之后植物逐渐适应低温环境开始重建新的平衡状态,各个激素含量回升并趋于稳定,至84 h后期4种抗逆激素保持在较高的稳定水平,共同调控低温下大灰藓的基因表达和生理生化过程。
4 结 论
较温和的低温处理(2 ℃/4 ℃)导致大灰藓植物体内抗逆激素迅速响应,处理12 h 即大幅上升,显示其作为信号及调节物质的快速响应。在低温处理的前期,大灰藓的H2O2含量和抗氧化酶指标亦从处理12 h 起即表现出较为剧烈的调整,在实验处理期间植物体处在不断的调整和适应过程中,而可溶性糖在84 h 时才明显上升,显示其响应速度相对较慢,处于调节通路的下游部分。处理84 h后,各项指标渐趋稳定,表明新的平衡逐渐形成。在实验处理后期,植物体内积累的高含量抗逆激素和可溶性糖可作为苔藓植物的胁迫印记物质。

