低共熔溶剂回收弛放气中NH3工艺的模拟计算
邓东顺,方 浩,郑春耀
(浙江工业大学 化学工程学院,浙江 杭州 310014)
氨气(NH3)是大吨位的基础化工产品,被广泛用于各种化肥的制造。作为在分子结构中引入氮元素的起始原料,NH3被广泛应用于化学纤维、塑料橡胶和制药等工业中。粮食增产对化肥的需求和化工行业的拓展促使了合成氨工业的快速发展。NH3的合成和使用环节都要涉及到含NH3弛放气和尾气的排放问题。如果将合成氨弛放气直接排入大气,不仅会损失有价值的氨资源,而且会带来严重的环境问题。氨在大气中被氧化生成NOx,NOx溶于雨水形成酸雨污染水循环系统;另外,NH3会与酸性的NOx和SOx形成无机盐,经复杂的物理和化学过程实现颗粒化,成为雾霾和PM2.5的污染源,最终影响工农业生产和人类的生存环境。因此,对弛放气中NH3进行吸收并回收一直受到科技工作者的广泛关注[1-3]。目前,弛放气中NH3的处理工艺主要有低温回收法和酸水吸收法。低温回收法利用节流膨胀原理降低弛放气的温度,从而达到分离回收氨的目的,然而该法存在NH3回收不完全的缺点,处理后的尾气中仍有1%~2%的NH3残留[4-5]。酸水吸收法则是利用NH3在水中具有极大的溶解度的特点,采用酸水洗涤含NH3废气,使其溶于水中以达到吸收的目的,然而该法耗水量巨大,并且产生大量低价值的稀氨水,提浓过程耗能高。因此,开发出高效、低能耗的NH3回收新工艺,减少弛放气污染物的排放具有良好的经济价值和环境效益[6]。
离子液体(ILs)是近二十年来广受关注的绿色溶剂,在化工诸多领域都有应用的报道,其主要优点是蒸气压极低、热分解温度低和结构可设计,可被用于气体的吸收和分离,在分离出高纯度气体和降低能耗方面具有独特的优势,ILs吸收NH3的方法包括物理吸收和化学吸收。物理吸附过程主要取决于离子液体的结构和性质,而化学吸附过程中NH3的溶解度主要取决于离子液体上的官能团[7-8]。Li等[9]测定了NH3在ILs中的溶解度。陈晏杰等[10]设计出了一种基于[C4mim]BF4的回收弛放气中NH3的工艺,并用Aspen plus软件对其进行模拟,结果表明:与传统工艺相比,该工艺节能17.5%。然而,ILs价格高、黏度大、制备工艺复杂和生物降解性差等不足也限制了其工业化应用的推广。例如。近年来发展的低共熔溶剂(DES)作为离子液体类似物日益受到关注[11]。它们由氢键受体(Hydrogen bond acceptor,HBA)与氢键供体(Hydrogen bond donor,HBD)按一定比例直接混合而成,且熔点大大低于原料组分的熔点。DES被誉为新一代的可调控溶剂,不仅具有ILs类似的溶剂特性,而且克服了ILs的许多不足,同时增加了混合比例这一调控维度,为DES获取合适的物理性质(如黏度、密度和表面张力等)提供了新的途径[11-13]。近年来,DES被广泛用于多种化工反应和分离,对于NH3的吸收和分离,涉及的DES主要包括氯化胆碱类、苯酚类和质子酸类。其中,由氯化胆碱(ChCl)和尿素(Urea)组成的体系是最早被提出来的DES,其具有原料便宜、来源广泛、毒性低和生物相容性好的特点,被广泛用于CO2,CH4和NH3的吸收,尤其是ChCl和Urea摩尔比为1∶2被认为具有良好的吸收效果,且生产成本仅为传统离子液体的4%~9%[14]。Zhong等[15]报道了在温度为298.15,313.15,323.15,333.15,343.15,353.15 K,压力为0~300 kPa的条件下,NH3在不同摩尔比ChCl+Urea(ChCl与Urea摩尔比分别为1∶1.5,1∶2,1∶2.5)中的溶解度。另外,对该体系的物理性质测定和热力学参数估算工作开展较多。基于DES具有类似于离子液体的诸多特点,笔者提出利用ChCl+Urea(ChCl与Urea摩尔比为1∶2)DES吸收弛放气中NH3的新工艺,并运用软件模拟吸收过程。采用非随机双液模型和Redlich-Kwong方程(NRTL-RK)关联ChCl+Urea-NH3体系以及ChCl+Urea-CH4体系的气液平衡实验数据,对DESs回收弛放气中NH3的工艺进行模拟计算和理论分析,优化分离操作的工艺参数,以期为DES用于弛放气的工业化应用和设计提供依据。
1 工艺流程设计
合成氨厂弛放气的主要成分包含H2,N2,CH4,Ar以及少量NH3,不同合成氨厂弛放气的组成存在一定差异。笔者选取典型的合成氨厂弛放气[10]为研究对象,其摩尔分数如表1所示。
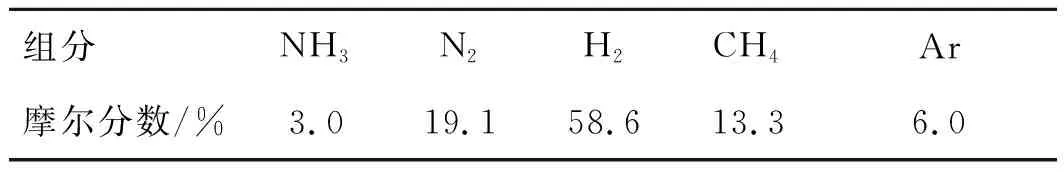
表1 合成氨厂弛放气的组成Table 1 Composition of purge gas
选择ChCl+Urea DES作为物理吸收溶剂,它在较低的温度和中等压力下对NH3具有较高的捕集容量。模拟流程主要包括气体吸收和吸收剂解吸再生两部分。由于解吸温度远低于ChCl+Urea的沸点,笔者采用简单的两级闪蒸工艺彻底解吸富液中的NH3,实现吸收剂的再生利用和NH3的回收。
建立的模拟过程完整工艺流程如图1所示。弛放气与来自闪蒸罐F1中的气体(含少量的NH3)混合进入吸收塔AB。吸收塔顶部喷洒NH3吸收剂ChCl+Urea,采取逆流吸收的方式提升气液传质效果。经吸收后的气体直接排空,含NH3的富液从吸收塔底部出来后直接进入一级闪蒸罐F1,释放溶解的CH4和部分NH3。从F1顶部出来的混合气回到吸收塔,底部富液进入二级闪蒸罐F2,通过进一步提高温度和降低压力实现溶剂的完全再生回收,解吸出来的NH3经压缩、冷却和气液分离纯度达到99%以上。从气液分离器中出来少量吸收剂与F2中的溶剂混合,经换热后循环回吸收塔。为了减少过程的热损失,将吸收塔前的冷却装置和F2前的加热装置合并为换热器EX,充分实现过程中的热交换。
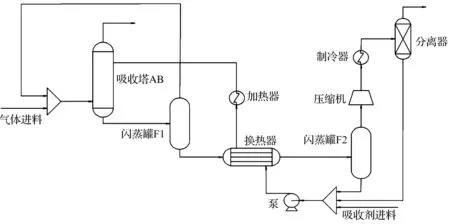
图1 DES回收弛放气中氨的工艺流程图Fig.1 Flow chart of ammonia recovery from purge gas by DES
2 热力学模型
过程模拟的准确性受制于气液相平衡的精确计算,因此合理的热力学模型的选用及可靠的物性参数的获取直接关系到模拟结果的收敛性以及模拟结果的可信度。模拟软件包含强大的纯组分物性数据库,能提供几十种气-液或液-液相平衡计算方法和多种传递性质计算方法,可满足绝大多数工艺过程的模拟需求。对于DES吸收弛放气中NH3的工艺模拟,软件数据库能提供NH3,N2,H2,Ar和CH4的物性数据,但缺少ChCl+Urea的物性数据。模拟参数采用相关文献估算的数据[16],并列于表2,3中,包括ChCl+Urea的摩尔质量M、偏心因子ω、沸点Tb、临界温度Tc、临界压力Pc和临界体积Vc,以及与温度相关的黏度η、热容Cp、液相体积Vl和表面张力σ[16-17]。

表2 ChCl+Urea的物性数据Table 2 The scalar parameters for ChCl+Urea

表3 ChCl+Urea的温度相关参数Table 3 The temperature-dependent correlation parameters for ChCl+Urea
采用NRTL方程描述极性液相的相行为,利用RK状态方程计算气相组分的逸度系数[18]。最终选用NRTL-RK模型关联和预测ChCl+Urea-NH3以及ChCl+Urea-CH4体系的气液平衡数据。由于H2和Ar在ChCl+Urea中的溶解度非常小,因此在流程模拟过程中将其设置为亨利组分。
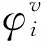
(1)
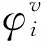
(2)
(3)
气体i在液相中的活度系数γi用NRTL方程来计算,任一组分的活度系数可表示为
(4)
(5)
NH3及CH4在ChCl+Urea中的溶解度数据摘自文献[15,18],具体列于表4,5中,p为NH3与CH4的平衡压力,xNH3和xCH4分别为气液平衡时ChCl+Urea中NH3和CH4的摩尔分数。
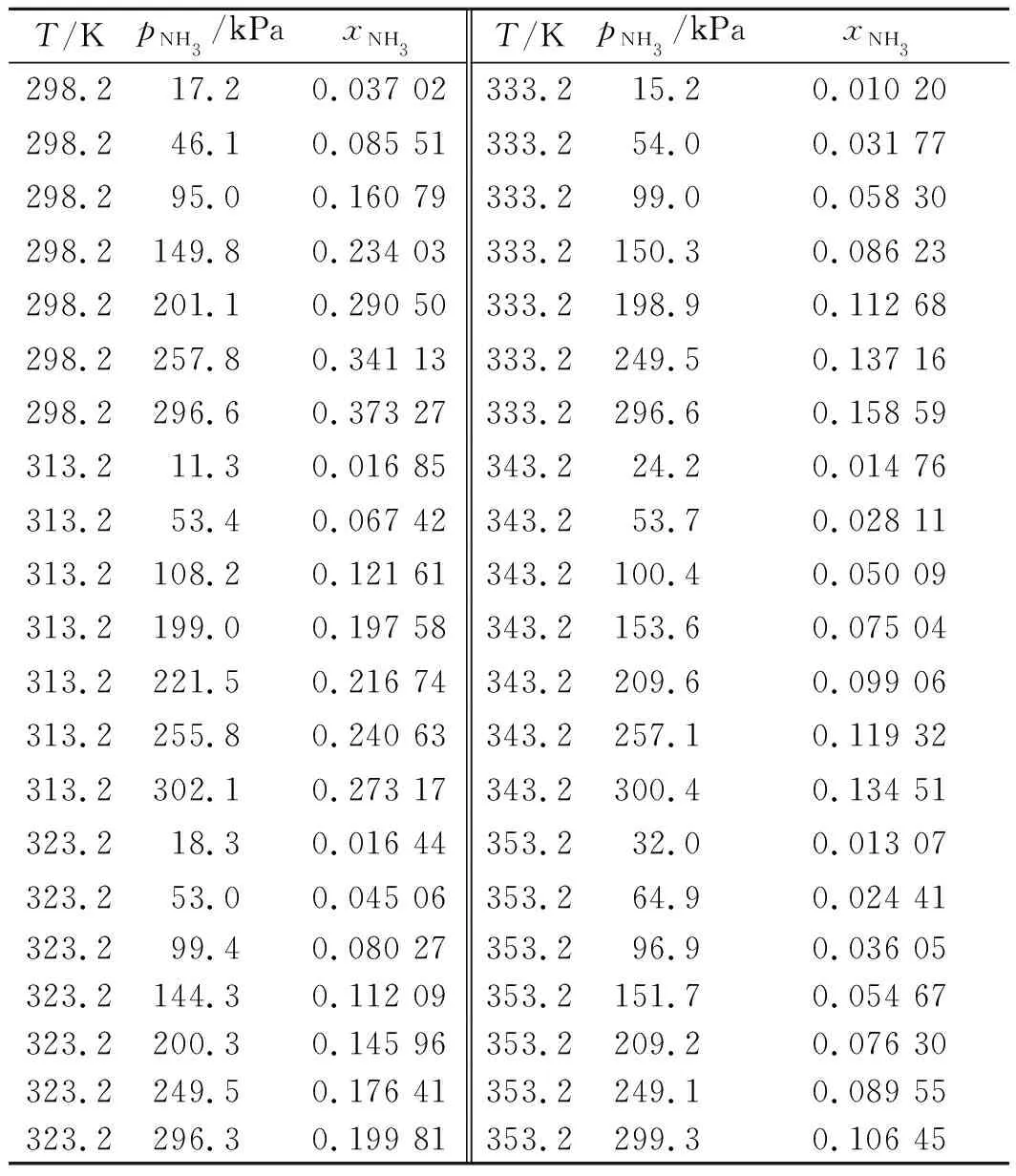
表4 NH3在ChCl+Urea中的溶解度xNH3Table 4 Solubility of NH3 in ChCl+Urea
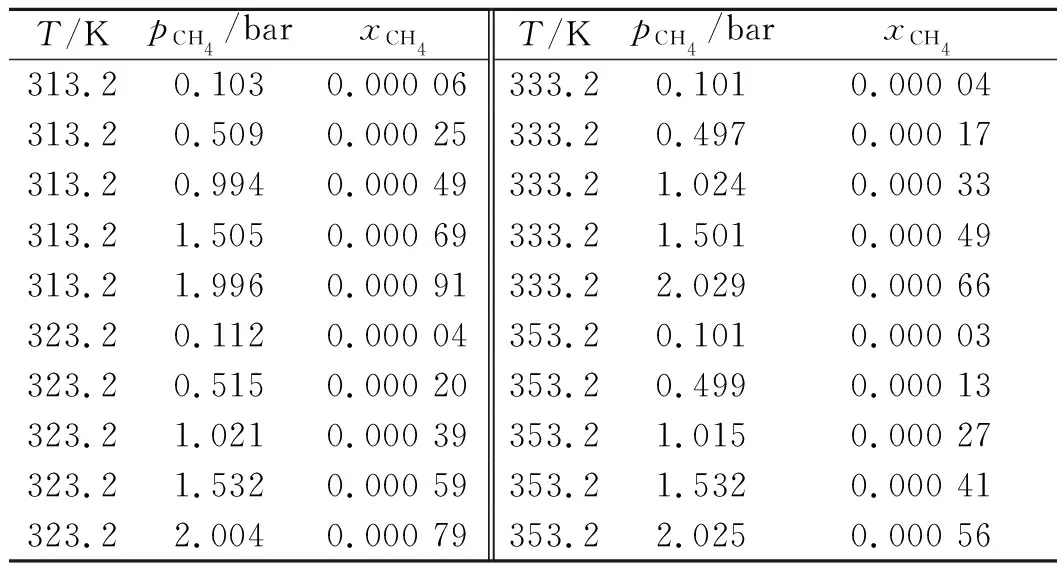
表5 CH4在ChCl+Urea中的溶解度xCH4Table 5 Solubility of CH4 in ChCl+Urea
ChCl+Urea对NH3的吸收可以假设为由液膜控制。考虑到ChCl+Urea黏度对吸收过程的影响,选用Rate-Based模型进行模拟,基于Chan和Fair提出的方法计算筛板液相传质系数[19-20],即
(6)
式中:kL为液相传质系数;Di,L为液体的扩散系数;Fs为表观F因子;L为液相的总摩尔流量;tL为液体平均停留时间;ρL为液体的平均摩尔密度;aI为总传质面积。
关联ChCl+Urea-NH3和ChCl+Urea-CH4两个体系的实验数据,获得的相互作用参数如表6所示。ChCl+Urea-N2体系缺乏实验数据,相互作用参数取自文献的估算值[21],也一并列于表6中。
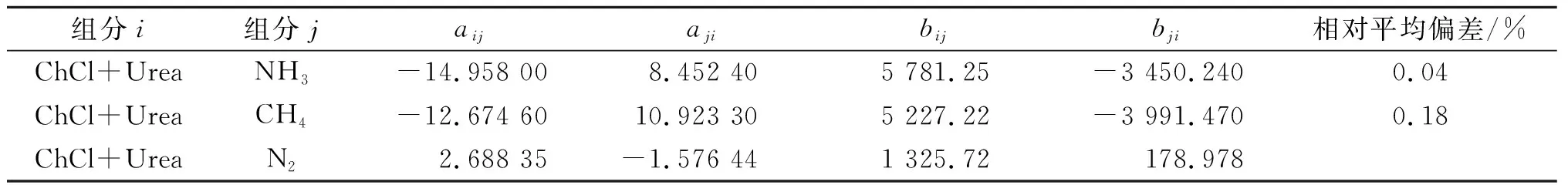
表6 NRTL二元交互参数(α=0.2)Table 6 The NRTL binary interaction parameters (α=0.2)
为了考察交互参数的准确性,分别绘出了ChCl+Urea-NH3以及ChCl+Urea-CH4二元体系总压及溶解度实验值(取自表4,5中所有温度压力条件下的数据)与模型关联值的对比图(ChCl与Urea摩尔比为1∶2),结果如图2,3所示。由图2,3可知:ChCl+Urea-NH3以及ChCl+Urea-CH4二元体系的总压、溶解度的关联值与实验值十分接近,相对平均误差均在0.5%以内,说明本模拟采用的NRTL-RK模型是合理的。
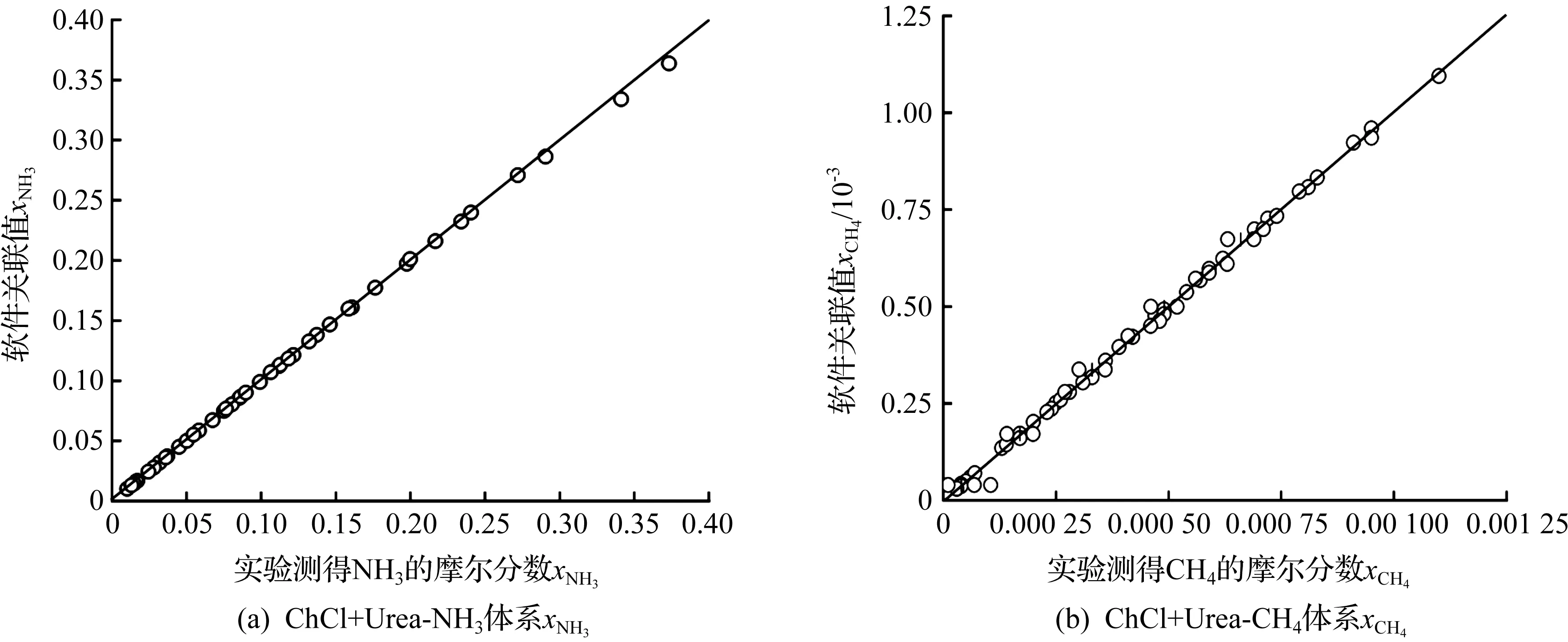
图2 不同温度下ChCl+Urea中和的实验值与关联值比较Fig.2 Comparison of experimental values and correlation values of xNH3 and xCH4 in ChCl+Urea at different temperatures
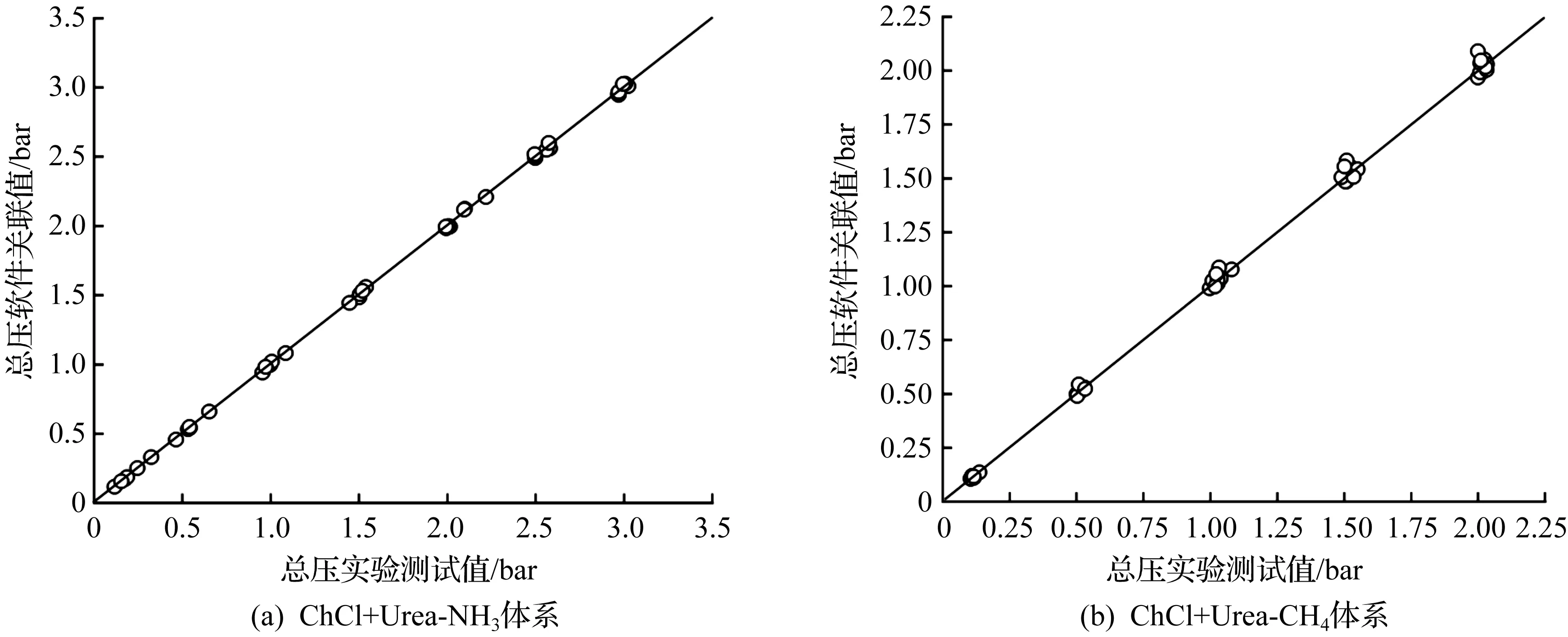
图3 不同温度下ChCl+Urea-NH3和ChCl+Urea-CH4体系总压实验值与关联值比较Fig.3 Comparison of experimental and correlation total pressures for ChCl+Urea-NH3 and ChCl+Urea-CH4 at different temperatures
3 模拟优化
笔者选择1 000 Nm3/h,25 ℃,20 bar的弛放气作为研究对象。依据《恶臭污染物排放标准》(GB 14554—1993)中一级排放标准以及工厂的设计要求,塔顶净化气氨质量浓度需要低于1 mg/m3,即NH3摩尔分数在50×10-6以下,再生氨摩尔分数高于0.95,根据NH3在ChCl+Urea中的溶解度计算得到ChCl+Urea的进料量约为7 000 kg/h。
通过整个过程的灵敏度分析可以得到不同工艺参数对新型DES吸收NH3工艺的影响以及合理的工艺条件。以几个重要参数为评价指标对该工艺进行了评价:1) 塔顶净化气中NH3的摩尔分数(PG);2) 再生氨的摩尔分数(PRO);3) 氨的回收率(RNH3)。
3.1 DES质量流量的影响
优化约束条件:保持吸收塔的温度为10 ℃,压力为20 bar不变;F1的温度为40 ℃,压力为1 bar;F2的温度为100 ℃,压力为0.07 bar。
吸收剂的质量流量是主要影响因素,直接影响NH3的吸收,随着质量流量的增加,根据物料守恒可以得到PG下降,且NH3在DES中的溶解度较大,为了使富液中的氨解吸完全,需要提高F2的温度以及减小F2的压力。因此,PRO随着DES质量流量的增加有减小的趋势。
笔者考察了6 000~20 000 kg/h下,DES质量流量对模拟过程中几个重要参数的影响,实验结果如图4所示,随着DES质量流量的增大,PG从46.5×10-6减小到12.5×10-6,PRO从0.976 3下降到0.924 4。由图4可知:实验范围内DES的质量流量都能使PG达到要求。当DES质量流量达到一定值(约13 000 kg/h)时,PRO将达不到要求。考虑到原料的利用率,继续增大DES质量流量没有进一步的效益。在后续的模拟分析中,取DES质量流量为7 000 kg/h,过程中NH3的回收率高达99.34%。
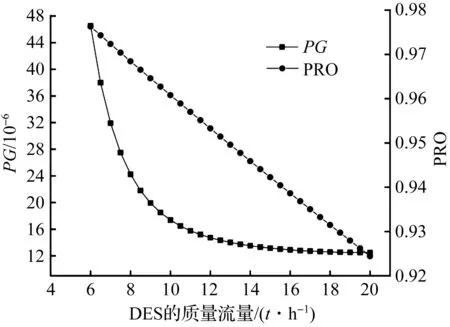
图4 DES质量流量对PG和PRO的影响Fig.4 Influence of DES mass flow rate on PG and PRO
3.2 吸收塔温度和压力的影响
优化约束条件:DES质量流量为7 000 kg/h;F1温度为40 ℃,压力为1 bar;F2温度为100 ℃,压力为0.07 bar。
吸收塔塔板的数量会影响弛放气的吸收容量。研究发现更多的塔板对NH3吸收的影响很小,因此选取12个塔板。在不同温度和压力条件下,DES对NH3的溶解度和选择性不同,导致吸收塔中温度和压力会对流程产生重要的影响,吸收塔的压力主要影响DES对NH3的选择性,吸收塔的温度影响NH3在DES中的溶解度。因此,在吸收塔的灵敏度分析中,研究了吸收塔温度和压力对PG和PRO的影响。
吸收塔压力对吸收过程的影响如图5(a)所示。在吸收塔温度维持在10 ℃的情况下,当压力由10 bar提升到100 bar时,PG从91.2×10-6迅速减小到0.89×10-6,而PRO并未发生明显变化,基本维持在0.974左右。说明DES对NH3的选择性随吸收塔压力的增加而增加。吸收塔温度的影响如图5(b)所示,在吸收塔压力保持在20 bar的情况下,在6~30 ℃的温度范围内,温度对DES吸收NH3的过程呈现出负面影响,随着温度的升高,PG显著增加。低温吸收虽然有利于PG的降低,但综合考虑到弛放气的进料条件以及降温需要的能耗,本研究选择吸收塔压力为20 bar,温度为10 ℃,在此工况下,吸收后排放气体的指标均能达到环保要求,且能耗较低。
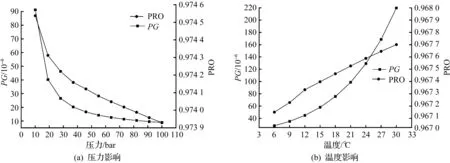
图5 吸收塔压力及温度对PG和PRO的影响Fig.5 Effect of pressure and temperature on PG and PRO in the absorption tower
3.3 F1温度和压力的影响
选择DES的质量流量为7 000 kg/h,吸收塔的温度为10 ℃,压力为20 bar,F2的温度为100 ℃,压力为0.07 bar,考察F1的温度和压力对吸收过程的影响。为了提高PRO,吸收塔中的含氨富液经过F1,解吸少量NH3。大部分H2,Ar,CH4和几乎所有的NH3返回到吸收塔。低压会导致NH3解吸过度,影响NH3回收率,而高压会导致CH4和N2解吸不足,降低再生氨的纯度。与压力相比,温度越高,NH3解吸量越大;温度越低,NH3和CH4解吸量越小。
F1压力对PG和PRO的影响如图6(a)所示。由图6(a)可知:当F1的温度保持在40 ℃时,将压力从0.4 bar增加到5 bar,PG从43.7×10-6减小到34.5×10-6,而PRO则从0.992 3下降到0.873 9。当压力超过2.0 bar时,PRO达不到要求。F1温度对PG和PRO的影响如图6(b)所示。由图6(b)可知:当F1的压力保持在1.0 bar时,在10~50 ℃下,PG从34.1×10-6增加到40.0×10-6,PRO从0.864 1提高到0.982 4。要达到PRO≥95%和PG≤50×10-6的要求,F1的压力必须低于2.0 bar,温度必须为30~50 ℃才能满足工艺要求。为避免不必要的能耗,将F1设为40 ℃等温闪蒸,闪蒸压力为1 bar。
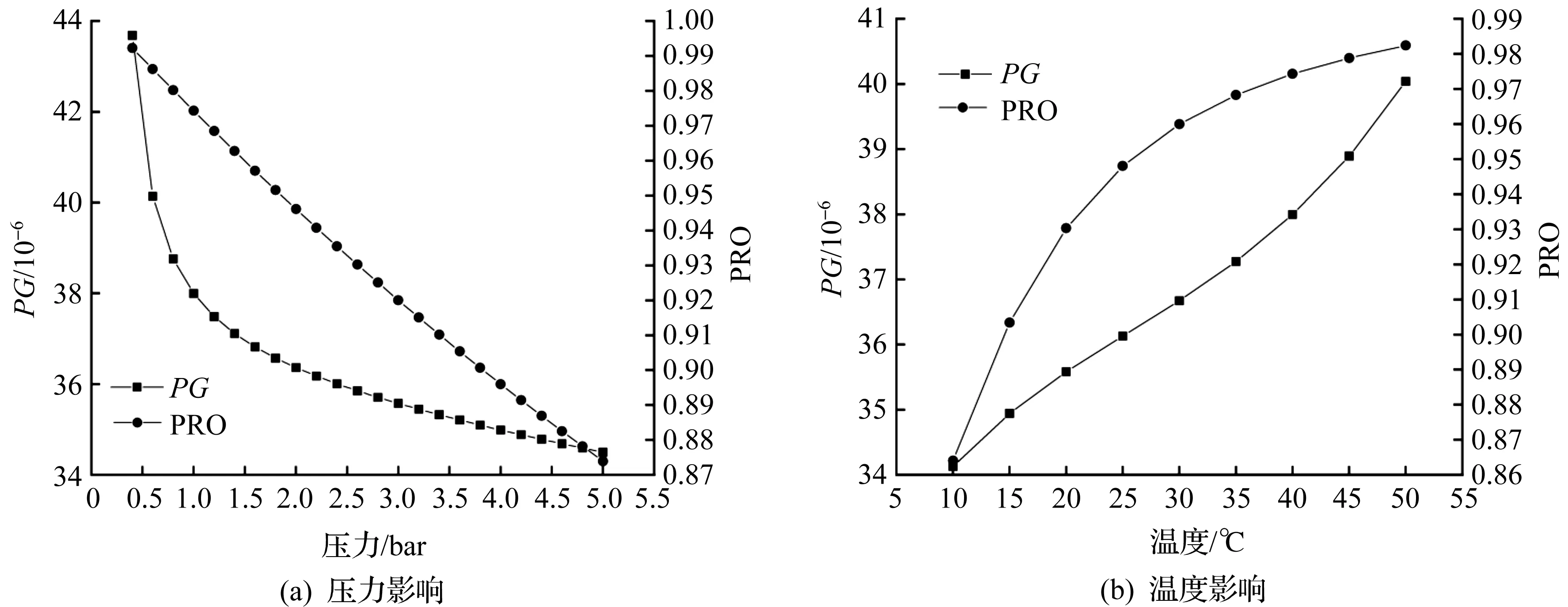
图6 F1压力及温度对PG和PRO的影响Fig.6 Effect of pressure and temperature on PG and PRO in F1
3.4 F2温度和压力的影响
优化约束条件:DES的质量流量为7 000 kg/h;吸收塔的温度为10 ℃,压力为20 bar;F1的温度为40 ℃,压力为1 bar。作为溶剂再生设备,F2采用升高温度和降低压力来实现解吸DES中捕集的NH3。温度过低或压力过高会使NH3解吸不充分,减弱再生吸收剂的气体捕集能力以及增大吸收塔顶净化气中NH3的摩尔分数。
F2压力对PG和PRO的影响如图7(a)所示。由图7(a)可知:当F2的温度保持在100 ℃不变时,随着压力从0.05 bar增加到0.2 bar,PG从17.8×10-6增加到109×10-6,PRO从0.970 1增加到了0.974 8。F2温度对PG和PRO的影响如图7(b)所示。由图7(b)可知:当F2的压力保持在0.07 bar不变时,在70~100 ℃下,NH3的解吸度随温度的升高而增加,PG从83.8×10-6减小到38.0×10-6,PRO从0.975 1下降到0.974 3。为了降低PG,同时满足PRO≥95%,降低DES的蒸发,将F2设为100 ℃等温闪蒸,闪蒸压力为0.07 bar。

图7 F2压力及温度对PG和PRO的影响Fig.7 Effect of pressure and temperature on PG and PRO in F2
3.5 最佳工艺条件和稳态模拟
由于NH3和CH4在离子液体中吸收过程比较简单,选用传统的筛板塔作为吸收装置。采用上述优化获得的关键参数,可以获得工艺流程中各个设备的具体工艺参数。根据模拟分析优化结果,确定工艺流程的最佳工艺条件,结果列于表7。
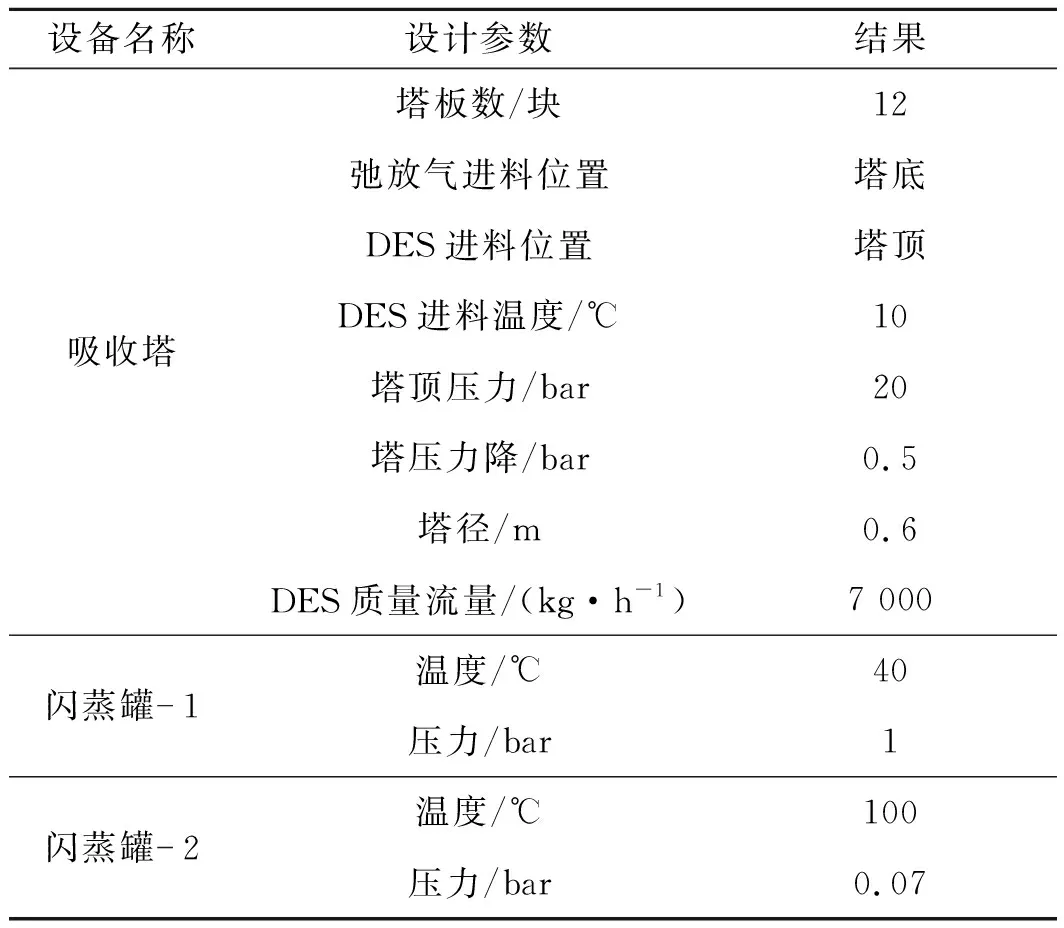
表7 流程模拟优化工艺条件Table 7 Optimization parameters for flow sheet simulation
基于优化后的工艺条件,PG为4.117×10-5,满足设计要求;PRO达到0.974 4,经计算可得整个过程RNH3为99.34%,DES溶剂循环回收率为99.997%。
4 能量平衡分析
基于模块设定值和工艺流程,计算得到的各设备的功负荷结果如表8所示,总功负荷为74.94 kW。该工艺再生氨可直接用于尿素合成或直接冷却作为液氨使用,避免了水洗法后续蒸氨系统的大量能耗或者副产大量低浓度氨水的不足。生产NH3的能耗计算式为
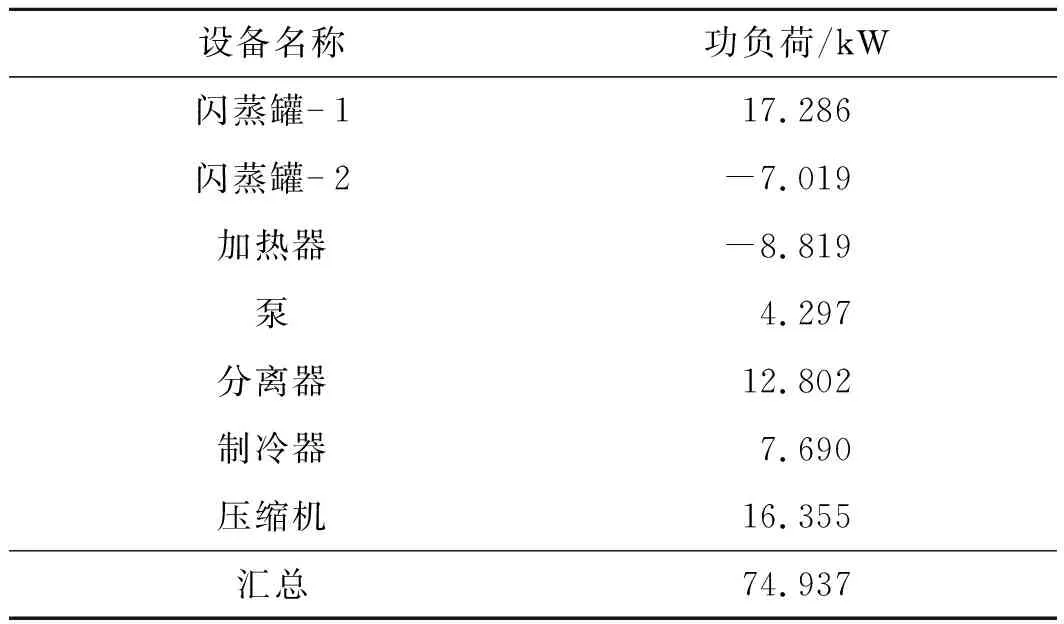
表8 耗能设备的能量消耗Table 8 Energy consumption of major energy- consuming equipment
(7)
式中:W为工艺设备能耗;P为设备总功负荷;MNH3为生产NH3的目标质量;QG为回收氨气的质量流量。其中本工艺的QG为21.05 kg/h,当MNH3取1 000 kg时,W为12.82 GJ。基于[C4mim]BF4设计的回收1 t氨工艺能耗为27.5 GJ[10],本工艺相对于离子液体的工艺节能约53.38%。综合工艺清洁性和能耗两方面的优势,该工艺有较好的工业应用前景。
5 结 论
提出了一种以ChCl+Urea为溶剂从合成氨弛放气中吸收NH3的工艺。吸收条件为温度10 ℃,压力20 bar,回收的再生氨可直接用于尿素合成或直接冷却作为液氨使用,避免了水吸收氨蒸氨系统蒸汽的大量消耗。用NRTL-RK方程描述了ChCl+Urea-NH3以及ChCl+Urea-CH4二元体系的气液相平衡。由于缺乏实验数据,从相关文献中获取ChCl+Urea-N2体系的气液平衡数据进行模拟,并将相关参数进一步输入到软件中进行模拟。结果表明:该模型能很好地关联和预测含DES的二元体系的气液平衡。增大DES吸收的质量流量、减小吸收温度以及适当改变解吸收的温度和压力都能有效地减小净化气中的氨的摩尔分数以及提高再生氨中氨的摩尔分数。DES吸收氨的优化操作条件为:质量流量7 000 kg/h,温度10 ℃。得到的净化气中氨的摩尔分数为4.117×10-5,再生氨中氨的摩尔分数为97.44%,NH3的回收率为99.34%,DES溶剂循环回收率为99.997%,满足设计要求。本工艺相对离子液体回收氨工艺节能约53.38%,该工艺设备简单、操作方便,易实现工业化。本研究为弛放气中NH3的回收提供了一种新的方法,模拟结果对设计工业装置具有指导意义。

