外源褪黑素调控棉花枯萎病抗性研究
朱金成 杨洋 娄慧 张薇
(石河子大学农学院 新疆生产建设兵团绿洲生态农业重点实验室,石河子 832003)
海岛棉(Gossypium barbadense)因其具有优良的纤维品质,是全球高档新型纺织品和特种纺织品不可缺少的重要原料。新疆因充足的光热资源,成为中国海岛棉唯一种植区域,在海岛棉生产中起着关键作用[1-2]。尖孢镰刀菌(Fusarium oxysporum)是一种土传性真菌,可感染120 多种植物,并给棉花、番茄、香蕉和甜瓜等许多重要作物种植带来巨大的经济损失[3]。棉花枯萎病是由尖孢镰刀菌萎蔫专化型真菌(Fusarium oxysporumf.sp.vasinfectum,Fov)引起,该病主要危害棉花的维管束等部位,轻者发育迟缓,纤维品质和产量下降,重者则于苗期或蕾铃期枯死,给棉花生产造成严重损失[4]。由于海岛棉相对陆地棉更易感枯萎病,一旦发生很难根治,使得枯萎病逐渐成为威胁新疆海岛棉产业发展的主要病害[5]。目前棉花枯萎病防治主要有两种,一是生物防治,即培育抗性品种及轮作;二是化学防治。然而,生物防治存在品种培育周期长、轮作受限于种植面积及轮作时间等问题,化学防治存在残留及环境污染等问题[6-7],因此亟需寻找一种无毒、高效且对环境无污染的防治办法。
褪黑素(N-acetyl-5-methoxytryptamine,MT)广泛存在于植物体内,具有多重作用[8]。褪黑素不仅可以促进种子萌发、幼苗生长以及影响植物衰老,而且还参与缓解高温、低温、盐碱、干旱等非生物胁迫[9-10]。研究发现,外源褪黑素的处理能够增强香蕉的抗氧化防御能力,并诱导冷响应基因的表达,从而提高香蕉的抗寒性[11]。外源褪黑素处理可以有效地改善干旱胁迫下番茄幼苗的生长、根系特征、叶片光合作用和抗氧化能力,从而提高番茄幼苗对干旱胁迫的耐受性[12]。在盐胁迫下,不同浓度褪黑素预处理后,棉花种子中可溶性糖、可溶性蛋白质、脯氨酸和K+/ Na+含量高于对照,表明外源褪黑素可以通过增强渗透调节物质和调节盐胁迫下的离子稳态来有效提高棉花种子对盐胁迫的耐受性[13]。外源施用褪黑素还可以通过上调内源褪黑素和赤霉素(GA)含量来延长高温胁迫下番茄幼苗叶片衰老,同时抑制脱落酸(ABA)形成和减少叶绿素降解[14]。近年来,褪黑素在植物抵御各种生物胁迫方面的研究引起了人们的广泛关注。研究发现,外源褪黑素通过调节过氧化氢(H2O2)的产生和茉莉酸(JA)的信号机制,在番茄对灰霉病菌的抗性中起到促进作用[15]。外源喷施褪黑素可提高抗氧化酶活性及抗氧化基因的表达,从而提高黄瓜对霜霉病的抗性[16]。褪黑素可以通过调节苯丙烷和磷酸戊糖途径及能量代谢来提高荔枝对霜霉病的抗性[17]。外源褪黑素还可与一氧化氮(NO)协同作用,增强OsPR1b和OsWEKY45的表达水平,提高水稻对条纹病的抗性[18]。此外,研究还发现褪黑素的同系物5-甲氧基吲哚(5-methoxyindole)同样能够提高小麦对赤霉病的抗病性[19]。
本研究以海岛棉品种新海14 号为材料,研究不同浓度外源褪黑素预处理对接菌后棉花枯萎病抗性的影响,探究外源褪黑素调控棉花对枯萎病抗性的作用机制,为棉花枯萎病防治提供理论依据。
1 材料与方法
1.1 材料
棉花品种新海14 号和枯萎病菌株F327 均由石河子大学农学院棉花分子育种实验室保存。褪黑素标准品购于Sigma-Aldrich 公司。几丁质酶(CHT)、β-1,3 葡聚糖酶(GLU)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)活性及过氧化氢(H2O2)含量、超氧阴离子产生速率检测试剂盒购于苏州科铭生物公司,植物RNA 快速提取试剂盒(EasyPure Plant RNA Kit)、反转录试剂盒(EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix)、荧光定量PCR 试剂盒(PerfectStart Green qPCR Super Mix)购自北京全式金生物技术有限公司,其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 外源褪黑素喷施处理 挑选颗粒饱满的种子,用75%酒精浸泡10 min 进行消毒,超纯水冲洗3-4次,种子用50-60℃的温水浸泡20 min 后,置于有灭菌纱布的发芽盒中。在25℃、黑暗条件下催芽48 h 后(保持纱布一直湿润),将发芽的种子清理好种植于营养钵中(营养钵直径6 cm,高度6 cm),基质为泥炭∶蛭石=3∶1。随后将营养钵放置于人工气候箱中,气候箱条件设置为温度28℃/25℃(日/夜),相对湿度60%,光照强度32 000 lx,光周期16 h/8 h(日/夜)。待棉花长到“两叶一心”期后,进行外源褪黑素浓度喷施处理。具体为喷施0、10、25、50、75、100 μmol/L 褪黑素于棉花幼苗地上部分(以喷至叶面滴水为标准),早晚各处理一次,连续喷施3 d。喷施处理结束静置24 h,准备接种枯萎菌。每个处理45 株棉花幼苗,3 个生物学重复。
1.2.2 外源褪黑素对枯萎病菌生长的影响 将枯萎病菌(-80℃保存)解冻后,在超净工作台下取200 μL 菌液用涂布器均匀涂布到PDA 培养基上,25℃暗培养7 d 后,用打孔器取大小一致的菌块,放置于含不同浓度褪黑素(0、10、25、50、75、100 μmol/L)的PDA 培养基上,25℃暗培养,在第7 天观察菌落生长情况,用十字交叉法计算菌丝直径。
1.2.3 枯萎病菌的活化及接菌处理 挑取在PDA 培养基上25℃暗培养活化3 d 的单菌落,于1 L 液体查氏(Czapek's)培养基中28℃、200 r/min 的恒温摇床上暗培养5-7 d。待菌液培养到合适浓度后,用6 层灭菌纱布缓慢过滤,用血球计数板计算过滤后孢子浓度,用无菌水将孢子浓度稀释为1×107个/mL,用于接菌试验。
取褪黑素预处理植株和对照组植株进行伤根接菌处理,具体方法为用灭菌手术刀均匀的在营养钵上划4 道伤口,每道伤口注射2.5 mL 的1×107个/mL的孢子悬浮液(共注射10 mL)。接菌结束后棉苗仍置于人工气候箱中,期间定量浇灌蒸馏水。
1.2.4 抗病性鉴定
1.2.4.1 病情指数 接菌6 d 后,每隔8 d 对褪黑素预处理组和对照组棉花发病情况进行调查并统计病情指数,苗期棉花枯萎病分级标准参考陈磊[20]方法。每个处理调查20 株棉花幼苗,3 个生物学重复。
1.2.4.2 剖茎观察 随机选取接种枯萎病菌后22 d的褪黑素预处理组和对照组棉花幼苗子叶节上部茎秆,用双面刀片纵切后,置于体式显微镜(SteREO Discovery.V20;ZEISS)下观察茎秆褐化程度并拍照。
1.2.5 生理指标测定 取50 μmol/L 褪黑素预处理植株和对照植株叶片,于接菌0、1、3、7 d 进行抗氧化系统及防御酶活性测定。过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)活性测定参照Yin 等[21]方法。几丁质酶(CHT)、β-1,3 葡聚糖酶(GLU)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)活性及过氧化氢(H2O2)含量、超氧阴离子产生速率测定按照试剂盒说明书进行。
1.2.6 基因相对表达量测定 取接菌0、6、12、24和48 h 的50 μmol/L 褪黑素预处理植株和对照植株根部组织,采用EasyPure Plant RNA Kit 试剂盒提取RNA,EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒反转录成cDNA,反应体系(20 μL):3 μL RNA、1 μL Anchored Oligo(dT)18Prime、10 μL 2×ES Reaction Mix、1 μLEasyScript®RT/RI Enzyme Mix、1 μL gDNA Remover 和4 μL RNase-free Water,42℃反应15 min,85℃加热5 s。使用PerfectStart Green qPCR Super Mix 试剂盒在罗氏LightCycler 480II 进行荧光定量PCR 分析。反应体系(10 μL):1 μL 稀释10 倍的cDNA、5μL 2×SYBR Green Mix、10 μmol/L 正反向引物各0.2 μL 和ddH2O 3.6 μL,95℃ 3 min;然后95℃变性10 s,60℃退火15 s,72℃延伸15 s,40 个循环。以GhUBQ7为内参基因,按照2-ΔΔCt方法计算相对表达量。生物学重复3 次,用primer 5 软件设计相关引物(表1),引物由上海捷瑞生物工程有限公司合成。

表1 荧光定量PCR 引物序列Table 1 Primer sequences for quantitative PCR
1.2.7 数据统计与分析 使用Excel 2010 软件对数据进行处理分析,SPSS 22 进行差异显著分析,GraphPad Prism 8 绘图。
2 结果
2.1 外源褪黑素对棉花抗病性的影响
用不同浓度褪黑素(0、10、25、50、75、100 μmol/L)预处理棉花幼苗后,进行棉花枯萎病菌接种处理,观察发病情况,并统计各处理病情指数。结果表明,接菌后22 d,对照组和褪黑素预处理组出现不同的病征。与褪黑素预处理组相比,对照组植株发病更为严重,叶片出现明显萎蔫、黄化和脱落(图1-A),茎秆褐化程度也明显较褪黑素预处理组高(图1-B)。各处理病情指数统计结果表明,随着接种时间的延长,病情指数随之升高,但处理组病情指数升高的趋势明显低于对照组(图1-C)。在接种后22 d,对照组病情指数为55,10、25、50、75、100 μmol/L 褪黑素预处理植株病情指数分别为47、35、23、31、32。其中,50 μmol/L 褪黑素预处理植株的病情指数显著低于对照组和其他浓度预处理组,茎秆褐化程度也更轻,表明50 μmol/L 褪黑素预处理显著提高了棉花对枯萎病的抗性,延缓病害的发生,因此选择50 μmol/L 褪黑素进行后续试验。

图1 不同浓度外源褪黑素预处理对棉花枯萎病抗性的影响Fig.1 Effects of exogenous melatonin pretreatment at different concentration on the cotton resistance to Fusarium oxysporum f.sp.vasinfectum(Fov)
2.2 外源褪黑素对枯萎病菌生长的影响
为了解外源褪黑素是否直接影响枯萎菌的生长,在含有不同褪黑素浓度(0、10、25、50、75、100 μmol/L)的PDA 培养基上放置同等大小的枯萎病菌饼,黑暗生长7 d 后,观察菌丝生长情况,结果发现枯萎菌菌丝的生长并未受到褪黑素处理的影响(图2-A),与对照(0 μmol/L)相比,各处理菌落直径无显著差异(图2-B),说明褪黑素是一种对枯萎菌生长无明显抑制的小分子物质。

图2 不同浓度外源褪黑素对枯萎菌生长的影响Fig.2 Effects of exogenous melatonin at different concentration on the growth of Fov
2.3 褪黑素预处理对接菌后棉花抗氧化系统的影响
在接种枯萎病菌后,叶片中的H2O2含量和O2·-产生速率均随着接菌时间的延长呈持续上升的趋势,但褪黑素预处理组低于对照组。预处理组中H2O2含量在第3、5、7 天显著低于对照组,分别降低了28.49%、15.98%、17.61%。O2·-产生速率在第3 天显著低于对照组,降低了24.64%(图3-A,B)。随着接菌时间的延长,褪黑素预处理组和对照组叶片中POD 和CAT 活性变化呈现相同的趋势,均为先升高后降低,在第5 天达到峰值,然后开始逐渐降低。褪黑素预处理组POD、CAT 活性均在第5 天和第7 天显著高于对照组,较对照分别提高45.02%、33.77% 和47.82%、30.04%(图3-C,D)。SOD 和APX 活性也表现为先升高后下降的变化趋势,褪黑素预处理组中SOD 活性在接菌后第1 天显著上升,在第3 天达到峰值后一直保持较高水平且极显著高于对照组,较对照分别提高32.58%、50.08%、54.52%、79.34%。APX 活性则在第5 天和第7 天极显著高于对照组,较对照分别提高70.07%、127.44%(图3-E,F)。由上述结果可知,随着接种时间的延长,H2O2大量积累、O2·-产生速率显著升高,但经褪黑素预处理后,接种枯萎病菌的棉花植株能够大幅提高POD、CAT、SOD 和APX 的活性,减少H2O2的积累和O2·-产生速率,从而减轻了棉花因枯萎病菌的侵染带来的氧化损伤。
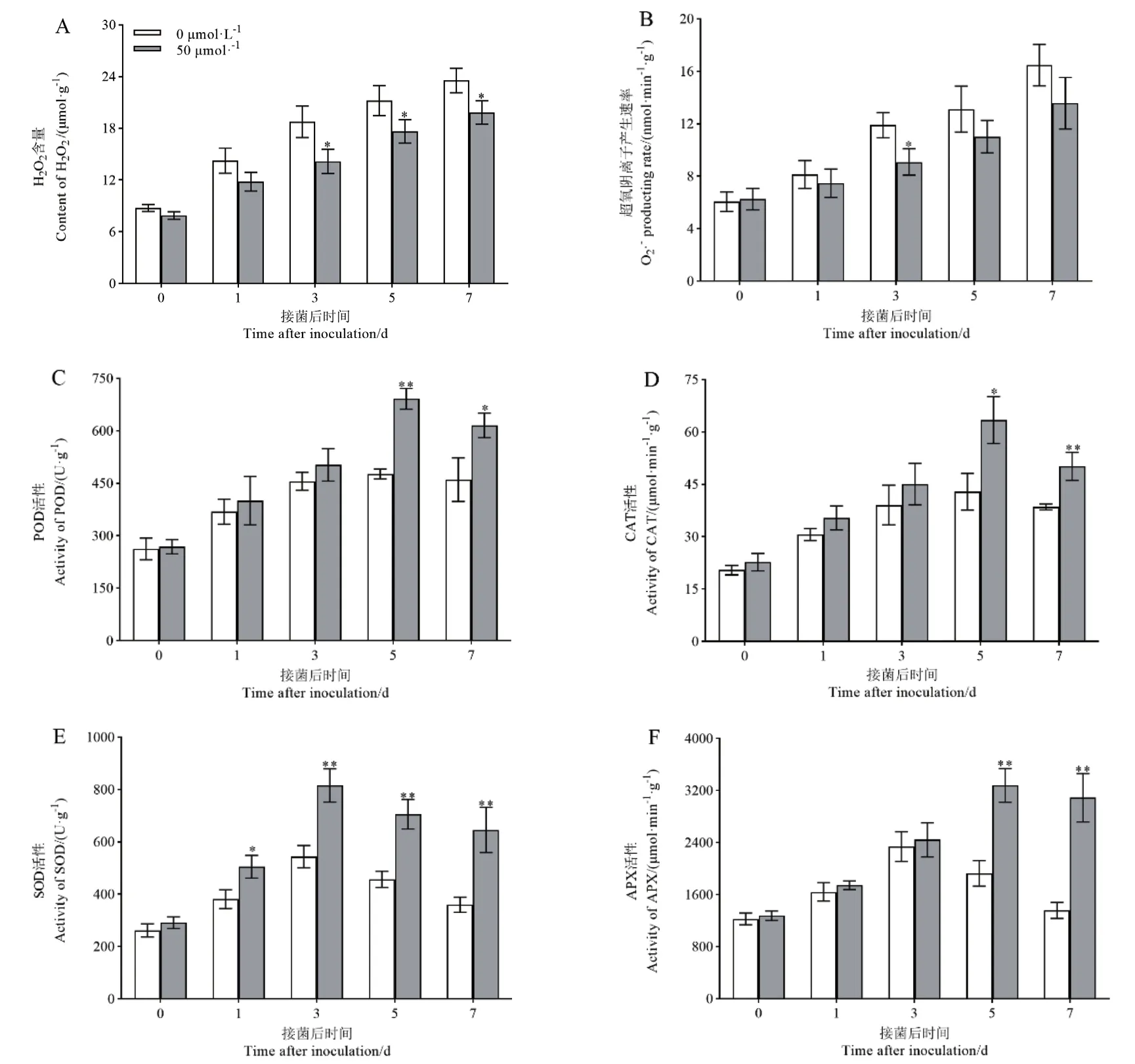
图3 褪黑素预处理对接菌后棉花抗氧化系统的影响Fig.3 Effects of melatonin pretreatment on cotton antioxidant system after Fov inoculated
2.4 褪黑素预处理对接菌后棉花防御酶活性的影响
接菌后对照组和褪黑素预处理组中PAL 活性变化趋势为先升高后下降,在接菌后3 d 达到最大值,且褪黑素预处理组中,PAL 活性在各时间点均显著高于对照组(图4-A)。对照组和褪黑素预处理组中PPO 活性变化呈现先升高后下降的趋势,单对照组叶片中PPO 活性在第1 天达到峰值,而后一直呈现下降趋势。褪黑素诱导组叶片中,PPO 活性则在第5 天达到峰值,其活性在第3、5、7 天极显著高于对照组,分别比对照提高61.66%、89.68%、70.10%(图4-B)。对照组中GLU 活性随着接菌时间的延长缓慢升高,在接种5 d 达到最大值,然后呈现下降的趋势。褪黑素预处理组GLU 活性变化趋势与对照组相似,峰值也出现在接种后第5 天,在接种后第1、3、5 天褪黑素诱导组酶活性显著高于对照组,分别比对照增加49.03%、67.27%、47.49%(图4-C)。CHT活性在对照组中表现出先升高后降低的趋势,其峰值出现在接种后的第5 天。褪黑素预处理组中则呈现持续升高的变化趋势,在第3、5、7 天显著高于对照组,分别比对照提高32.58%、36.16%、68.87%(图4-D)。以上结果表明,褪黑素预处理能够有效提高接菌后棉花植株PAL、PPO、CHT 和GLU 活性,从而抵御病原菌的侵染和抑制病原菌的繁殖。
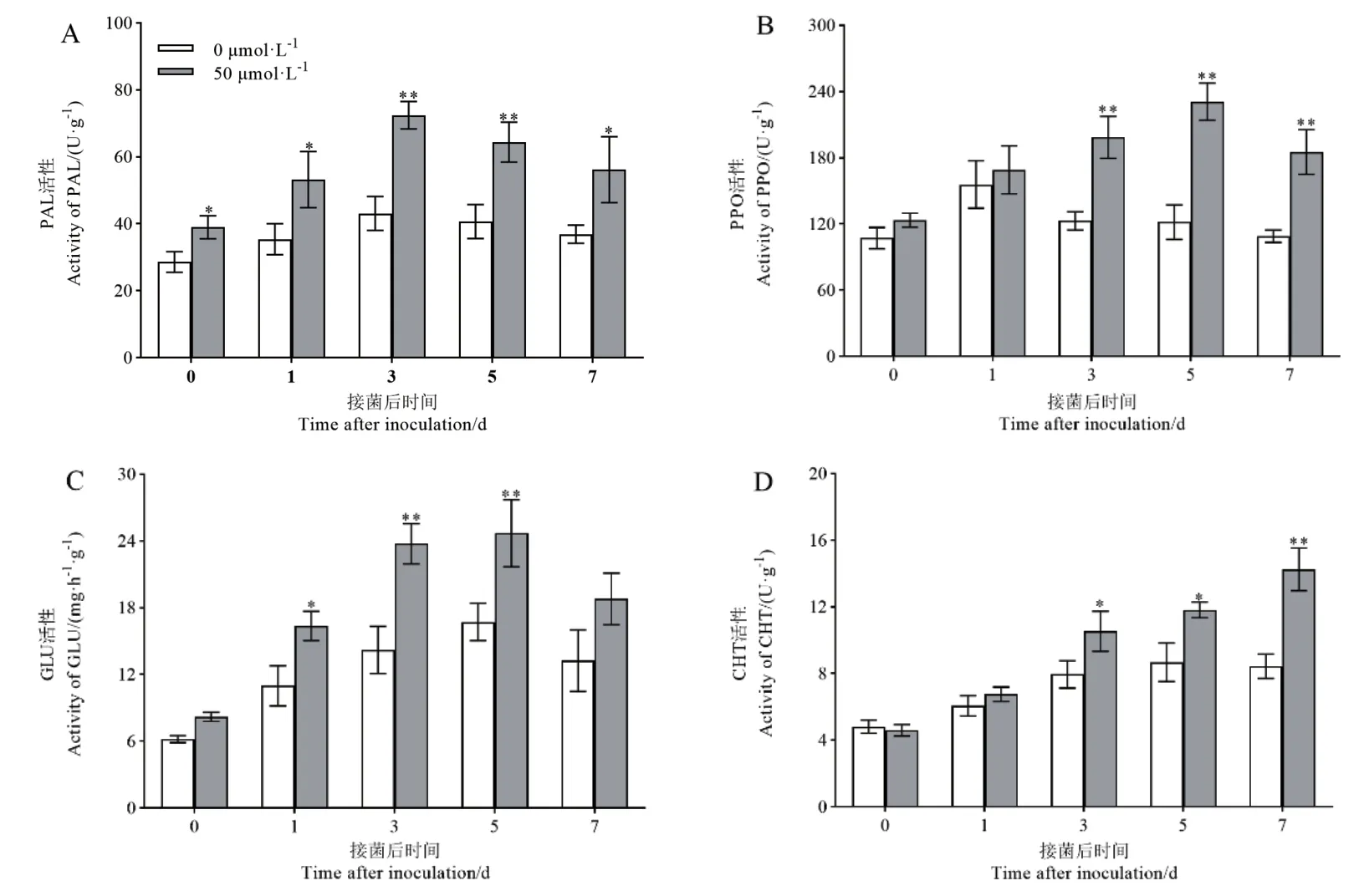
图4 褪黑素预处理对接菌后棉花防御酶活性的影响Fig.4 Effects of melatonin pretreatment on the cotton defense enzyme activity after Fov inoculated
2.5 褪黑素预处理对接菌后棉花木质素、类黄酮代谢通路相关基因表达的影响
GbPAL、Gb4CL、GbCAD和GbCHI、GbDFR、GbTT7分别是苯丙烷代谢中木质素合成和类黄酮合成途径的关键基因,为探索苯丙烷代谢途径中关键基因是否受褪黑素诱导表达,本研究采用实时荧光定量PCR 技术检测了接菌0、6、12、24、48 h 后对照组和褪黑素预处理组根部组织中上述6 个基因的表达情况。在接菌后,对照组和褪黑素预处理组中GbPAL基因的相对表达量变化均为先升后降,但对照组中GbPAL基因的相对表达量在6 h 达到峰值,而后逐渐下降,而褪黑素预处理组中该基因的相对表达量则在24 h 达到峰值且显著高于对照,表达量是对照的6.78 倍(图5-A)。褪黑素预处理组中Gb4CL基因的相对表达量均显著高于对照组,在接菌后6、12、24、48 h 分别是对照的6.93、9.07、1.65、2.88 倍(图5-B)。褪黑素预处理组中,GbCAD表达量在未接菌时与对照相比已有极显著提高,随后呈现先降后升再降的变化趋势(图5-C)。褪黑素预处理组中,GbCHI基因表达量在接菌后呈现先升后降的变化趋势,在接菌后12 h 达到峰值,其相对表达量在各个时间点均显著高于对照组,在接菌后6、12、24、48 h 分别是对照的3.12、5.31、3.15、2.10 倍,而对照组中该基因的相对表达量在接菌后变化不明显(图5-D)。GbDFR基因的相对表达量在褪黑素预处理组中呈现持续上升的变化趋势,接菌后其表达量均极显著高于对照组,在接菌后6、12、24、48 h分别是对照的5.03、7.01、23.30、7.21 倍(图5-E)。GbTT7相对表达量在褪黑素预处理组中表现出先升高后下降的变化趋势,在接菌后12 h 其相对表达量达到峰值,是同时期对照的6.38 倍,但在接菌24 h后显著低于对照组(图5-F)。结果表明,褪黑素能够显著诱导苯丙烷代谢途径中关键基因的表达进而提高对枯萎病的抗性。
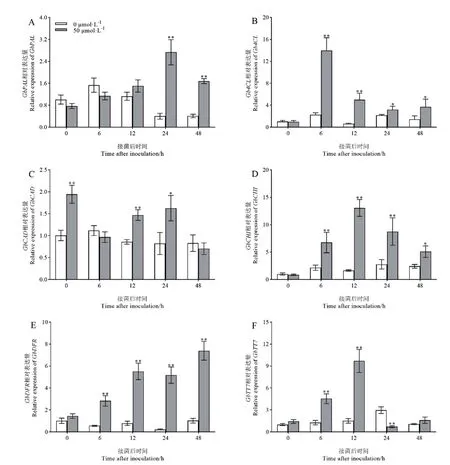
图5 褪黑素预处理对接菌后棉花木质素、类黄酮代谢通路相关基因表达水平的影响Fig.5 Effects of melatonin pretreatment on the cotton expressions of genes related to phenylpropane metabolic pathway related genes after Fov inoculated
3 讨论
3.1 外源褪黑素提高棉花对枯萎病抗性
近年来,褪黑素已作为一种普遍存在的多功能信号分子,在植物受到生物胁迫和非生物胁迫时发挥作用[22],但目前未见施用褪黑素提高棉花对枯萎病抗性的报道。在本研究中,用不同浓度(0、10、25、50、75、100 μmol/L)褪黑素诱导棉花后接种枯萎病菌,病情指数随褪黑素浓度升高呈现先下降后上升的趋势,其中50 μmol/L 浓度预处理后的效果最佳,而100 μmol/L 浓度预处理组病情指数则显著高于其他预处理组,说明褪黑素对提高棉花枯萎病抗性存在明显剂量依赖效应。夏铭[23]研究发现不同浓度褪黑素处理的萝卜幼苗接种链格孢菌后,低浓度褪黑素可显著诱导植株对病菌免疫,而高浓度褪黑素则无显著性影响,这与本研究结果一致,但高浓度褪黑素为何作为逆境因素降低棉花对枯萎病抗性的机制还需进一步研究。抑菌试验表明,褪黑素并不会直接影响枯萎菌的生长,但褪黑素预处理后的棉花幼苗与对照相比却出现了对枯萎病不同程度的抗性,说明褪黑素通过调控其他途径来增强棉花对枯萎病的抗性,这与褪黑素提高对棉花黄萎病[24]、香蕉果皮炭疽病[25]、樱桃番茄灰霉病[26]的抗病性结果一致。
3.2 外源褪黑素通过提高抗氧化酶活性来增强棉花对枯萎病抗性
当植物受到病原菌胁迫后,会产生大量的活性氧(ROS)来杀死病原菌,但过多的ROS 会造成植物DNA、RNA、蛋白质和细胞膜严重的氧化损伤[27]。本研究发现,在接菌后对照组和诱导组中超氧阴离子产生速率和H2O2含量随着侵染时间的延长而增加,但褪黑素诱导后在一定程度上抑制了侵染后期叶片中超氧阴离子产生速率和H2O2含量。POD、SOD、CAT、APX 是主要的ROS 清除剂,在植物受到病原菌胁迫时能够迅速的做出响应,有效地避免或减少细胞的氧化损伤,维持一个相对稳态。在本研究中,外源施用褪黑素能够通过增强这4 种抗氧化酶的活性来提高棉花对活性氧的清除效率,缓解过氧化损伤。Sun 等[16]研究发现外源褪黑素增强了抗氧化酶活性和抗氧化基因表达,从而提高了黄瓜对霜霉病的抗性,这与本研究结果一致。因此外源褪黑素预处理可以提高POD、SOD、CAT 和APX 活性来维持侵染后期棉花叶片中相对较低的ROS水平,从而减轻接种枯萎病菌后ROS 对棉花造成的伤害。
3.3 外源褪黑素通过提高防御酶活性来增强棉花对枯萎病抗性
PAL 催化苯丙氨酸合成肉桂酸,进而产生木质素、黄酮、多酚等防御类物质,有效的阻碍病原菌的生长和繁殖。PPO 能够氧化木质素前体物质,形成有毒性的醌类化合物来抑制病原菌的生长[28]。研究表明,PPO 通过氧化多酚形成奎宁参与植物的防御反应[29]。病程相关蛋白共分为17 个家族,在对病原菌的识别及抗病信号通路的起始上起着极其重要的作用,CHT 和GLU 是其中两个重要蛋白酶[30]。这两种酶可以降解病原真菌细胞壁中的几丁质和葡聚糖,抑制病原菌的生长和孢子的萌发。本研究发现,接种枯萎病菌后棉花叶片中PAL、PPO、CHT、GLU活性呈现不同程度的增加,但褪黑素预处理组棉花受到枯萎病菌胁迫的后期,这4 种酶活性依旧维持在高于对照的水平,有助于提高棉花对枯萎病抗性。Yin 等[21]在研究苹果抗褐斑病的过程中也发现外源褪黑素的施用能够提高这4 种酶活性,在一定程度上提高红冬果对苹果褐斑病的抗性。
3.4 外源褪黑素通过激活木质素、类黄酮代谢通路相关基因来增强棉花对枯萎病抗性
苯丙烷代谢途径是植物三大代谢途径之一,木质素代谢通路及类黄酮代谢通路是其中两个重要支路[31]。Hou 等[32]通过转录组测序发现,木质素合成相关基因通过正向调节木质素合成和提高木质素含量来提高棉花对枯萎病的抗性。黄启秀等[2]研究发现,在接种枯萎病菌40 h 后,类黄酮代谢通路上的多数基因在抗病材料中表达量均显著高于感病材料,表明类黄酮代谢途径在棉花抗枯萎病中具有重要作用。Gao 等[33]通过分析对照和褪黑素处理的葡萄DNA 甲基组和转录组发现,褪黑素在增强类黄酮生物合成和葡萄抗病性中发挥关键作用。Li 等[24]研究发现,褪黑素通过调控苯丙烷代谢通路及棉酚合成通路相关基因的表达,来提高棉花对黄萎病的抗性。在本研究中,对照组中木质素代谢通路GbPAL基因表达量在枯萎病菌侵染后,略微升高后逐渐下降,但褪黑素预处理组中该基因的表达量则保持在一个较高的水平。褪黑素预处理组中Gb4CL、GbCAD则在接菌前期就表现出较高表达,推测外源褪黑素可以通过调控GbPAL、Gb4CL、GbCAD的表达促进木质素合成,有效阻止病原菌的侵入。在枯萎病菌整个侵染期间,类黄酮代谢通路GbCHI、GbDFR表达量在褪黑素诱导组中显著高于对照组,而GbCAD表达量在侵染前期高于对照组,后期低于对照组,推测外源褪黑素的施用能够提高GbCHI、GbDFR、GbTT7的表达量,增加类黄酮化合物的积累,进而提高棉花对枯萎病的抗性。
4 结论
褪黑素对棉花枯萎病菌的生长没有明显抑制作用,外源褪黑素能不同程度提高棉花对枯萎病的抗性,其中50 μmol/L 褪黑素预处理的棉花抗病性最强。棉花受到枯萎病菌胁迫后,能够显著提高抗氧化酶活性清除过量积累的活性氧。此外,外源施用褪黑素还上调了木质素代谢通路及类黄酮代谢通路中关键基因的表达,提高防御酶活性,从而提高棉花对枯萎病的抗性。

