盐胁迫下花生种子萌发期代谢组学分析
徐扬 丁红 张冠初 郭庆 张智猛 戴良香
(山东省花生研究所,青岛 266100)
我国盐碱地分布广泛,面积约为3.6×107hm2[1],是重要的现实和潜在的农业资源,但目前保护性开发利用率较低。2021年习近平总书记在黄河三角洲视察工作时做出了“端稳中国粮、盐碱地大有可为”的重要批示,为开发利用盐碱地、保障我国粮食安全指明了新方向。花生固氮养地,耐瘠抗旱,并具备较强盐碱耐受能力,是目前盐碱地区较适宜种植的经济和油料作物之一[2-3]。但盐碱地较高的土壤盐分会在种子周围形成高渗透势、离子(Na+和Cl-)和氧化毒害[4-5],导致花生种子发芽率降低、出苗时间延长、健苗率低、严重减产[6-7],成为限制盐碱地花生生产的瓶颈。因此,如何“促萌发、保全苗、成壮苗”是提高盐碱地花生产量和扩大种植面积的关键,对盐碱地农业结构优化和花生产业持续发展具有重要现实意义。
种子萌发过程中代谢活动较旺盛[8],吸水膨胀会激活新陈代谢、产生能量、降解高分子内含物并产生营养物质,涉及氨基酸、糖酵解、三羧酸循环和戊糖磷酸等多条代谢途径[9]。种子萌发的代谢过程对种子发芽及植株形态建成至关重要,已逐渐成为评价种子活力和品质的重要指标[10-11]。目前关于花生种子萌发过程中物质变化的研究主要集中在内源激素等生理生化指标、营养成分变化及基因调控等方面[12-14],对盐胁迫下花生种子萌发期代谢物动态变化的研究鲜见报道。本研究以生产中广泛应用且兼具耐盐能力的花育22 号为试验材料,利用高效液相色谱串联质谱技术,监测盐胁迫下花生种子不同萌发阶段相关代谢产物变化,探索花生盐胁迫应答引发的萌发过程代谢物变化规律,为通过遗传育种和外源调控促进盐碱地花生萌发出苗提供重要代谢物资源和理论依据。
1 材料与方法
1.1 材料
供试花生品种为花育22 号,由山东省花生研究所提供。选取当年收获的籽粒饱满、均匀一致的种子2 kg 备用。
1.2 方法
1.2.1 种子萌发阶段代谢组学样品的培养与采集 先将备好的花生种子用0.5%次氯酸钠消毒,无菌水冲洗5、6 次,吸水纸吸干水分后备用。设置2 个NaCl 处理浓度(0 和150 mmol/L),3 个吸水膨胀时间(0 h、6 h 和72 h)。将花生种子(20 粒)置于直径为120 mm、底部垫有2 层滤纸的培养皿中,每皿中分别加入处理要求的同体积(70 mL)培养液,使种子分别均匀半浸于0 或150 mmol/L 的培养液中,置于28℃暗培养箱中吸胀萌发,每处理6 次重复。分别于培养后0 h、6 h 和72 h 以重复为单位随机采集各处理皿6 粒种子样品,置于无菌袋中,于-80℃超低温冰箱中保存备分析用。不同处理和对照组命名如下:正常条件(0 mmol/L NaCl 即ddH2O,CK)吸水膨胀0 h、6 h 和72 h 各时段的种子样本分别表示为CK0、CK6 和CK72,150 mmol/L NaCl(S)吸水膨胀0 h、6 h 和72 h 各时段的种子样本分别表示为S0、S6、S72,每处理6 次重复。其中CK0与S0 皆为吸水膨胀0 h,因处理一致统一为对照(CK)进行代谢组学检测。经前期研究表明6 h 为花生种子快速吸水膨胀期,72 h 为花生种子胚根伸长期[15-16]。样品由青岛科创质量检测有限公司同批次检测完成。
1.2.2 花生发芽率统计 将20 粒/皿花生种子半浸于150 mmol/L NaCl 基质或ddH2O 培养皿(70 mL),均置于28℃暗培养箱中吸胀萌发,每隔2 d 补充NaCl 溶液和ddH2O,6 次生物学重复。自浸种之日起至8 d 每天定时进行种子发芽率调查(胚根突破种皮3 mm 即视为发芽)。发芽率(%)=(发芽种子数/供试花生种子总数)×100%[17]。
1.2.3 代谢组学检测
1.2.3.1 代谢组学样品提取 1 000 mg 样品加入1.3 mL 提取液(甲醇∶水=4∶1;V∶V),低温下高通量组织破碎仪破碎,低温涡旋混匀处理30 min。4℃13 000×g离心15 min,取上清后重复上述萃取操作3 次,将上清液在氮气下混合浓缩。最终,样品用乙腈∶水=1∶100 μL(V∶V)复溶后用于液相色谱-质谱分析。
1.2.3.2 高效液相色谱串联质谱(LC-MS/MS)分析 色谱条件:仪器为超高效液相色谱仪(Thermo Vanquish UHPLC,Thermo Fisher Scientific)和Zorbax Eclipse C18色谱柱(1.8 μm×2.1×100 mm,Agilent technologies);柱温为30℃;流速为0.3 mL/min;流动相组成A(水+0.1%甲酸)和B(纯乙腈);进样量为2 μL,自动进样器温度为4℃。质谱条件:仪器为高分辨质谱(Q-Exactive HF,Thermo Fisher Scientific),分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。离子化模式为加热电喷雾离子源(heated electron spray ionization,HESI);质谱扫描范围在100-1 500 m/z,扫描速度为1 000 Da/s。环设定为最大值3;隔离窗口设置为2;动态扣除为10 s;喷雾电压3.50 kV;毛细管温度330℃;加热器温度325℃。鞘气、辅助气体和吹扫气体分别50.0、12.0 和1.0 arbitrary units。校准溶液用于仪器校准,在全扫描模式(FM)下进行分析。一级MS扫描的分辨率设置为120 000,二级MS/MS 扫描的分辨率为60 000。填充C-Trap 的离子数为1e6,最大注射时间30 ms。标准化碰撞能量(normalized collision energy,NCE)12.5、25 和35 eV;隔离窗口(isolation window,IW)为3;Loop 设置为2。
1.2.3.3 代谢物定性和数据分析 使用Compound Discoverer 3.1 进行保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作,同时利用Thermo mzCloud 在线数据库,Thermo mzValut 本地数据库,ChemSpider 数据库等进行物质鉴定。数据预处理后,利用Simca-Pv13.0(UmetricsAB,Umea,Sweden)进行偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA),利用PLINK软件进行主成分分析(principal component analysis,PCA),两者用于研究组间代谢物差异变化情况;利用R 语言软件包进行PCA 和PLS-DA 的分析绘制[18];采用PLS-DA 模型得到的变量权重值(variable importance in projection,VIP>1),并结合student'st-test(P<0.05)和差异倍数(fold change ≥2 和fold change ≤0.5)相结合的方法筛选差异代谢物[19]。KEGG 是研究生物体内代谢网络的重要工具,本研究利用超几何检验筛选与比较分析差异代谢物富集的KEGG pathway,获得差异代谢物参与的重要代谢通路[19]。在美吉I-Sanger 云数据分析平台上(www.majorbio.com)对所有测序数据进行在线数据分析。运用SPSS 20 软件,采用Student'st-test 比较各组间的统计学差异。
1.2.4 种子营养成分含量分析 花生种子可溶性蛋白含量测定采用双缩脲法(Biuret);脂肪含量测定采用索氏抽提法(GB/T5009.6-2016);可溶性糖含量的测定采用蒽酮比色法[20]。
2 结果
2.1 盐胁迫下花生种子发芽率及种子营养成分含量分析
如图1-A 显示,盐胁迫下花生种子发芽速率较慢,发芽率降低,至培养8 d 其发芽率只有83.5%,显著低于正常条件(100%)。淀粉、蛋白质和脂肪作为种子中的重要组成部分,其在种子萌发过程中发生剧烈变化,可溶性蛋白质随种子萌发时间的推进,含量逐渐降低,但到萌发后期即胚根伸长期(72 h)含量增加(图1-B),而脂肪和可溶性糖含量则随萌发过程的推进不断降低,在种子胚根伸长期其含量下降到较低水平(图1-C,1-D)。盐胁迫处理下花生种子可溶性蛋白、脂肪和可溶性糖的含量变化趋势与正常条件相同,但含量均低于对照。盐胁迫下吸水膨胀期(6 h)和胚根伸长期(72 h)可溶性蛋白含量分别较正常条件降低8.89%和6.25%,可溶性糖含量分别降低15.79%和20.00%(图1-B,1-D)。综上结果表明,花生种子萌发需消耗大量蛋白质、糖类和脂肪类物质用于供能,盐胁迫较正常萌发需消耗更多的能量,可能与胁迫应答有关。
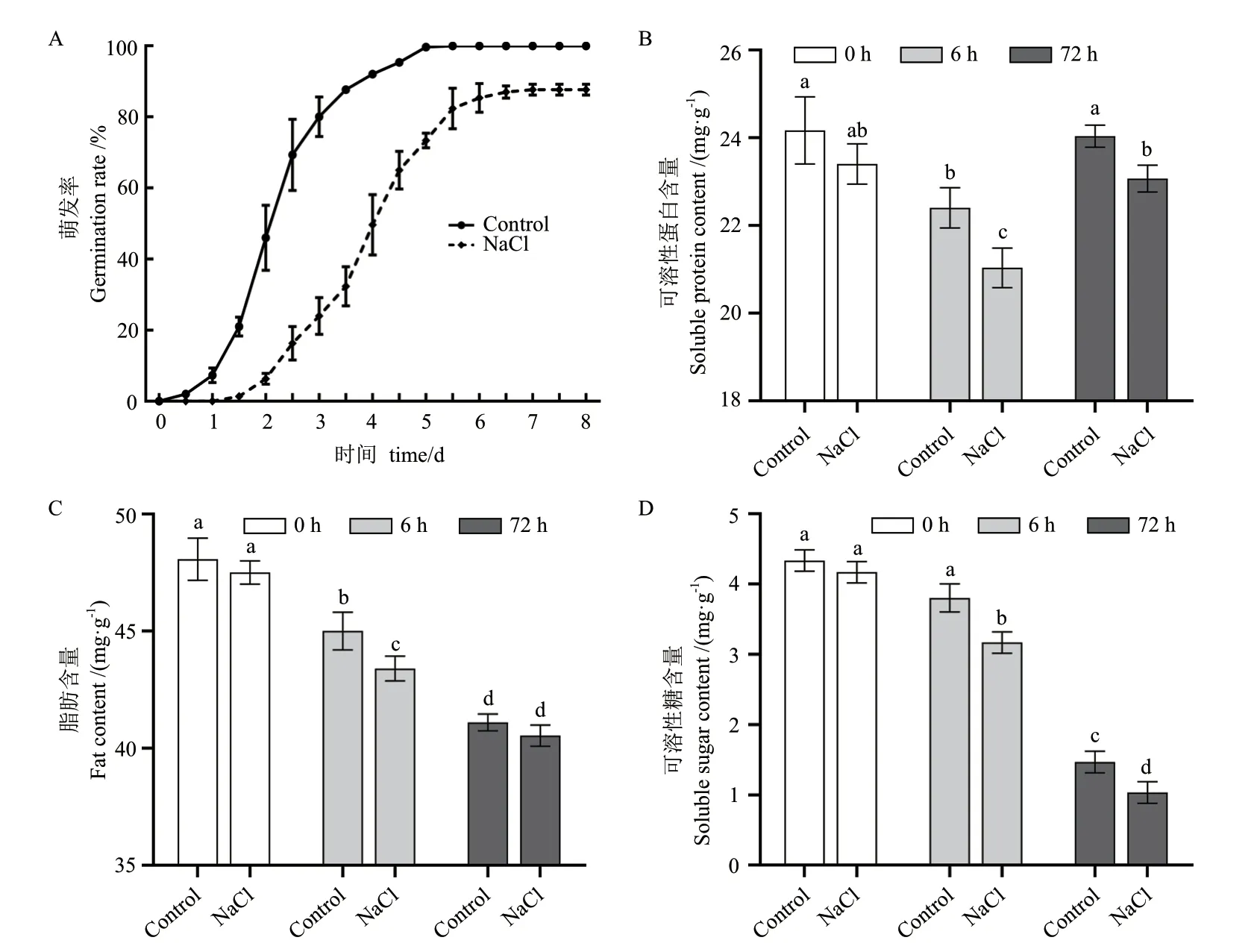
图1 盐胁迫和正常条件下花生种子发芽率和种子营养成分含量分析Fig.1 Analysis of peanut seed germination rate and seed nutrient component under salt stress and normal condition
2.2 主成分分析(PCA)和偏最小二乘法判别分析(PLS-DA)
PCA 分析本质上是一种无监督的多元统计分析方法,能从总体上反应各组样本之间的总体差异和组内样本之间的变异度大小。对花生种子不同萌发条件、不同萌发时段的代谢物检测结果进行PCA 分析显示,正常萌发条件下吸水膨胀6 h(吸水膨胀期,CK6)与对照(吸水膨胀0 h,CK)聚为一类,正常条件下吸水膨胀72 h(胚根伸长期,CK72)与其分离,但仍处于同一象限;而盐胁迫处理组(S6 与S72)与正常条件各组均存在明显差异,分布于不同象限,表明盐胁迫显著改变萌发期代谢(图2-A)。PLS-DA 分析可用于评价多变量样本间差异分析,如图2-B 所示,CK6 与CK 聚为一类,而CK72 与其分离,表明萌发后期物质能量代谢较前期变化更大。盐胁迫处理组(S6 与S72)与正常条件各组均存在明显差异,分布于不同象限,表明盐胁迫处理较种子萌发本身改变花生种子代谢的效果更显著,与PCA 结果一致。PCA 和PLS-DA 分析图上QC 样本密集分布,说明本次实验重复性较高(图2-A,B)。而组内样本表现更聚集,差异性较小,且样本全部处于95%置信区间,说明重复间差异小,取样较合理(图2-A,B)。PLS-DA 正负离子模式的模型参数分别为R2Y=0.4981,Q2=0.7536(图2-C)。Q2表示模型的可预测性,Q2大于0.5,表明处理样本间存在明显差异(图2-C)。同时,Q 的回归线与纵轴的截距在零以下,体现了原模型具有良好的稳定性。PLS-DA 分析表明,该方法能较好的将盐胁迫和正常萌发下不同萌发阶段的花生种子区分开来,不存在过度拟合现象,稳健性良好,结果可用于后续的代谢物差异成分分析。
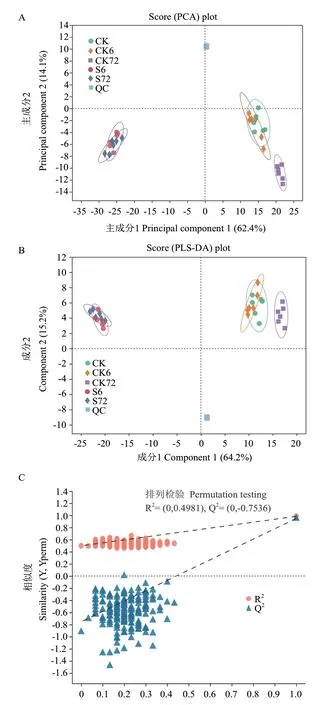
图2 PCA 和PLS-DA 分析Fig.2 PCA and PLS-DA analysis
2.3 差异代谢物筛选
为进一步分析盐胁迫对花生种子萌发期代谢物的影响,需要对VIP 值进行计算。结合PLSDA 模型和方差分析(one-way ANOVA)筛选(fold change ≥2 和fold change ≤0.5,同时VIP>1.0 及student'st-test 的P<0.05)差异代谢物,正常萌发不同时段,CK6 与CK 相比,正负离子模式下分别鉴定出差异代谢物5 和6 个,上调表达1 和3 个,下调表达4 和3 个(图3-A);CK72 与CK 相比,正负离子模式下分别鉴定差异代谢物23 和16 个,上调表达14 和3 个,下调表达9 和13 个(图3-B);CK72 与CK6 相比,正负离子模式下分别鉴定差异代谢物5 和9 个,上调表达1 和6 个,下调表达4和3 个(图3-C)。
盐胁迫与正常条件同时段比较,S6 与CK6 正负离子模式下分别鉴定出差异代谢物69 和56 个,上调表达48 和42 个,下调表达21 和14 个(图3-D);S72 与CK72 正负离子模式下分别鉴定出差异代谢物69 和67 个,上调表达45 和34 个,下调表达24和33 个(图3-E)。盐胁迫不同时段比较分析显示,S72 与S6 比较正负离子模式下分别鉴定出差异代谢物16 和18 个,上调表达4 和2 个,下调表达12 和16 个(图3-F)。盐胁迫与对照比较:S6 与CK 正负离子模式下分别鉴定出差异代谢物65 和45 个,上调表达20 和12,下调表达45 和33(图3-G);S72与CK 正负离子模式分别鉴定出差异代谢物68 和49个,上调表达25 和22 个,下调表达43 和27 个(图3-H)。表明花生种子萌发后期(胚根伸长期)较前期(吸水膨胀期)差异代谢物更多,这与随花生种子萌发期代谢活动趋于旺盛有关。另外,盐处理显著改变了花生种子萌发期代谢,差异代谢物数量较正常条件增加。试验筛选出的差异代谢物为进一步深入分析提供了有效的数据支持。
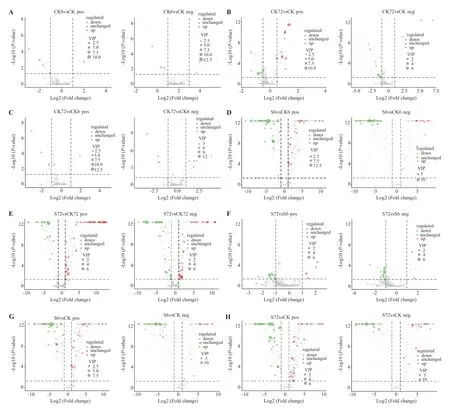
图3 正负离子模式下不同处理比较差异代谢物火山图Fig.3 Volcano plot of date in the positive and negative ion modes of differential metabolites under different treatments
2.4 正常条件下花生种子不同萌发时段差异代谢物KEGG pathway分析
将全部差异代谢物提交至KEGG 网站,进行KEGG pathway 分析。结果显示,CK6vsCK 差异代谢物(皆为目前尚未定义或分类的代谢物)未定位到KEGG pathway,CK72vsCK 差异代谢物共富集到12个KEGG pathway(表1)。其中6 种氨基酸包括左旋络氨酸(L-Tyrosine)共参与6 个代谢通路,亮氨酸(Leucine)和左旋精氨酸(L-(+)-Arginine)各参与3 个代谢通路;左旋组氨酸(L-Histidine)、左旋甲硫氨酸(L-Methionine)、左旋脯氨酸(L-Methionine)各参与2 个代谢通路。苯乙酰胺(2-Phenylacetamide)和羟基肉桂酸(2-Hydroxycinnamic acid)主要参与苯丙氨酸代谢。正常条件下不同萌发时段差异代谢物比较分析显示,CK72vsCK6 差异代谢物含量均升高,共富集到10 个KEGG pathway,表明胚根伸长期较吸水膨胀期有更多的代谢物和代谢通路变化(表2)。KEGG pathway 分析显示各差异代谢物除主要涉及氨基酸合成与代谢相关的信号通路,还涉及乙醛酸和二羧酸代谢、氮代谢以及光合作用(泛醌及其他萜类醌生物合成、卟啉和叶绿素代谢),并且随种子萌发时间延长,差异代谢物增加,所涉及的代谢通路也更多。

表1 正常条件下花生种子萌发胚根伸长期与对照组(CK72vsCK)差异代谢物富集KEGG pathwayTable 1 Differential metabolites enriched KEGG pathway at radicle extension period compared with CK group(CK72vsCK)in peanut seed germinated under normal condition

表2 正常条件下花生种子萌发胚根伸长期与吸水膨胀期(CK72vsCK6)差异代谢物富集KEGG pathwayTable 2 Differential metabolites enriched KEGG pathway in comparison of radicle extension period with water absorption period(CK72vsCK6)in peanut seed germinated under normal condition
2.5 盐胁迫下花生种子萌发期差异代谢物KEGG pathway分析
同一萌发时段不同处理下花生种子差异代谢物分析显示,S6 与CK6 相比,盐处理后能定位到KEGG pathway 的差异代谢物表达水平均提高,尤其是甜菜碱和脯氨酸两种渗透保护物。差异代谢物共参与26 个KEGG pathway,主要包括氨基酸合成及代谢、糖代谢、脂质代谢、三羧酸循环(TCA)等代谢过程,还涉及甘油磷脂代谢、谷胱甘肽代谢、芥子油苷生物合成(表3)。S72 与CK72 相比,盐处理后能定位到KEGG pathway 的差异代谢物除硫胺素含量降低,其他差异代谢物含量均显著提高,共参与31 个差异代谢物富集KEGG pathway,其中包括与S6vsCK6 相同的26 个通路,并增加了5 个代谢通路,包括3 个氨基酸代谢(半胱氨酸和甲硫氨酸代谢、组氨酸代谢、络氨酸代谢)、硫胺素代谢和异喹啉生物碱生物合成途径(表4)。不同萌发时段差异代谢物比较分析显示,S72 与S6 相比,PC(16:0/0:0)、脱氧腺苷和硫氨酸含量降低,而6 种代谢物包括左旋络氨酸、甲硫氨酸、左旋组氨酸、羟基肉桂酸、乙酰氨基和苯基酰胺含量均显著升高,主要涉及多种氨基酸代谢、能量代谢和芥子油苷合成等多条途径(表5)。盐胁迫下花生种子胚根伸长期比种子吸水膨胀期有更多的差异代谢物和KEGG pathway 变化,与正常萌发结果一致。另外,盐胁迫处理比同时段正常萌发KEGG pathway 变化更复杂,除涉及糖代谢(半乳糖代谢,磷酸戊糖途径)、脂肪代谢(甘油磷脂代谢、柠檬酸循环、乙醛酸和二羧酸代谢等)、氨基酸代谢、光合作用相关途径外,甘油磷脂代谢、谷胱甘肽代谢和芥子油苷生物合成途径也发生了变化,这些代谢途径与胁迫应答密切相关,可能对盐胁迫下花生种子萌发有利。

表3 花生种子萌发吸水膨胀期盐胁迫与正常条件(S6vsCK6)对比差异代谢物富集KEGG pathwayTable 3 Differential metabolites enriched KEGG pathway at water absorption period in peanut seed germinated under salt stress and normal condition(S6vsCK6)

表4 花生种子萌发胚根伸长期盐胁迫与正常条件(S72vsCK72)对比差异代谢物富集KEGG PathwayTable 4 Differential metabolites enriched KEGG pathway at radicle extension period in peanut seed germinated under salt stress and normal condition(S72vsCK72)
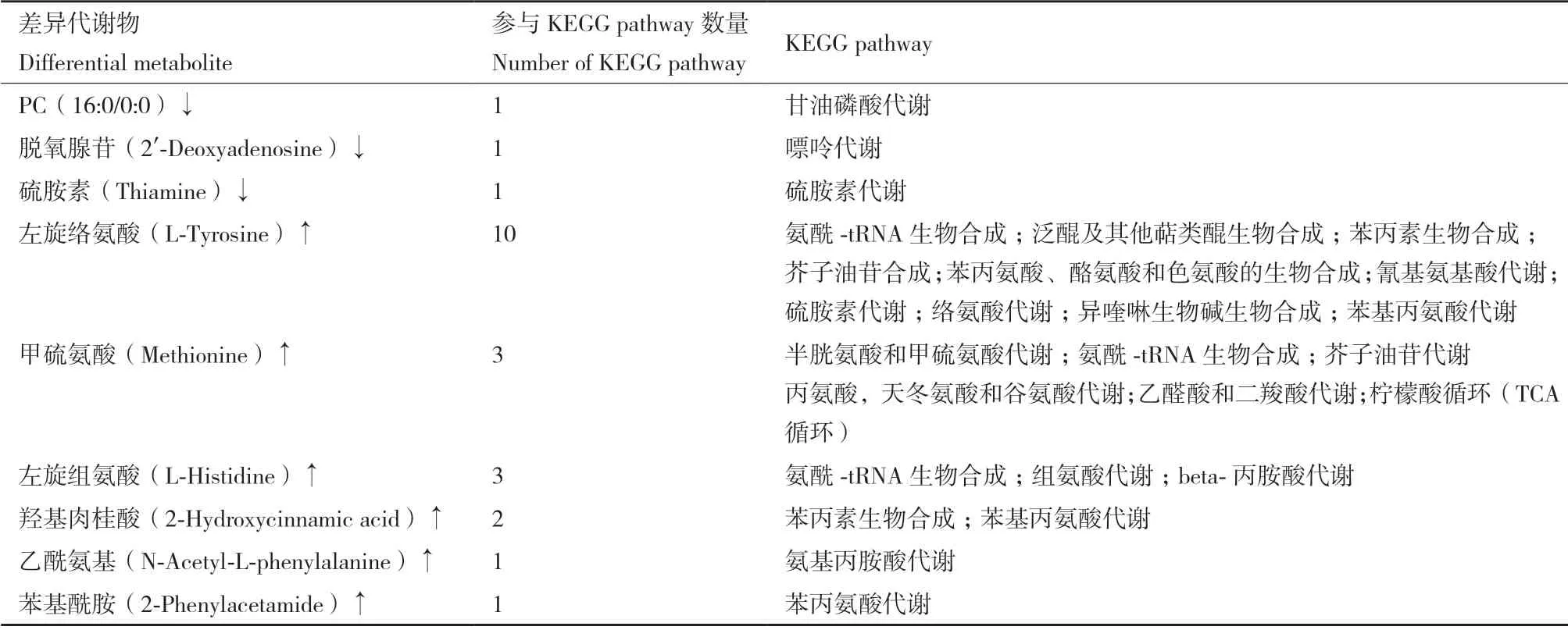
表5 盐胁迫下花生种子萌发胚根伸长期与吸水膨胀期(S72vsS6)对比差异代谢物富集KEGG pathwayTable 5 Differential metabolites enriched KEGG pathway in comparison of radicle extension period with water absorption period(S72vS6)in peanut seed germinated under salt stress
S6vsCK 比较组差异代谢物及KEGG pathway 与S6vsCK6 组相类似,除亮氨酸和腺苷仅在S6vsCK6组中被检测到,而槲皮苷和芸香苷2 种差异代谢物仅在S6vsCK 组中,其主要涉及黄酮和黄酮醇的生物合成及类黄酮生物合成途径(表6)。而S72vsCK与S72vsCK72 两组差异代谢物及KEGG pathway 比较显示,S72vsCK 比较组中未检测到腺苷,而鉴定到槲皮苷和芸香苷(表7)。S6 及S72 与CK 比较存在两个变量,即萌发条件和萌发时间的差异,故与单一变量比较组(S6vsCK6 及S72vsCK6)结果不同,也进一步佐证除盐胁迫处理外,萌发本身也会改变代谢。

表6 花生种子萌发盐胁迫吸水膨胀期与对照比较(S6vsCK)差异代谢物富集KEGG pathwayTable 6 Differential metabolites enriched KEGG pathway at water absorption period in peanut seed germinated under salt stress compared with control group(S6vsCK)

表7 花生种子萌发盐胁迫胚根伸长期与对照比较(S72vsCK)差异代谢物富集KEGG pathwayTable 7 Differential metabolites enriched KEGG pathway at radicle extension period in peanut seed germinated under salt stress compared with control group(S72vsCK)
3 讨论
种子萌发是一个复杂变化的过程,起始于吸水膨胀,结束于胚根出芽,是植物生命周期的初始阶段,决定了整个生命过程的成败[21-22]。能量代谢是种子萌发的基础,可溶性糖参与的糖酵解以及脂肪参与的乙醛酸循环、丙酮酸代谢等代谢途径是种子萌发的能量来源[11,23]。本研究发现,萌发过程可溶性糖类和脂肪类含量逐渐降低,可能与其不断分解持续供能有关。蛋白类物质在种子吸水激活后不断分解为种子的呼吸氧化过程提供碳源及氮源[24],其含量不断降低,其不断生产的氨基酸又会继续组装成新细胞的蛋白质,故蛋白质含量呈现先降低后升高的变化趋势,本研究与之前研究结果一致[20]。
差异代谢物鉴定及KEGG pathway 富集检测显示,盐胁迫显著促进了甘油磷脂代谢、谷胱甘肽代谢、芥子油苷生物合成途径以及能量代谢等相关通路。甘油磷脂是细胞膜等生物膜的重要组成物质,也是重要的信号分子,在植物生长发育和逆境反应中起重要作用[25-26]。棉花种子可通过提升甘油磷脂代谢水平增强耐盐性[27];紫花苜蓿通过提高甘油磷脂类物质的含量提高抗旱性[28]。本研究发现甘油磷脂代谢相关的差异代谢物在盐胁迫处理后均上调表达,猜测盐胁迫条件下花生种子可通过提升甘油磷脂代谢水平,维护细胞膜的正常功能,促进体内的信号转导等,增强萌发期耐盐性。谷胱甘肽是一种重要的抗氧化剂,植物通过形成谷胱甘肽等抗氧化剂抵御逆境胁迫[29]。水稻种子可通过增强谷胱甘肽代谢提高细胞抵御氧化胁迫能力,调控萌发过程[30];冬小麦也能提高谷胱甘肽等代谢增强镉耐受[31]。本研究中,盐胁迫处理后提高的谷胱甘肽代谢可能对盐胁迫下花生种子萌发有一定帮助。芥子油苷是一类有生物学活性的植物次生代谢物,与渗透保护化合物的合成有关,可通过提高耐渗透胁迫能力增强盐胁迫抗性[32-33]。有研究表明,外源茉莉酸处理能促进盐芥花青素和芥子油苷的积累,提高植物抗氧化活性[34];外源色氨酸处理可通过调控生长素IAA合成途径和吲哚族芥子油苷的合成途径相关基因表达,有效地促进油菜生长调节物质和生物防御物质的累积,提高抗病性[35]。本研究发现芥子油苷生物合成途径相关差异代谢物在盐处理后被显著诱导,可能对盐胁迫下花生种子萌发有一定促进作用。能量代谢除参与正常生命活动外,在植物响应盐胁迫过程中也发挥重要作用[36]。本研究发现,盐胁迫处理后,大量氨基酸代谢,糖代谢和脂肪代谢相关KEGG pathway 的差异代谢物显著上调,可能与盐胁迫下花生种子萌发需要更多的能量参与胁迫应答有关。综上可见,盐胁迫条件下花生种子萌发期可通过提高甘油磷脂代谢、谷胱甘肽代谢、芥子油苷生物合成和能量代谢等代谢途径增强花生种子萌发期耐盐性,适应外界盐胁迫。
甜菜碱和脯氨酸是植物重要的渗透保护物,可通过提高渗透调节能力增强植物耐盐性[37-38]。外源甜菜碱可提高苜蓿种子及幼苗的耐盐能力,促进苜蓿在盐渍环境下的生长发育[39];甜菜碱浸种能促进盐胁迫下石榴种子萌发,有效提高幼苗耐盐性[40]。脯氨酸浸种可提高盐胁迫下的玉米发芽率,其过氧化物酶和超氧化物歧化酶活性增强[41],还可降低盐胁迫对油菜种子的抑制,促进其萌发出苗[42]。本研究发现,盐胁迫处理能显著提高甜菜碱和脯氨酸的含量,推测这两种渗透保护物可能对花生种子萌发有利。本研究为遗传育种和外源调控提供重要代谢物资源,未来可通过外源浸种或遗传转化方式,研究诸如甜菜碱和脯氨酸在花生种子萌发期的生物学功能,为促进盐碱地花生萌发出苗提供可靠途径。
4 结论
对盐胁迫下花生种子萌发不同时期代谢组学研究发现,胚根伸长期较吸水膨胀期物质能量代谢更旺盛,甜菜碱和脯氨酸可能是花生种子萌发期适应
盐胁迫的关键调控因子,甘油磷脂代谢、谷胱甘肽代谢以及芥子油苷生物合成等途径可能是重要的代谢调控通路,可为进一步揭示花生种子萌发期的耐盐调控机制奠定基础。

