镉胁迫下水稻OsPT1的表达及功能分析
姜南 石杨 赵志慧 李斌 赵熠辉 杨俊彪 闫家铭 靳雨璠 陈稷 黄进
(1.成都理工大学生态环境学院,成都 610059;2.四川农业大学农学院,成都 611130)
镉(cadmium,Cd)具有高毒性且不可被生物通过代谢途径降解[1],过度积累会抑制水稻光合作用及呼吸作用等生理过程,导致水稻(Oryza sativa)的株高、根长、生物量及产量等明显降低[2-3]。同时,Cd 具有高迁移性,不仅易被水稻吸收,还会通过食物链富集于人体,对人的健康造成损害[4-5]。培育低Cd 积累的水稻品种,减少大米中Cd 的含量,已成为当前应对Cd 污染危害主流的研究趋势之一[6-8]。研究水稻Cd 吸收、转运相关基因及功能为水稻应对Cd 胁迫的机制及培育低积累Cd 的水稻品种具有重要的借鉴意义[9]。
研究表明,植物可通过相关的转运蛋白将重金属离子转运至胞外或隔离在液泡及质外体中,以降低重金属对植物的毒害[10-14]。在这一过程中,部分依赖于H+偶联的阳离子转运蛋白发挥重要的调控作用。研究发现,阳离子/H+转运蛋白CAX(cation/H+exchanger)可依赖跨膜H+质子梯度,将Mn2+、Cd2+等游离金属离子逆浓度梯度地转运并隔离在液泡中[15];而Na+/H+逆向转运蛋白NHX1(Na+/H+antiporter)则可通过介导细胞质膜上H+浓度,将Cd 转运出细胞外[16],这两种转运蛋白均可藉此增强植物对Cd 胁迫的耐受性。OsPT1 蛋白(phosphate transporter 1)作为水稻H2PO4-/H+共运体Pht1 蛋白家族中的一员,是一种定位于细胞质膜上的磷酸盐转运蛋白,它们通过调控细胞质膜上H+浓度梯度参与水稻对外界磷酸盐和重金属砷(As)的吸收及转运[17]。研究发现,与野生型相比,过表达OsPT1水稻在根和叶片中积累了更多的磷酸盐和As,当OsPT1突变后,水稻地上部分As 的积累量显著降低,表明OsPT1不但参与水稻对外源磷酸盐吸收积累,还可能在水稻应对As 胁迫的过程中发挥作用[18-20]。而水稻Pht1 家族其他成员(如OsPT3、OsPT4、OsPT5、OsPT7、OsPT8 等)也参与水稻对磷酸盐吸收转运过程,其中,OsPT4 和OsPT8 还参与对As 的吸收转运[21-24]。在对马铃薯StPT7的研究过程中发现,其野生型、过表达和突变体植株对干旱胁迫的耐受性依次降低,表明Pht1 蛋白还影响植物的干旱胁迫耐受性[25]。亚麻荠Pht1 家族成员响应多种逆境胁迫,其中就包括Cd[26]。
OsPT1 可能通过调控细胞质膜上H+浓度介导水稻Cd 转运,但当前研究对OsPT1 是否在重金属Cd转运中发挥作用尚未阐明。前期利用生物信息学筛选到多个水稻Cd 响应基因,其中包括OsPT1。
本研究以水稻、酵母为材料,克隆OsPT1并对其进行生物信息学分析,构建表达载体,转化酵母,验证OsPT1在Cd 胁迫下的功能。利用RT-qPCR 检测OsPT1在Cd 胁迫下的表达情况,为OsPT1的Cd 响应功能研究及低积累Cd 的水稻品种选育奠定基础。
1 材料与方法
1.1 材料
水稻种子消毒后,置于37℃150 r/min 催芽2 d。随后种植于1/2 MS 植物培养基(pH=5.8),30℃光照培养5 d。选取生长状态良好且株高相近的幼苗,分别种植于含0(对照)和100 μmol/L CdCl2的1/2 MS 培养基进行培养。分别在1、6 和12 h 时取样,每个时间点取8 株幼苗,对地上部分和根部分别取样,立即置于液氮速冻,-80℃保存备用。
1.2 方法
1.2.1 水稻总RNA 提取及cDNA 反转录 将水稻组织样品研磨成粉末,利用植物RNA 快速提取试剂盒(北京艾德莱生物科技有限公司)提取总RNA,并使用反转录试剂盒(默飞世尔科技公司)反转录成cDNA。
1.2.2 水稻OsPT1的克隆及表达载体的构建 根据OsPT1登录号(Locus ID:LOC_Os03g05620),从Rice Genome Annotation Project(http://rice.plantbiology.msu.edu/)网站下载CDS 序列。设计OsPT1引物(上游引物OsPT1-F:5'-ATGGCGGGAGGGCAGCTCAACG-3';下游引物OsPT1-R:5'-TTACTTCGGGTAGGCCGCCTCC-3')。PCR 反应体系为引物各1 μL、模板1 μL、金牌Mix 酶44.5 μL、DMSO 2.5 μL,补至50 μL。PCR 反应程序为98℃ 2 min;98℃ 10 s,55℃ 30 s,72℃ 30 s,30 个循环;72℃ 5 min。PCR产物回收纯化后,与pGADT7表达载体连接,并转化DH5α 大肠杆菌感受态细胞,提取质粒经酶切鉴定正确后送样测序。
1.2.3OsPT1表达分析 cDNA 稀释10 倍后作为模板,通过RT-qPCR 检测OsPT1的相对表达量。反应体系为cDNA 3 μL、上下游引物(表1)各1 μL、2×ChamQ Universal SYBR 5 μL。RT-qPCR 反应程序为95℃ 2 min;95℃ 15 s,55℃ 20 s,72℃ 15 s,40 个循环。以ubiquitin为内参基因,每个处理3 次重复,采用2-ΔΔCt相对定量法进行数据分析。

表1 RT-qPCR 引物序列Table 1 Quantitative real-time PCR primer sequence
1.2.4OsPT1在酵母中的功能分析 使用聚乙二醇(PEG)-乙酸锂转化法[27]将pGADT7-OsPT1表达载体与pGADT7空载体(作为阴性对照)转化到Cd敏感型酵母菌株Δycf BY4741(Mata his3Δ1 leu2Δ0 met15Δ0 ura3Δ0 YDR135c::kanMX4)中。在亮氨酸缺陷型(SD-Leu)酵母固体培养基上选择酵母单克隆,接种于SD-Leu 液体培养基中,30℃ 200 r/min 振荡培养过夜。之后用新鲜的SD-Leu 液体培养基稀释10 倍后再活化培养2 h,将菌液培养至OD600=0.4-0.8,离心收集细胞,用无菌水调OD600=1。随后,将5 μL 经梯度稀释的酵母细胞液(OD600为1.0、0.1、0.01和0.001)点样到含有2%葡萄糖和25 μmol/L CdCl2的SD-Leu 固体培养基表面,30℃培养3 d,拍照采集数据。
1.2.5 生物信息学分析 利用在线网站ExPASy(https://web.expasy.org/protparam/)预测分析OsPT1的理化性质。使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 分析OsPT1 的二级结构。利用PHYRE2 Protein Fold Recognition Server(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index,对OsPT1 蛋白的三级结构进行预测。通过NetPhos v3.1(http://www.cbs.dtu.dk/se rvices/NetPhos/)预测OsPT1 蛋白可能的磷酸化位点。通过ProtComp(http://linux1.softberry.com/berry.phtm l?topic=protcomppl&group=programs&subgroup=proloc)网站预测OsPT1 蛋白的亚细胞定位。使用NCBI 中的BLAST 功能,找到不同物种中OsPT1 蛋白的同源序列,并通过软件MEGA7.0 使用NJ 法构建进化树。
2 结果
2.1 OsPT1的克隆
以水稻cDNA 为模板进行扩增,获得一条约1 600 bp 条带(图1-A),与重组载体酶切后的产物大小相近(图1-B)。经测序,获得的序列与通过Rice Genome Annotation Project 网站查询得到的OsPT1(LOC_Os03g05620)CDS 序列比对一致,表明成功克隆目的基因。
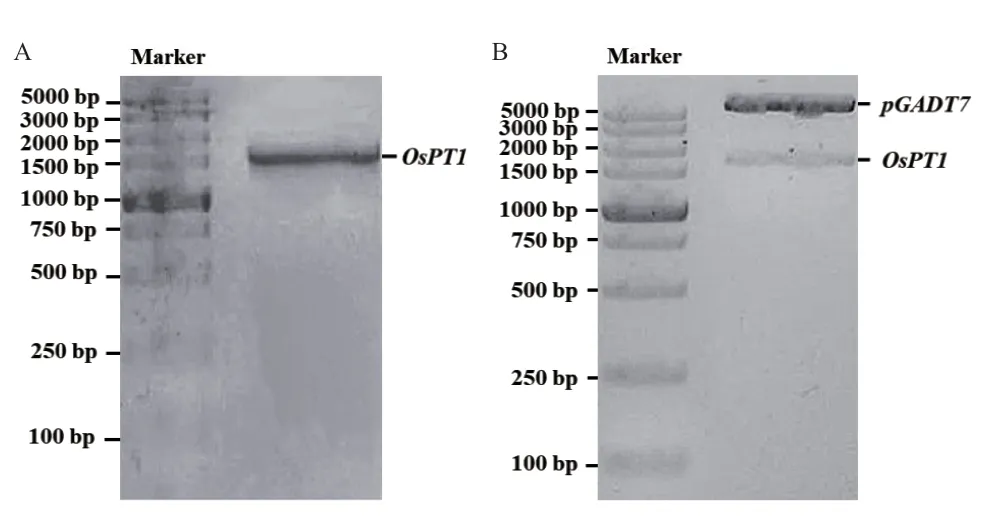
图1 OsPT1 的PCR 扩增及pGADT7-OsPT1 重组载体的酶切验证Fig.1 PCR amplification of OsPT1 gene and endonuclease digestion of the recombinant vector pGADT7-OsPT1
2.2 OsPT1的生物信息学分析
2.2.1 OsPT1 的理化性质预测 利用ExPASy 网站分析OsPT1 的理化性质(表2),OsPT1 蛋白分子质量为57.46 kD,蛋白分子式为C2656H4021N667O710S25。其编码氨基酸组成(表3)如下,Ala(A)有67 个,所占比例最高,为12.7%,Cys(C)有6 个,所占比例最低,为1.1%。OsPT1带负电残基总数(Asp+Glu)34 个,带正电残基总数(Arg+Lys)38 个,理论等电点为8.57,不稳定指数为31.09,说明该蛋白为稳定的弱碱性蛋白。由于此蛋白亲和性(GRAVY)平均水平为0.361,而从蛋白的亲和性分析(图2)可以看出,处于正值的蛋白比例明显大于负值部分,说明此蛋白为疏水性蛋白。
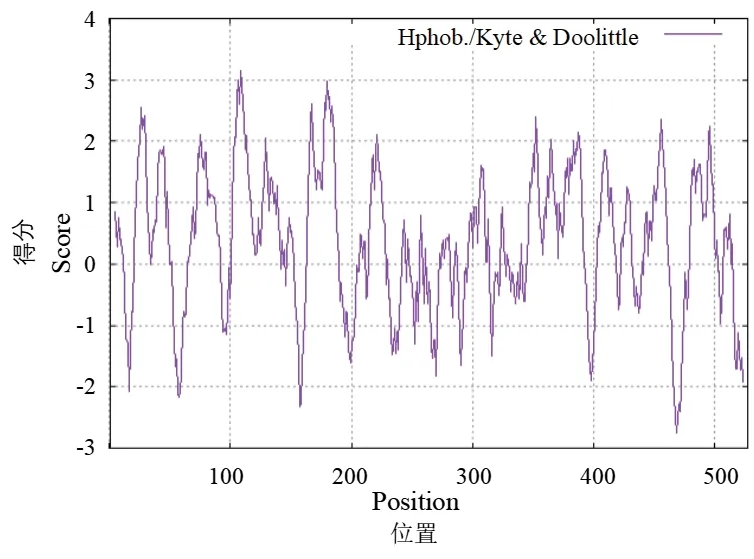
图2 OsPT1 蛋白亲疏水性分析Fig.2 Hydrophobicity analysis of OsPT1 protein

表2 OsPT1 蛋白的理化性质Table 2 Physicochemical properties of OsPT1 protein
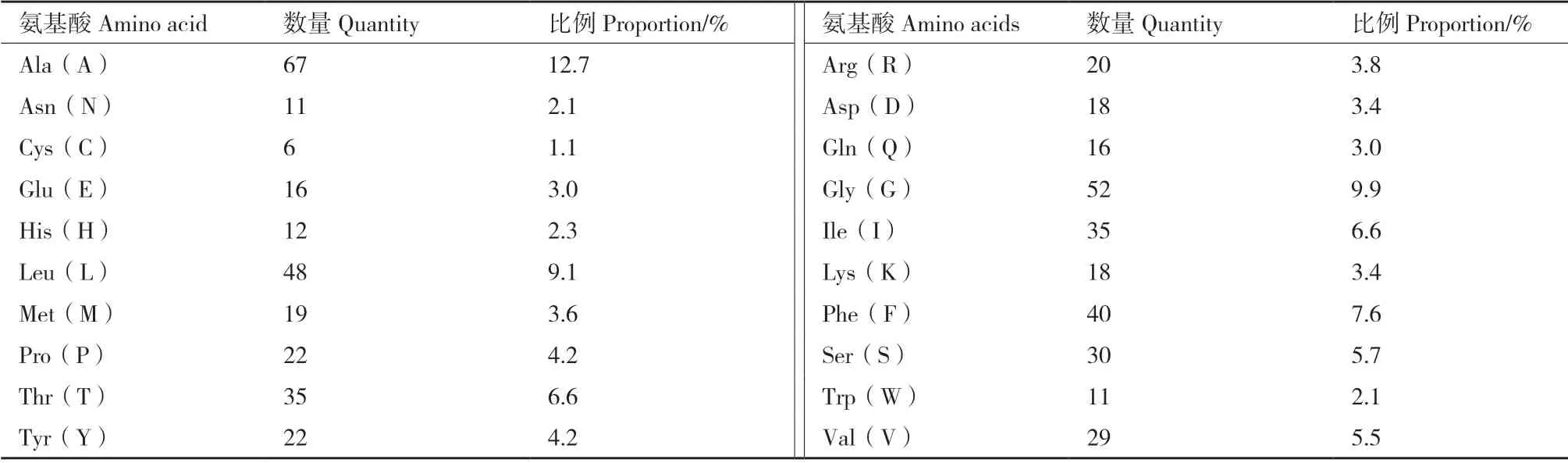
表3 OsPT1 蛋白的氨基酸组成Table 3 Amino acid composition of OsPT1 protein
2.2.2 OsPT1 的二、三级结构预测 运用SOPMA网站预测OsPT1 蛋白的二级结构(图3-A),发现α-螺旋有260 个氨基酸,占49.34%;延伸链有71个氨基酸,占13.47%;β-转角有24 个氨基酸,占4.55%;无规则卷曲有172 个氨基酸,占32.64%。使用PHYRE2 网站预测OsPT1 蛋白的三级结构(图3-B),蛋白质中含有大量丙氨酸(Ala),而α-螺旋和无规则卷曲是蛋白质三级结构的主要组成,与二级结构预测结果基本吻合。

图3 OsPT1 蛋白质的二、三级结构预测Fig.3 Secondary and tertiary structure prediction of OsPT1 protein
2.2.3 OsPT1 蛋白的亚细胞定位及磷酸化位点分析 使用在线工具ProtComp 分析OsPT1 蛋白的亚细胞定位,OsPT1 蛋白主要分布在细胞质膜上。蛋白质的磷酸化可介导蛋白活性,对生物体内很多生理过程都具有重要的调控作用。利用在线软件Net Phos 3.1 分析OsPT1 潜在的磷酸化位点(图4)发现,OsPT1 存在34 处潜在的磷酸化位点,包括14 处潜在的丝氨酸(S)磷酸化位点,14 处潜在的苏氨酸(T)磷酸化位点,6 处潜在的酪氨酸(Y)磷酸化位点,这些磷酸化位点对OsPT1 蛋白行使功能有着重要意义。
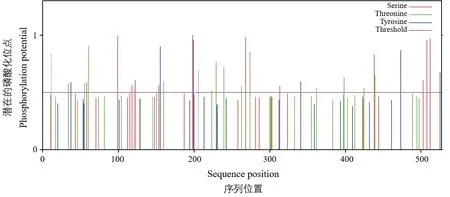
图4 OsPT1 蛋白潜在的磷酸化位点分析Fig.4 potential phosphorylation sites analysis of OsPT1 protein
2.2.4 OsPT1 的系统进化分析 为了研究OsPT1 蛋白在不同物种的进化关系,运用NCBI Blast 查询与OsPT1 蛋白同源性最高的其他物种的蛋白序列,利用MEGA7.0 软件邻接法构建进化树(图5)。目的基因编码的蛋白在双子叶植物和单子叶植物间分为2 支,与高粱(Sorghum bicolor)的亲缘关系最近。
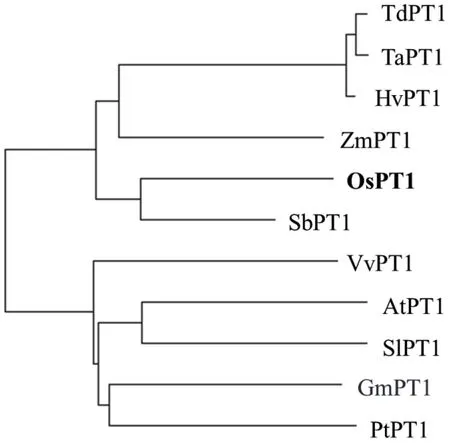
图5 PT1 蛋白系统进化分析Fig.5 Phylogenetic analysis of PT1 proteins
2.2.5OsPT1顺式作用元件分析 运用PlantCARE网站分析OsPT1上游2 000 bp 启动子区序列,通过TBtools 对结果进行可视化处理。结果(图6)显示,OsPT1上游2 000 bp 启动子区含有对光响应作用元件CAG-motif、G-Box、AE-box、ACE、GT1-motif、TCT-motif,对茉莉酸甲酯响应元件CGTCA-motif、TGACG-motif,厌氧环境响应元件ARE,对水杨酸响应的元件TCA-element,对逆境响应的元件TC-rich repeats。
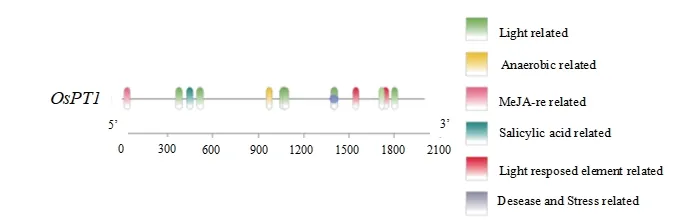
图6 OsPT1 的顺式作用元件分析Fig.6 Cis-acting elements analysis of OsPT1 gene
2.3 OsPT1响应Cd胁迫的表达模式
在不同时间Cd 胁迫下,运用RT-qPCR 分析OsPT1水稻幼苗不同组织中的表达情况,并使用GraphPad Prism 9 软件分析数据。结果表明,在Cd处理浓度100 μmol/L 时,OsPT1在水稻地上部分的相对表达量整体呈上升趋势。在处理1、6 和12 h 后,OsPT1在植物地上部分的转录水平分别上调至处理前的1.31、1.34 和2.46 倍(图7-A)。而在根中,处理时间为1 和6 h 时,OsPT1的相对表达量上调了1.28和1.14 倍;当处理时间达到12 h 时,OsPT1的相对表达量出现下调,约为0.62 倍(图7-B)。OsPT1相对表达量的变化表明其能够响应Cd 胁迫。

图7 OsPT1 响应Cd 胁迫表达分析Fig.7 Expression analysis of OsPT1 under Cd stress treatment
2.4 转基因酵母的Cd耐受性分析
将转基因酵母与空载体酵母经25 μmol/L Cd 处理3 d 后,与对照组(0 μmol/L Cd)相比,转入目的基因的酵母在含25 μmol/L Cd 的SD-Leu 培养基上生长活性较空载体酵母弱(图8),表明OsPT1在一定程度上降低了酵母细胞对Cd 的耐受性。

图8 OsPT1 对酵母Cd 敏感性的影响Fig.8 Effects of OsPT1 on the sensibility of Cd in yeast
3 讨论
水稻在进化和发育过程中,形成了一套应对Cd胁迫的调控机制,这些调控机制的发挥依赖各种已知和未知的转运蛋白以及相关的转录调控因子[28-29]。OsPT1 作为一种转运蛋白,在吸收、转运磷酸盐及重金属As 方面具有重要作用。除此之外,OsPT1 对水稻茎和根毛的伸长及分蘖等生长发育也具有调控作用[18]。但对于其在重金属Cd 胁迫下的功能未知。
本研究通过对OsPT1的顺式作用元件进行分析发现,该基因上游启动子区含有与光、厌氧、茉莉酸甲酯等环境和激素相关的元件,同时还含有防御与应激反应的相关元件,推测其可能参与多种非生物胁迫[30],并受到激素的调节作用。有研究表明,苹果酸盐转运蛋白MdALMT14 具有丝氨酸磷酸化位点,可被磷酸化修饰以减少苹果对Cd 的吸收[31]。本研究对OsPT1 磷酸化位点进行预测发现,其含有14 个丝氨酸磷酸化位点,推测OsPT1 依赖这些位点的磷酸化修饰来调控蛋白质活性,发挥生物学功能,介导对Cd 的吸收及转运,但尚未有相关研究进行报道。此外,系统进化树显示OsPT1 与禾本科植物高粱SbPT1、玉米(Zea mays)ZmPT1、大麦(Hordeum vulgare)HvPT1 及小麦(Triticum aestivum)TaPT1亲缘关系较近,表明同一科物种的PT1 蛋白同源性更高。虽无这些蛋白在响应重金属胁迫过程中功能的相关报道,但对与OsPT1 亲缘关系较远的拟南芥(Arabidopsis thaliana)AtPT1 研究发现,AtPT1 也参与对As 的吸收转运[32],表明在植物中PT1 功能较为保守。
为进一步探究OsPT1响应Cd 胁迫的表达特性及功能,本研究通过RT-qPCR 分析了在100 μmol/L浓度Cd 处理下OsPT1的相对表达量,并构建转基因酵母研究OsPT1对酵母Cd 敏感性的影响。RTqPCR 分析发现,在Cd 处理1 h 和6 h 后,OsPT1在水稻所有组织中的表达量均上调,推测该基因可能参与水稻应对Cd 胁迫的调控机制。前人研究发现,OsPT1的表达与其功能相适应[33],在添加As 后能显著诱导OsPT1在根中的表达、降低在地上部分的表达,同时根中As 积累量显著高于地上部分[19,21]。本研究发现,在Cd 处理后12 h,OsPT1在根中表达上调、在地上部分表达下调,与As 处理不同的表达模式也暗示OsPT1在水稻应对Cd 胁迫中所发挥的调控机制与As 不同,进一步推测OsPT1在水稻早期参与地上部分对Cd 的再分配,而在根部参与减少水稻对Cd 的吸收。此外,有研究表明,磷在植物中可通过提高Cd 胁迫下抗氧化酶的活性以增强植株对Cd 的耐受性[34],OsPT1的表达在地上部上升,预示着在Cd 处理下水稻在地上部分积累了更多的磷,可能据此缓解Cd 的毒性;在Cd 处理后1 h 和6 h根中OsPT1的表达量无显著变化,但在处理后12 h表达量却下调,预示着水稻对磷酸盐的吸收减少,这可能是Cd 导致植株生长缓慢的原因之一。前人研究发现,表达OsPT1基因的磷吸收缺陷型酵母能够恢复其生长活性,表明OsPT1 在酵母中也发挥转运磷的功能[18]。而在本研究中,表达OsPT1的酵母对Cd 的耐受性有所减弱,可能预示着OsPT1 也具有转运Cd 的功能,通过将Cd 转运至细胞内,降低了酵母菌株的生长活性。此外,最近一项研究发现,在对酵母补充磷酸盐的过程中,Cd 对酵母的毒性显著增强,且该研究认为这一结果可能由于产生了更多的活性氧造成的[35]。而本研究中转OsPT1的酵母显示出对Cd 的耐受性减弱,也可能由于OsPT1 转运了更多的磷酸盐至酵母细胞内,导致活性氧含量上升从而降低了酵母对Cd 的耐受性。目前已有多项研究表明,在施加外源磷的条件下,水稻植株积累了更多的Cd[36-38],预示着水稻对Cd 与磷的转运存在着协同作用,然而造成该现象的具体作用机制尚不明确。本研究结果表明,OsPT1可能参与水稻对Cd胁迫的响应机制,结合前人研究推测OsPT1 不仅参与对外源磷的吸收转运,同时也在水稻吸收Cd 的过程中发挥重要的功能。然而,这些机制均有待进一步研究确认。
本研究对OsPT1响应重金属Cd 胁迫的功能进行了生物信息学预测,并分析了Cd 胁迫下该基因的表达模式和功能,初步推测该基因可能在水稻抵御重金属胁迫过程中发挥某种调控作用,为进一步研究其生物学功能提供参考,同时本研究也提出有关磷、Cd 共存时对水稻生长影响的新见解。但对于OsPT1在这些过程中具体的调控作用尚不明确,因此后续可通过构建水稻OsPT1的突变体植株和过表达植株,在Cd 胁迫处理下对水稻的表型特征及重金属抵御相关的生物学功能进行分析,以进一步明确OsPT1在应对重金属过程中的功能机制。
4 结论
克隆获得OsPT1,其CDS 序列全长为1 584 bp,共编码527 个氨基酸。OsPT1 蛋白质定位在细胞质膜上,与高粱SbPT1 亲缘关系最近,分子量为57.46 kD,等电点为8.57,是一个稳定的疏水性蛋白质,含有许多与光、厌氧、茉莉酸甲酯等环境和激素响应相关的调控元件;含有34 处潜在的磷酸化位点;OsPT1可一定程度降低酵母细胞对Cd 的耐受性。

