AtERF49在拟南芥应答盐碱胁迫中的作用
阮航 多浩源 范文艳 吕清晗 姜述君 朱生伟
(1.黑龙江八一农垦大学农学院,大庆 163316;2.中国科学院植物研究所植物分子生理学重点实验室,北京 100093)
土壤盐碱化是影响植物生长、产量和品质的主要环境条件之一[1]。据联合国教科文组织(UNESCO)和粮农组织(FAO)的不完全统计,世界上大约有9.5×109km2的盐碱地,其中我国占9.9×106km2,土壤盐碱化造成生态环境恶化,严重威胁我国粮食生产安全[2]。为了适应土壤盐碱胁迫,植物会通过改变抗逆相关基因表达以及自身的生理生化等响应逆境胁迫[3]。
植物AP2/ERF(APELATA2/ethylene response factors)转录因子家族,在植物生长发育及其非生物逆境胁迫响应过程中具有重要作用[4-5]。拟南芥(Arabidopsis thaliana)中含有147 个成员,根据其蛋白结构,将AP2/ERF 家族分为5 组,即AP2 亚家族、RAV 亚家族、CBF/DREB 亚家族、ERF 亚家族以及一个特异蛋白AL079349[6]。研究表明,一些ERFs参与植物对干旱、高盐以及渗透等胁迫的响应过程。过表达RAP2.2(RELATED TO AP2 2)、RAP2.3和RAP2.12(RAPs)可以增强拟南芥对脱落酸(ABA)的敏感性和缺氧、氧化以及渗透胁迫的耐受性[7]。过表达EIN3(ETHYLENEINSENSITIVE3)和ESE1促进盐反应基因表达,提高植物对盐胁迫抗性[8]。过表达TSRF1通过调节胁迫响应基因的表达,提高水稻的渗透和耐旱性[9]。DREB 亚家族转录因子受干旱、低温和盐等胁迫因子诱导表达,参与植物对非生物胁迫响应过程。如过表达AtDREB1A和OsDREB1A可增强拟南芥对冷冻和脱水耐受性[10-11]。在油菜中,过表达BNCBF/DREB1可增加淀粉和蔗糖生物合成酶含量,提高植株对冷胁迫的抗性[12]。
在拟南芥中,AP2/ERF 转录因子家族主要集中于对干旱、高盐等胁迫的研究,对盐碱胁迫研究尚未见报道。AP2/ERF 转录因子可参与水杨酸、茉莉酸和脱落酸等多种激素信号转导途径,其中AtERF49 可能是逆境信号交叉途径中的关键连接因子(未发表)。AtERF49(AT1G75490)属于DREB亚家族中A-2 亚组[13]。AtERF49只有1 个外显子,编码206 个氨基酸,其蛋白含有一个保守AP2 结构和一个CMIV-1 结构域。
本研究以拟南芥为材料,对其进行混合盐碱胁迫处理,利用荧光定量PCR 技术对AtERF49基因的基本特性、盐碱胁迫及光合响应基因表达模式等进行分析,并进行叶片叶绿素荧光参数测定,研究AtERF49在植物对盐碱胁迫应答过程中的功能,以期为深入解析AtERF49参与植物抗盐碱胁迫分子机理提供基础依据。
1 材料与方法
1.1 材料
试验所用到的拟南芥(Arabidopsis thalianaL.)材料为生态型Col-0、过表达AtERF49转基因材料(AtERF49OX-11、AtERF49OX-39)和CRISPR/Cas9突变体CR-erf49材料(erf49-6、erf49-4)。种植条件为22℃,光照周期为16 h 光照/8 h 黑暗。
1.2 方法
1.2.1 转基因AtERF49拟南芥盐碱胁迫处理 将在1/2 MS 培养基上生长1 周龄的Col-0、过表达AtERF49转基因材料、CR-erf49突变体,移栽到8 cm×8 cm 方盒(土∶蛭石=3∶1)中,待长到7-8 片叶子时,进行盐碱胁迫处理。处理组用150 mmol/L 混合盐碱(摩尔比NaHCO3∶Na2CO3=9∶1)溶液进行处理,用水作为对照组,每3 d 浇灌一次。
1.2.2 抗逆基因、光合相关基因的RT-qPCR 检测 将生长16 d 的拟南芥材料经盐碱胁迫处理0、1和6 h 取样,采用聚合美试剂盒(MF045-05)进行RNA 提取,参照HiScript® Reverse Transcriptase 说明书(Vazyme 公司)进行反转录PCR,按照诺唯赞Q111 说明书,以AtUBC30为内参,用RT-qPCR方法检测转基因拟南芥中RAB18和RD29A以及光合相关基因rbcl和psaA的表达量。RT-qPCR 的引物见表1。

表1 荧光定量PCR AtERF49 所用引物Table 1 Primers used for fluorescence quantitative PCR
1.2.3 叶绿素荧光参数测定 拟南芥生长16 d 时进行盐碱胁迫处理,处理11 d 后,暗处理20 min,利用叶绿素荧光-成像-气体交换同步测量系统(GFS-DUAL)测定暗适应后植株叶片光化学淬灭系数(qP)、非光化学淬灭系数(qN)、光系统II 实际量子产能Y(II)和能量耗散的量子产能(NO)。每个处理重复4 次,每次测定7 株。
1.2.4 统计分析 使用GraphPad Prism 5 软件对数据进行双因素方差分析及差异显著性检验(Two-way ANOVA)。
2 结果
2.1 盐碱胁迫促进AtERF49的表达
在Col-0 生长至16 d 时,经150 mmol/L 盐碱溶液处理0、1、3 和6 h 后,检测拟南芥叶片中AtERF49的表达情况(图1)。以AtUBC30为内参,盐碱胁迫处理后,AtERF49的表达量上升,在3 h时达到最高(25 倍),6 h 后,表达量急剧降低,下降97.4%,表明盐碱胁迫可快速诱导AtERF49表达。

图1 盐碱胁迫下AtERF49 表达量分析Fig.1 Analysis of AtERF49 expression under Saline-alkali stress
2.2 过表达AtERF49增加植物对盐碱的抗性
选取生长4 周龄的转基因拟南芥叶片,利用RT-qPCR 方法检测AtERF49的表达水平。结果表明,过表达转基因植株AtERF49-OX中AtEFR49的表达量均高于Col-0(2-4 倍),而erf49突变体中AtERF49的表达量低于Col-0(图2-B)。在正常条件下,转基因拟南芥和Col-0 在叶片大小和颜色上无明显的区别(图2-A);盐碱胁迫处理后,Col-0 和erf49突变体植株叶片出现萎蔫和黄化,严重者叶片死亡,而过表达AtERF49转基因植株叶片出现少许黄化(图2-A)。过表达AtERF49增强植株对盐碱胁迫的抗性,而erf49突变体植株对盐碱胁迫更加敏感,表明AtERF49正向调控植物对盐碱胁迫的响应
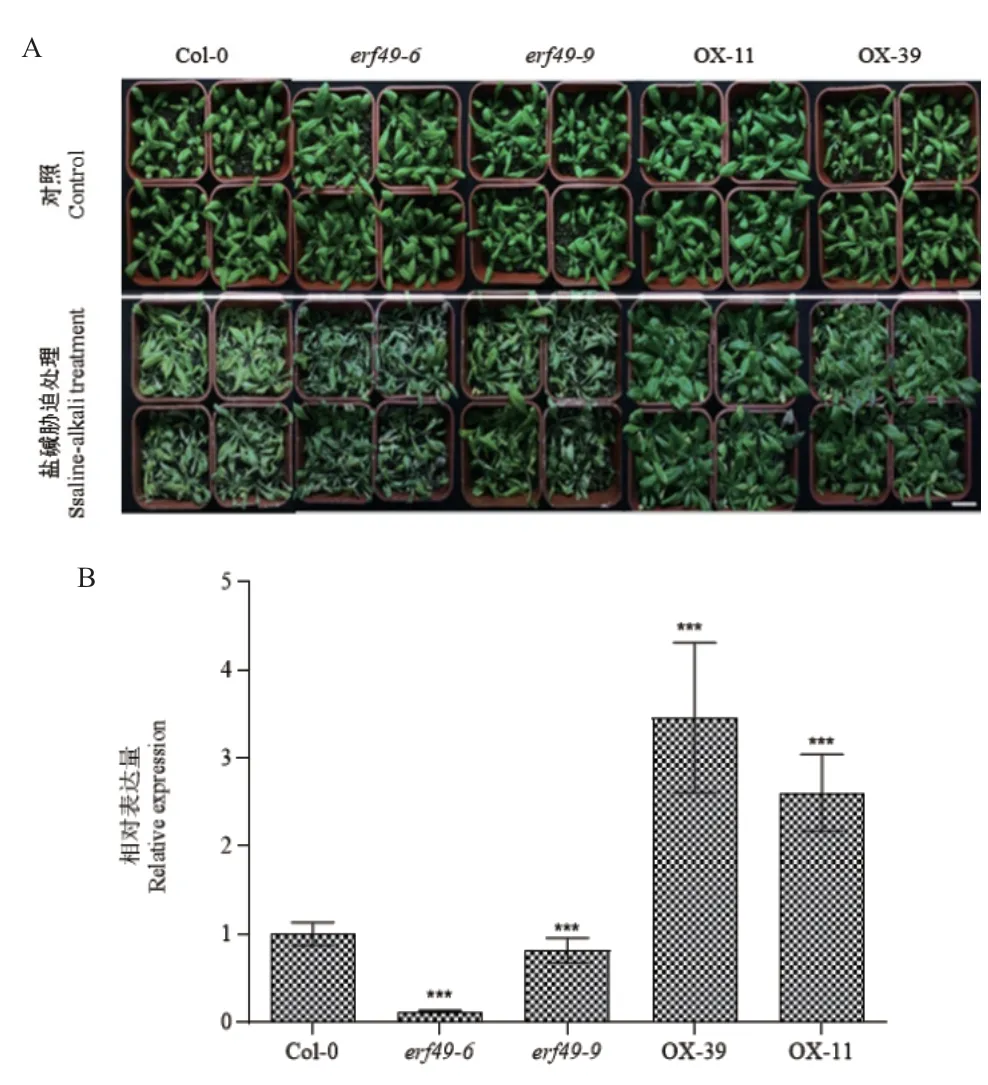
图2 过表达AtERF49 增强拟南芥对盐碱胁迫的抗性Fig.2 Overexpression of AtERF49 gene increasing Arabidopsis resistance to Saline-alkali stress
2.3 过表达AtERF49增加下游相应基因的表达
为了探究过表达AtERF49增强拟南芥抗盐碱胁迫的机理,利用RT-qPCR 检测抗逆响应相关基因RD29A和RAB18的表达。结果表明,在盐碱溶液处理前(0 h),Col-0、AtERF49- OX 以及erf49中RD29A和RAB18的表达量有明显的差别,均高于Col-0。盐碱处理1 h 后,过表达转基因植株中RD29A和RAB18的表达水平提高,且极显著高于Col-0,其中,RAB18的表达量为Col-0 的2-3 倍(图3-A),RD29A的表达量上调6-10 倍(图3-B),而erf49突变体中AtERF49的表达量较Col-0 显著降低,其中,RAB18的表达量降低62%-66%(图3-A),RD29A的表达量降低29%(图3-B)。
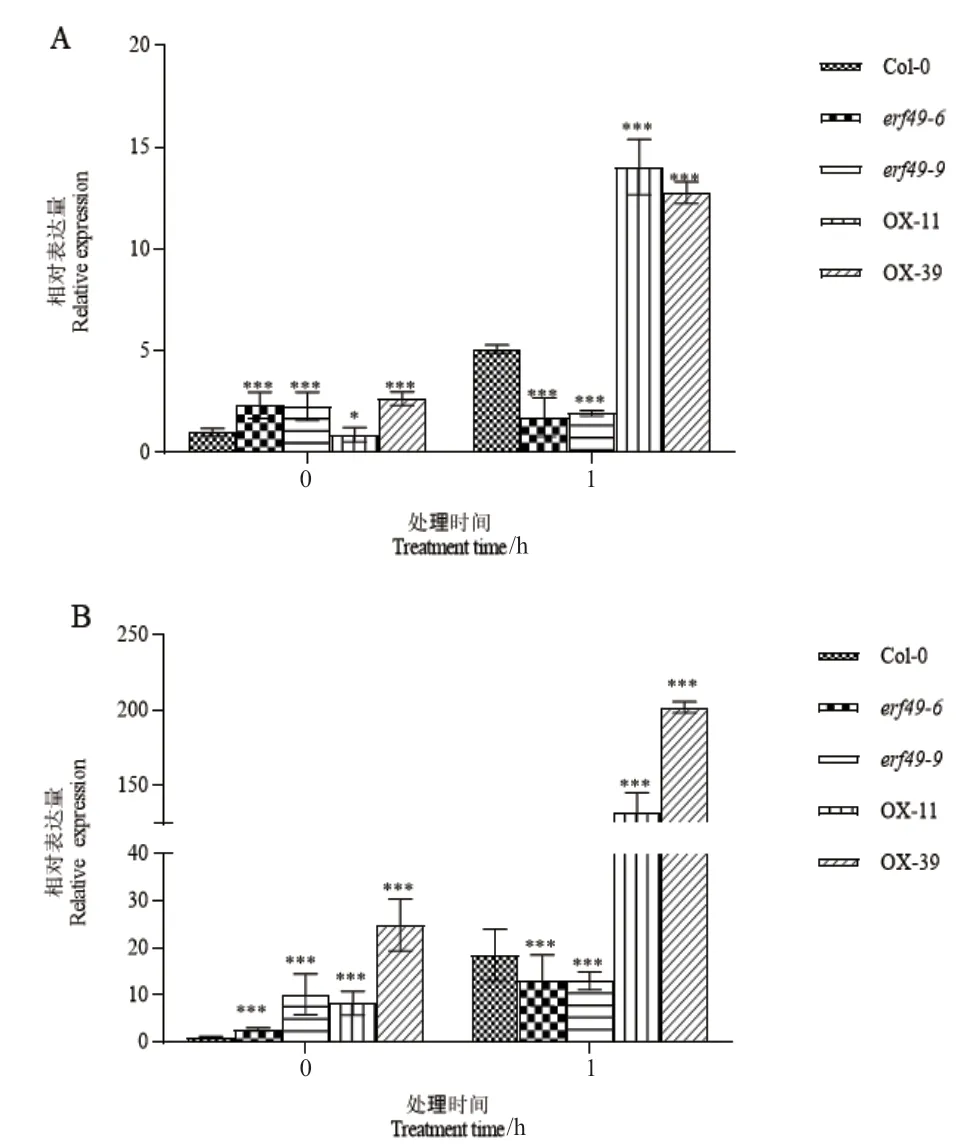
图3 转基因AtERF49 植株中RAB18(A)和RD29A(B)的表达分析Fig.3 Expression analysis of RAB18(A)and RD29A(B)in AtERF49 transgenic lines
2.4 盐碱胁迫下,AtERF49对拟南芥叶绿素荧光参数的影响
过表达AtERF49增强拟南芥抗盐碱胁迫的能力,叶片黄化表型较轻(图2-A),推测其可能影响叶片光合作用能力和光合电子传递速率。对转基因拟南芥和Col-0 的叶绿素荧光参数qP、qN、Y(II)和NO 进行检测。结果表明,盐碱胁迫处理前,转基因拟南芥和Col-0 植株的qP、qN、Y(II)和NO 均无差异。盐碱溶液处理后,erf49突变体植株的Y(II)和qP 均低于Col-0,NO 和qN 均高于Col-0(图4-B和图4-C);而AtERF49-OX植株在处理之后,Y(II)和qP 均显著高于Col-0,NO 和qN 均显著低于Col-0(图4-A 和图4-D)。表明盐碱胁迫下,erf49突变体植株光损伤程度较严重,PSII 反应中心的开放程度降低,ERF49 可能影响光系统II 反应中心光化学反应、开放状态以及光损伤程度。

图4 盐碱胁迫对转基因AtERF49 拟南芥叶片叶绿素荧光参数的影响Fig.4 Effects of Saline-alkali stress on the chlorophyll fluorescence parameters of leaves of AtERF49 transgenic Arabidopsis
2.5 AtERF49调控光合响应基因表达
在盐碱胁迫处理前后,对转基因AtERF49拟南芥莲座叶光合响应基因psaA和rbcL的表达进行分析,结果(图5)表明,在正常条件下,psaA、rbcl在AtERF49-OX、erf49和Col-0 中表达量无明显差异。在盐碱胁迫处理下,与Col-0 相比,AtERF49-OX植株中rbcL表达量显著增加(4-5 倍),psaA表达量显著降低(47%-64%);而psaA、rbcl在erf49突变体植株表达与AtERF49-OX植株相反。psaA能够编码光系统I(PSI)跨膜复合物的中心蛋白A,其作为原初反应中心在光系统I 中起着重要作用,可参与叶绿素分子间的相互作用;rbcL编码核酮糖1,5 二磷酸羧化酶/加氧酶(rubisco)大亚基,调节rubisco 的合成和活性,rubisco 的活性与叶片的羧化效率及光合作用呈正相关。psaA、rbcl在AtERF49-OX、erf49中表达存在差异,说明ERF49可能通过调控psaA和rbcL表达影响植物光合作用电子传递和碳同化能力,进而影响植物对盐碱胁迫的抗性。

图5 AtERF49 转基因株系中rbcL 和psaA 的表达Fig.5 Relative expressions of rbcL and psaA in AtERF49 transgenic lines
3 讨论
AP2/ERF 家族转录因子作为关键调节因子参与植物对多种非生物胁迫应答过程[14]。植物对盐碱胁迫应答的基因调控网络,分为ABA 依赖和非依赖两大调控网络[15],相关的转录因子会随之调控不同下游基因的表达[16],如植物逆境相关基因RD29A和RAB18。本研究中,在盐碱胁迫处理1 h 时,AtERF49-OX植株RD29A和RAB18的表达量显著上升,而erf49突变体中其表达量降低。结合盐碱处理下植株表型,推测在盐碱胁迫条件下,AtERF49-OX拟南芥的抗盐碱胁迫能力提高,可能与ABA 依赖基因RD29A和RAB18的表达增强密切相关。
盐碱胁迫对植物的影响是多方面的,在影响光合电子传递速率的同时也会引发光合机构的紊乱[17]。Y(II)是光系统II 实际量子产能。本研究中,在盐碱处理之前,各株系的Y(II)无明显差异;在盐碱胁迫处理条件下,erf49突变体Y(II)显著下降,而AtERF49-OX植株的Y(II)增加,说明盐碱胁迫下erf49突变体光系统II 反应中心失活程度较严重,过表达株系则表现出强的耐受能力。
光化学淬灭(qP)反映PSII 吸收的光能在光化学反应电子传递链中的份数,在一定程度上反映PSII 反应中心的开放程度,要想保持高的光化学淬灭就要使PSII 反应中心处于“开放状态”。非光化学淬灭(qN)反映植物耗散过剩光能为热的能力[18-19]。本实验研究结果表明,在盐碱胁迫处理前,转基因株系和Col-0 的qP 和qN 值无明显差异。在胁迫处理后,AtERF49-OX植株的qP 值在上升,qN 值下降;而erf49突变体则与之相反。这就说明erf49突变体遭受盐碱胁迫之后,天线色素吸收的光能用于光化学反应的份额在减少,主要转化成热量散失。能量耗散的量子产能(NO)是光损伤的重要指标,若NO 值越高,则表示受到的光损伤越严重。本研究结果表明,在盐碱处理条件下,erf49突变体NO 值上升并显著高于Col-0,而AtERF49-OX植株NO 值下降,erf49突变体在逆境胁迫下更容易受到光损伤。进一步说明过表达AtERF49基因能有效的减少光损伤,在盐碱胁迫发生时还能保持较高的光能利用率。
psaA和rbcL是叶绿体中重要生物学功能的基因,psaA能够编码光系统I 跨膜复合物的中心蛋白A,又称P700 脱辅基蛋白A,其作为原初反应中心在光系统I 中起着重要作用,可能参与结合中间电子传递体Fx,也可能参与了与叶绿素分子的相互作用[20];rbcL基因编码核酮糖1,5 二磷酸羧化酶/加氧酶(ribulose-1,5-bishosphate carboxylase/oxygenase,rubisco)大亚基,调节rubisco 的合成和活性,rubisco 在光合作用的暗反应中起重要作用,负责碳同化又引发光呼吸,其活性与叶片的羧化效率及光合作用呈正相关[21-22]。盐碱处理前,转基因株系和Col-0 中psaA和rbcL的表达量无明显差异。在盐碱处理后二者基因表达量发生变化,AtERF49-OX植株的rbcL表达量上升并显著高于Col-0,psaA表达量显著下降,erf49突变体株系与之相反。erf49突变体psaA表达量在盐碱胁迫处理后上升,而AtERF49-OX植株psaA表达量下降,这可能是因为在盐碱胁迫条件下,光系统I 跨膜复合物中心蛋白A 稳定性有关[23]。有研究表明虫黄藻psbA和psaA转录水平的主动降低对抵抗热应激具有积极作用[24],可能与盐碱胁迫中机制是不同的,还需进一步研究。非生物胁迫可导致植物的rubisco 酶活性降低[25],本研究中,erf49突变体的rbcL表达量在盐碱胁迫处理之后下降,可能是盐碱胁迫导致rubisco 合成的转录过程和转录后翻译表达受到抑制,使rubisco 合成受阻,从而影响暗反应中的碳同化和叶片的羧化效率,造成叶片黄化。
4 结论
盐碱胁迫下,AtERF49 通过调控逆境胁迫相关基因RAB18和RD29A的表达以及对植物叶片光合作用相关基因(psaA和rbcL)及电子传递等影响,参与植物对盐碱胁迫的响应过程。

