不同类型盐生植物适应盐胁迫的生理生长机制及Na+逆向转运研究进展
刘佳欣 张会龙 邹荣松 杨秀艳 朱建峰 张华新
(1.中国林业科学研究院生态保护与修复研究所 国家林业和草原局盐碱地研究中心,北京 100091;2.中国林业科学研究院天津林业科学研究所,天津 300457;3.中国林业科学研究院黄河三角洲综合试验中心,东营 257500)
盐渍土是一系列受土体中盐碱成分作用的土壤,是各种盐土和碱土以及其他不同程度盐化和碱化的各种类型土壤的统称,也称盐碱土[1]。据统计,世界盐渍土面积约为9.543 8×109hm2,广泛分布于100 多个国家和地区。我国是世界盐渍土面积第三大国,盐渍土面积达9.913 3×108hm2,约占全国土地面积的10%,分布在23 个省、市、自治区,其中,西北、华北、东北及沿海地区是我国盐渍土的主要集中分布地区[2]。在世界范围内,盐渍土带来了人口、资源、环境等诸多问题。盐渍土环境不利于植物的生长,盐渍土中过量矿质元素如Na+或Cl-对植物产生的不利影响,称为盐胁迫[3]。盐胁迫通过渗透胁迫和离子胁迫在整个植物和细胞水平上影响植物生理[4-5],如过量Na+会干扰K+的吸收和代谢,K+参与酶的活化、蛋白质的合成、渗透调节、光合作用等生理过程[6],K+缺乏会引起呼吸速率和离子毒性增加,植物生长变化,矿物分布改变,以及光合作用速率降低[7],还会引起枯萎病,继而导致植物叶片坏死;此外Na+取代Ca2+造成膜不稳定[8],膜通透性改变[9],导致植物减产甚至死亡[10]。盐渍土中存在一种特有的盐生植物生态系统,系统中的盐生植物不仅能够在盐渍土中生长,还能够改善盐渍土环境[11]。
大多数植物不能适应盐渍土环境,但盐生植物(halophytes)能在离子浓度至少200 mmol/L 以上的生境中生长和完成生活史[12]。例如唐古特白刺(Nitraria tangutorum)、中国柽柳(Tamarix chinensis)、芨芨草(Achnatherum splendens)和黄花补血草(Limonium aureum)[13]等。Brekle 根据盐生植物体内离子运输和积累的特点,将其分成稀盐盐生植物(euhalophytes)、泌盐盐生植物(recretohalophytes)和拒盐盐生植物(pseudohalophytes)3 种。
离子区隔化(ion compartmentalization)利用特定转运蛋白对有毒离子进行细胞分隔,是盐生植物维持细胞内适度的Na+/K+比的一种关键模式[5]。盐生植物通过调节离子的吸收和将离子区隔化来抵抗或减轻盐胁迫造成的伤害,主要是通过将过量Na+区隔在植物组织器官的局部或细胞的局部,甚至排出体外,从而避免或降低Na+对植物正常生长和生理代谢的影响。本文重点讨论了3 类盐生植物的生长形态特征,并按植物体内对Na+运输和积累特点对3 种盐生植物的典型耐盐机制研究进展进行了阐述,旨在为今后盐生植物及其耐盐机制研究提供相关依据,为植物耐盐分子育种奠定基础。
1 稀盐盐生植物耐盐机制
稀盐盐生植物,也叫真盐盐生植物,是将盐离子区隔在肉质化组织和液泡中的一类盐生植物[14]。稀盐盐生植物是盐生植物中耐盐性最强的一类植物,多能在200-400 mmol/L 的盐渍土环境中生长[1]。稀盐盐生植物绝大部分是藜科植物,例如盐地碱蓬(Suaeda salsa)、盐爪爪(Kalidium foliatum)、盐穗木(Halostachys caspica)等。
1.1 稀盐盐生植物耐盐形态特征
稀盐盐生植物的内在结构和外观形态在一定程度上适应盐胁迫,其形态上最突出的特征是茎叶肉质化。肉质化组织含水量高,可以将体内盐分稀释,使植物体不受高盐环境的伤害[15]。茎肉质化稀盐盐生植物,皮层分化为内部皮层和外部皮层两部分,内部皮层发育成贮水组织,细胞呈球形或椭圆形,外部皮层发育成栅栏组织,细胞内含大量叶绿体。盐节木(Halocnemum strobilaceum)、盐穗木[16]等植物都是茎肉质化的稀盐盐生植物,其形态存在以上特点。叶肉质化的稀盐盐生植物,叶肉质且无柄,呈圆柱状或半圆柱状,气孔少,叶表皮细胞排列紧密,几乎全部由贮水细胞组成,表皮外被角质层。Gao等[17]研究表明假木贼(Halocnemum strobilaceum)在盐溶液浓度为0.9%-5.4%时,叶肉质化程度增加。刘彧等[18]研究表明盐地碱蓬叶片对Na+和Cl-的积累是叶片肉质化的主要原因,在盐胁迫下,叶片肉质化,细胞数目增多。另外,碱蓬属(Suaeda)、盐爪爪属(Kalidium)、假木贼属(Anabasis)的植物,也是叶肉质化的稀盐盐生植物。
1.2 稀盐盐生植物耐盐生理机制
稀盐盐生植物除凭茎叶肉质化稀释植物体内盐分外,主要是通过离子区隔化作用,将离子运输到细胞的特定部位,从而降低盐离子对胞质中的细胞器、酶等的毒害,且伴随着细胞浓度的增大,水势降低,细胞吸水及抗渗透胁迫能力增强[19]。刘彧等[18]发现盐地碱蓬叶片细胞将Na+区隔到液泡中,以减少Na+对植物造成的渗透胁迫及离子胁迫,有利于盐地碱蓬在高盐条件下生存。西伯利亚白刺(Nitraria sibirica)通过Na+液泡区隔化增强叶片组织的耐盐性,保持胞质溶液中较低Na+含量,提高渗透调节能力,从而在盐胁迫下维持正常生理活动[20]。1.3 稀盐盐生植物耐盐分子机制
细胞内Na+/K+浓度的平衡是保证植物在盐渍环境下进行正常生理代谢的关键。稀盐盐生植物在盐胁迫条件下,通过盐诱导Na+/H+逆向转运体将Na+从胞质中排出或在液泡中分隔[21],其中质膜Na+/H+逆向转运蛋白SOS1(plasma membrane Na+/H+exchanger 1)能够将胞质中过量的Na+排出到胞外;液泡膜Na+/H+逆向转运蛋白NHX(vacuolar Na+/H+antiporter)如NHX1 和NHX2 能够将胞质中过量的Na+逆浓度梯度转运至液泡中,SOS1 和NHX 均可减少胞质内Na+的累积,维持细胞的离子稳态,抵御盐胁迫[22]。植物分泌途径的细胞膜上同时存在两类致电H+泵,液泡膜H+-腺苷三磷酸酶(vacuolar H+-ATPase,简称液泡膜H+-ATPase)、液泡膜焦磷酸酶(vacuolar H+-pyrophosphatase,简称液泡膜H+-PPase)[23]和质膜H+- 腺苷三磷酸酶(plasma membrane H+-ATPase,简称质膜H+-ATPase),它们为离子区隔化作用提供能量,并催化H+由胞质向液泡和胞质向胞外的运输[24]。盐胁迫下,盐地碱蓬质膜H+-ATP 酶和液泡膜H+-ATP 酶的表达和活性显著升高[25]。Liu 等[26]用不同浓度的NaCl(100、200、300 和400 mmol/L) 和Ca2+(0、5、10、15、20 mmol/L)处理唐古特白刺幼苗时发现,盐胁迫(NaCl浓度为300 mmol/L)显著促进液泡膜H+-ATP 酶和H+-PPase 酶活性。一定浓度的外源Ca2+有效增强了唐古特白刺液泡膜和质膜的离子泵活性,促进细胞内Na+区隔化,从而提高唐古特白刺的耐盐性。
Qiu 等[27]从拟南芥(Arabidopsis thaliana)中分离鉴定了位于质膜的Na+/H+逆向转运蛋白SOS1和位于液泡膜的Na+/H+逆向转运蛋白NHX1,认为这2 个转运蛋白共同作用使胞质中Na+维持在较低浓度[28]。Na+/H+逆向转运蛋白依靠跨液泡膜的H+浓度梯度对Na+进行转运,因此可以推测通过超表达液泡膜H+-ATPase,使质子梯度增加,能够提高NHXs 对 Na+的区隔能力。在盐胁迫条件下,西伯利亚白刺Na+/H+逆向转运蛋白NsNHX1 和NsSOS1 的表达水平显著上调,过表达NsSOS1 减少了转基因植株Na+的含量,过表达NsNHX1 增加了转基因植株Na+的含量,表明NsSOS1 介导过量Na+的外排,NsNHX1 介导过量Na+的区隔化,它们对提高转基因植物耐盐性有重要作用[22]。另外,有研究表明,NHX 类蛋白在K+区隔化进入液泡和维持细胞内的pH 平衡中也起着重要作用[29](表1)。
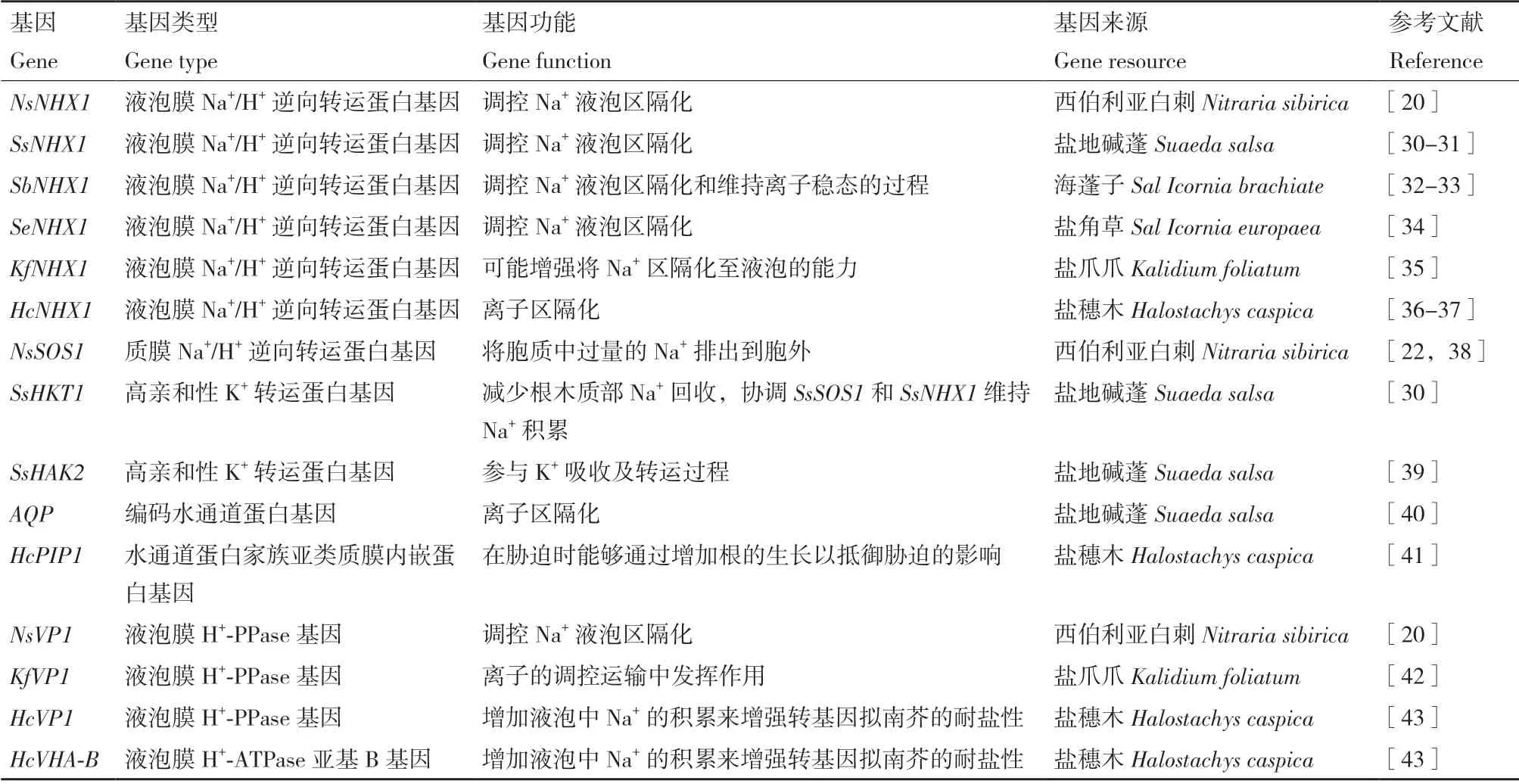
表1 稀盐盐生植物关键耐盐基因Table 1 Key salt-tolerant genes in euhalophytes
2 泌盐盐生植物耐盐机制
泌盐盐生植物是一类通过盐腺或盐囊泡将吸收到体内的盐分分泌到体外的盐生植物。大部分泌盐盐生植物的耐盐性低于稀盐盐生植物[1]。常见的泌盐盐生植物有中华柽柳(Tamarix chinensis)、二色补血草(Limonium bicolor)等。
2.1 泌盐盐生植物耐盐形态特征
泌盐盐生植物的主要形态特征是其叶片或茎上形成了专门分泌盐分的盐腺或盐囊泡,盐腺或盐囊泡可以分泌植物体内过量的盐离子,因此盐腺和盐囊泡对泌盐盐生植物适应盐胁迫起重要作用。根据盐离子运输方式的不同,又可将泌盐盐生植物分为向内和向外泌盐植物。向内泌盐植物(endoreoretohalophytes)将体内的盐分分泌到叶表面的囊泡中暂时贮存,而后盐囊泡破裂将体内过量盐离子排出。盐囊泡有1 个柄和1 个膨大的泡状细胞,柄细胞通过大量胞间连丝与泡状细胞、叶肉细胞相连。藜(Chenopodium album)的盐囊泡是从茎尖和腋芽处的茎叶表皮细胞分化而来,部分表皮细胞生长变大,凸起于茎叶表面,形成盐囊泡的原始细胞,原始细胞进一步分裂分化为1 个柄细胞和1 个泡状细胞,成熟后的盐囊泡外被角质层[44]。利用扫描电镜发现四翅滨藜(Atriplex canescens)盐囊泡与其它藜科植物盐囊泡结构相似,是由体积庞大的肾形囊泡细胞、细长的柄细胞以及基部的表皮细胞共同构成盐囊泡复合体,且随着叶龄增加,盐囊泡逐渐破裂退化[45]。
向外泌盐植物(exo-reoretohalophytes)利用盐腺和分泌细胞将盐离子分泌到体外。盐腺分为单细胞盐腺、双细胞盐腺和多细胞盐腺[46]。单细胞盐腺有大液泡和很少的细胞器,具分泌细胞盐腺。目前对单细胞盐腺盐生植物研究较少。双细胞盐腺由1个基细胞和1 个帽细胞组成,两个细胞通过胞间连丝相连[47],细胞质稠密,有一个明显细胞核,没有中央液泡,且腺体细胞壁角质化或栓质化。Kuster等[48]通过对报春花(Jacquinia armillaris)叶片腺状毛的解剖和组织化学研究发现,其叶片盐腺是由一个收集细胞和一个单柄细胞组成,其顶端有多个分泌细胞。非洲虎尾草(Chloris gayana)是具有双细胞盐腺的泌盐盐生植物[49]。另外,禾本科的獐毛属(Aeluropus)、鼠尾粟属(Sporobolus)、大米草属(Spartina)、结缕草属(Zoysia)等9 个属也存在双细胞盐腺[50]。双子叶泌盐盐生植物的盐腺均为多细胞盐腺,多细胞盐腺呈球形或盘状结构,由基底收集细胞和远端分泌细胞构成,整个结构常陷入表皮中[46]。冯中涛[51]研究发现二色补血草盐腺由16个细胞组成,中央为4 个长的分泌细胞,每个分泌细胞外侧均有1 个毗邻细胞,再向外依次包围着4个内杯状细胞和4 个外杯状细胞,邻近的细胞称为收集细胞;细胞核较大,富含线粒体、高尔基体和小囊泡,但缺少中央大液泡,也没有叶绿体;细胞之间通过胞间连丝连接,盐腺外被角质层。不同的盐生植物其盐腺呈现不同的形状。
2.2 泌盐盐生植物耐盐生理机制
泌盐盐生植物通过盐腺或盐囊泡向体外分泌植物体内过多的盐分,避免盐分在体内过量积累,从而应对盐胁迫对植物的伤害[52]。关于泌盐盐生植物分泌盐的机制,前人经过大量研究,从组织化学和超微结构的角度提出了3 个假说:(1)1955年Arisz等[53]提出渗透机制假说,认为盐腺的泌盐是一个物理过程,盐腺中离子的主动积累使分泌细胞渗透压降低,从而导致静水压力的显著增加。当盐腺内压力达到最高时,分泌细胞通过分泌孔周期性地形成液滴,释放静水压力,将离子排出盐腺外[54]。盐草(Distichlis spicata)的超微结构证实了这一假说,其盐腺只有一层薄膜,类似于一个瓣膜,将细胞质壁层隔开[55]。渗透机制假说还受到了一些研究结果的挑战,盐腺泌盐存在离子选择性和主动运输的特征,即盐腺泌盐不是简单的物理过程[56]。(2)1967年Ziegler 和Luttge[57]提出胞饮反向活动假说,认为盐腺的分泌作用是通过贮存在小细胞质囊泡中的盐液向细胞外表面排出的过程。通过使用电子显微镜对二色补血草[58]和柽柳[59]盐腺进行扫描,观察到电子密度物质主要聚集在囊泡中,特别是在盐处理的植物中,大量的囊泡与质膜融合,从而证明了这一假说。(3)1971年Levering 和Thomson[60]提出盐腺的分泌作用类似于动物液流运输系统假说,研究者假设大米草属基底细胞形成了广泛的膜系统,盐腺通过膜上的离子通道分泌离子,类似于动物组织上皮细胞的吸收和分泌[52]。
盐囊泡的泌盐方式不同于盐腺,盐腺直接将盐分分泌至体外,而盐囊泡则是通过积累大量盐分并膨胀,最终破裂,将盐分释放到植物体外[61],具体过程主要包括:Na+从叶肉细胞排出,经柄细胞转运至盐囊泡,最后被区隔在盐囊泡液泡[62]。研究表明,四翅滨藜盐囊泡Na+积累过程是Na+沿表皮细胞-柄细胞-盐囊泡复合体(EC-SC-EBC complex)逆着其浓度梯度的单向极性跨膜转运[63]。Barkla 等[64]通过对冰叶日中花(Mesembryanthemum crystallinum)盐囊泡中的离子组成分析发现,其中含有大量Na+和Cl-,并进一步证明离子区隔化提高了该植物的耐盐性。
2.3 泌盐盐生植物耐盐分子机制
泌盐盐生植物盐的分泌是植物活跃的生理过程。在盐胁迫条件下,H+-ATPase 的表达随着盐分泌的增加而增加[65]。张春蕊等[66]在刚毛柽柳(Tamarix hispida)中鉴定获得液泡膜H+-PPase 基因ThVP1,发现在NaCl 胁迫下,刚毛柽柳根和叶中的ThVP1基因表达明显上调。在对二色补血草的盐腺结构观察时发现其盐腺中不存在叶绿体,且盐腺中的线粒体比叶肉细胞的线粒体大,证明线粒体能够为盐腺分泌盐分提供能量[56]。Panda 等[67]指出通过三羧酸循环的上调来持续提供能量,同时不间断地合成蛋白质和维持光合机制的结构完整性,是柳枝梭梭(Haloxylon Sal Icornicum)耐盐的主要机制。
Hamada 等[68]从盐生植物北滨藜(Atriplex gmelini)中分离出一个Na+/H+逆向转运蛋白基因,并将其命名为AgNHX1,发现AgNHX1的迁移模式与液泡膜H+-ATPase 相关,而与液泡膜H+-PPase 无关,AgNHX1定位于液泡膜,盐胁迫下,在mRNA和蛋白水平上均上调表达。通过AlNHX转化的盐生植物小獐毛(Aeluropus littoralis)表现出较高的耐盐性(400 mmol/L NaCl)[69],由此可以看出AgNHX1产物在耐盐性中具有重要作用[70]。Dang[71]和Yuan等[56,72]陆续在红砂(Reaumuria trigyna)和补血草属(Limonium)植物中进行了转录组测序,获得了参与盐腺分泌的一系列候选基因,为提高植物耐盐性提供可能(表2)。
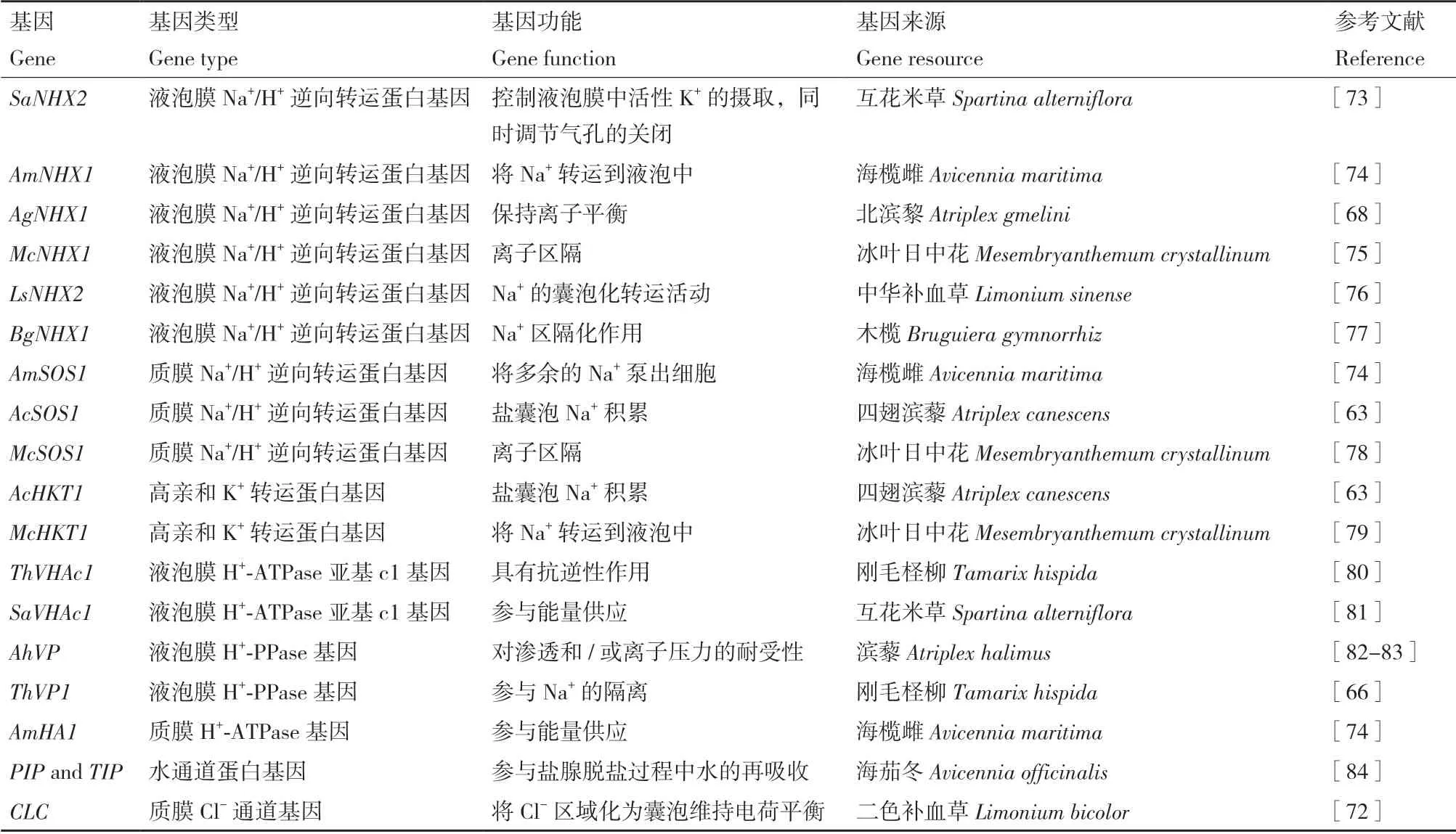
表2 泌盐盐生植物关键耐盐基因Table 2 Key salt-tolerant genes in recretohalophytes
3 拒盐盐生植物耐盐机制
拒盐盐生植物,又称假盐盐生植物,拒绝或少吸收外界盐分,能够将盐离子积累在皮层细胞液泡和根部木质部的薄壁细胞中,减少向上部茎叶运输盐离子[14],降低盐分对植物的胁迫作用。沙枣(Elaeagnus angustifolia)[85]、芦苇(Phragmites australis)[86]、莎草(Cyperus rotundus)等是较为常见的拒盐盐生植物。拒盐盐生植物种类较稀盐盐生植物和泌盐盐生植物少[1]。
3.1 拒盐盐生植物耐盐形态特征
拒盐盐生植物根部皮层栓质化,栓质化的主要成分是难溶于水的脂肪类物质,具有不透水、不透气性,导致溶解于土壤水分中的盐分难以进入根中;茎的表皮切向壁具有发达的角质层,维管束近于星散分布;叶的上表皮向外延伸的表皮毛较多,气孔下陷;叶肉组织排列疏松,胞间隙较大,叶脉维管束鞘由两层细胞构成[87]。在高浓度盐胁迫下,拒盐植物小花碱茅(Puccinellia tenuiflora)的内皮层显著加厚,根内皮层细胞表面的木栓质沉积受盐胁迫诱导而增强[88]。经过盐处理的灯芯草属(Juncus)植物,根和茎中具有发育良好的通气组织,且根皮脱落,皮质很厚,凯氏带(Casparian strips)木质化[89],对植物抵抗盐胁迫发挥重要作用。
3.2 拒盐盐生植物耐盐生理和分子机制
拒盐盐生植物的拒盐机理,不同植物不尽相同。有些拒盐盐生植物拒Na+或者拒Cl-,有些既拒Na+又拒Cl-[1]。芦苇在盐胁迫下,Na+转运速率从根至芽依次降低,从而避免在芽中积累过量的Na+[90]。陈琳等[91]对潮滩芦苇和河滩芦苇的耐盐性进行比较发现,因潮滩芦苇的根系有更高的排Na+能力而耐盐性更强。彭彦辉[92]通过观察小花碱茅根系电镜扫描结果发现,控制Na+/K+选择性吸收是发生在根内皮层上的。小花碱茅通过较高的Na+/K+选择性吸收能力,能减少Na+在体内的净积累[93]。Abideen等[94]和王树凤等[95]观察到,根系生长可以补偿其吸收功能的损失,由于盐胁迫引起的干重积累和表面积的增加,这些补偿效应有利于根系对K+的吸收和Na+的贮存,由此推测根系补偿性生长可能是沙枣增强耐盐性的一种机制[96]。Liu 等[96]研究进一步证实了沙枣根Na+和Cl-贮存的可扩展能力,有效地限制Na+从茎到叶的运输,以及根补偿生长是沙枣对盐胁迫的生理适应机制。
Perez-Jimenez 等[97]通过γ 辐射获得具有抗盐性的5 个柑橘(Citrus×paradisi)砧木突变体,并对突变体抵抗盐度水平的程度进行评估,数据表明柑橘是通过积累较少Na+或 Cl-来提高耐盐性。Zhang等[98]发现PtNHX1、PtSOS1 和PtHKT1;5 等转运蛋白在小花碱茅的不同组织协同调控,使植物维持Na+稳态,增加小花碱茅的耐盐性。李静[99]采用非损伤微测技术分析小花碱茅响应盐胁迫的各种离子流动态变化机制,推测小花碱茅在高盐胁迫初期,Ca2+的大量内流可能在SOS 系统信号转导过程中发挥了关键作用,从而激活SOS1 以增强Na+外流。杨升等[100]研究指出,在盐胁迫下,沙枣幼苗根系进行Na+积累和K+外流,为减少Na+积累,通过根系Na+/H+逆向转运蛋白将Na+从体内排出(表3)。

表3 拒盐盐生植物关键耐盐基因Table 3 Key salt-tolerant genes in pseudohalophytes
4 总结与展望
通过对3 类盐生植物耐盐形态、生理及分子机制的总结发现,大部分盐生植物主要是通过两类基因应对胞质中过高的Na+,其中一类是离子转运蛋白编码基因,如液泡膜Na+/H+逆向转运蛋白编码基因NHX1和质膜Na+/H+逆向转运蛋白编码基因SOS1;另一类是提供能量的基因,如液泡膜 H+-ATPase 和H+-PPase 基因以及质膜H+-ATPase 基因。液泡膜H+-ATPase 和H+-PPase 及质膜H+-ATPase 产生H+梯度并提供能量,液泡膜Na+/H+逆向转运蛋白NHX1 将胞质中过量的Na+逆浓度梯度转运至液泡中,质膜Na+/H+逆向转运蛋白SOS1 将胞质中过量的Na+排出到胞外,这样就可以使植物胞质中的Na+浓度降低到植物耐受的范围内。
在生理和形态上,3 类盐生植物应对盐胁迫的策略各有不同。稀盐盐生植物通过离子区隔化应对盐胁迫,将过量Na+区隔在液泡中,并通过茎叶肉质化将体内盐分进行稀释,使植物体不受高盐环境的伤害(图1-a)[102-103];泌盐盐生植物拥有其特有的生理结构——盐腺或盐囊泡,能够利用盐腺和分泌细胞将盐离子分泌到体外,或是把体内盐分分泌到叶表面的盐囊泡中暂时贮存,而后盐囊泡破裂将体内多余盐分释放,从而避免盐分在体内过量积累以维持植物体正常生理活动(图1-b)[104-105];拒盐盐生植物通常是将盐离子积累在皮层细胞液泡和根部木质部薄壁细胞中,减少向上运输盐离子,且根外皮层栓质化不透水透气性,进一步实现不吸收或很少吸收盐离子以适应盐胁迫(图1-c)[29]。经前人大量研究,大部分的稀盐盐生植物耐盐性高于泌盐盐生植物,高于拒盐盐生植物,这3 种盐生植物耐盐性的不同,可能与其生理生长机制的差异有关,但仍需要进行大量的实验进行验证。
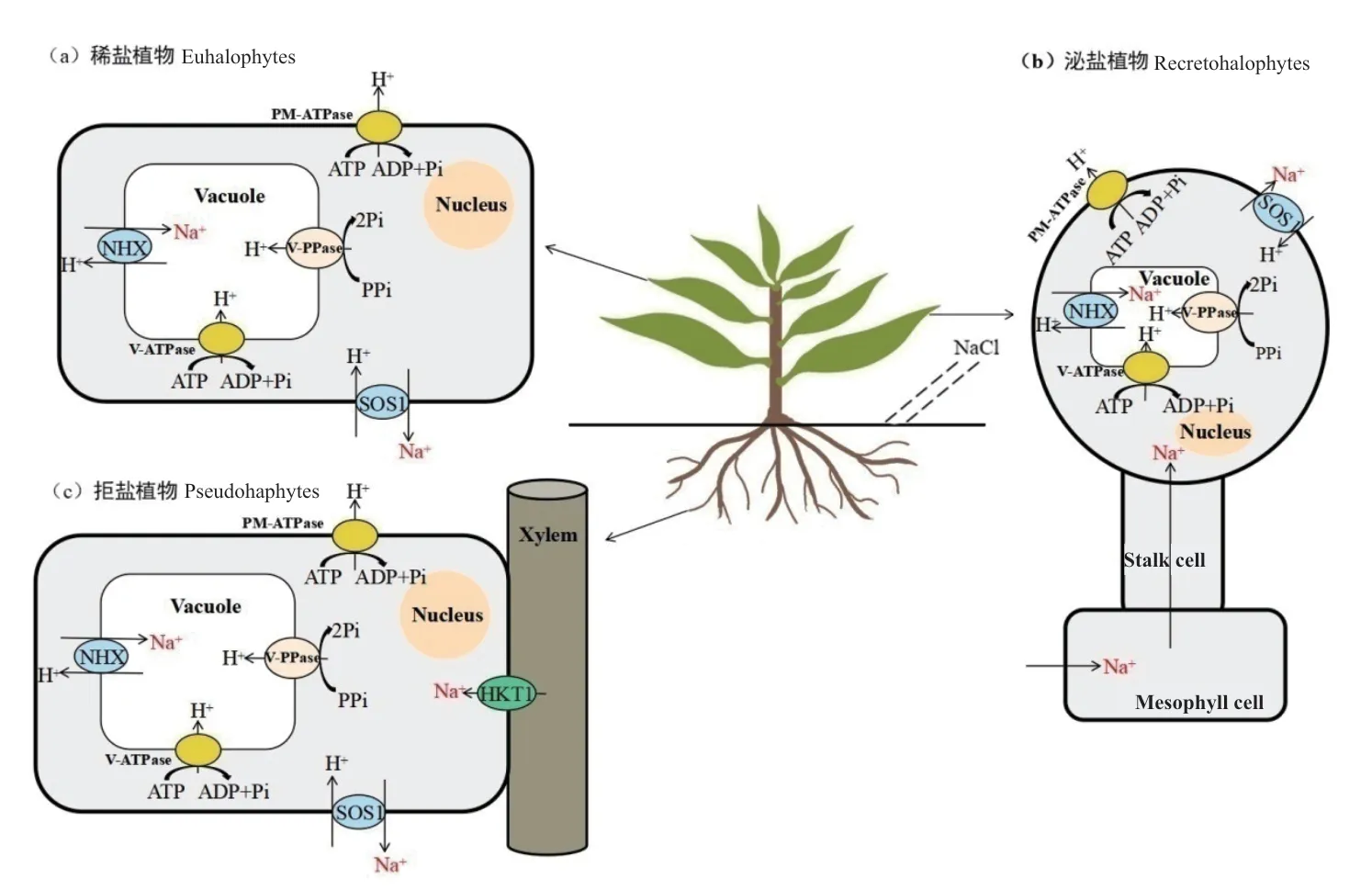
图1 三类盐生植物Na+逆向转运耐盐机制模式图Fig.1 Model diagram of Na+ antiport mechanisms for salt tolerance in three halophytes
除了以上研究,还有许多问题亟待进一步探究:一是离子转运蛋白和提供能量的两大类基因在各类盐生及非盐生植物中均存在,但不同植物的耐盐性差异巨大,因此,应进一步挖掘盐生和非盐生植物耐盐基因,比较不同种植物间相同基因如NHX1、SOS1的功能差异,研究相同基因在不同植物体内的调控机制,并进行基因功能的验证分析;二是决定及调控盐生植物在盐胁迫下特化出组织结构的基因需要进一步挖掘,如稀盐盐生植物的肉质化茎和叶、泌盐盐生植物的盐腺和盐囊泡、拒盐盐生植物栓质化根;三是植物耐盐是一个由多基因协调控制的复杂生物学过程,以往的研究大多是将单一目的基因转入到植物体内以提高植物的耐盐性,今后可以将离子转运蛋白和提供能量的两类基因同时转化到植物中,与单一基因的转化进行比较,探索更有效的多基因转化组合,为耐盐植物的育种提供依据。

