ICU 细菌感染性肺炎病人抗菌药物相关性腹泻预警模型的构建
陈 玄,朱建龙,黄振飞,刘晓兰,杨 柳
赣州市人民医院,江西 341000
重症细菌性肺炎是重症监护病房(intensive care unit,ICU)常见的呼吸系统感染性疾病[1]。抗菌药物作为临床治疗重症细菌性肺炎最有效的方法,是决定病人预后的关键[2]。抗菌药物种类多样且频繁更换,极易出现优势菌迁移及抗菌药物相关性腹泻(antibioticassociated diarrhea,AAD)[3]。AAD 是指在使用抗菌药物过程中或使用抗菌药物后8 周内出现的无法用其他原因解释的腹泻[4-5]。研究表明,并发AAD 的病人住院时间延长,医疗费用及死亡风险显著增加[6-7]。鉴于此,本研究旨在探讨ICU 细菌感染性肺炎病人抗菌药物相关性腹泻的危险因素,构建个体化预警模型,为临床个性化防治及护理提供依据。
1 资料与方法
1.1 一般资料 选取2017 年1 月—2020 年12 月收治的ICU 细菌感染性肺炎病人作为研究对象。纳入标准:①细菌感染性肺炎确诊符合《中国急诊重症肺炎临床实践专家共识》[8]中的诊断标准;②年龄18~80 岁;③入院前2 个月无腹泻病史;④病例资料完整可靠。排除标准:①肠道结构功能紊乱;②脂肪泻、慢性肠炎急性发作、食物中毒、细菌性痢疾以及护理不当等原因引起的腹泻;③既往存在精神病史;④合并恶性肿瘤;⑤合并严重肝功能不全及肾衰竭等严重慢性疾病;⑥自身免疫性疾病及严重血液系统疾病;⑦器官移植术后;⑧院内死亡;⑨近3 个月内服用免疫抑制剂及激素类药物。本研究符合《赫尔辛基宣言》提出的要求且经本院伦理委员会审查通过。根据以上标准,本次研究共纳入317 例细菌感染性肺炎病人,根据其 是 否 发生AAD 分为AAD 组(n=91)和非AAD 组(n=226)。
1.2 方法
1.2.1 数据收集 收集病人的一般资料,包括年龄、性别、体质指数(body mass index,BMI)、居住地、文化程度、婚姻状况、吸烟史、饮酒史、高血压、糖尿病、冠心病、病程、肺炎严重指数评分、急性生理与慢性健康状况评分(Acute Physiology,Age and Chronic Health Evaluation,APACHEⅡ)、ICU 住院天数、机械通气、质子泵抑制剂(proton pump inhibitor,PPI)、抗菌药物种类以及抗菌药物用药时间;病人抗菌药物应用前的实验室指标,主要包括清蛋白(albumin,ALB)、血红蛋白(hemoglobin,Hb)、红细胞(red blood cell,RBC)、白细胞(white blood cell,WBC)、血小板(platelet,PLT)、中性粒细胞、淋巴细胞、C-反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerols,TG)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein,HDL-C)、肌酐(creatinine,Cr)以及尿素氮(blood urea nitrogen,BUN)。
1.2.2 AAD 诊断 AAD 诊断标准[9]:①应用抗菌药物后粪便性状改变,如水样便、黏液脓血便或见斑块条索状伪膜;②腹泻频率每日≥3 次;③持续腹泻时间≥2 d;④粪常规检查提示无或少量白细胞,可检出金黄色葡萄球菌、难辨梭状芽孢杆菌及白色念珠菌等特殊病原菌或肠道菌群失调。
1.3 统计学方法 采用SPSS 26.0 进行统计学分析。定量资料采用均数±标准差(±s)描述,进行独立样本t检验;分类资料采用例数描述,进行χ2检验。连续性资料的最佳截断值及曲线下面积(area under the curve,AUC)通 过MedCalc 软 件 获 得,采 用 多 因 素Logistic 回归分析影响AAD 发生的独立危险因素。基于多因素Logistic 回归分析结果,利用R 3.5.2 版中的RMS 软件包绘制相关Nomogram 模型,内部验证结果由校正曲线以及决策曲线分析获得。P<0.05 表示差异具有统计学意义。
2 结果
2.1 ICU 细菌感染性肺炎病人基线指标 91 例(28.71%)ICU 细菌感染性肺炎病人发生AAD,AAD组病人与非AAD 组病人基线指标比较见表1。
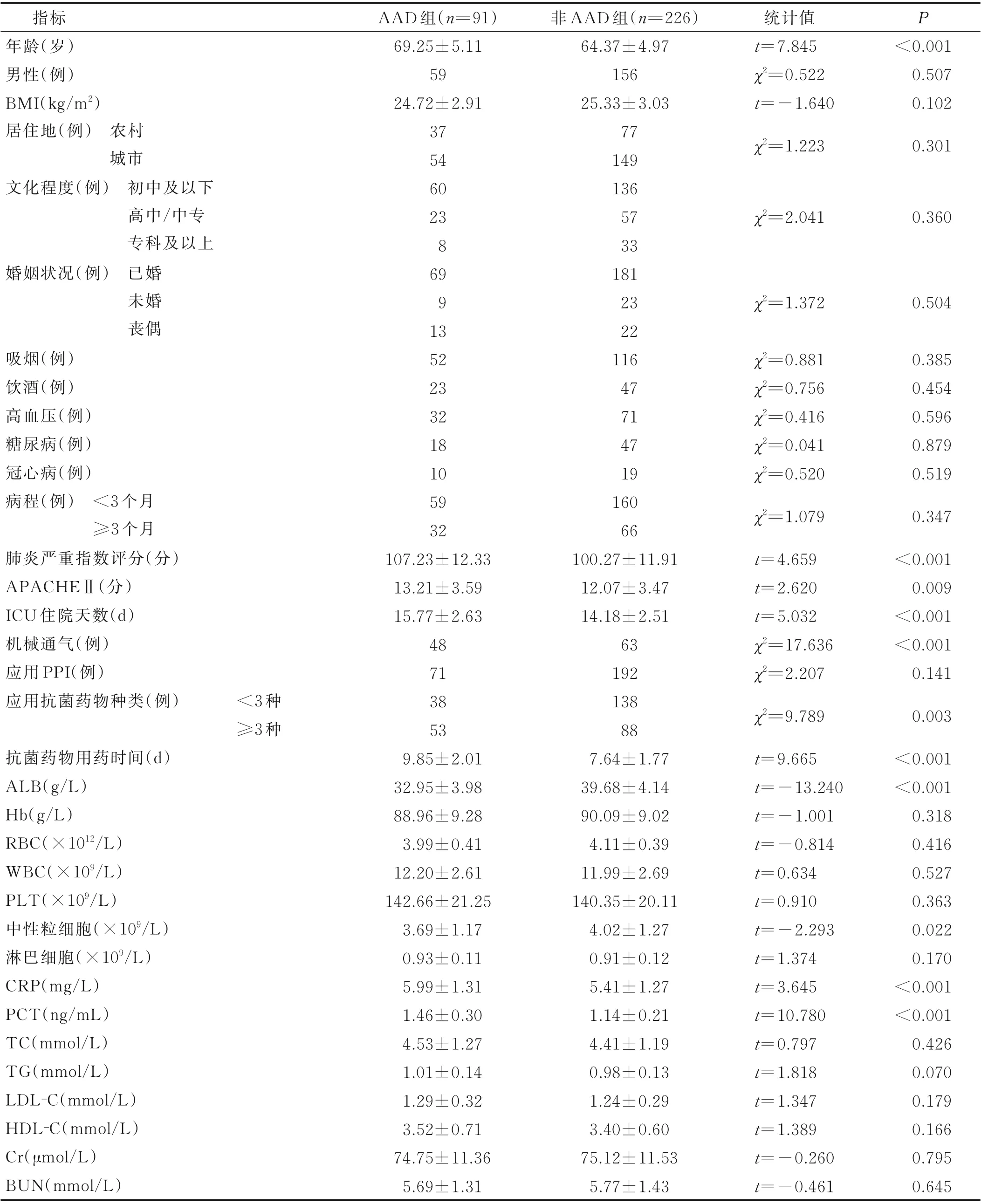
表1 AAD 组病人与非AAD 组病人基线资料比较
2.2 ROC 曲线分析 筛选出两组ICU 细菌感染性肺炎病人间差异比较具有统计学意义的连续性变量,进行ROC 曲线分析。结果见图1 及表2。

表2 两组ICU 细菌感染性肺炎间相关连续性变量ROC 曲线分析结果
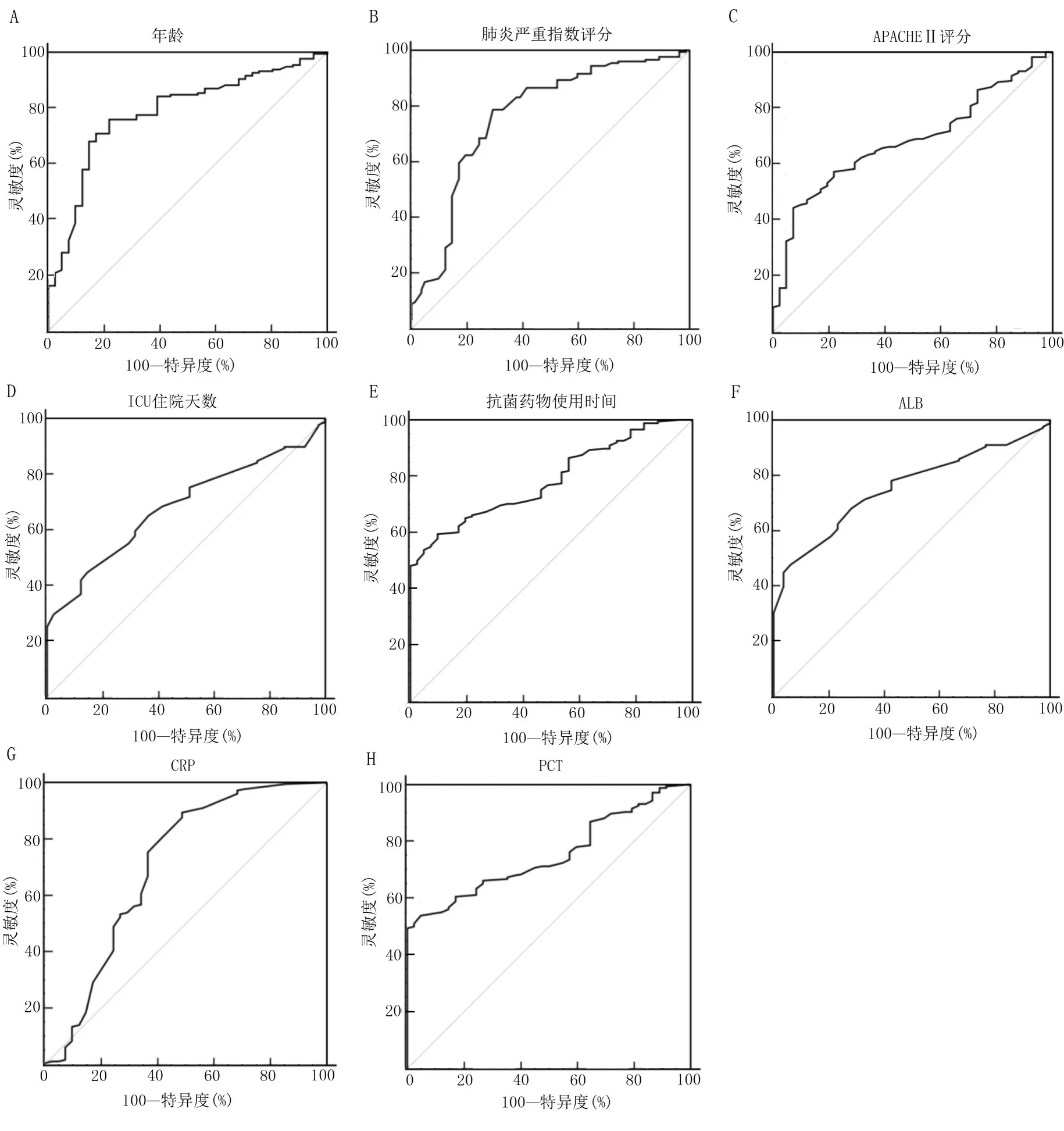
图1 两组ICU 细菌感染性肺炎间相关连续性变量ROC 曲线
2.3 Logistic 回归分析 Logistic 回归分析结果显示:年龄(≥70 岁)、肺炎严重指数评分(≥108 分)、抗菌药物种类(≥3 种)、抗菌药物使用时间(≥10 d)以及ALB(≤32 g/L)是ICU 细菌感染性肺炎病人发生AAD 的独立危险因素(P<0.05),见表3。

表3 ICU 细菌感染性肺炎病人发生AAD 的多因素Logistic 回归分析
2.4 构建ICU 细菌感染性肺炎病人发生AAD 风险的Nomogram 模型 将上述5 项AAD 发生的独立危险因素纳入ICU 细菌感染性肺炎病人发生AAD 的风险预测体系,建立Nomogram 模型,见图2。针对该Nomogram 模型进行内部验证,结果显示,C-index 为0.817,95%CI(0.788,0.853),且模型预测结果与实际观测结果接近,提示该Nomogram 模型的预测准确度较好,见图3。决策曲线结果显示,高风险阈值>0.18时,该Nomogram 模型在预测ICU 细菌感染性肺炎病人发生AAD 方面可提供高于单个独立危险因素的额外临床净收益,提示该Nomogram 模型具有较好的临床效能,见图4。

图2 预测ICU 细菌感染性肺炎病人发生AAD 高风险的Nomogram 模型
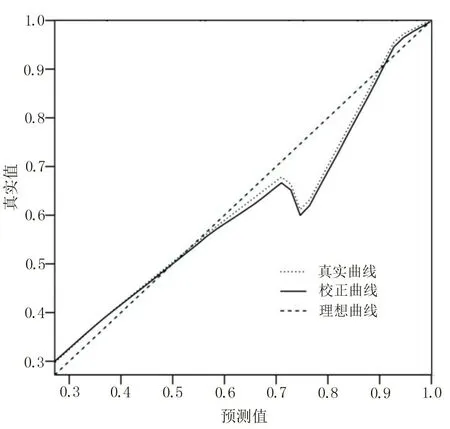
图3 验证ICU 细菌感染性肺炎病人Nomogram 模型准确性的矫正曲线
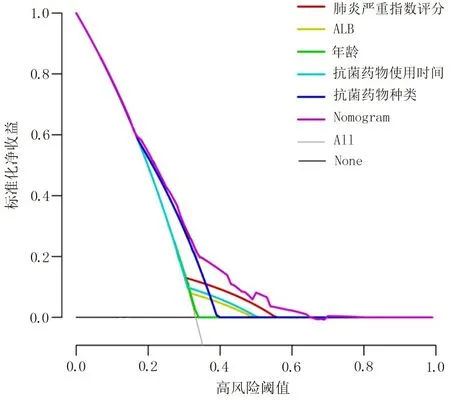
图4 预测ICU 细菌感染性肺炎病人发生AAD 高风险的决策曲线
3 讨论
3.1 ICU 细菌感染性肺炎病人发生AAD 的现状及其分析 本研究成功构建了预测ICU 细菌感染性肺炎病人AAD 发生的Nomogram 模型,并通过内部验证显示该Nomogram 模型的临床效能及预测能力较好。Nomogram 模型因具有整合独立危险因素并将疾病发生风险概率直观显示的能力,故可作为图表工具用于临床风险预测[10]。本研究中,91 例(28.71%)ICU 细菌感染性肺炎病人发生AAD,与徐元平等[11]关于老年重症肺炎及曾芹静等[12]关于ICU 病人的研究结果一致。
3.2 ICU 细菌感染性肺炎病人AAD 发生的危险因素及其护理策略 本研究结果显示,年龄(≥70 岁)、肺炎严重指数评分(≥108 分)、抗菌药物种类(≥3 种)、抗菌药物使用时间(≥10 d)以及ALB(≤32 g/L)是ICU 细菌感染性肺炎病人发生AAD 的独立危险因素。既往有研究报道,高龄是公认的AAD 的独立危险因素[13]。究其原因,可能与老年人独特的病理、生理有关,老年病人各脏器机能及储备能力下降,基础疾病较多,加之机体抵抗能力差等多重因素,使肠道菌群稳态被打破,肠黏膜细胞增殖障碍,肠黏膜屏障功能下降,易受到病原微生物感染,最终导致AAD[14]。提示护理人员应特别关注年龄≥70 岁的ICU 细菌感染性肺炎病人,注意AAD 发生前兆症状,提醒主管医生及时采取相关措施消除AAD 发生风险。肺炎严重指数评分也是一个独立危险因素,肺炎病情较重的病人常合并严重感染,尤其易诱发脓毒症等致死性疾病,需采用广谱、抗菌能力强的抗菌药物,导致肠道耐药菌大量繁殖,敏感菌被抑制,增加AAD 发生的风险[15]。护理人员应随时关注病人的病情变化,遵医嘱采取相应的治疗措施控制病情,减少AAD 发生的风险。抗菌药物种类及抗菌药物使用时间等指标亦能反映ICU 细菌感染性肺炎病人发生AAD 风险,这与既往研究结果[16]一致。因此,护理人员应随时记录病人的用药情况,积极参与制定个体化合理用药方案。另外,本研究还发现,ALB≤32 g/L 也是ICU 细菌感染性肺炎病人发生AAD 的一个独立危险因素。ALB 是临床上应用最广泛的营养评价指标之一。细菌感染性肺炎是一种消耗性疾病,导致ALB 降低,加之感染性疾病释放的内毒素作用于肝细胞会抑制ALB 合成。因此,ALB 水平常反映ICU 细菌感染性肺炎的严重程度[17]。ALB 水平下降会导致机体免疫力下降,最终增加AAD 发生的概率。因此,护理人员应为病人制定个性化的营养护理方案。
综上所述,本研究构建的可视化Nomogram 模型临床操作性较强,方便临床护理人员对ICU 细菌感染性肺炎病人AAD 风险程度划分,并针对性地采取积极、有效的护理策略以降低AAD 发生的概率。但本研究是一项小样本单中心、回顾性研究,且只进行了内部数据验证,未来可进一步开展多中心、大样本的外部数据验证,以改进模型,提高临床适用性。

