鹅4种常见病毒多重PCR检测方法的建立及初步应用
姚鑫炎,孙 静,刘 宏,吕志航,车艺俊,黄淑坚,袁 生*,张雪莲*
(1.佛山科学技术学院 生命科学与工程学院,广东 佛山 528231;2.广东格沣动保科技有限公司,广东 肇庆 526238)
近年来,随着养鹅业的不断发展,鹅病毒性疾病变得越来越复杂化与多样化,加之鹅饲养模式自身限制的影响,多种病原的混合感染在养鹅业已日益凸显。有研究数据表明鹅细小病毒(goose parvovirus,GPV)、鹅圆环病毒(goose circovirus,GoCV)、鸭坦布苏病毒(duck Tembusu virus,DTMUV)和鹅星状病毒(goose astrovirus,GoAstV)4种病原在养鹅业发病率较高且存在隐性感染[1-3]和混合感染[4-7],给养鹅业造成了巨大的经济损失,严重制约养鹅业的健康发展。
鹅圆环病毒病是由GoCV感染引起鹅生长发育缓慢,羽毛脱落,胸腺、脾脏、法氏囊等免疫器官淋巴细胞减少的免疫抑制性传染病[8];该病流行广泛,对雏鹅危害较大,常呈隐性感染,可使雏鹅机体免疫力下降而诱发其他多种病原的继发感染。GPV感染雏鹅常被称为小鹅瘟,也称为Derzsy 病[9-10],该病是一种急性、高传染性和致命性的疾病,主要引起雏鹅纤维性坏死性肠炎;该疾病的严重程度与年龄有关,1周龄以内的雏鹅最易感,病死率高达100%;4周龄以上的鹅感染后则很少表现出典型的临床特征[11]。研究发现,GoCV与GPV存在混合感染,造成雏鹅脱毛断羽等疾病[5]。而DTMUV感染可引起鹅采食量急剧下降,腹泻、瘫痪及共济失调,感染率100%,病死率5%~30%不等[12]。GoAstV感染可引起雏鹅关节肿大,肾脏苍白肿胀,内脏、关节腔、输尿管有尿酸盐沉积等[13]。最新研究表明,GoAstV还可导致雏鹅淋巴细胞和巨噬细胞凋亡,故该病毒感染可能引起机体的免疫抑制[14],某种程度上也会引发多病原的混合感染,从而加速相关疾病病程导致雏鹅的死亡。
大量研究显示,GPV、DTMUV、GoCV和GoAstV的感染主要危害雏鹅,且临床上存在多病原的混合感染,一旦发病,病程急、病死率极高,给养鹅业造成了巨大经济损失。因此,本研究旨在建立一种可以同时检出GPV、DTMUV、GoCV和GoAstV 4种病原的多重PCR检测方法,为上述疾病的临床诊断及流行病学调查提供技术支撑及理论基础。
1 材料与方法
1.1 主要试剂TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0、pMDTM18-T Vector Cloning Kit、Premix Ex TaqTM、PrimeScriptTMOne Step RT-PCR Kit Ver.2、DL2000 DNA Marker均购自宝生物工程(大连)有限公司;Trans5α Chemically Competent Cell购自全式金生物技术有限公司;Gel Extraction Kit购自广州飞扬生物工程有限公司;SteadyPure Plasmid DNA Extraction Kit 购自湖南艾科瑞生物工程有限公司。
1.2 病毒核酸鸭甲肝病毒1型(DHAV-1)、鸭甲肝病毒3型(DHAV-3)、DTMUV、H5N6亚型禽流感病毒(AIV)、H9N2亚型禽流感病毒(AIV)、新城疫病毒(NDV)、鸭病毒性肠炎病毒(DEV)、GoAstV、GPV、鸭腺病毒3型(FADV-3)、GoCV、新型鸭呼肠孤病毒(NDRV)阳性核酸均由佛山科学技术学院预防兽医学实验室保存。
1.3 临床病料样品2020年12月-2021年8月采集于广东省部分地区水禽养殖场疑似病毒感染致死的病料样本,共计40份,主要组织器官为肝脏。取1 mg肝脏组织加入2 mL无菌PBS后利用生物组织研磨器进行研磨,而后12 000 r/min离心10 min,收集组织研磨液上清,并于-80℃冰箱中保存备用。
1.4 多重PCR引物设计与合成根据GenBank中GoAstV、GoCV、GPV及DTMUV参考毒株的全基因组序列,利用MEGA5.1 软件进行比对,选取GoAstV的ORF2蛋白、GoCV的Rep蛋白、GPV的VP3蛋白及DTMUV的NS5蛋白序列,利用Primer Primer 5.0分别设计1对特异性PCR引物(表1),引物均由广州天一辉远基因科技有限公司合成。
1.5 核酸的提取参照TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0试剂盒说明书,提取临床病料样品的核酸,置-80℃保存备用。

表1 多重PCR引物序列
1.6 单重PCR扩增及重组质粒构建以TaKaRa PrimeScriptTMOne Step RT-PCR Kit Ver.2说明书对GoAstV、GoCV、GPV、DTMUV阳性核酸进行PCR扩增;反应体系为(50 μL):PrimeScript 1 Step Enzyme Mix 2.5 μL,上、下游引物(10 μmol/L)各1.5 μL,阳性核酸模板5.0 μL,2×1 Step Buffer 25.0 μL,加RNase Free ddH2O至50.0 μL。扩增程序为:50℃反转录30 min;94℃预变性3 min;94℃变性40 s,53℃退火40 s,72℃延伸45 s,35个循环;72℃延伸5 min。扩增产物进行2%的琼脂糖凝胶电泳鉴定。将与预期大小相符的DNA片段进行纯化回收,并按照pMDTM18-T Vector Cloning Kit试剂盒说明书将上述DNA片段与pMD18-T载体相连,转化入DH5α感受态中,通过PCR鉴定筛选阳性克隆,并将阳性菌株送至生工生物工程(上海)股份有限公司广州分公司进行测序,序列正确的菌液提取质粒保存于-20℃。
1.7 多重PCR扩增条件优化
1.7.1退火温度的优化 以4种病毒的阳性重组质粒混合成相同的质量浓度作为多重PCR反应的模板(15 mg/L),表1中4种病毒的引物等比混合为扩增引物(1.25 μmol/L),反应体系为20.0 μL:PrimeScript 1 Step Enzyme Mix 1.0 μL,混合引物(1.25 μmol/L)4.8 μL,混合模板(15 mg/L)2.0 μL,2×1 Step Buffer 10.0 μL,加RNase Free dH2O至20.0 μL。反应条件同1.6反应条件,但退火温度设置为50,52,54,56,58,60℃ 6个梯度的退火温度。扩增产物经3%的琼脂糖凝胶电泳检测,以确定最佳退火温度。
1.7.2引物浓度的优化 在20 μL的反应体系中加入0.8,1.6,2.4,3.2,4.0,4.8,5.6,6.4,7.2 μL体积的混合引物,使得4种病毒的上、下游引物依次为0.05,0.10,0.15,0.20,0.25,0.30,0.35,0.40,0.45 μmol/L 9个引物浓度梯度。扩增产物经3%的琼脂糖凝胶电泳检测,以确定最佳引物浓度。
1.8 多重PCR特异性试验采用已优化好的扩增条件,以4种病毒阳性核酸混合物、GoAstV、DTMUV、GPV、GoCV、DHAV-1、DHAV-3、NDV、NDRV、DEV、DAdV-3、H5N6 亚型、H9N2 亚型核酸作为模板进行检测,并以ddH2O作为阴性对照,检测四重PCR方法的特异性。
1.9 多重PCR敏感性试验利用超微量紫外分光光度计测定GoAstv、GoCV、GPV、DTMUV 4种阳性重组质粒标准品的质量浓度分别为192,190,217,212 mg/L,将4种阳性重组质粒混合至终质量浓度为15 mg/L,进行100~109倍比稀释。各取2 μL 作为模板,按照上述优化的扩增体系和扩增条件多重PCR检测,以模板稀释最高倍数扩增呈阳性的为该多重PCR的敏感度。
1.10 多重PCR临床样品检测对采自广东省部分地区鹅养殖场的疑似病毒感染致死的40份病料样本,用TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0提取肝脏组织核酸,采用已优化好的多重PCR检测方法,对肝脏组织核酸进行检测;同时利用单一病毒PCR检测方法对相应样品进行再次检测,并将2次检测结果进行对比、分析。
2 结果
2.1 单重PCR扩增及阳性重组质粒构建利用4种病毒的各自引物对4种病毒的阳性核酸进行单一PCR扩增。结果显示,GoAstV、GoCV、GPV及DTMUV 4种阳性核酸分别扩增出约为731,543,392及200 bp大小的目的条带(图1)。而后,将扩增的4种病毒的目的片端进行纯化回收,并与pMD18-T载体相连,构建4种病毒片段的阳性重组质粒,并分别命名为pMD18T-GoAstV、pMD18T-GoCV、pMD18T-GPV及pMD18T-DTMUV。测序结果显示,4个病毒的目的片段与GenBank中相应病毒的参考序列同源性均在99.0%以上。

M.DL2000 DNA Marker;1.GPV;2.GoCV;3.GoAstV;4.DTMUV;5.阴性对照
2.2 多重PCR反应条件的优化分别对多重PCR退火温度及引物浓度进行优化,最佳退火温度为52℃(图2),GPV、DTMUV、GoCV和GoAstV引物等比混合浓度为0.25 μmol/L(图3)。优化后的多重PCR扩增体系为(20.0 μL):PrimeScript 1 Step Enzyme Mix 1 μL,混合引物(1.25 μmol/L)4.0 μL,模板2.0 μL,2×1 Step Buffer 10.0 μL,加RNase Free dH2O至20.0 μL。扩增程序:50℃反转录30 min;94℃预变性3 min;94℃变性40 s,52℃退火40 s,72℃延伸45 s,35个循环;72℃延终伸5 min。
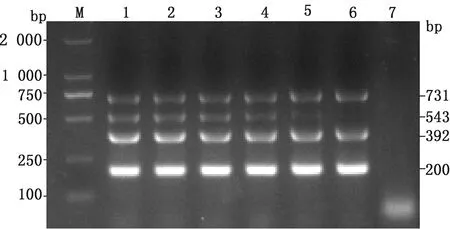
M.DL2000 DNA Marker;1~6.50,52,54,56,58,60℃;7.阴性对照
2.3 多重PCR特异性试验分别以GoAstV、DTMUV、GPV、GoCV、DHAV-1、DHAV-3、NDV、NDRV、DEV、DAdV-3、H5N6亚型、H9N2亚型禽流感病毒的阳性核酸及GoAstV、DTMUV、GPV、GoCV阳性核酸混合物为模板,对所建立的多重PCR检测方法进行特异性试验。结果显示,GoAstV、DTMUV、GPV、GoCV混合模板可扩增出4条清晰的目的条带,GoAstV、DTMUV、GPV、GoCV阳性核酸均扩增出与预期大小一致的单一条带,其他病毒阳性核算均未扩增出任何条带(图4)。
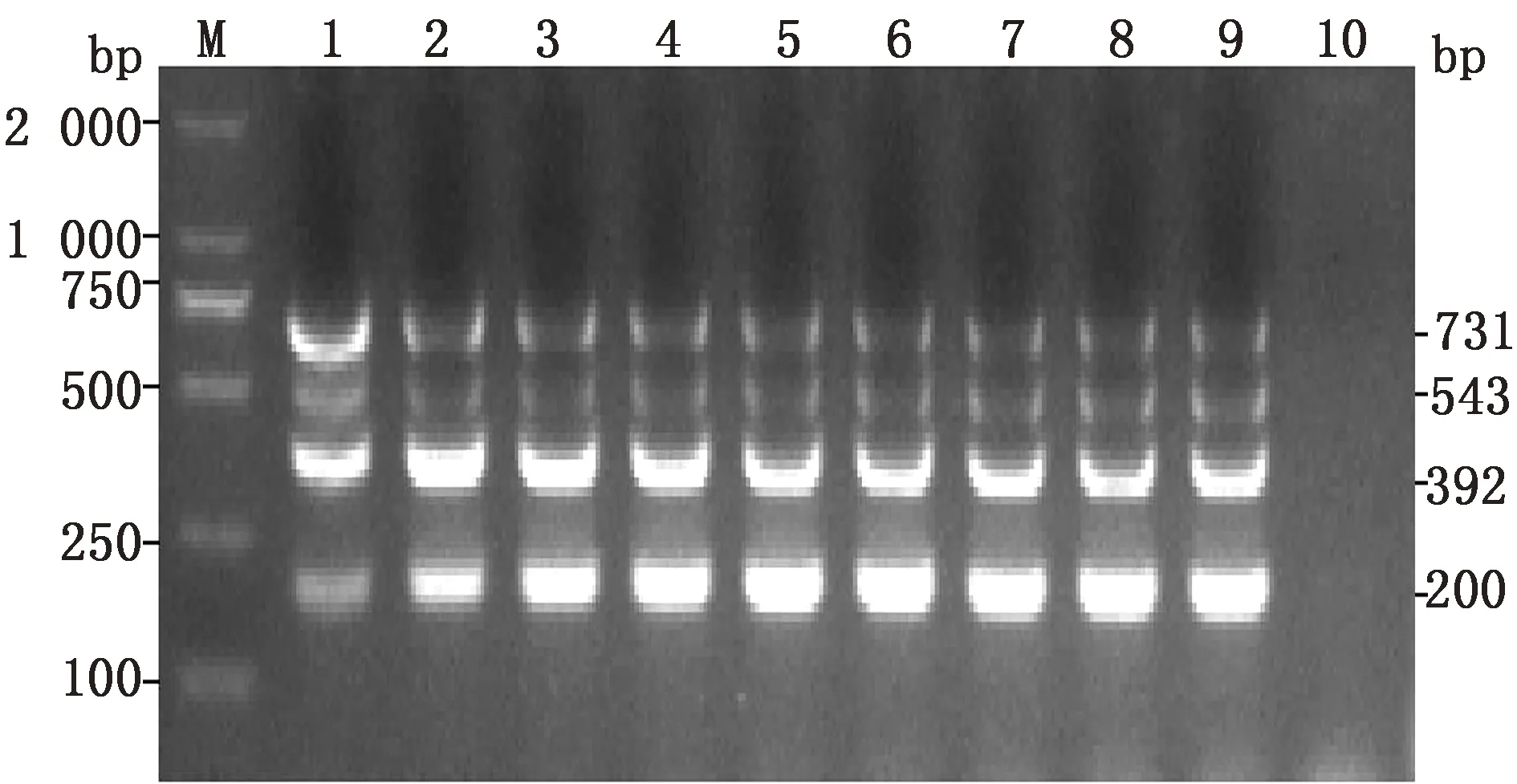
M.DL2000 DNA Marker;1~9:0.05,0.10,0.15,0.20,0.25,0.30,0.35,0.40,0.45 μmol/L;10.阴性对照
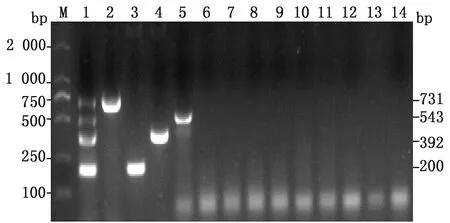
M.DL2000 DNA Marker;1.GoAstV、DTMUV、GPV、GoCV阳性核酸混合模板;2~13.GoAstV、DTMUV、GPV、GoCV、DHAV-1、DHAV-3、NDV、NDRV、DEV、DAdV-3、H5N6、H9N2阳性核酸;14.阴性对照
2.4 多重PCR灵敏性试验以pMD18T-GoAstV、pMD18T-GoCV、pMD18T-GPV、pMD18T-DTMUV为模板,验证该多重PCR检测方法的敏感性。4种质粒初始浓度为4.00×108,4.22×108,4.43×108,4.73×108copies/μL,结果显示,GoAstV最低检出限度为4.00×103copies/μL,GoCV最低检出限度为4.22×103copies/μL,GPV最低检出限度为4.43×103copies/μL,DTMUV最低检出限度为4.73×103copies/μL(图5)。
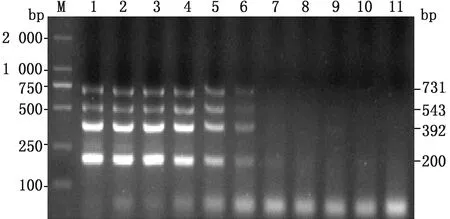
M.DL2000 DNA Marker;1.未稀释;2~10.101~109倍稀释;11.阴性对照
2.5 临床样品的检测利用本试验建立的多重PCR检测方法对收集的40份组织样品进行检测。结果显示,40份临床样本中检出GoAstV阳性18份,GoCV阳性2份,GPV阳性16份,DTMUV阳性9份,且存在上述病毒的双重或三重感染(表2)。以单一PCR检测方法对所有样品进行检测,结果与多重PCR检测结果一致,两者符合率为100%。

表2 临床样品的检测结果 份
3 讨论
近年来,我国养鹅业的规模不断扩大、饲养模式多样,致使鹅源病毒性疾病复杂多变,故对相关病原进行准确诊断、找出致病原因,并采取具体的防控及治疗措施变得尤为重要。在临床诊断中,当多种病毒混合感染时很难做出准确的判断,常规的检测方法(如病原分离和血清学试验等)费时又费力,且单一PCR只能对特异的病毒核酸进行扩增,极大影响了相关传染病病原判断的准确性和及时性。而与单一PCR检测方法相比,多重PCR在一个反应体系中加入多种不同病原的特异性引物,可同时对多个病原进行实时共检,故多重PCR检测方法既具备了单一PCR检测的优点,又达到了降低成本、节约时间、同步诊断的目的。
GoCV的感染引起雏鹅免疫力低下,继发多重病原的混合感染。有研究显示,GoAstV感染的雏鹅脾脏出现淋巴细胞减少,特别是白髓周围淋巴细胞减少[14],说明GoAstV有可能会降低机体免疫力,故该病毒感染后也可引发多种病原的混合感染。同时,已有研究表明,GoCV与GPV、GoAstV与GPV、GoCV与DTMUV存在混合感染[1-2,5],临床中也发现了GoCV与GoAstV、GoAstV与DHAV-1的混合感染。因此,快速、准确且能够同时检测出多种病原的混合感染对于临床检测及相关疾病的流行病学调查具有重要的意义。研究表明,雏鹅对GPV、DTMUV、GoCV和GoAstV均易感,加之雏鹅的免疫器官尚未发育成熟,且这4种病毒均可垂直传播,使得这4种病毒感染引发的疾病给养鹅业的健康发展造成了巨大威胁。虽针对GPV、DTMUV、GoCV和GoAstV均已有单一的PCR检测方法,但实现这4种常见病毒共检的多重PCR检测方法尚未有研究报道。
本研究建立的多重PCR检测方法,分别根据GPV、DTMUV、GoCV和GoAstV 4种病毒的VP3、NS5、Rep及ORF2蛋白基因序列设计4对特异性的引物,通过优化扩增的反应条件,使其灵敏性达到最高。结果显示,本研究建立的多重PCR方法针对GoAstV、GoCV、GPV、DTMUV的阳性重组质粒标准品最低检出限度分别为4.00×103,4.22×103,4.43×103,4.73×103copies/μL,且对DHAV-1、DHAV-3、NDV、NDRV、DEV、DAdV-3、H5N6亚型、H9N2亚型禽流感毒阳性核酸进行扩增,均无目的片段,表明建立的多重PCR检测方法特异性良好。利用本研究建立的多重PCR检测方法对收集的40份临床样品进行检测,检测结果与单一病毒的PCR方法的检测结果相吻合。综上所述,本研究建立的GPV、DTMUV、GoCV和GoAstV多重PCR检测方法具有快速、灵敏、特异和同时检测4种病原的诸多优点,且具有良好的应用性,可用于现地临床样品的检测及相关病毒病的流行病学调查。

