同步辐射X射线成像技术在脑成像研究中的应用
汤乔伟,蔡小青,李 江,诸 颖,王丽华,田 阳,樊春海,胡 钧
(1.中国科学院上海应用物理研究所,中国科学院微观界面物理与探测重点实验室,上海 201800;2.中国科学院上海高等研究院,基础交叉研究中心,上海同步辐射光源,张江实验室,上海 201210;3.上海交通大学化学化工学院,上海 200025;4.华东师范大学化学与分子工程学院,上海 200241;5.中国科学院大学,北京 100049)
大脑是中枢神经系统的主要组成部分,思考、运动等心理或生理运动都离不开大脑,其重要性不言而喻.人脑神经联接功能异常会导致帕金森症、癫痫、精神分裂症等神经系统疾病和精神疾病[1~5],人脑联接图谱是这一系列问题的重要突破点.联接组学主要是通过分析神经元之间的联接和组织方式来达到分析大脑的运行机制这一终极目的的一门学科,描绘出完整的人脑联接图谱不仅可以帮助理解特定反应和行为回路的构成,也可以帮助理解这些回路是如何整合来产生一个具有一致性和优先级的适应性输出[6].
人脑联接图谱的绘制离不开成像方法的支持,目前,应用于脑成像领域的三维成像方法主要是核磁共振成像(Magnetic resonance imaging,MRI)、光学成像和电子显微镜成像(Electron microscopy,EM),通过这些成像方法已获得了神经元和神经回路不同尺度的图像数据.在突触分辨率下,研究者们已通过EM获得了线虫、果蝇及小鼠等全脑或部分脑联接组图谱[7~9],但黑腹果蝇的大脑体量只有约0.08 mm3,成像时间长约16个月,依次推算若要成像1 mm3需要花费16.7年,假设对人全脑成像则需花费2.5×107年,因此以现有的EM成像技术,完成人脑联接图谱几乎是不可能完成的任务.作为科学研究新的大型光源,同步辐射光源在各研究领域均取得了重大的成果突破,其中同步辐射X射线成像技术,相较于实验室X射线源具有高准直性、高亮度等优势,无论是对神经元结构成像,还是对大脑中蛋白质及元素探测都具有高灵敏度[10,11].基于同步辐射的微米X射线断层扫描(Micro-computed tomography,Micro-CT)和X射线纳米全息层析成像(X-ray nano holotomagraphy,XNH)等技术,具有高穿透性(可对毫米厚度的脑组织块进行成像)和成像速度快(可在1 min内成像1 mm3的组织块)的特点[12].同步辐射X射线成像技术可能会是脑科学尤其是大尺寸脑组织联接图谱绘制的一大利器.本综述先介绍了核磁共振波谱、光学显微镜和电子显微镜等成像方法在脑成像及联接图谱中的应用,再对同步辐射X射线成像的基本情况及其在脑成像领域的应用进行综合评述,探讨了同步辐射X射线成像技术在人脑联接图谱绘制的应用前景及现有技术的局限,指出了进一步研究的重点发展方向.
1 脑科学研究的主要成像方法
神经元作为神经系统结构与功能的基本组成单位,神经元成像对神经科学的研究至关重要.脑联接图谱研究大致分为3个层次[13]:宏观联接图谱(Macroscopic connectome),其分辨率在毫米级以上,研究不同脑灰质区域之间的联接,主要成像工具是核磁共振波谱;介观联接图谱(Mesoscopic connectome),其分辨率在微米级至亚微米级,研究不同类型神经元之间的联接,主要成像工具是光学显微镜;微观联接图谱(Microscopic connectome),其分辨率在纳米级,在突触水平上对神经元之间的联接进行研究,主要成像工具是电子显微镜.成像速度和成像体量会直接影响获取全脑神经联接图谱的时间[14],图1[15]对生物成像技术的空间和时间分辨率进行了比较.核磁共振成像、光学显微镜和电子显微镜在成像速度、成像体量及分辨率上各有优势,下面着重介绍它们在脑成像领域及联接图谱中的应用.
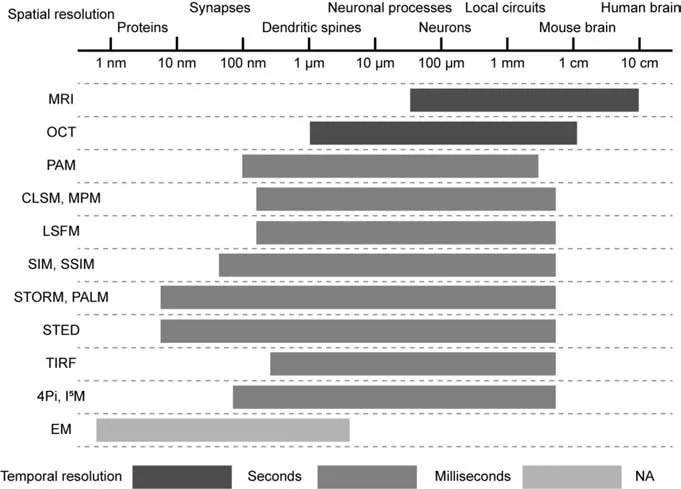
Fig.1 Comparison of the spatial and temporal resolutions of biological imaging techniques[15]
1.1 核磁共振成像
核磁共振成像是一种断层成像技术,MRI的成像信号来源于样品本身,无需注射放射性同位素,这使得MRI具有高安全性,可广泛用于医学成像.在神经系统病变、心血管系统病变、软组织病变等方面MRI具有良好的成像效果,临床上已应用于脑肿瘤、脑梗塞等疾病的检查.研究者通过MRI可对不同脑灰质区域之间的宏观联接进行研究,也可对大脑模型进行探索.
MRI对铁含量具有高敏感性,Brammerloh等[16]通过核磁共振弛豫法测定了黑质多巴胺能神经元中的铁含量,并由此测量出黑质黑体的神经元密度,为早期检测帕金森综合症中多巴胺能神经元缺失的生物标志物的开发提供了研究方向.铁信号的变化不仅会影响帕金森综合症的发病,在非典型帕金森综合症中也有铁信号的变化,主要体现在进行性核上性麻痹(PSP)和多发性系统萎缩(MSA)上[17].MRI可无创可视化大脑结构,但缺少细胞特异性和功能信息.Aswendt等[18]开发了一种新型顺磁造影剂,响应仅由抑制性γ-氨基丁酸(GABA)能神经元表达的谷氨酸脱羧酶活性,从而可选择性检测GABA能神经元.
MRI安全性高,适用于活体成像,并由于其较快的成像速度,可用于获取和分析不同人群的大脑差异.Basaia等[19]对肌萎缩性侧索硬化症(ALS)、原发性侧索硬化症(PLS)、进行性肌肉萎缩(PMA)和健康对照在内的173例人群进行了脑部MRI扫描评估.结合图形分析和联接组学,他们评估了全局拓扑网络特性、区域结构和功能性脑联接,发现了在ALS患者和PLS患者中结构连通性降低,这种结构联接改变可能与运动障碍相关.MRI可用于大脑模型预测的数据获取,Agosta等[20]通过对200名运动神经元疾病(MND)患者进行神经系统检查、认知评估以及脑部MRI信号的检测,建立了Royston-Parmar这一运动神经元疾病的生存预测模型.如果将神经元视为节点,神经元之间的轴突视为边缘,在大脑网络中会出现高边缘数及密集互联的节点,这些节点被称为富人俱乐部(Rich club),Bertolero等[21]通过分析线虫结构和功能网络、猕猴结构网络和人脑功能网络,提出了边缘在不同网络分布不同的多样性俱乐部(Diverse club),发现了Diverse club对于综合网络整合的重要性,其中人脑数据的获取通过fMRI(functional MRI)实现.
MRI的分辨率通常在毫米级,分辨率的限制使得MRI更适用于宏观尺度下不同脑区之间联接图谱的绘制.2013年,加拿大和德国的研究人员[22]将人脑切成7400片,将切片染色并进行核磁共振成像和数字化处理,最终生成高清模型呈现出大脑的皮层、脑灰质和白质等大体结构[图2(A)和(B)].2022年剑桥大学的Bethlehem和宾夕法尼亚大学的Seidlitz等[23]对不同年龄人群的MRI数据进行统计分析,绘制了首个涵盖各年龄段(从受孕后115 d到100岁)的人脑图谱,通过基于位置、尺度、形状的广义加法(Generalized additive model for location scale and shape,GAMLSS)模型等方法,对大脑中的特征变化与年龄相结合,发现了脑生长发育的多个关键时期,并发现了阿尔兹海默症(Alzheimer’s disease,AD)等疾病患者脑区结构与正常人群的差异.这些研究成果证实了脑联接图谱对于脑疾病治疗诊断的重要意义.

Fig.2 Three-dimensional reconstruction of neurons
1.2 光学成像方法
当代神经科学的开端与发展离不开光学成像方法,Golgi和Cajal在一个多世纪前通过光学显微镜观察到染色的神经细胞,展现了神经元的结构图像.随着光学成像设备和染色标记技术的发展,光学成像方法依旧是脑成像领域不可或缺的方法.光学成像方法具有较广的记录范围和较高的时空分辨率,并可结合多种特异性染色标记技术,实现结构与功能成像.由于阿贝极限的限制,光学成像方法的分辨率主要在亚微米尺度.光片照明荧光显微镜(Light-sheet fluorescence microscopy,LSFM)、双光子显微镜(Two-photon microscopy,TPM)以及显微光学切片断层扫描成像系统(Micro-optical sectioning tomography,MOST)广泛应用于神经元成像.
1.2.1 光片照明荧光显微镜 LSFM的成像原理与点扫描技术(如共聚焦显微镜和TPM)不同,LSFM只激发一定厚度的组织块,形成光学切片并对该切片成像,LSFM避免了长时间的荧光激发带来的光漂白现象,并拥有比点扫描成像技术更好的体积成像能力[24].Doerr等[25]通过基于狂犬病毒(Rabies Virus,RV)的逆行追踪结合LSFM,可视化移植细胞和连接的宿主神经元,通过与MRI参考数据集的共配准,实现了宿主输入神经元的精确解剖分配.在细胞分辨率条件下,Tomer等[26]通过将景深扩展与光学切片相结合,搭建了球面像差辅助扩展景深(SPherical-aberration-assisted extended depth-of-field,SPED)光片显微镜,提升了其成像速度和体积视场,通过对透明化的小鼠大脑成像和对斑马鱼大脑进行Ca2+成像,展现了SPED光片显微镜的高速细胞分辨率体积图谱的获取能力.
高成像深度可避免频繁的组织切片及机械应力对组织带来的损伤,但由于光散射,活体动物的非侵入性深部组织的三维光学成像具有挑战性.Wang等[27]开发了一种近红外Ⅱ区的光片显微成像技术,在不进行侵入性手术的前提下可将成像深度提升至750μm.在该技术基础上,该课题组对完整的小鼠头部进行三维成像,并监测到创伤性脑组织损伤部位的巨噬细胞和小胶质细胞的募集情况.成像通量会影响到获取三维成像数据的速度.Fang等[28]将大视场贝塞尔光片显微技术与三维压缩感知算法相结合,对脑组织进行三维高通量各向同性成像.该技术可对经过快速透明化的脑组织进行1~5μm厚度的光学层析激发,并在10 min内获取了小鼠大脑的三维数据集.
对脑组织进行LSFM成像通常需要透明化技术的支持,德国组织医学和再生研究所的Zhao等[29]通过开发由小胶束介导的人体器官高效清除与标记(Small-micelle-mediated human organ efficient clearing and labeling,SHANEL)方法对完整人体器官进行透明,实现厘米尺度人体器官的三维(3D)组织学研究.该工作首次透明了完整人全脑,并通过改良的LSFM获取了直径约3 cm的完整清晰的人眼镶嵌图像,三维重建了巩膜、虹膜和悬韧带等解剖结构的细节,为完整人脑3D组织学研究提供了基础.光片显微镜结合组织透明技术、神经元标记技术可在脑组织三维成像中扮演重要的角色.
1.2.2 双光子显微镜 TPM是一种用于非侵入式或低侵入式的活体生物样品成像的荧光显微镜,可提供生物样品的结构和功能信息.由于非侵入性的成像方式、较小的光毒性、较深的成像深度和良好的空间分辨率等优点,双光子显微镜成为了生物活体脑成像中不可或缺的工具.传统TPM的活体成像深度在500μm左右,Wang等[30]报道了一种通过近红外Ⅱ区激光激发具有近红外Ⅰ区荧光发射的共轭聚合物聚四{[(4,4,9,9-四(4-辛氧基苯基)-4,9-二氢-s-苯并二茚并[1,2-b:5,6-b′]二噻吩)]-替代-合-[4,7-二(2-噻吩基)-2,1,3-苯并噻二唑]}(PIDTDBT),以此实现具有更高活体成像深度的TPM成像方法.结果表明,通过1200 nm的激发光可获得最大成像深度1010μm的小鼠大脑血管三维结构图.在亚细胞分辨率上,Chen等[31]改良了TPM的成像系统,通过对自适应光学(AO)TPM系统的优化和波前传感算法的改进,将小鼠脑活体成像深度扩展到了脑下700μm,实现了对第5层锥体神经元的亚细胞分辨率经颅成像.在该课题组之前的工作中,通过植入自聚焦(GRIN)透镜结合AO技术实现了对小鼠海马CA1(Cornu ammonis)区神经元的结构成像,并可分辨树突棘等精细结构[32],为高分辨在体光学深脑成像提供了新成像方法.
为了扩大TPM的成像视野,Zong等[33]开发了快速高分辨微型双光子显微镜(Fast high-resolution,miniaturized two-photon microscope,FHIRM-TPM 2.0),可用于大视场、多平面和长期脑成像.FHIRMTPM 2.0相较于上一代系统,成像视场扩大了7.8倍,可在420μm×420μm×180μm的体积上实现轴向分辨率1μm的多平面成像,并将微型物镜的工作距离提升到1 mm.对自由运动小鼠头部的长时间成像具有较大挑战,FHIRM-TPM 2.0稳定性高,可在数周时间范围内检测同一脑区的神经元活动,对长时间内行为与神经元活动之间的研究提供成像方法.
长距离投射神经元的形态重建对研究大脑信息交流具有重要意义,TPM较高的成像深度和高分辨率,使得TPM可用于全脑范围内的投射神经元成像.2019年,美国霍华德休斯医学研究所珍妮亚研究中心的Winnubst等[34]通过腺相关病毒(Adeno-associated virus,AAV)标记了小鼠大脑中的少数投射神经元,通过改良的连续双光子断层扫描成像系统以亚微米分辨率对小鼠全脑进行成像,重建了运动皮层、丘脑等脑区的1000多个投射神经元,建立了当时最大的亚微米分辨投射神经元数据集.该研究对脑联接图谱的构建具有重要意义.
1.2.3 显微光学切片断层扫描成像系统 MOST是近些年发展的新成像技术,Li等[35]于2010年首次发表了这一工作.MOST采用延时积分电荷耦合器件(Charge coupled device,CCD),切片与成像同时进行,在缩短数据获取时间的同时降低了图像配准的难度.该课题组通过MOST两百多小时的不间断扫描,获得了小鼠全脑的冠状切面图像[图2(C)~(F)],体素尺寸0.33μm×0.33μm×1μm.在该课题组后续的工作中,将荧光光路引入MOST中搭建出了fMOST(fluorescence MOST)对神经元荧光成像[36]以及HD-fMOST(High-Definition fMOST)以提高样品成像中的信噪比[37].针对MOST数据集的分析,该课题组开发了NeuroGPS和NeuroGPS-Tree软件可对胞体进行定位和对密集染色的神经元进行自动分割[38,39].改良的FNT(Fast neurit tracer)软件可对MOST数据集进行三维追踪与分析,提升了MOST数据集的分析速度[40].
通过MOST可在数天内获取小鼠全脑数据集.Zhang等[41]通过MOST获取了AD转基因小鼠的全脑亚微米分辨血管图谱,通过对AD模型小鼠和野生型小鼠海马中血管直径及分支角度的测量分析,发现AD模型小鼠海马中的血管损伤,尤其体现在海马齿状回.Wang等[42]报道了一种化学层析结合fMOST的成像技术,成像前只激发亚微米厚度的顶层脑组织以降低背景干扰,从而实现了亚细胞分辨率下的全脑高通量多色成像.Sun等[43]通过AAV病毒示踪结合fMOST对AD模型小鼠全脑成像,解析了内侧前额叶皮层脑外投射神经元形态及输入/输出联接,揭示了小鼠物体识别记忆缺陷中内侧前额叶皮层环路机制.MOST不仅适用于小鼠全脑成像,对灵长类动物猕猴同样适用.Zhou等[44]通过病毒标记结合fMOST对猕猴全脑进行亚细胞分辨率成像,体素尺寸0.65μm×0.65μm×3μm,实现了猕猴脑的三维自动数据采集.在此基础上该课题组发现猕猴脑中前额叶皮层的神经元可同时靶向视觉皮层、纹状体、丘脑和中脑多个脑区.
MOST为投射神经元重建和神经元分型提供了成像手段.2021年,Peng等[45]通过稀疏标记和fMOST重建了小鼠大脑丘脑、纹状体等脑区中的1741个神经元,结合不同形状特征和基因表达特征确定了11种投射神经元类型.同年,Muñoz-Castañeda等[46]通过遗传和病毒标记结合fMOST构建了小鼠初级运动皮层,上肢区域(MOp-ul)的3D结构图谱,并由此确定了24种投射神经元类型.2022年,Gao等[40]率先构建了小鼠前额叶皮层6357个单神经元的全脑投射图谱,建立了最大的小鼠全脑介观神经联接图谱数据库,并确定了64种投射神经元亚型.该工作发现了前额叶皮层内部的3个功能相关模块和其内部联接以及神经元转录组亚型与投射组亚型的对应关系,并提出前额叶皮层可能的工作模型.MOST的快速成像速度和高分辨率使其广泛地应用于全脑成像及图谱构建.
由于高分辨率和荧光成像,通过光学成像方法可获得高衬度的神经元结构图像,此外光学成像方法也是活体高分辨成像的重要技术手段.近些年发展的连续扫描成像方法使得光学成像方法在全脑数据获取中具有独特的优势,为介观联接图谱构建提供了技术手段.
1.3 电子显微镜
高分辨率EM是目前唯一可全面解析单个突触联接的神经元成像方法,可提供纳米分辨率识别突触结构[47].由于EM的成像原理,利用EM成像需要对脑组织进行超薄切片,这使得通过EM获取模式动物的全脑数据集成为巨大挑战.1986年White等[48]通过EM成像完成了线虫的第一张大脑全连线图,尽管线虫仅拥有302个神经元,但这项工作通过手绘神经元耗费15年才完成.
近些年发展的连续切片电子显微镜(serial-section electron microscopy,ssEM)提升了模式动物大脑数据集的获取速度.Bock等[8,49]通过ssEM分别对小鼠皮质区的部分神经元和成年黑腹果蝇完整大脑做了三维重建[图2(G)和(H)];Hildebrand等[50]通过ssEM对斑马鱼幼虫的全脑进行了三维重建分析;Cook等[6]通过ssEM重建了秀丽隐杆线虫的全脑神经联接图谱.2021年Allen大脑研究所[51]公布了小鼠视觉新皮层中20万个脑细胞的精细结构和联接的数据集,这些研究成果证明EM在获取模式动物大脑纳米分辨率数据集方面强大的能力.2021年哈佛和谷歌的研究团队[52]以4 nm分辨率对人类大脑皮层进行了约5000片30 nm厚度切片的连续扫描,绘制出了“百万分之一”人脑神经3D联接图谱.从数据集中该研究团队发现了不同的神经元结构,如轴突卷曲且互相盘旋的神经元以及拥有两个轴突的神经元,这说明获取3D联接图谱对解析人脑结构具有重要意义.
EM数据集的数据量庞大,以上述人脑数据集为例,针头大小组织块的数据量达到了1.4 PB.并且由于形状的不规则性,从EM数据集中识别提取特征结构具有挑战.虽然发展了EM数据集的神经元自动分割方法以加快神经元追踪的速度[53],但突触结构的重建仍然靠人工操作,这增加了通过EM获取纳米分辨率图谱的时间.Buhmann等[47]通过卷积神经网络方法开发了CIRCUITMAP,成功实现对果蝇全脑EM数据集中突触联接的自动识别,特别是果蝇大脑中典型的一对多突触结构.该工作对EM数据集的自动处理提供了新方法,突破了此前绘制果蝇大脑联接组的瓶颈.EM在纳米分辨率联接组图谱的绘制中起到不可或缺的作用,是探索模式动物乃至人脑全联接图谱的重要成像手段.
2 同步辐射X射线成像的基本情况
接近光速(v≈c)的带电粒子在电磁场中沿曲线轨道运动时,会在带电粒子运动的切线方向发出电磁辐射,由于它最初在同步加速器上发现,故称之为“同步辐射”.同步辐射光源发展至今已有四代装置问世[图3(A)][54]:第一代同步辐射光源依托于高能物理研究的加速器;第二代同步辐射光源是专门为同步辐射应用而设计的光源;第三代同步辐射光源相对于第二代光源亮度提高了100倍,这使得依托同步辐射光源进行时间分辨和空间分辨的研究成为可能;第四代同步辐射光源为自由电子激光器,目前中国也已在多地兴建第四代同步辐射光源.同步辐射光的波长覆盖了从远红外到X射线波段的连续光谱,并且其高亮度、高准直性、高偏振等性质是传统光源无法比拟的.此外,同步辐射光源的洁净、能量可调性和窄脉冲等,也是其作为科学研究一大利器的主要原因.同步辐射光源诞生至今,已在物理学、化学、生命科学、材料科学和地质学等领域发挥出了重大的作用[55~57].

Fig.3 Different imaging methods based on synchrotron radiation
2.1 同步辐射成像方法
同步辐射光源由于其较长的波段,衍生出了一系列的扫描分析方法,如同步辐射红外光谱、磁圆二色谱、同步辐射X射线成像相关技术等[图3(B)][54].同步辐射X射线具有丰富的辐射-物质相互作用,包括吸收、衍射、散射、荧光等相互作用.基于这些相互作用,开发了一系列的实验方法:X射线吸收成像(X-ray absorption imaging)[图3(C)][58]、X射线衍射(X-ray diffraction,XRD)、广角X射线散射(Wide angle X-ray scattering,WAXS)、小角X射线散射(Small angle X-ray scattering,SAXS)、X射线相衬成像(X-ray phase-contrast imaging,X-PCI)和X射线荧光(X-ray fluorescence,XRF)等成像方法.X射线吸收成像、X射线相衬成像(X-PCI)和X射线荧光成像等方法,由于其独特的性质,在脑科学研究中发挥着重要作用.
随着成像技术的发展,基于傅里叶光学的X射线衍射成像技术形成了X射线衍射成像(X-ray diffraction imaging,XDI)和相干X射线衍射成像(Coherent X-ray diffraction imaging,CXDI/CDI)等技术X射线衍射成像原理是X射线照射物体时,碰撞物体内的原子或离子发生散射,增强了X射线某些方向上的相位,从而用于解析物质结构[59].CDI由Sayre首次提出[60],与XDI不同的是相干X射线直接照射样品,通过探测器接受样品的远场衍射图像,最后使用重构算法计算样品的吸收和相位信息,从而获得样品的结构信息.由于其不依赖成像的光学器件,CDI有望突破更高的分辨率.在第四代同步辐射的基础上,CDI可以实现时间分辨成像[61,62].
鬼成像(Ghost imaging,GI)又被称作量子关联成像,也被称作单像素相机成像.GI是一种间接成像方式,通过预先测定照射在物体上的光场分布以及透过物体的总光强之间的关联来复原物体的图像.由于其与传统成像方式的不同,GI对探测器的要求低,降低了散粒噪声对于测量的影响,并可实现超低辐射的X射线鬼成像(X-ray ghost imaging,XGI).但由于X射线波长短,衍射线的强度及分布受扰动影响较大,故在同步辐射光源上,XGI有更大的发挥空间[63].
2.2 同步辐射在脑科学功能研究中的应用
发展神经科学的基础是对神经系统进行一个系统且详细的描述,现如今有许多新方法以越来越高的分辨率用于测绘神经组织,这些高分辨且大通量的数据测量将有可能彻底改变大脑的发育研究[64].由于同步辐射光源的高亮度等性质,基于同步辐射的各种成像方法具有高分辨率、高穿透深度、高探测灵敏度等优势,可用于脑科学研究.
模式动物和人类大脑中的金属元素和蛋白质等物质会影响大脑的结构与功能,基于同步辐射的X射线成像方法可用于测量这些物质.脑组织样品在经过X射线照射后,内层电子发生电离产生空缺,外层电子发生跃迁从而发出次级荧光X射线,产生的能量与元素种类相关,从而可以用于探测元素.XRF可用于探测神经元内部元素和化学分析,对阐明大脑相关机制具有重要作用.Bissardon等[65]提出了一种基于同步辐射的XRF成像方法,结合X射线荧光纳米成像探针可以提供亚细胞水平上离子分布所需要的灵敏度和空间分辨率,阐明细胞器水平上整个细胞内金属的二维及三维分布和浓度.Domart等[66]将受激发射损耗显微镜(Stimulated emission-depletion microscopy,STED)和XRF结合起来,以40 nm的空间分辨率成像大鼠海马神经元中的铜、锌和蛋白质,揭示了锌和微管蛋白在树突中的纳米级共定位以及铜和F-肌动蛋白的共分离.由于锌、铜参与神经元的分化和突触的可塑性,这一机制将有望为记忆形成提供实际证据.
由于组织散射和吸收的影响,荧光成像中的成像深度受限,对脑组织进行透明化可一定程度上提升成像深度.同步辐射XRF相比于传统荧光成像手段,拥有更高的穿透深度和能量分辨率.Yan等[67]使用EB和免疫球蛋白G(lgG)设计了一种双峰探针,对黑质致密区(SNc)和腹侧被盖区(VTA)的多巴胺能神经元进行成像,实现了通过同步辐射XRF识别特定的神经元.Surowka等[68]将同步辐射X-PCI和XRF联用,在观测到黑质(SN)神经元的前提下,对神经元内部的元素与神经元结构共定位成像,在化学成分和结构组织之间建立起了分析方法.
软X射线由于其独特的被吸收性质,在测量生物样品的软X射线范围(约0.1~1 keV)时,无需染色剂或者造影剂标记.2018年,Everett等[69]通过同步辐射X射线扫描透射显微镜(Scanning transmission X-ray microscopy,STXM)对无标记脱水人脑组织进行了40 nm分辨率成像,可清晰分辨神经元细胞结构.2020年,Brooks等[70]通过光学显微镜成像帕金森患者脑组织切片定位多巴胺能神经元后,结合STXM对人脑神经黑素进行无标记纳米成像.在后续的工作中,该课题组对帕金森患者的人脑组织切片进行成像,展示了帕金森氏病患者含神经黑素神经元铁沉积物特征,该研究可能为治疗帕金森氏病提供帮助[71].
基于同步辐射的成像方法由于其高分辨率和高灵敏度适用于脑科学功能的研究.同步辐射XRF对于金属元素具有较高的灵敏度,为了解帕金森等疾病的发病机理研究提供了技术手段[72].同步辐射X射线技术还可对在体大鼠脑血管进行成像,进一步研究脑血管的结构和功能改变[73].如果将病毒包装的质粒小鼠特定脑区进行表达后,利用不同金属染料对不同脑区神经元进行特异性标记,有望利用同步辐射X射线成像技术对功能性神经环路成像.近些年发展的冷冻软X射线断层扫描(Cryo-SXT)成像技术和纳米级蛋白质定位的基因编码X射线细胞成像等方法[74~78]也有望在脑科学功能研究中发挥重要的作用.
3 同步辐射在大脑结构成像中的应用
通过分析线虫、果蝇、小鼠和人类的联接组数据,研究者们取得了一系列研究成果,并在分析神经元联接的基础上实现了调控模式动物的部分行为[79].神经元全联接图谱需要纳米分辨率成像技术的支持,目前EM在获取纳米分辨率大脑数据集中占据着主导地位.虽然EM拥有纳米分辨率,但获取较大模式动物大脑的数据集仍是耗时的.神经元的主要结构(如胞体、树突、轴突及树突棘)都落在介观尺度范围内,跨脑区投射神经元结构的重建通常也需要对大脑完整成像,故介观尺度全脑成像同样重要.目前在介观尺度下无损/低损成像全脑样品仍存在挑战.
提高Z轴分辨率可获得Z方向上更多的信息,光学成像方法通常是通过降低组织切片或光学切片的厚度来提高Z轴分辨率,但成像时间会成倍增加.由于采用光学切片,LSFM的Z轴分辨率很难降低至1 mm以下.基于同步辐射X射线的成像方法(如Micro-CT,X-PCI和XNH)拥有各向同性分辨率,Z轴分辨率可达0.3μm甚至数十纳米.由于同步辐射光源的高亮度和硬X射线的高穿透性,此类成像方法成像深度高,可对立方毫米体积未经透明化处理的脑组织块三维成像.这降低了样品的预处理时间,保留了组织完整性,并避免了频繁的组织切片对脑组织带来的损伤[58].基于同步辐射的X射线成像方法的优势,使其适用于较大模式动物脑组织成像,下面着重介绍X-PCI,XNH和Micro-CT这3种应用于大脑结构成像的成像方法.
3.1 X射线相衬成像
X-PCI利用软组织样品对X射线相位信息的响应,获得良好的X射线对比度,从而实现无标记成像.无标记成像可简化样品的处理流程,缩短样品的预处理时间.Fratini等[80]通过同步辐射X-PCI,在无造影剂和切片的前提下,对小鼠脊髓血管和神经元系统进行亚微米分辨三维分布成像[图4(A)],解决了血管与神经元系统之间的纠缠关系问题.对于更大的模式动物大鼠,X-PCI同样适用,Hu等[81]对大鼠脊髓血管和神经元系统进行三维无损成像,同样无染色剂和造影剂的支持.这证明同步辐射X-PCI是一种优秀的同时成像血管和神经元系统的成像方法.

Fig.4 Imaging of model animal soft tissues by X-PCI
同步辐射X-PCI可成像脑神经元并拥有高穿透深度.Koh等[82]通过同步辐射X-PCI对帕金森患者脑组织中路易小体(Lewy body)的显微细节进行成像,结果表明,在对不经过染色处理的3 mm厚组织块进行成像时仍可清晰分辨3个残留的路易小体.Rodgers等[83,84]通过X-PCI对福尔马林固定和石蜡包埋的小鼠大脑进行了虚拟组织学研究,量化了组织固定和包埋过程中的形态变化.神经探针是神经科学研究的重要工具,但由于宿主与探针之间的相互作用,植入性的微型设备可能在时间推移下出现功能不稳定和造成组织损伤的情况.Böhm等[85]通过X-PCI对神经探针植入区域进行无标记成像,成像结果仍可区分细胞、血管及探针[图4(B)和(C)],基于此,该课题组发现了探针植入对组织带来的损伤.通过X-PCI获取的图像数据存在条状或环状伪影的情况,这会影响提取关键信息的效率和难度,Croton等[86]发展了一种在不需要对样品有先验信息的情况下有效的环状伪影校正方法,采用双材料相位检索算法增强图像对比度,基于此,对新西兰白兔的头部进行成像,降低了伪影对数据处理带来的影响.
X-PCI适用于人脑的细胞分辨率研究.Bikis等[87]通过传统基于同步辐射的X射线断层扫描和基于同步辐射的X射线双光栅干涉测量法对石蜡包埋的人脑组织进行成像,对对比度噪声比(CNR)等指标进行了定量比较,并讨论了石蜡包埋下相位衬度和吸收衬度的相对优点.Töpperwien等[88]通过优化光学结构的X-PCI对石蜡包埋的无标记人小脑进行3D成像,结合Hough变换和区域生长算法,成功识别了分子层和颗粒层细胞并从中提取出浦肯野细胞[图4(D)],并在此基础上计算出分子层和颗粒层细胞的密度.结果表明,颗粒层的细胞具有很强的短程有序性和局部聚集性,通过对神经元“Packing”量化,解释了人类小脑如何在10%的体积下容纳人脑总神经元的80%.
同步辐射X-PCI适用于胞体和浦肯野细胞等的三维成像以及脑中的胞体分布研究.通过X-PCI成像无需对样品染色,最大化保留了组织的完整性,避免了频繁的组织切片对样品带来的损伤.
3.2 X射线纳米全息层析成像
XNH是一种同步辐射高分辨X射线成像技术,它结合了全息和层析重建,原理类似X射线断层扫描,但XNH技术根据样品引起光束细微相移的变化来获取图像[89,90].XNH以其高分辨率、高穿透深度和快成像速度弥补了光镜和电镜之间的空白,是大尺寸脑组织高分辨成像的重要技术手段[91].
XNH能获得神经元亚细胞分辨率结构信息.Khimchenko等[92]通过XNH对人小脑和皮层样品进行无标记成像,并与苏木精和伊红染色的组织切片进行比较[图5(A)和(B)].结果显示,XNH可在更高分辨率下获得亚细胞结构(如核膜和核孔)的信息,且XNH具有更好的在单细胞核仁水平上快速层析成像的能力[图5(C)].XNH具有高穿透深度和高各向同性分辨率.通过对立方毫米体积的人脑样品成像,各向同性体素分辨率25 nm,空间分辨率88 nm,可清晰观察到浦肯野细胞和锥体细胞等的亚细胞结构.该课题组还通过对福尔马林固定和石蜡包埋的人脑组织进行XNH成像,各向同性体素分辨率为50 nm,并通过发展半自动分割方法,成功将浦肯野细胞的亚核结构等分割出来[93].

Fig.5 Imaging of model animal soft tissues by XNH[92]
大脑中存在跨脑区投射的神经元,保留组织的完整性和快速成像有利于对投射神经元等的追踪.XNH成像速度快,可在12 h以50 nm的各向同性分辨率成像果蝇整脑[92],且XNH具有较大的视场/分辨率比,适用于追踪较长神经元.2020年哈佛大学的Kuan等[94]通过多次XNH扫描,结合Mosaic成像策略追踪了果蝇肌肉到中枢神经系统的单根运动轴突.通过训练卷积神经网络,从数据中快速分割出神经元,果蝇和小鼠神经元以87 nm的空间分辨率被密集重建,通过和EM的联用数百个皮质区锥体细胞在纳米分辨率上被重建出来.
综上所述,XNH以其高分辨率、无须标记和快速成像能力在脑组织精细成像中起到了重要作用.
3.3 微米X射线断层扫描
Micro-CT基于硬X射线吸收成像.近几十年来X射线吸收成像在原子尺度下广泛应用于研究非均相催化剂结构和组成、揭示活性位点的性质、建立催化剂结构基序、局部电子结构和催化性质之间联系[95,96].由于硬X射线不能被碳、氢、氧、氮这一类低原子序数元素强吸收,导致软组织产生的对比度较低,故在通过硬X射线吸收成像对生物组织成像时,通常需要染色技术或增强对比技术的支持.
锇酸染色和碘造影剂常被用于增强血管成像的对比度.Zhang等[97]在2014年对此前通过同步辐射Micro-CT对动物大脑微血管成像的研究成果进行了综述,展现了Micro-CT成像血管的能力.Seo等[98]通过锇酸和醋酸铀染色结合Micro-CT对斑马鱼进行三维成像,通过比较高胆固醇血症斑马鱼模型与正常斑马鱼的全身三维形态结构,发现高胆固醇血症斑马鱼血管周围脂肪、皮下脂肪及小肠和肝脏中的脂质积累,这将有助于了解循环血管高脂血症疾病的发病机制.Micro-CT作为一种微米及亚微米快速成像方法,可作为纳米分辨率EM和毫米分辨率MRI之间的补充.Foxley等[99]通过将MRI,Micro-CT和EM联用,对醛固定和锇酸染色的小鼠大脑5个空间分辨率的成像,这种多尺度成像有助于快速定位目标区域,以更高的分辨率对该区域精细成像.
碘造影剂相比于锇酸染色毒性更小,Metscher等[100]开发了一种以无机碘和磷钨酸为基础的染色剂,在简化处理流程的基础上拥有更高的X射线成像整体对比度和组织差异对比度.该课题组通过Micro-CT对模式动物进行三维X射线成像,成功从成像数据集中分辨出单个肌肉纤维和单个血细胞.通过碘造影剂提高组织度通常是不可逆的,Strotton等[101]开发了一种可逆碘染色技术,对石蜡包埋的直径3.5 mm大鼠脊髓进行了快速(12 min)高分辨(3.2~4.8μm)Micro-CT三维成像,通过浅层学习机器可以从Micro-CT数据集中将运动神经元等宏微观特征提取出来.
Mazzarello等[102]对Golgi发现高尔基染色法的历史进行了回顾,高尔基染色法可染色神经元的胞体、轴突、树突和树突棘结构.硬X射线会被高原子序数元素吸收,由于高尔基染色液中含有汞、铬等元素,通过高尔基染色的神经元在Micro-CT上有良好的对比度.Kim等[103]通过高尔基染色结合同步辐射Micro-CT观测到了浦肯野细胞[图6(A)]并分辨了树突的形态变化,发现小鼠皮层发育障碍模型中浦肯野细胞的三维分形维数有明显减少,树突的复杂度明显降低,该研究可能会对无脑回畸形和各种神经发育障碍的病因和进一步的潜在治疗方案提供见解.Fonseca等[104]在巴西同步辐射光源上对高尔基染色的小鼠脑海马神经元和皮层神经元等进行成像[图6(B)],并从数据集中自动提取出神经元结构[图6(C)~(E)].他们通过将基于匹罗卡品诱发的癫痫小鼠与正常小鼠对照,发现癫痫小鼠额叶和海马区胞体数量明显降低.高尔基染色的脑组织会产生部分伪影,一定程度上会影响神经元识别.Jiang等[105]优化了高尔基染色方法,降低了高尔基染色方法产生伪影的数量,提高了被染色的神经元同周围组织的对比度,基于此,结合Micro-CT对小鼠的脊髓神经元进行成像并从数据集中提取出单运动神经元.
同步辐射Micro-CT的三维成像速度是目前最快的,可达到1 mm3/min[12].2020年Chin等[106]报道了一种“AXON”(Accelerated X-ray Observation of Neurons)成像策略,可在几分钟内对果蝇大脑进行各向同性分辨率0.3μm的投影图拍摄,并在实际测试中几天内绘制了果蝇的全脑神经联接的X射线成像图谱.Micro-CT的成像深度高,可穿透2 mm厚度的高尔基染色鼠脑样品.该课题组通过硬X射线CT结合高尔基染色方法对果蝇全身[图6(F)]和小鼠全脑进行成像,并可清晰分辨神经元的轴突与树突结构.数据结果表明通过Micro-CT可在10 d内获取小鼠大脑的数据集,并从多角度分析了通过同步辐射X射线CT绘制多尺度联接图谱的可行性[58,107,108].同步辐射硬X射线同样可对高尔基染色小鼠神经元的轴突和树突棘进行高精度成像,Wu等[107]在台湾光源上实现了20 nm分辨率的轴突和树突棘成像.
通过Micro-CT对模式动物脑神经元的胞体、轴突和树突成像已取得了一系列的成果,由于Micro-CT极快的成像速度、高成像深度和神经元染色技术带来的神经元对比度提升,利用Micro-CT绘制介观尺度下大脑神经联接图谱具有很高的可行性.
Micro-CT,X-PCI和XNH相比较于光学成像方法及EM拥有以下优势:(1)X射线成像拥有各向同性分辨率,在Z轴上具有更高的分辨率,突破了LSFM等Z轴分辨率的限制.光学成像方法提高Z轴分辨率的方式通常是减少切片或光学切片的厚度,但数据获取时间大幅增加.Micro-CT的各向同性分辨率可达到0.3μm,XNH的分辨率可达到20 nm,允许在Z轴上获得更多的结构信息;(2)X射线成像样品制备相对简单,样品无需透明化处理和薄切片,XNH和X-PCI还可对无标记的脑组织进行成像.通过MOST成像后样品完整性被严重损伤,而同步辐射X射线成像方法可保留组织的完整性,在此前提下经过成像的样品可进行后续的组织学研究;(3)硬X射线的穿透深度高,可满足立方毫米体积的脑组织块成像,这降低了多组数据配准的工作量和工作难度;(4)相比于荧光成像等成像手段,X射线成像无光漂白的现象,可长时间成像,并可以反复成像;(5)Micro-CT的成像速度快,在1 min内可以成像1 mm3的组织块,可缩短数据获取的时间,是目前成像速度最快的三维成像手段.
此外,全场透射X射线显微镜(Full-field transmission X-ray microscopy,Full-field TXM)在近十年也已在多个同步辐射光源上投入适用,TXM与光学显微镜的正入射不同,TXM采用空心环形光照明,成像系统的空间分辨率和成像视场受到菲涅尔波带片的限制.2018年Ge等[109]在National Synchrotron Light Source II(NSLS-II)上通过Full-field TXM在1 min内实现了空间分辨率低于50 nm的纳米层析成像,与之前的成像手段相比速度提高了10倍以上.Holler等[110]报道了一种16 nm各向同性三维分辨率的成像方法,采用了相干衍射成像(CDI),保证分辨率的同时拥有较深的穿透深度.2021年美国阿贡国家实验室的De Andrade等[111]在TXM上实现了小于10 nm空间分辨率的快速(85 min)3D层析成像,缩小了X射线技术与EM分辨率之间的差距.TXM将成为高分辨脑成像的重要技术手段.

Fig.6 Imaging of model animal soft tissues by Micro-CT
4 绘制人脑联接图谱的需求与现有技术的局限
联接组是指神经系统中神经元联接的总和,是全联接的总和.当两个神经元之间有突触联接时,就说明这两个神经元之间是存在联接的,联接组的差异对个体差异至关重要.基因组早在受孕时就已经确定,但神经元之间的联接在后天会发生改变,无论是增强减弱还是增加减少神经元之间的联接,神经元之间的联接总是在发生改变[112].虽然2021年有关人海马区单细胞RNA测序的结果表明人成年后没有真正意义上新生神经元的产生[113,114],但神经元之间的联接在不断发生改变,从而导致联接组的改变.所以联接组可能会更好地揭示大脑的运行机制以及每个人的个体差异性.
联接组对于理解模式动物乃至人脑的行为模式及意识均具有重要意义.迫切需要联接组学研究者们解决的一个问题是,如何通过联接组来考察复杂的行为,Susoy等[115]对线虫的性行为进行了描述,并证实了对联接组的研究可以用于考察复杂的行为.由于线虫仅有302个神经元,这也是目前唯一可以编译出完整、详细联接组的模式动物,他们通过将复杂的交配行为分解成各种子行为,将神经元活动与线虫的联接组相对应,以判断线虫交配行为与神经元之间的联系.研究发现在使用的8种线虫中,大脑活动图呈现了高度一致性,并基于此可预测第9种线虫的行为.在准确摘除了线虫中与转动相关的一个神经元,线虫失去了转动的能力.这说明获取联接组图谱对于理解大脑功能以及不同模式动物乃至人类的行为是至关重要甚至是必要的.联接组并不是一成不变的,同种模式动物的联接组也会发生改变.通过比较同种模式动物的多个联接组,可以比较个体上的特征差异.Witvliet等[116]对8个基因完全相同的线虫幼虫和成年虫之间神经元联接方式的差异进行了比较,研究结果表明,尽管在基因上相同,大脑中神经元间的联接却有约40%的差异.一致的联接可能与动物基本的生存活动相关,而联接的差异性可能是个体差异的原因.所以多组联接组图谱对于联接组学的研究是必要的,可用于比较个体之间的一致性和差异性,最终将行为、疾病等与神经元结构与联接结合起来.
通过EM获取百万分之一人脑联接组数据耗费了大量的采样时间和储存空间[48],目前想通过EM获取完整人脑联接组数据几乎是不可能完成的任务.基于同步辐射的TXM和XNH可能是解决这一问题的突破点,目前TXM已经实现小于10 nm空间分辨率的快速(85 min)三维层析成像[111],同时实现了20 nm空间分辨率的高尔基染色神经元成像[107],XNH也已实现25 nm各向同性分辨率果蝇和小鼠神经元的三维成像[94],且仍未达到XNH的极限.虽然目前仍未有通过TXM和XNH对突触三维成像的报道,但如果可进一步提高成像分辨率及神经元的对比度,TXM和XNH有望应用于突触分辨率的联接组图谱构建.结合TXM和XNH较快的成像速度,其有望在人脑联接组图谱的构建中提供重要的技术支持.
获取完整人脑联接组数据的另一突破点是构建介观尺度脑联接图谱.通过EM构建联接组图谱受限于其成像速度,对大尺寸脑组织往往只能成像部分脑区,对跨脑区投射的神经元无法成像其完整结构.由于胞体、轴突、树突的尺寸在介观尺度上,构建介观尺度人脑联接图谱也是至关重要的,可通过图谱分析神经元在脑区之间的交流甚至分析复杂的人类行为.但获取人脑介观尺度脑联接图谱的工作量是惊人的,并受到多方面条件的制约.荧光显微镜技术是目前应用于介观尺度脑联接图谱研究最广泛和有效的手段,荧光成像得益于荧光标记技术的飞跃发展,但目前常用的荧光标记技术[如转基因动物、基于AAV、狂犬病毒(Rabies virus,RV)等病毒标记技术]无法用于活体人脑组织标记,这极大限制了荧光成像技术在人脑联接图谱研究上的应用.高尔基染色法可对死后的人脑组织进行固定及染色,高尔基染色对于人脑神经元成像具有更高的普适性.但对目前的MOST而言,若以分辨率0.3μm×0.3μm×0.3μm对完整人脑进行成像,需要花费数百年.
Micro-CT可能是绘制人脑介观脑联接图谱的重要技术手段.Micro-CT具有各向同性、高穿透深度、高对比度及快成像速度等一系列优势.以人脑体量(约1.2×106mm3)来计算,对完整人脑进行介观尺度成像只需要不到900 d的时间.人脑介观尺度联接图谱的绘制是一个巨大的工程,任何课题组和研究团队都无法独立完成,需要多团队的分工合作.目前国际上由中国上海光源(SSRF)、中国台湾同步辐射研究中心(NSRRC)、韩国浦项光源(Pohang Light Source)、新加坡光源中心(SSLS)、日本Spring 8光源、澳大利亚以及泰国光源等共同成立的大科学装置群的同步辐射神经科学亚太联盟(Synchrotrons for Neuroscience-an Asia-Pacific Strategic Enterprise,SYNAPSE),旨在绘制全世界首幅人全脑介观X射线联结图谱成像[99],赵振堂、胡钧和樊春海为联盟执委.该联盟是非政府组织,通过数十条相关同步辐射X射线成像线站,相互通力合作,拟在2025年前完成第一例介观尺度人全脑联接图谱X射线三维成像图谱.以目前1 mm3/min的成像速度,十条相关同步辐射X射线成像线站协作,完成人全脑介观尺度X射线成像所用时间不到90 d.基于上述种种原因,同步辐射Micro-CT或将成为人脑介观联接图谱绘制的重要手段.
要获得人脑介观联接图谱,目前仍存在一些问题需要攻克.首先,现阶段最适合Micro-CT的神经元染色方法是高尔基染色法,但传统高尔基染色方法仅有1%~5%的随机标记效率.虽然稀疏染色可让Micro-CT产生的投影图有足够的对比度和衬度,但要获取人脑联接图谱就需要获取更多数据集来提高覆盖所有神经元的置信度,这在一定程度上增大了数据获取的工作量.其次,轴突是神经元之间交流的关键,虽然高尔基染色技术在一定程度上可染色轴突,但目前仍未有对跨脑区投射神经元轴突染色的报道.提高高尔基染色神经元的完整性和效率可使高尔基染色技术更好地应用于Micro-CT.由于光路及同步辐射光稳定性的原因,通过Micro-CT获取的投影图中会出现明暗条纹以及亮度不均的情况,这一定程度上会影响图像关键信息的提取.近些年深度学习的方法广泛应用于不同科学领域,如果能从深度学习入手,对投影图的明暗条纹及背景进行精准扣除将会对关键信息有更准确的判断.最后,Micro-CT获取的是二维投影数据且组数较多,如何对多组数据实现快速切片重构以及空间上的配准是急需解决的问题.所以无论是改良现有的高尔基染色技术、开发新型的适用于Micro-CT神经元成像的染色标记技术还是发展适用于Micro-CT大数据处理技术都是至关重要的.
5 总结与展望
同步辐射X射线成像相比于其它技术手段,体现出了其独特的优势.Micro-CT成像具有高速、高穿透性、各向同性分辨率等方面的优势;XNH在具备高分辨率的同时拥有高穿透和较快的成像速度;X-PCI则可以对无标记的组织样品进行成像,缩短样品制备的时间;XRF则可以对脑组织中的相关金属元素进行定量分析等.这一系列技术展示了同步辐射光源这一大科学装置在脑成像领域扮演的重要角色.同步辐射X射线成像也在不断开发新的成像方法,如何将其应用于脑成像领域中还有待探索和考究.人脑介观尺度联接图谱的绘制是一个巨大的工程,这不可能是一个课题组可以完成的,需要多个课题组分工合作,目前国际上已经成立了基于大科学装置群的SYNAPSE.针对不同联接图谱分辨率的需求,适用的方法也不尽相同.但就人脑亚微米分辨联接图谱也就是介观联接图谱而言,同步辐射X射线成像技术是最快速且高分辨的方法,但仍有许多问题需要解决.如果仅靠单一光源线站对人脑进行X射线Micro-CT数据的获取,数据获取的时间仍旧十分庞大,这一问题的解决方法是众多大科学装置群多线站合作(如SYNAPSE)或开发更快速更大体量的成像系统.其次,如何从庞大的人脑成像数据中快速高效提取有效信息、保留结构框架、剔除无用的信号和噪音也是急需解决的问题.最后,应当改良或开发新的神经元染色标记技术,使其适用于同步辐射X射线成像方法.如果有这一系列技术的支持和突破,完成人脑联接图谱的绘制将只是时间问题,同步辐射X射线成像技术应在其中发挥不可替代的重要作用.

