载酶纳米催化体系用于疾病诊疗的研究进展
唐玉静,胡 敏,王 霞,王启刚
(同济大学化学科学与工程学院,上海 200092)
酶作为一种由活细胞产生的高效催化剂[1],在生物体的各项生命活动中起着举足轻重的作用,如光合过程[2]、呼吸作用等各种代谢过程.离体酶也具有催化活性,能够在温和的条件下降低反应的活化能,特异性催化底物进行高效转化[3],在药物合成、病灶成像、生物传感和疾病治疗等医学领域具有广泛应用[4~7].酶是一个规模十分庞大的体系,其中,氧化还原酶是数量最多的酶类,能够催化分子间的电子转移反应,与细胞的生命历程及生物体的生命活动密切相关[8],已成为酶催化科学与生物医学领域的研究热点.
尽管如此,天然酶仍存在提取复杂、价格昂贵、储存困难和易失活等固有弊端,因此发展具有类酶活性的材料是酶学研究的必然之势[9].Breslow等[10]在1970年提出了“人造酶”的概念,2007年,阎锡蕴院士团队[11]首次报道了Fe3O4纳米颗粒具有过氧化物酶活性,随后十几年间模拟酶(纳米酶)的研究呈现蓬勃发展的趋势,目前已经开发了多种金属基纳米酶及非金属基纳米酶[12~14],而对于模拟酶材料的活性、专一性的设计探索是研究的重点和难点.单个酶的原位反应往往难以完成复杂的催化行为,而细胞内的代谢过程往往是由酶级联或多酶体发挥作用[6],该过程可以避免中间体的分离纯化步骤,且推动化学平衡向产物侧转移[6,15],多酶级联体系材料的设计显得尤为重要.研究人员开发了天然酶级联和有模拟酶参与的级联体系[16~18],为生物催化应用提供了更广阔的视角.因此,仿生载酶纳米催化体系设计的关键是构建类细胞区室化结构的纳米体系,形成酶的限域微环境和底物扩散通道[19].随着纳米技术和纳米医学的崛起,酶催化纳米载体的发展为设计理想的人工催化模型开拓了道路.这种催化体系的构建可以有效清除底物的扩散屏障,保持酶的活性并提高级联酶的催化效果,特殊的尺寸也可以增强肿瘤等疾病部位的渗透保留能力,为稳定、高效的载酶纳米催化反应提供保证[20~22].
生命体中的多酶催化体系直接影响生命代谢系统,而代谢调控又和疾病息息相关.因此利用仿生构建载酶体系来实现疾病的诊疗研究是非常有潜力的[23].随着人类饮食结构和生活方式的变化,癌症和其它代谢类疾病已成为制约人口寿命增长的主要障碍,发病人群呈现年轻化的趋势[24].基于微环境专一性和高效性的酶催化反应,酶催化纳米体系有望在疾病的成像诊断和多模式治疗方面实现突破性进展.生物成像可以实现病变部位的可视化[25],酶尤其是模拟酶特殊的物理性质和生物催化特性的结合丰富了成像方式,同时可以在一定程度上诊断疾病和追踪治疗进展[26~28].疾病治疗方面,酶催化纳米体系主要通过对病变部位活性氧的调节及其它代谢产物的清除来调控细胞命运,其光磁等物理响应性赋予了疾病的多模式协同治疗的可能性[29~31].近年来酶催化纳米体系在疾病诊疗方面的研究已取得了长足的发展,若能实现从实验室到临床应用的转换,对人类的健康将有很大的促进作用,但目前该领域的研究仍存在很多挑战,催化体系的构效关系、理论研究尚存在短板,进入人体后生物循环和生物安全性仍需进一步研究,酶催化纳米体系真正实现临床应用还有很多问题需要解决.
本文总结了近年来酶催化纳米体系在疾病诊疗方面的研究进展,首先介绍了酶催化纳米体系的构建,包括单酶和级联酶体系的基本组成及酶纳米载体的发展;接下来对酶催化纳米体系在超声成像、荧光成像、光声成像和磁共振成像中的具体应用进行了归纳;随后讨论了其在肿瘤治疗和其它代谢类疾病治疗的作用途径;最后对酶纳米体系用于疾病诊疗领域的研究进行了总结和展望(Scheme 1).

Scheme 1 Enzyme-load nanocatalytic systems for bioimaging and disease treatment
1 酶催化纳米体系
1.1 单酶体系
1.1.1 天然酶 天然酶中的氧化还原酶具有调节氧化应激的能力,可以与催化特异性底物进行电子转移,在细胞内发挥着重要作用.过氧化物酶是用于生物催化聚合的酶催化剂大家族,主要以过氧化氢为底物,催化生成活性氧物种.其中,辣根过氧化物酶(HRP)作为典型的代表,在催化反应中被广泛研究.HRP是以铁卟啉Fe(Ⅲ)为活性中心的酶,反应未发生时,HRP中的Fe(III)处于未激活状态,进入催化循环中后,Fe(III)上的水配体被过氧化物末端的H2O2取代,形成化合物1.过氧化物键裂解后,形成活性Fe(Ⅳ)催化中心(化合物2),此时开始催化底物,从底物中拔两个氢产生相应的自由基启动聚合过程,如此便完成了一个催化循环[17][图1(A)].

Fig.1 Catalytic mechanisms of four typical natural enzymes
超氧化物歧化酶(SOD)作为细胞内必需的抗氧化酶,可以清除超氧阴离子,在维持细胞稳态中发挥着重要作用.Martin等[32]以锰超氧化物歧化酶为例,结合密度泛函理论和量子、分子力学计算,对Mn(Ⅲ)和Mn(Ⅱ)的循环催化过程进行了研究[图1(B)],该过程涉及两个半反应:超氧阴离子被歧化分别生成O2和H2O2,防止超氧化物过量积累造成的细胞损伤.
葡萄糖氧化酶(GOx)是一种含有黄素腺嘌呤二核苷酸(FAD)的蛋白质[33],可以在氧气的存在下消耗葡萄糖生成葡萄糖酸和过氧化氢[34].这个过程中,辅因子FAD起到了不可或缺的作用,FAD可以进行单电子和双电子的转移[图1(C)],在还原半反应中,葡萄糖被氧化成葡萄糖内酯,辅因子FAD被还原为FADH2.在氧化半反应中,FADH2被O2重新氧化并生成H2O2[35].葡萄糖内酯可以水解产生葡萄糖酸,可以降低反应体系的pH值,有利于细胞内响应性系统的构建.
如上所述,GOx的催化过程需要辅因子的参与,然而也有很多氧化酶不需要辅因子就可以与氧气反应,尿酸氧化酶(UOX)就是一种无辅因子氧化酶,可以在O2介导下催化尿酸(UA)降解为5-羟基尿酸盐[图1(D)].如图所示,UOX从尿酸阴离子上拔氢质子,随后尿酸阴离子与O2发生电子转移生成尿酸自由基和超氧阴离子,之后通过两种可能的路径生成H2O2和最后的水解产物尿囊素[36].
以上几种酶是应用中比较常见的天然酶,除此之外,细胞内还有众多酶协同发挥作用,涉及质子辅助电子转移的过程,这里不再具体介绍.
1.1.2 模拟酶 天然酶在使用过程中面临着使用条件苛刻、难以回收和稳定性差等问题,因此,科学家们研究了一系列具有类酶催化活性的材料,称为模拟酶.模拟酶按化学成分可以分为非金属基和金属基两类,除了常见的纳米颗粒,氨基酸配位金属的模拟酶近期也受到了广泛的关注.
非金属模拟酶主要由碳基材料构成,通常是在材料表面进行官能团修饰,显示出类酶催化活性[37,38].石墨烯作为一种典型的碳材料,被酸氧化后在表面引入了含氧基团,氧化石墨烯具有过氧化物酶活性,在H2O2的存在下可以有效地催化3,3′,5,5′-四甲基联苯胺(TMB)氧化[39].非金属杂原子的掺杂可以诱导纳米材料中的电荷转移,提高催化活性,Fan等[40]将氮元素掺杂在多孔碳球中构建了一种具有4种酶催化活性的纳米酶,可以特异性调节肿瘤细胞内的活性氧,导致肿瘤的消退.Liang等[41]还开发了氮和磷双掺杂的多孔空心碳球,实验结果表明,双掺杂比单掺杂的模拟酶具有更高的过氧化物酶活性,可与吲哚乙酸(IAA)形成前体药物系统治疗肿瘤.
金属基纳米酶因具有类天然酶的活性中心和特殊的物理特性而被广泛研究.贵金属纳米颗粒可以作为纳米酶发挥催化作用,碳负载或柠檬酸盐包被的金纳米颗粒具有GOx活性[42],Dong等[43]则对多种贵金属纳米颗粒模拟GOx的机理进行了系统研究,发现以O2作为电子受体时,金纳米酶氧化葡萄糖可以生成H2O2,而Pt,Pd,Ru和Rh等其它贵金属纳米粒子的催化产物为H2O,同时发现贵金属纳米酶也可以发挥辅酶的作用.这项研究丰富了纳米酶的理论研究,可以进一步指导纳米酶的设计.此外,贵金属纳米颗粒可以模拟多种酶活性[如过氧化物酶(PDP)、超氧化物歧化酶、过氧化氢酶(CAT)等[44~47]],可以用于生物信号检测及调控氧化还原平衡,但其体外和体内的毒性作用仍不容忽视.
金属氧化物也是纳米酶中很重要的组成部分.作为纳米酶领域的开创性研究工作,许多科研人员已经对Fe3O4纳米颗粒的POD活性进行了深入的探究[11].近年来,其它过渡金属氧化物的氧化还原酶活性也得到了极大的发展.Ge等[48]以人血清白蛋白(HSA)为模板制备了MnO2纳米颗粒,其具有氧化酶的活性,可以直接在不需要H2O2的条件下将TMB氧化.Li等[49]将MnO2作为细胞保护壳,封装单个酵母细胞,不仅可以增强细胞的严苛物理条件下的耐受性,还可以利用其固有的SOD和CAT模拟活性,在体外和体内有效去除细胞内有害的活性氧(ROS),提高细胞的保存时间.氧化铈(CeO2)纳米颗粒中的Ce可以在三价和四价之间相互转化,可以模拟氧化还原酶分解一些活性氧及活性氮,在氧化应激类疾病的治疗中发挥着重要作用[50~52].Zeng等[53]以透明质酸为模板合成了CeO2纳米酶,可以模拟过氧化氢酶释放氧气,缓解肿瘤缺氧问题.Baldim等[52]也利用热分解法制备了CeO2纳米颗粒,并对聚合物包裹的CeO2纳米酶进行了酶活性的探究.氧化钴(Co3O4)在类酶材料的发展中也具有重要地位.Qin等[54]发现Co3O4具有类氧化酶活性,在无外源H2O2添加的情况下能够催化氧化TMB变色,可用于监测亚硫酸盐.Mu等[55]则对Co3O4的类过氧化氢酶活性进行了探究,发现Co3O4纳米粒子和天然酶具有相似的活化能,且能在不同pH和温度下保持稳定,能用作监测过氧化氢的传感器,并提出了相应的催化机制.但是,过渡金属氧化物在生物体内存在容易形成聚集体的趋势,无疑会降低其类酶活性,这限制了该类纳米材料的进一步应用,同时也为纳米材料的表面修饰、模板合成和载体构建方面的研究提供了空间.
从天然酶的结构出发,金属和氨基酸的配位通常是催化活性位点,因此活性中心配位环境的模拟对设计具有高选择性的酶十分重要[56].甘氨酸亚铁(Fe[Gly]2)作为一种两个甘氨酸配位的亚铁螯合物,被证明具有过氧化物酶活性,Zhang等[57]通过理论计算研究了Fe[Gly]2的催化机理,H2O2首先通过电子转移使亚铁变成亚铁的过氧化物(cpd 0),甘氨酸配体上失去一个电子生成阳离子自由基(cpd I),之后从底物分子拔一个氢,得到cpd II,再拔一个氢则回到最原始的Fe[Gly]2状态.在最后两步拔氢的过程中可以产生自由基,引发聚合反应[图2(A)].Qu等[58]以Fe3O4纳米粒子为催化内核,以不同的含有手性氨基酸的聚合物为壳,构建了具有立体选择性的纳米酶,为设计更具有立体选择性的纳米酶开辟了新途径.我们团队[59,60]也进行了一系列氨基酸配位金属模拟酶的研究,Xia等[60]将赖氨酸和氯化亚铁的水溶液混合,在60℃下通氮气除氧进行反应,随后进行纯化得到产物赖氨酸亚铁Fe[Lys]2[图2(C)],对将Fe[Lys]2和H2O2混合后,对其进行了低温电子顺磁共振(EPR)测试,发现谱线呈现三价铁的特征[图2(B)],验证了在催化过程中存在三价铁中间体.Qi等[59]用SOD试剂盒和TMB比色法探究了Fe[Gly]2的SOD活性和POD活性,发现并推测了其可能的反应机理[图2(D)].不同于Fe2+的芬顿反应产生羟基自由基,Fe[Gly]2在此催化过程具有与天然HRP相似的电子转移机理,并不产生羟基自由基.
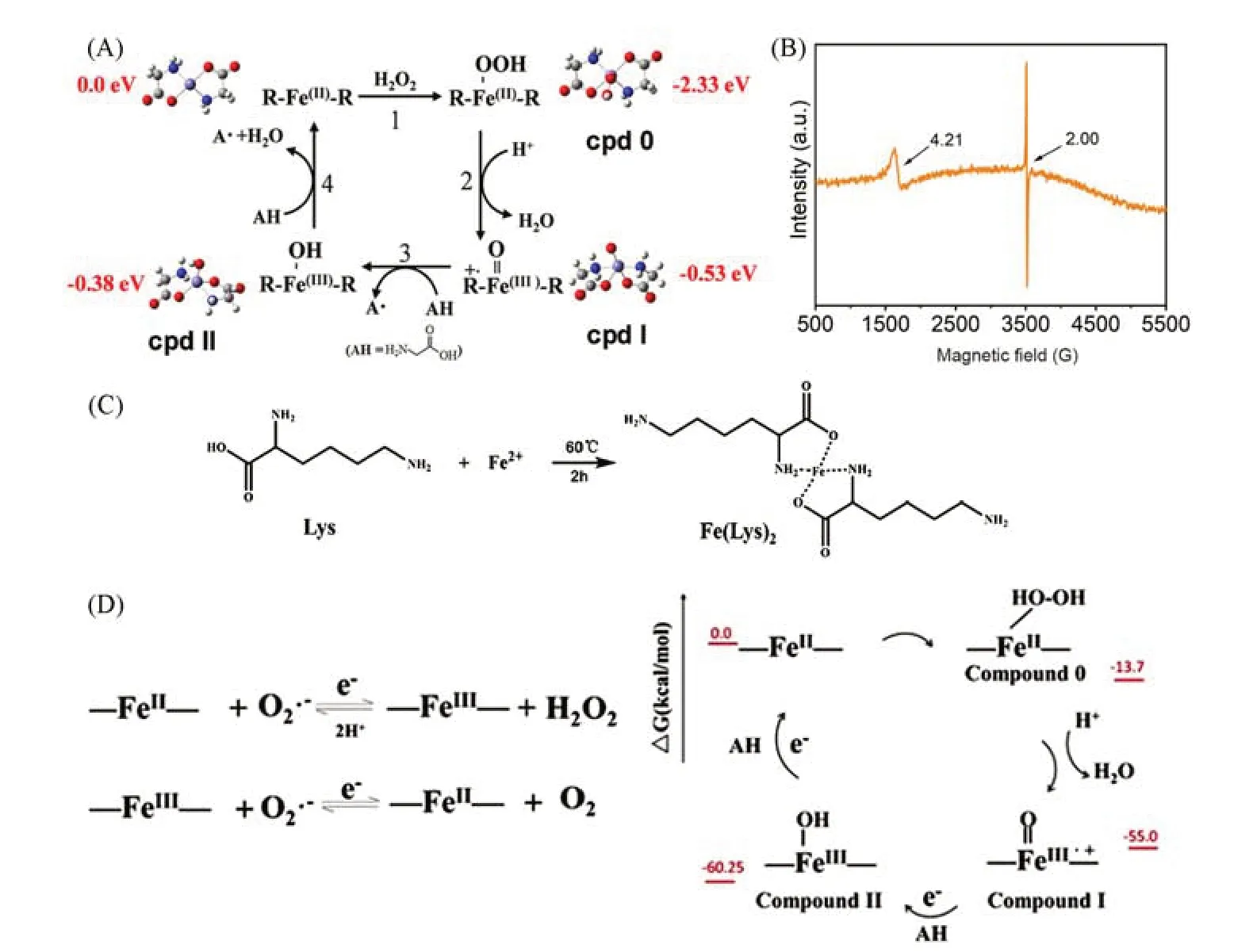
Fig.2 Suggested catalytic mechanisms of some enzyme mimics
1.2 级联酶体系
单酶的治疗效果往往十分有限,受细胞内多酶作用的启发,酶级联体系得到了极大的发展.酶串联可以提高局部浓度,改善传质效率并避免了中间体积累可能产生的毒副作用[61].级联酶体系可以简单地分为天然酶级联和有模拟酶参与的级联体系.
1.2.1 天然酶级联体系 H2O2作为众多酶催化的产物和生成物,是连接很多酶级联反应的桥梁.GOx可以在有氧条件下氧化葡萄糖产生H2O2,该体系作为HRP催化反应的供给系统,可原位催化聚合反应.我们团队[62,63]开发了GOx-HRP双酶聚合体系,HRP利用GOx催化葡萄糖产生的H2O2作为底物,催化乙酰丙酮产生碳自由基,可以在温和条件下快速引发单体聚合,维持了H2O2的平衡并消耗了O2[图3(A)].乳酸是细胞代谢的重要产物,乳酸氧化酶(LOx)将乳酸盐转化为H2O2,Ge等[64]据此开发了一种含有乳酸氧化酶和HRP的多酶探针,HRP催化前一步酶促产生的H2O2结合荧光红染料生成荧光产物,可在活细胞中实现乳酸的特异性灵敏检测[图3(B)].此外,我们团队[65]还整合了SOD和CAT级联体系,SOD可以催化超氧阴离子生成H2O2和O2,CAT将利用此H2O2产生O2,实现了超氧阴离子到分子氧的转变,可应用于生物成像[图3(C)].此外,氯过氧化物酶(CPD)可以在H2O2的存在下将卤离子氧化生成次氯酸和单线态氧,我们团队[66,67]也开发了GOx-CPO级联体系和SOD-CPO级联体系用于酶动力肿瘤治疗的应用[图3(D)和(E)].
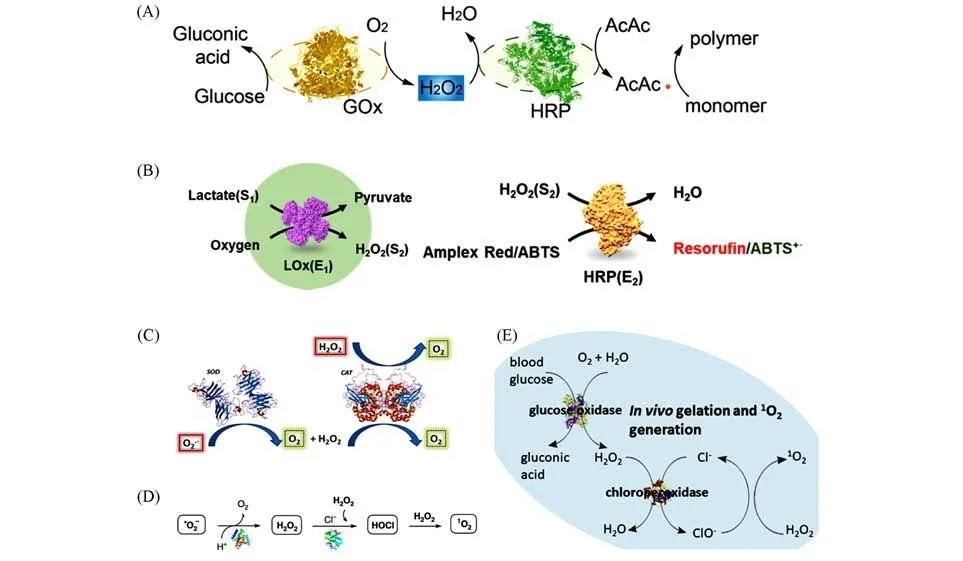
Fig.3 Schematic representation of a few cascade of enzymatic systems
1.2.2 有模拟酶参与的级联体系 在级联反应中引入模拟酶来替代天然酶,可以规避天然酶难以回收、恶劣条件易失活导致的催化性能不足的风险.天然酶和模拟酶的联用可以提高酶在多种反应环境的稳定性,Qu等[68]用具有POD活性的二维金属有机框架(MOF)材料吸附GOx,通过自活化产生的H2O2可以用于MOF纳米酶的后续催化产生羟基自由基以增强抗菌效果,该级联反应在小鼠背部伤口模型中体现出了优异的抗菌性能,并促进了伤口的愈合.Ming等[69]将GOx偶联到具有CAT和POD酶活性的Pd@Pt纳米片上,并用透明质酸进行修饰,可以实现肿瘤靶向,并在细胞内部特异性激活酶的催化活性.具体而言,内源性H2O2可以被CAT催化产生O2,增强了GOx对葡萄糖的氧化来进行饥饿治疗,同时GOx催化反应产生的葡萄糖酸和H2O2进一步促进了纳米酶CAT和POD酶活性,经由类POD酶活性产生剧毒的羟基自由基可以发挥化学动力治疗的作用.此外,Du等[70]还开发了胆固醇氧化酶和具有POD活性的MOF材料用于癌症研究.然而,想进一步提高催化活性及酶的负载量仍具有挑战性.
完全基于纳米酶的级联反应也被广泛探究.Gao等[30]设计了一种基于肿瘤微环境触发的双无机纳米酶平台,用多空二氧化硅实现了具有GOx活性的Au纳米颗粒和具有POD活性的Fe3O4的共载.该平台可以通过EPR效应载肿瘤组织中积累,Au将葡萄糖氧化生成H2O2,Fe3O4将H2O2歧化产生羟基自由基,诱导肿瘤细胞死亡,实验证明,该体系可以达到69.08%的肿瘤抑制率.Liu等[71]在Mn基MOF中掺杂了Pt纳米颗粒,MOF可以模拟SOD将超氧阴离子转化为过氧化氢,Pt纳米颗粒具有CAT活性催化过氧化氢产生O2,该级联体系可以有效地清除活性氧用于缓解炎症型肠病.由于很多模拟酶具有多酶活性,可以实现自级联催化.Wang等[72]开发了一种基于MOF材料、具有谷胱甘肽氧化酶和过氧化物酶活性的铜纳米酶,可以在有氧条件下消耗细胞内的谷胱甘肽产生H2O2,并将Cu(Ⅱ)转换为Cu(Ⅰ),用于后续POD催化生成羟基自由基诱导肿瘤细胞的凋亡.Xia等[73]对环糊精修饰的金纳米颗粒(CD@Au NPs)的多酶级联催化机理进行了研究,基于Bader电荷分析,CD@Au NPs上的Au与氧原子连接而显电负性,与带负电的水合葡萄糖阴离子有较强的亲和力继而发挥类GOx的催化作用,也用实验证明了CD分子的特殊拓扑结构调节了Au NPs的表面电子态,此外发现CD@Au NPs可以催化TMB转化为oxTMB,显示出POD活性,相较于HRP对TMB具有更高的亲和力.尽管如此,模拟酶仍存在很多不可预测的催化活性,且进入生物体的催化路径难以控制.
1.3 酶催化载体体系
酶对病理微环境具有特异性响应能力,与此同时,游离酶的活性容易受到环境的干扰,其不稳定性和难以重复使用性也限制了酶的应用,尤其是级联酶反应过程中,酶之间的距离对催化活性及反应进程意义重大.因此,发展固定化酶的纳米载体可以进一步丰富酶的应用场景.目前,固定酶的常用手段主要包括物理吸附和包埋、化学交联、共价结合和原位合成,由于酶固有属性的差异性及服务场景的多样性,越来越多的纳米载体应运而生.根据载体材料的不同,可将其大致分为无机载体、有机-无机杂化载体以及有机载体.
1.3.1 无机纳米载体 无机纳米载体包括多孔二氧化硅、金属氧化物、量子点、碳基材料及贵金属等.Jo等[74]在微乳液中通过一锅法合成了酶纳米反应器,主要是利用了酶的羧基和硅酸盐单体上的氨基之间进行偶联反应,同时硅酸盐单体反应形成硅纳米颗粒,成功实现了酶的高效包封且能够进行区域级联反应.一些金属及金属氧化物因具有高稳定性和生物相容性,也可以用作酶纳米载体,Gu等[75]将酪氨酸酶固定在金诱导生长ZnO的纳米棒上,可用于生物传感领域,Rani等[76]也进行了ZnO及MnO2负载漆酶的探究,发现负载后的酶活性及稳定性有明显提高.此外,一些载体材料本身具有的类酶活性、成像能力、光热及磁热性能,为肿瘤联合治疗提供了更有效的途径[77].Zhang等[78]则是先将氧化铁纳米颗粒进行聚多巴胺修饰,而后通过共价结合作用成功负载了GOx.在该系统中,氧化铁在作为载体的同时,也可以作为光热剂和催化剂,实现肿瘤的化学动力学和光热协同治疗.He等[79]则将磁性纳米颗粒Fe3O4表面修饰聚乙二醇(PEG),通过酰胺化反应负载GOx,改变PEG的分子量调控GOx和Fe3O4的距离[图4(A)],利用Fe3O4具有过氧化物酶活性与GOx级联产生羟基自由基来杀死肿瘤细胞,同时该纳米催化体系在交变磁场中具有磁热性能,可以增强肿瘤治疗效果.无机纳米载体在酶负载方面得到了广泛应用,但仍存在结构不易调控、酶泄露风险大、金属及金属氧化物高毒性等问题,这也限制了无机纳米酶载体的发展.
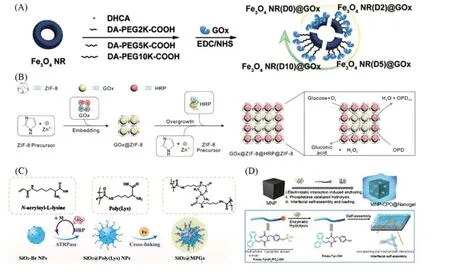
Fig.4 Some approaches to immobilizing enzymes
1.3.2 有机-无机杂化纳米载体 有机-无机杂化载体中最典型的例子是MOF材料,因其具有高的比表面积和可调的孔隙结构,既能实现酶的表面固定又能对酶进行多孔内部空间限定,且作为连接点的金属离子通常具有类酶活性,进一步扩大了级联酶反应类型,所以MOF载体固定酶一直是该领域的研究热点[21].目前,MOF载体固定酶主要有从头固定和合成后固定两种策略.基于合成之后的MOF材料再封装方法,可以采取表面修饰与酶进行偶联,这种方法可以推广到多种载体,但往往酶的固定效率不高,而MOF的多孔网络结构为酶负载提供了一个有效环境.Li等[80]基于锆基MOF材料,通过设计不同的配体来调控介孔尺寸,合成了相互连接且具有分层介孔通道的MOF酶载体材料,之后将MOF材料浸泡于酶溶液中,实现了乳酸脱氢酶的负载.此研究中MOF中的大孔道结构用于固定酶,小尺寸通道可实现底物和辅酶的扩散,固定酶的活性与游离酶的活性相当.所谓从头固定即酶在MOF结晶的过程中锚定在材料中,这样的负载方式会比后浸润的方式结合得更紧密[81].Man等[61]采用从头固定酶的方式,在MOF合成的过程中负载GOx,并以此为核进行MOF的二次生长同时实现HRP的负载[图4(B)],这种多壳结构为级联酶反应提供了有效的微环境.该团队也用类似的封装步骤对碱性蛋白酶和醇脱氢酶进行了探究,发现相较于游离酶,MOF整合酶可以将级联催化效率提高5.8~13.5倍.为了解决酶限制在MOF壁上导致的自由度受限的问题,Tian团队[82]提出了一种以Pickering乳液为导向剂的MOF界面组装成型的微反应器,模拟活细胞微工厂.酶和金属离子被分散在Pickering液滴中,加入配体后MOF在液滴界面生长,二氧化硅则分布于外部稳定液滴.实验表明,这种区室化微环境赋予了酶更优异的催化效率、稳定性和耐久性.MOF载体固定酶在大规模工业应用方面具有巨大的潜力,同时也面临着一些挑战,如探索载体材料和酶之间的相互作用、进行MOF孔道的设计优化等.
1.3.3 有机纳米载体 有机纳米载体主要由聚合物构成,包括天然聚合物和合成聚合物.Jiang等[83]利用乳液模板法制备具有磁响应性的玉米蛋白质基纳米载体,其表现出优异的催化性能和储存稳定性及可回收性.Wu等[84]将丙烯化的基团与酪氨酸酶表面的基团共价结合进行锚定,之后在水溶液中引发原位聚合形成聚合物网络壳,得到单酶负载的纳米胶囊,其可用于生物传感.Zhao等[85]也利用酶上的氨基和聚合物上的醛基形成聚合物,实现了GOx的固定.此外,纳米凝胶作为酶载体研究的重要组成部分,也助推了酶固定领域的发展,Zhao等[86]用GOx纳米凝胶进行了黑色素瘤的治疗,同时发现GOx单独使用时并不能达到治疗效果,游离酶的稳定性差且具有免疫原性,这充分体现了纳米载体在提高单酶的生物安全性方面的作用.在级联酶固定方面,纳米凝胶在实现酶负载的同时,提高了级联酶之间的传质效率,为酶催化反应提供了区隔化的限域.近年来我们组发展了纳米凝胶作为载体固定及模拟酶的方法.Qi等[59]对纳米级表面进行卤素引发剂的修饰,利用酶催化原子转移自由基聚合的方法,以修饰有双键的赖氨酸为单体,在界面形成聚合物刷,引入亚铁离子与赖氨酸上的羧基和氨基配位作为交联剂形成纳米凝胶,同时亚铁离子也作为活性中心模拟SOD酶和POD酶[图4(C)].此外,基于多肽前体的原位界面自组装包裹酶的纳米催化体系也得到了进一步的开发,Zhang等[87]通过静电作用锚定碱性磷酸酶于纳米内核,诱导多肽Fmoc-Tyr(H2PO3)-OH脱去磷酸基团,溶解性下降,随后在界面自组装成超分子凝胶同时实现CPO的负载[图4(D)].以自由酶的活性为对照,探究了纳米凝胶包覆酶的活性随时间及温度的变化,如图所示,温度升高对酶的活性有一定影响,但总体来讲维持着较高的活性.Wu等[66]也利用碱性磷酸酶诱导多肽界面组装的方法制备了纳米凝胶,并实现了SOD和CPO的双酶负载(nanogel@SOD/CPO).相较于游离的SOD/CPO体系,nanogel@SOD/CPO催化产生单线态氧的速率相对慢一些,但这种产生单线态氧的方法是可行的.天然聚合物和合成聚合物在酶负载方面各有优点,天然聚合物生物相容性好,但对温度等外界条件变化的抵抗力有限,合成聚合物的种类丰富且价格更低,但生物安全性值得考量,因此开发将两者优势二合一的纳米载体更具吸引力.
具有氧化还原能力的天然酶或类酶材料可以有效地对生物体内的活性氧/氮物种进行调控,在响应性成像和疾病治疗中有着重要的应用价值.载酶纳米体系的合理构建是进行生物诊疗应用的关键.纳米体系的尺寸通常控制在200 nm以内,这是因为该尺寸范围内的纳米粒子比较容易递送、渗透和在病变组织中积累,消除生物屏障的限制,延长作用时间[88].在载酶体系的组成成分上,通常选用生物相容性好的大分子(如细胞膜[89~91]、多糖[92,93]、蛋白[94~96]等)对其进行修饰或包裹,这在降低生物毒性、保持酶活性的同时,也可以在一定程度上靶向病变组织,靶向因子的添加提高了载酶体系的治疗效果.
2 成像检测
2.1 超声成像
超声成像(Ultrasound imaging)具有方便、便宜、无电离辐射的特点[97],是目前临床上最常用的实时成像方式.亚微米级和纳米级的气泡能穿透肿瘤血管空隙,常被用作成像和治疗的超声造影剂[98,99].利用酶催化产生气泡用于超声成像,可进行病理部位特异性诊疗,目前,研究较多的是过氧化氢酶.
Olson等[100]将中空介孔二氧化硅壳悬浮在过氧化氢酶溶液中,制得一种粒径约为200 nm的新型的中空酶负载纳米球[图5(A)],在大鼠缺血性肾损伤模型中,过氧化氢酶将H2O2催化成水和O2,O2会使纳米壳周围的流体饱和,当暴露于超声波时,O2微气泡从溶液中成核并被超声波检测和成像.单酶纳米系统可能存在底物浓度低、成像效果差等问题,利用级联酶催化反应可以改善超声成像的效果.Wang等[65]开发了一种双酶负载的多功能混合纳米凝胶探针(SGC),该纳米凝胶高效担载了SOD和CAT,粒径约为13 nm.SOD将超氧化物(O2·)转化为H2O2和分子氧,随后通过CAT将H2O2转化为水和分子氧.氧气(O2)的快速积累导致气泡的形成,从而改变组织的声阻抗并增强超声成像,此外,凝胶晶格的存在也可确保酶充分利用病理组织中的活性氧,为超声成像提供出色的对比度.体内试验结果表明,注射该探针后1 h,肿瘤的超声成像信号增强约7倍[图5(B)].因此,该探针可用作高效的超声成像造影剂.

Fig.5 Schematic diagram of ultrasound imaging
除了天然过氧化氢酶催化产生氧气泡可用于超声成像,许多具有过氧化氢酶活性的纳米酶也被开发以丰富超声成像的研究场景.Yang等[101]设计了一种基于普鲁士蓝纳米颗粒(PBNPs)的O2纳米发生器(粒径为50 nm),利用普鲁士蓝的类过氧化物酶活性,可在过度产生自由基氧化剂的肿瘤组织中,与自由基氧化剂反应产生氧气气泡,从而改变经历氧化应激的组织的声阻抗,使其可以通过超声成像被检测到[图5(C)].Su等[102]用纳米乳液自组装法,制备了一种单原子Fe分散的氮掺杂介孔碳纳米球(SAFe-NMCNs)双酶模拟物,既可以模拟过氧化氢酶,产生的氧气在肿瘤部位实现超声成像,又可以模拟过氧化物酶,产生的·OH用于纳米催化治疗,同时在近红外二区具有很强的光学吸收,可用于肿瘤光热治疗.
2.2 荧光成像
荧光成像(Fluorescence imaging)具有成本和辐射风险低、灵敏和分辨率高及成像捕获实时等特点[103],可适用于肿瘤诊断、代谢类疾病治疗等领域.
肿瘤微环境的低pH、谷胱甘肽(GSH)的过表达和高水平的H2O2可以用作内源性刺激以激活探针的荧光[104].Zhao等[105]合成了负载有金纳米酶团簇和阿霉素(DOX)的铜离子掺杂ZIF-8(记作ACD),可用于肿瘤微环境激活荧光成像指导下的肿瘤化疗和化学动力疗法(CDT)协同治疗.ACD未被肿瘤细胞摄取时,由于聚集猝灭作用,DOX没有荧光发射,金纳米团簇的荧光也被铜离子猝灭,此时没有荧光产生.ACD进入肿瘤细胞后,Cu2+与GSH竞争性结合,掺杂的ZIF-8壳逐渐降解,DOX和金纳米团簇被释放,恢复获得了肿瘤区域的荧光信号,可以进行高信噪比的荧光成像.
利用肿瘤微环境的特点,还可以提高人工酶的活性,催化底物产生荧光.Di等[106]利用硫醇-马来酰亚胺Michael加成反应,将催化组氨酸残基引入季戊四醇四(3-巯基丙酸酯)(PTT),获得了PTT-SGH(丝氨酸-甘氨酸-组氨酸三肽)单体单元,之后通过细胞内ROS介导的硫醇基团氧化在细胞内形成大聚集体PTT-SGH人造酶.由于肿瘤微环境中的ROS浓度较高,因此在肿瘤细胞中显著促进了该过程.通过交联PTT-SGH的去质子化,该人工酶的催化活性得到强化,显示出典型的酯酶活性.该酶可以有效催化细胞内笼状荧光团FN[荧光素二(4-硝基苯甲酸酯)]的酯键的裂解,体外细胞实验表明,以PTTSGH作为仿生酶、FN作为诊断成分,根据细胞内ROS的不同浓度可以区分癌细胞和正常细胞,实现肿瘤细胞的选择性荧光成像.
Qi等[59]提出了一种酶催化原子转移自由基聚合(ATRPase)方法,构建了一种金属配位聚合纳米凝胶(MPGs),同时表现出SOD和POD活性.考虑到肿瘤环境中超氧化物自由基水平相对较高,纳米凝胶与荧光红染料联用,通过级联反应将肿瘤部位过量的超氧自由基转化为H2O2,上调肿瘤部位的H2O2浓度,在荷瘤小鼠中成功实现了高效的ROS响应生物荧光成像.
血清中葡萄糖和碱性磷酸酶(ALP)的异常水平与多种疾病密切相关[107],Jin等[108]开发了两种酶促途径来制备具有等离子体和荧光特性的量子点(QD)/Au杂交纳米探针,他们利用GOx和ALP分别制备了CdSe/ZnS@Au杂化纳米颗粒,两种酶的酶产物用作还原剂,控制QD表面的Au沉积.采用聚合物多层逐层组装,调节QD芯与等离子体Au的分离,有效降低Au对量子点的猝灭效果.所制备的QD@Au杂交纳米结构是优良的双峰成像纳米探针,并成功应用于MCF-7细胞的荧光和暗场散射成像,据此开发的酶传感平台对于葡萄糖和ALP相关疾病的诊断具有重要意义.
2.3 光声成像
光声成像(Photoacoustic imaging)结合了传统光声成像和超声成像的优势,具有丰富对比度、高时空分辨率和深层组织穿透力等特点,在临床中具有广阔的应用前景[109].其具体原理是利用光声效应,组织结构由于吸收光的能量产生了瞬时热弹性膨胀,发出宽带超声波,该波可以被超声传感器检测到并转化为电信号,进行适当的处理从而获得光声图像[110].
过氧化物酶是一种氧化还原酶,能够催化多种反应,在光声成像中具有广泛应用.Yang等[111]开发了一种负载HRP及光敏剂2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)的钆(Gd)纳米颗粒,可用于肿瘤响应性光声成像[图6(A)].其中,HRP负载后保留有70%的酶活性,不仅作为仿生化学中的培养箱、稳定剂和载体,而且可以作为催化剂催化负载底物(ABTS)和H2O2之间的氧化反应,产生的ABTS自由基在近红外波段有很强的吸收,从而可以实现在肿瘤部位选择性高效光声成像.毒理学实验也表明,该纳米颗粒可以通过肾脏清除,未发现明显的毒性,可作为一种安全的光声成像剂应用.ABTS自由基是一种优异光声成像造影剂,受此启发,Ding等[112]利用石墨烯量子点纳米酶(GQDzyme)的固有过氧化物酶样活性,设计了一种用于鼻咽癌检测的H2O2响应性纳米酶囊泡.该纳米酶囊泡由GQDzyme/ABTS纳米颗粒组成,涂有叶酸(FA)靶向修饰的天然红细胞膜(RM),仿生外泌体区室化策略,延长循环时间,促进肿瘤摄取.在GQDzyme的催化作用下,ABTS被氧化,体内动物实验表明,这种类似外泌体的纳米酶囊泡在鼻咽癌中有效积累,并选择性地触发了对鼻咽癌的催化光声成像.Xia等[60]原位构建了一种稳定的氨基酸配位金属模拟酶基凝胶体系,集中了天然酶和无机纳米酶的优势,得到了一种纳米催化剂材料,实现了肿瘤催化诊疗研究,以表面修饰了羧基的纳米硅球为内核,设计多肽(Nap-Phe-Phe-Glu)氨基酸配位铁功能化单体[NapFFE-Fe(Lys)2],基于酰胺反应诱导质子化,引发单体在硅球表面自组装,形成一层氨基酸铁多肽纳米凝胶(SiO2@MCSGs).该超分子纳米凝胶具有模拟SOD和POD的活性,在负载了底物ABTS后,级联催化肿瘤中较高浓度的超氧阴离子转化过氧化氢,进而氧化ABTS,最终实现肿瘤部位安全高效的光声成像.
传统的光声成像窗口大都位于近红外一区(NIR-Ⅰ,780~900 nm),这种成像组织穿透较浅且存在背景干扰,与之相比,近红外二区(NIR-II,900~1700 nm)窗口的吸收可以改善穿透深度且减少光散射,实现更高分辨率的成像[113~115].Zhang等[113]在阴离子囊泡(AOT)表面,利用HRP通过单电子氧化苯胺产生活性苯胺自由基,进一步聚合形成PANI-ES,得到纳米复合物PANI-ES@AOT[图6(B)].通过酶促反应合成的PANI-ES@AOT在近红外二区波段具有显著的光热能力,无需纯化既可用作光声成像引导肿瘤光热治疗.Wang等[116]将(NH4)6Mo7O24·4H2O和CuCl2在不同温度下简单混合,“一锅法”制成了一种基于多金属氧酸盐的多功能纳米酶(Ox-POM@Cu).该纳米酶在肿瘤微环境中具有多重酶促活性,可参与肿瘤组织中GSH的氧化还原反应,POM在NIR-Ⅱ有很强的吸收,所以通过NIR-Ⅱ照射可以激活光声成像,提供肿瘤的准确诊断,同时激活PTT进行精准治疗.此外,纳米酶中的Cu+可以与肿瘤微环境中的H2O2反应形成·OH,从而进行CDT.
此外,酶还可用于提高光声探针的灵敏度,以获得更优异的成像结果.Wu等[117]开发了一种ROS敏感型纳米酶增强光声探针,并用于急性肝功能衰竭(ALF)的体内成像,将酞菁锌(ZnPc)和铈纳米酶(CeNZ)通过两亲性ROS敏感性二硒化物聚合物(DSeP)制备了探针,命名为RSPN,在血液循环过程中,ZnPc的多光谱光声(PA)信号和CeNZ的催化活性保持“OFF”状态,因为它们保留在疏水核心内并屏蔽在水环境中.当暴露于损伤肝脏富含ROS的微环境中时,DSeP壳的二硒键被ROS切割,导致RSPN的结构转化以及ZnPc和CeNZ的释放.随后,释放的ZnPc由于分子间疏水相互作用和芳香族π-π堆叠效应而重新生长成大颗粒,作为光声成像(PAI)的信号发生器模块[图6(C)].释放的CeNZ的催化活性得以恢复,进一步将ROS催化成O2气泡,通过气泡触发惯性空化效应放大PA信号[118,119].同时,受损肝脏组织的氧化和缺氧微环境被活化的CeNZ逆转,实现ALF的及时纳米催化治疗.

Fig.6 Schematic illustration of enzyme complex for photoacoustic imaging
Lei等[120]设计了一种使用两种酶来构建可生物降解的环级联催化系统(表示为PMNSG),由二维(2D)基于Pd的纳米酶与GOx偶联而成,可以利用三维(3D)PA分子成像来监测基于双酶驱动的循环反应平台的体内级联催化疗法.纳米酶和GOx的组合可以诱导内源性分子的PA信号变异.结合纳米酶的
PA响应,可以同时绘制与催化过程相关的动态内源和外源分子的3D PA信号,从而实现局部动态信息实时非侵入性的可视化,同时为肿瘤的催化治疗提供反馈.
2.4 磁共振成像
磁共振成像(Magnetic resonance imaging,MRI)是一种无电离辐射成像技术,对软组织有具有亚毫米级的空间分辨率,MRI的组织穿透能力远高于荧光成像,是医学成像中评估组织功能或诊断疾病的最佳无创方法之一.它具有出色的时空分辨率、成像的有效时间窗口长、信号对比度细等几个优点.然而,由于弛豫时间范围有限,通常需要造影剂(CA)来增强MRI对比度.
靶向和成像模式整合到单个纳米级复合物中成为未来纳米治疗学发展的新趋势,许多金属氧化物的纳米结构(如Mn,Fe等)具有酶催化活性[9,121],同时可作为磁共振成像的造影剂,准确跟踪肿瘤.Shen等[122]报道了一种线粒体靶向的磁热纳米酶(Ir@MnFe2O4NPs),可用于实现无创和高度局部化的癌症治疗.具体而言,MnFe2O4NPs具有优异的磁热性能,铱(Ir)配合物在MnFe2O4NPs表面充当线粒体靶向剂,线粒体内过度表达的GHS将Ir@MnFe2O4NPs表面的Fe(III)还原为Fe(II),从而引发Fenton反应,产生细胞毒性·OH.同时,当暴露于交变磁场时,Ir@MnFe2O4NPs会引起局部高温,进一步提高Fe(III)向Fe(II)的转化率,进而加速了·OH生成,可引起细胞内氧化还原稳态的破坏和治疗效果的放大.体内实验表明,该磁热纳米酶是一种出色的T2加权MRI造影剂,同时集成了化学动力疗法、磁热疗法和双光子显微镜成像技术,为癌症的精准诊疗提供了一种途径.类似的,Liu等[123]将晶体氧化铁嵌入在氮掺杂的碳纳米片中,得到一种协同肿瘤级联治疗的近红外光触发的纳米酶IONCNs[图7(A)],IONCNs可以吸收980 nm的光,并转化为局部热量促进癌细胞的热消融及氧化铁的溶解,在肿瘤的弱酸环境中产生Fe2+/Fe3+,一方面可以利用芬顿反应产生·OH,另一方面可以促进内源性谷胱甘肽的消耗来放大氧化应激,改善抗肿瘤性能,同时IONCN可用于通过磁共振成像直观地跟踪治疗过程.
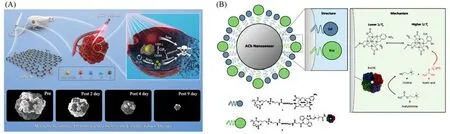
Fig.7 Nanocatalytic systems for MRI
相较于正常组织,肿瘤组织显示出SOD水平降低,因此,Ragg等[124]提出可以利用MnO纳米颗粒的超氧化物歧化酶活性,增强了MRI的成像效果.他们用儿茶酚-聚乙二醇对MnO纳米颗粒进行功能化修饰,当暴露于超氧自由基时,其表现出基于延长的T1和T2的强烈增强的MRI对比度,研究表明,MnO NPs可以同时用于治疗氧化应激促进的肿瘤进展和转移,或作为选择性临床MRI成像工具.
此外,为了提高纳米酶的主动靶向能力和免疫规避能力,还可以利用细胞膜的生物学特性[125,126],合成细胞膜包被的纳米酶.Huang等[127]将Au@Pd核、MnO2壳和NK-92细胞膜整合到一个纳米平台中(APMN NPs),该纳米颗粒显示了出色的肿瘤特异性和肿瘤微环境(TME)触发的MR成像及药物释放特性.静脉注射后,APMN NPs可以在正常脉管系统中保持隐秘和沉默,通过NK-92细胞膜介导的肿瘤靶向能力选择性地在靶位积累,从而诱导TME响应性MR成像和有效的多种协同抗肿瘤治疗.
Wang等[128]提出了一种基于金属有机骨架的多功能纳米酶,可用于磁共振成像并原位生成内源性氧气,增强光动力疗法的治疗效率.介孔二氧化硅涂覆锰钴基MOF,在环境气氛下进行退火,去除介孔硅壳并用聚多巴胺和聚乙二醇改性提高生物相容性,之后负载光敏剂Ce6,显示出T2加权磁共振成像能力,并用于其体内跟踪,MCOPP NE通过静脉注射施用于4T1荷瘤小鼠.肿瘤部位的T2加权MR成像信号随时间逐渐增加,通过增强实体瘤的高通透性和滞留(EPR)效应表现出MCOPP NE的时间依赖性肿瘤积累.类似的,Feng等[129]实现了普鲁士蓝纳米颗粒(PBNPs)的可控合成,探究了PBNPs的过氧化物酶和过氧化氢酶活性,并发现其可用于T1加权磁共振成像.
如前所述,MRI造影剂已被封装在纳米颗粒中,以放大磁弛豫[130],提高在肿瘤中的渗透和积累[131],并用于治疗诊断[132].然而,用于神经递质化学成像的纳米级MRI造影剂的尚未广泛开发.Luo等[133]开发了一种纳米粒子传感平台,用于活脑组织中的神经递质乙酰胆碱的磁共振成像.该传感器由乙酰胆碱催化酶和钆(Gd)造影剂共同定位在聚合物纳米颗粒表面组成,其成像机制为乙酰胆碱被酶水解为胆碱和乙酸,使得pH值局部降低,因此改变了pH敏感的钆螯合物水配位[134][图7(B)],导致MRI信号变化.纳米传感器在大鼠内侧前额叶皮层中的体内适用性显示,由药理刺激诱导的T1弛豫速率(1/T1)明显增加.类似的响应性传感器的发展可有助于更好地理解大脑功能和疾病相关的神经信号传导事件.
3 疾病治疗
3.1 肿瘤响应性治疗
癌症对人类的生存和健康有着巨大的威胁[135,136],随着纳米技术的发展,酶催化纳米材料为肿瘤治疗提供了一种新型的临床解决方案,具有应用范围广、特异性强、安全性高和多模式协同治疗等特点.肿瘤特异性的微环境给予酶响应治疗极大的发挥空间,可施行饥饿治疗、化学动力疗法(CDT)、光治疗[光热治疗(PTT)/光动力治疗(PDT)]、磁热治疗(MHT)及酶动力治疗(EDT)等,在酶催化纳米材料介导的肿瘤治疗中,以上各种疗法往往协同发挥作用,以发挥出比单一治疗模式更强的治疗效果.
饥饿疗法是指利用酶消耗癌细胞中的氧气和营养,从而使癌细胞无法维持快速的生长速度,在这个过程中被“饿死”[137].GOx专门用于催化葡萄糖氧化,在此过程中会不断地消耗肿瘤细胞中的葡萄糖和氧气,是饥饿治疗中常用的酶[138].Zhang等[139]将GOx和化疗药物替拉帕胺(TPZ)加载到碳酸钙纳米颗粒上,并由透明质酸进一步连接.由于透明质酸的主动靶向和纳米颗粒的被动靶向作用,该纳米系统可在肿瘤部位积累,GOx可以切断癌细胞的葡萄糖供应,进行饥饿治疗,同时造成肿瘤部位缺氧和酸度增加,碳酸钙被水解,进而触发化疗药物的释放,同时该化疗药物具有缺氧依赖性,因此能够及时地展开化疗.具有GOx活性的模拟酶同样也可以用于饥饿治疗.Tang等[140]利用一种新颖的湿化学和声化学合成方法,开发了一种具有GOx活性的二维MnO2纳米片,可用于癌细胞饥饿治疗,同时,由于该纳米片具有出色的光疗性能,还可以进行有效的光声成像引导增强光热治疗,促进癌细胞的消融[图8(A)].
化学动力疗法是利用芬顿或者类芬顿反应,将癌细胞内过表达的过氧化氢歧化为有高度毒性的羟基自由基,进而可以通过破坏DNA,使蛋白质失活并破坏磷脂膜诱导肿瘤细胞凋亡[141~143].Wang等[144]设计了一种肿瘤微环境响应的智能纳米系统[图8(B)],利用上转换纳米颗粒(UCNP)作为载体,负载天然酶(GOx)和纳米酶(Cu-Cys),在肿瘤微环境中可以通过酶级联特异性激活,原位扩增活性氧的生成,并用于肿瘤的饥饿/化学动力学/免疫治疗.在此过程中,GOx(GOx)一方面可以用于消耗葡萄糖进行饥饿治疗,另一方面可以产生H2O2以增强纳米酶的化学动力疗法的治疗效果.
光治疗主要包括光动力治疗(PDT)和光热治疗(PTT),其共同特点是都需要外源光的照射.光热疗法是通过光热转换将光能转化为热能来破坏异常细胞[145],但局部温度过高也可能会引起炎症及外周组织病变[146],因此开发在适宜温度下的光热疗法对肿瘤治疗具有重要意义.He等[147]用空心介孔二氧化硅负载TMB,GOx和HRP制备了多功能级联纳米反应器,可以用于肿瘤饥饿和光热协同治疗.GOx消耗细胞中的葡萄糖进行饥饿治疗,同时调整热休克蛋白的水平来降低热电阻,之后HRP可以消耗H2O2并将TMB氧化成oxTMB,oxTMB是一种光热剂,可以进行光热治疗.体内外实验均表明,该纳米反应器显著抑制了肿瘤生长,使实体瘤消融.
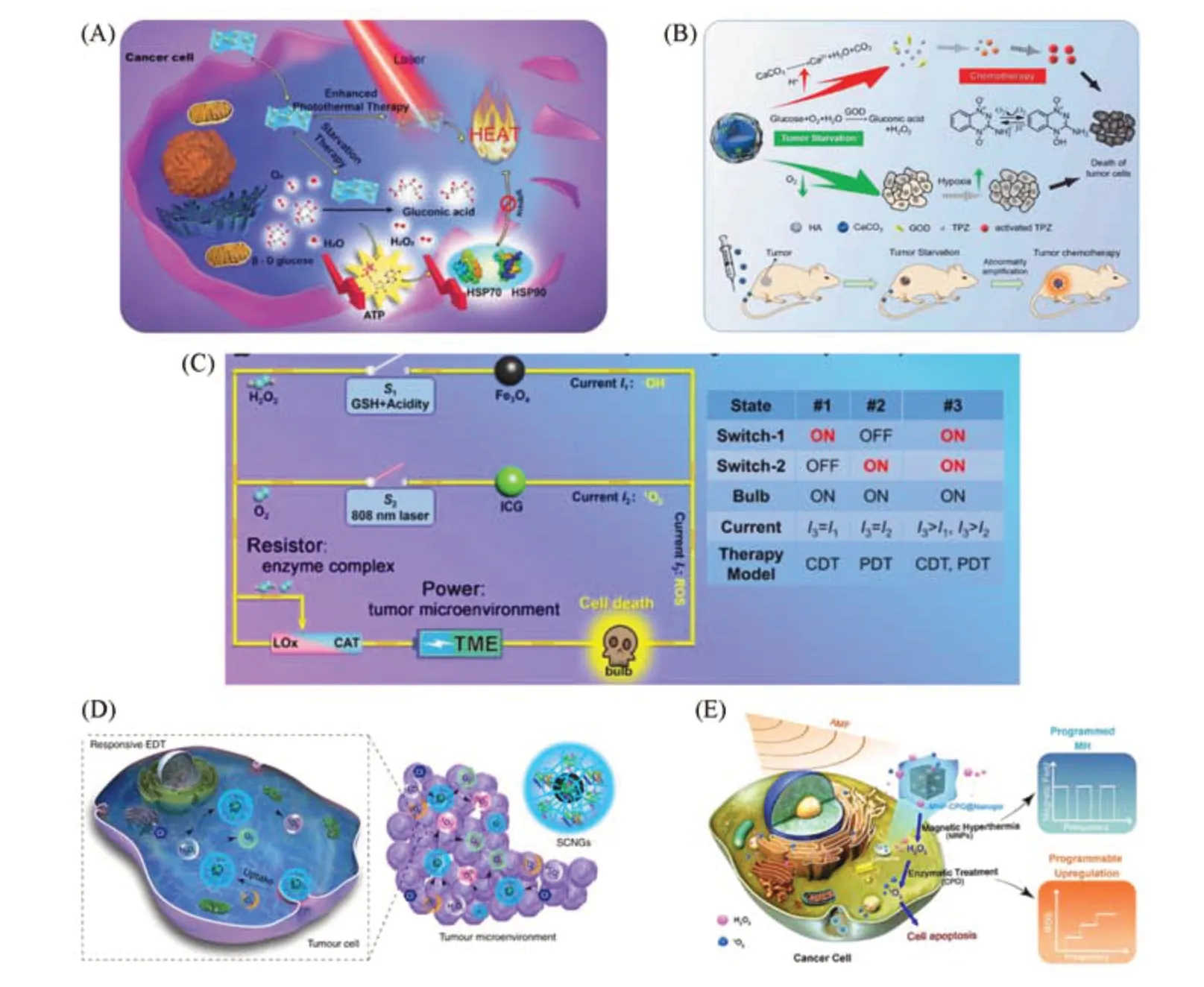
Fig.8 Enzyme-load nanocatalytic systems for cancer therapy
与光热疗法不同,光动力疗法是基于活性氧的产生来诱导细胞毒性作用,肿瘤内光敏剂被光照射后激发,激发态的光敏剂可以参与电子转移反应产生高活性的单线态氧或其它自由基,提高细胞内的活性氧浓度从而产生细胞毒性[148].实体瘤的乏氧微环境限制了光动力治疗的效率,Zhou等[149]引入过氧化氢酶纳米晶(Cat-Cry)作为原位氧生成系统,并加载光敏剂亚甲基蓝(MB),显著提高了肿瘤光动力治疗效果.具体而言,Cat-Cry可以催化内源性H2O2分解,高效持续地产生O2供应,同时,产生的O2与MB都被限制在Cat-Cry的纳米多孔结构中,由于限域效应,可以大幅提高单线态氧的产生,增强光动力治疗效果.此外,级联酶催化体系进一步发展了光动力疗法,并可以结合化学动力疗法,对更深的肿瘤进行治疗.Qin等[150]设计了一种杂化纳米凝胶系统(命名为FIGs-LC),将乳酸氧化酶(LOx)、CAT及光敏剂吲哚菁绿(ICG)整合到Fe3O4负载的杂化纳米凝胶中.其中,乳酸氧化酶可以催化肿瘤组织中过量的乳酸盐底物产生H2O2,同内源性H2O2一起,被CAT催化产生稳定的O2纳米气泡,O2在808 nm激光的照射下,接受来自相邻激发态ICG的能量,转化为单线态氧,进行光动力治疗.同时,该纳米系统还可以进行芬顿反应原位产生羟基自由基,进行化学动力治疗[图8(C)].体内实验表明,该纳米系统可作为药物被动靶向肿瘤进行治疗.
磁热治疗是磁性纳米颗粒将外部磁场的能量转化为热量进而消融肿瘤细胞的方法.由于磁场巨大的组织穿透能力,MHT可以治疗较深深度的肿瘤.磁热治疗需要磁热转换效率优异的纳米材料,且目前的研究通常利用材料本身类酶活性或负载天然酶,协同其它治疗方式进行肿瘤的联合治疗.Ying等[151]将含有Fe2+的中空磁性氧化铁(HIONCs)刻蚀并包封GOx,构建了集饥饿-化学动力学-磁热3种治疗方法于一体的纳米系统.HIONCs具有过氧化氢酶活性,可以补充GOx在饥饿治疗中消耗的氧气,同时HIONCs存在的Fe2+可以进行芬顿反应促进活性氧的产生,进行化学动力治疗诱导细胞凋亡.磁性氧化铁固有的磁热转换性能在外加磁场的作用下可使局部温度升高,进行磁热治疗,并进一步增强了芬顿效应.
除了以上治疗策略,Wang等[66,87]还创新性地提出了一种新的癌症治疗方法——酶动力疗法(EDT).它是指充分利用肿瘤区域的酶催化反应,可控产生高细胞毒性的单线态氧来治疗癌症.Wu等[66]在Fe3O4表面通过酶切界面自组装形成了超分子纳米凝胶,并负载了SOD和氯过氧化物酶(CPO),在没有施加外部能量的情况下,可高效产生单线态氧治疗癌症[图8(D)].体内外实验均表明,该级联酶系统能够在肿瘤组织产生单线态氧,有效地诱导肿瘤细胞凋亡.此外,该级联反应还会产生O2,可用于超声成像,实现诊疗一体化.在此研究基础上,Zhang等[87]结合了物理和生化方法,在磁性纳米粒子(MNPs)表面包覆凝胶层并负载CPO,模拟先天免疫系统中的中性粒细胞来调控细胞命运.当该材料进入肿瘤细胞后,由于MNPs具有磁热效应,外界施加磁场时,肿瘤细胞的温度会升高,进而激活氧化应激反应,提高H2O2水平,此时凝胶层中负载的CPO可将H2O2持续转化为单线态氧,用于肿瘤治疗[图8(E)].研究发现在程序化交变磁场的作用下,肿瘤细胞内的H2O2和单线态氧均呈逐步增加的趋势,表明该系统兼具物理可激活性和酶催化可持续性,为时空调控治疗深层肿瘤提供了一种新方法.
3.2 慢性疾病治疗
高尿酸血症是一种由嘌呤代谢异常及不良生活方式等因素引起的疾病,是痛风的重要诱因[152,153].尿酸氧化酶可以催化尿酸氧化成易溶的尿囊酸,降低血清尿酸水平并抑制尿酸晶体的产生和沉积[154],目前已经开发了一系列基于尿酸酶的疗法来作为治疗高尿酸血症以缓解痛风的新兴策略.Xiong等[155]开发了一种纳米胶囊组装体,利用多个纳米胶囊负载尿酸氧化酶,显示出比游离尿酸酶更优异的催化活性和稳定性,可以有效地降低尿酸.值得注意的是,尿酸酶氧化过程中会产生H2O2,H2O2的积累会引起细胞内的氧化应激及关节损伤等问题,所以利用级联反应来依次消除尿酸和H2O2可以达到更好的治疗效果.Ming等[156]将Pd-Ru纳米酶、尿酸酶和红细胞膜进行集成,制备了一种用于高尿酸血症治疗的串联纳米反应器.该纳米反应器能利用尿酸酶将尿酸有效降解为尿囊素和H2O2,并利用具有CAT活性的Pd-Ru纳米片清除H2O2.更重要的是,H2O2被分解之后可以产生O2,反过来可以促进尿酸的的催化氧化.细胞实验和动物实验均表明,该纳米反应器具有生物安全性及较长的血液循环,可以实现高效的高尿酸血症治疗.Lin等[157]研究了Pt及其它铂族元素的尿酸酶活性和CAT酶活性,基于尿酸溶解的自级联催化效果,筛选出效果最好的Pt/CeO2纳米酶进行痛风的模拟酶治疗[图9(A)].

Fig.9 Enzyme-load nanocatalytic systems for chronic diseases treatment
糖尿病是一种以高血糖为特征的代谢紊乱[158],若未及时干预治疗,会引起心血管疾病、视网膜病变、肝肾脏疾病及神经系统疾病等多种并发症[159~162],因此,糖尿病标记物的检测和安全有效地响应性治疗对于人的健康管理十分重要.目前,胰岛素给药仍是治疗糖尿病的主要手段.在此过程中,设计胰岛素的可控释放系统至关重要.GOx具有优异的葡萄糖响应能力,因此很多研究将GOx与pH敏感材料相结合用于胰岛素可控释放系统的制备[163].Zhang等[164]用pH敏感的MOF封装GOx和胰岛素,当葡萄糖进入MOF空腔后,可以被GOx催化产生葡萄糖酸使pH值降低,进而引起MOF的降解,同时释放胰岛素进行血糖调节,体内实验结果表明,该系统可以使患Ⅰ型糖尿病的小鼠维持72 h的血糖正常水平.Li等[165]用pH敏感的多肽水凝胶基质负载GOx、CAT和胰岛素,用于胰岛素的可控释放,CAT还可以对GOx催化葡萄糖产生的副产物H2O2进行降解,同时提供GOx催化过程中所需的氧气.Fu等[166]则基于酶氧化方案制备了一种核壳结构的胰岛素可控递送纳米平台,以乙氧基缩醛衍生化的葡聚糖纳米颗粒作为内核,同时负载胰岛素及GOx和CAT,以红细胞膜衍生的囊泡作为外壳.其中,外壳上的葡萄糖转运蛋白具有血糖感知能力,促进葡萄糖的向内转运,激活内部GOx的催化反应,触发内核的降解行为及胰岛素的释放.值得注意的是,该平台集成了葡萄糖传感模块和胰岛素释放模块,可以实现即时响应治疗.
像肥胖、高血糖等此类能量代谢问题可以增加心血管病、肠胃道疾病和肾病的风险,酶纳米体系也有助于解决此类疾病.NO在很多病理和生理过程中起着重要的调节作用,可以保护心血管系统免受损伤[167],Li等[168]开发了一种由介孔SiO2壳包裹的Au纳米棒,经探究,该材料具有3种酶(还原型辅酶Ⅱ氧化酶、超氧化物歧化酶和一氧化氮合酶)的活性[图9(B)],可以将L-Arg转化为NO,用于持续可控递送NO实现心血管疾病的治疗和预防.在肠病治疗方面,Liu等[71]开发了一种由Mn基MOF和Pt纳米颗粒组成的级联纳米酶体系,该纳米酶可以表达SOD和CAT两种酶活性,可以有效缓解炎症型肠病.在该ROS清除系统中,两种类酶具有空间上分离的活性位点,同时又集成在同一个纳米酶中,动力学分析表明,这种纳米邻近效应大大提高了级联反应的效率,体外实验和炎症动物模型均证明,该体系具有ROS清除能力,有望用于体内抗炎治疗.
药物在体内的生物转化过程也容易引起体内器官的病变,尤其是肝脏、肾脏部位的活性氧积累.酶纳米催化体系在此类疾病治疗领域也崭露头角.如常见的镇痛药乙酰氨基酚摄入过量则会消耗肝脏中的谷胱甘肽,进而代谢产生过量的活性氧,导致肝细胞坏死[169].Li等[170]利用反胶束方法制备了铈纳米颗粒,并进行了改性,且进一步评估了该纳米酶的CAT和SOD酶活性,实验结果表明,该纳米酶比乙酰半胱氨酸具有更长的治疗时间窗口,在清除活性氧的同时具有抗炎作用,为药物诱导的肝损伤临床晚期治疗提供新的视角.顺铂类药物也容易引起肾损伤[171],Zhang等[172]制备了一种由聚乙烯吡咯烷酮修饰的超小型铱纳米颗粒,平均粒径为1~2 nm,同时具有CAT,POD和SOD 3种酶活性,可以在肾脏部位高度富集并发挥清除活性氧的功效,从而降低细胞对氧化应激损伤的敏感性.此外该种纳米酶的尺寸低于肾脏的过滤阈值[173],使其能够通过尿液排出,具有良好的生物安全性,证明该酶有临床治疗的转化潜力.类似的,Liu等[174]也开发了超小型RuO2纳米酶并用作急性肾损伤治疗[图9(C)],实验结果表明,该纳米酶可以有效清除活性氧,维持细胞内的氧化还原平衡.
此外,神经系统疾病作为一种侵害公共健康的慢性疾病,与多胺代谢的失调密切相关[175],近年来也备受关注.酶纳米体系在治疗此类疾病方面也显示出了巨大潜力.与前述疾病治疗机制类似,主要通过减轻氧化应激来保护细胞免受损失以缓解疾病.Feng等[176]详细探究了V2C的多酶(SOD,CAT,POD,HPO,TPx,GPx)模拟活性及相关抗氧化机制,评估了该酶的体内毒性和抗炎作用,并用该酶对帕金森病小鼠进行处理,探索其治疗效果.结果表明,该酶具有优异的抗炎作用,并能显著保护小鼠免受神经毒性损害.Ma等[177]制备了一种介孔普鲁士蓝纳米酶,发现其对·OH,·O2-和H2O2具有明显的清除作用,进而可以抑制炎症小体活化,并减轻外源性诱导的线粒体功能障碍,从而抑制神经元的焦亡,但具体机制尚未研究清晰.Feng等[89]也进行了基于普鲁士蓝的多酶催化活性在保护神经元方面的探究,并使用中性粒细胞样膜包裹,提高了纳米颗粒靶向递送到受损大脑的效率,拓宽了纳米酶治疗神经系统疾病的应用.
尽管目前纳米酶在疾病治疗领域蓬勃发展,但要实现真正的临床转化,仍面临着很多挑战,疾病的发病机理错综复杂,需要医学、工科及理学多学科研究者的共同努力.
4 总结与展望
近年来,构建仿生细胞结构的载酶催化纳米材料得到了广泛的开发和利用,由于其高效的催化活性、出色的光/磁-热转换性能、灵敏的环境响应性和特异的靶向能力,在生物成像和疾病治疗领域潜力巨大.本文对氧化还原酶纳米体系在疾病诊疗方面的应用进行了总结,从酶的催化过程出发,推进到酶纳米体系的构建,随后着重讨论了近几年酶催化纳米材料在响应性成像和疾病治疗方面的具体应用.
虽然酶催化纳米材料在疾病诊疗领域的研究取得了长足的发展,但其仍面临诸多挑战:(1)酶学理论尚不完善.天然酶的催化机制已被广泛研究,但很多模拟酶的催化机制、电子转移等并未深入探讨,目前也未形成一个完整的理论体系;(2)酶与纳米载体的构效关系尚不明确.目前的研究多关注于材料的构建和功能表现,而酶纳米系统的研究是个“黑盒”,内部成分互相作用的客观规律有待进一步探究;(3)酶纳米系统的生物效应仍待进一步评估.该类体系进入动物体内的稳定性和生物安全性需要进一步研究,尤其是涉及模拟多酶的体系,如何进行材料设计调控酶的活性,使其特异性表达,如何规范合成策略使其规模化应用,这些问题的解决对真正实现临床应用具有重大意义.
—— “T”级联

