濒危植物辐花苣苔与同属2种植物光合生理特性的比较
欧明烛,安明态,任启飞,汤升虎,刘芳,马菁华,陈云飞
1.贵州大学林学院,贵阳 550025; 2.贵州省植物园,贵阳 550004
珍稀植物的濒危机制及保护策略研究是植物多样性保护的重点工作之一。植物濒危的进程是该物种的竞争力及其对立地条件适应力等互作的生态过程[1],然而植物的竞争力和适应力与其本身的生物学特性紧密相关[2]。光合作用是植物有机物质形成的基础,对植物生长发育起着至关重要的作用[3],光合生理能反映植物的生长策略和对资源的获取与利用能力,是植物与立地环境互作的体现。植物光合日变化与响应曲线是衡量植物光合能力的重要指标,叶绿素荧光参数能反映植物光合作用的“内部”特征,揭示植物叶片的光合特性[4]。
苦苣苔科(Gesneriaceae)植物多为多年生草本,我国苦苣苔科植物在喀斯特地貌地区分布较多,是特化适应石灰岩地貌的一个重要类群,具有重要的观赏价值[5]。该科植物多分布于热带及亚热带荫蔽潮湿区域,多数植株或生长在岩石壁上,或见于林下斜坡,具有极强的耐荫性[6],开展该科植物的光合特征研究有助于了解其光照需求,是解析其光环境适应机制的重要途径[7]。辐花苣苔(Oreocharis esquiro⁃lii)是多年生草本,花冠紫色或蓝色,花期8月,因其花辐射对称被收录在单型属辐花苣苔属(Thamno⁃charis)中[8],2011年被并入广义马铃苣苔属(Oreo⁃charis)[9-10],为国家一级重点保护野生植物,极狭域分布在海拔1 500~1 600 m的林下岩石上,它的存在对于研究贵州喀斯特环境演变与生物多样性起源及进化具有重要作用。近年来,辐花苣苔居群及栖息地面积有明显的下降趋势,这说明了它对环境要求的严格程度及自身对环境适应的脆弱性。我们前期的调查表明,辐花苣苔生长在郁闭度极高的林下岩石表面[11],生境的光限制或其自身的光合能力或许是影响因素之一。都匀马铃苣苔(O. duyunensis)和紫花粗筒苣苔(O. elegantissima)与辐花苣苔同系广义马铃苣苔属植物,其中都匀马铃苣苔为特产于贵州的苦苣苔科植物新种,野外分布在海拔580~1 100 m的山坡林下岩石上,花冠钟状细筒形、蓝紫色,花期8月[12]。紫花粗筒苣苔产于贵州、重庆,分布于海拔约600 m的潮湿悬崖上,花冠粗筒状,紫色,花期8月[8],在开展苦苣苔科植物保育的工作中,我们发现都匀马铃苣苔和紫花粗筒苣苔在保育地具有较好的适应能力,且它们的生长物候特征与辐花苣苔较为一致。
在相同的生态条件下濒危植物通常表现出生存力及适应力较差的共同特征,而多数濒危植物的生理代谢速率,如光合速率、呼吸速率和蒸腾速率亦低于非濒危近缘种[13]。开展濒危植物与同属非濒危植物光合生理生态特性差异的研究,以濒危植物所表现出的独特生理生态特征,找出其可能存在与周围环境不相适应的特性,有助于阐明其濒危的内在机制,从而为制定保护方案提供科学依据。为研究濒危物种辐花苣苔光合作用能力,进一步阐释其濒危机制,本研究以其同属非濒危植物紫花粗筒苣苔和都匀马铃苣苔为对照,在同等栽培环境中开展植物光合生理特性的比较,以期为揭示辐花苣苔的濒危机制及进一步制定保护策略提供科学依据。
1 材料与方法
1.1 研究材料概况
试验地为中国苦苣苔科植物保育中心(贵州),位于贵州省贵阳市,贵州省植物园内(106°42′E,26°34′N),海拔约1 300 m,年均气温15.3 ℃,相对湿度约为74%,年平均总降水量为1 174.7 mm。辐花苣苔、紫花粗筒苣苔和都匀马铃苣苔均为中国苦苣苔科植物保育中心繁殖栽培的成熟植株。试验时3种植物分别选择长势良好一致的植株3~4株,标记健康成熟的叶片作为测试叶,测定时保持叶片自然生长角度不变,每株植物重复测定3次。
1.2 研究方法
1) 叶绿素含量测定。摘取健康功能叶片用于叶绿素含量测定,测定及计算参考Lichtenthaler等[14]的方法。
2) 叶绿素荧光参数测定。测定时间在2021年8月,选择晴朗天气的上午(08:30-11:30), 使用OP‑TI-sciences公司的OS-5p+便携式脉冲调制叶绿素荧光仪测定,随机选择生长状况良好且相对一致植株,每株选取3~4片功能叶,每个功能叶重复测定4次,记录各项数据。在自然光下适应20 min后测定叶绿体光系统Ⅱ实际光化学量子产量Y(Ⅱ)、表观电子传递速率(electron transportation rate,ETR)。
3)光合日进程观测。选择晴朗天气的08:00-18:00时,在保育基地自然环境条件下,采用美国LI-COR公司的Li-6800便携式光合仪,测定3种植物叶片的光合日变化。每种植物选取长势一致的3~4片功能叶,1 h测1次。测定的主要参数包括净光合速率(Pn)、蒸腾速率(E)、胞间CO2浓度(Ci)、气孔导度(Gs)、饱和水汽压亏缺(vapor pres‑sure deficit,VPD)等。
4)光响应曲线测定。选择晴朗天气的09:00-11:30测定,测定前对待测叶片进行充分光诱导,设定叶室温度28 ℃,叶室相对湿度60%,气体流速为500 μmol/s,CO2浓度为400 μmol/mol(用CO2小钢瓶控制浓度),设置0~1 500 μmol/(m2·s)的14个光合有效辐射强度(photosynthetically active radiatio,PAR)梯度进行测定,各处理稳定2~3 min后记录数据,重复3次,取平均值。根据R语言软件(R version 4.1.1,新西兰)采用非直角双曲线模型对光合光响应曲线进行拟合[15]。
5)CO2响应曲线测定。与测定光响应曲线的条件相同,测定前控制光强为600 μmol/(m2·s),CO2浓度为400 μmol/mol,对待测叶片进行诱导20 min,设置10~2 100 μmol/mol 的9个CO2浓度梯度,测定叶片净光合速率Pn对CO2浓度的响应,采用FvCB模型对光合CO2响应曲线进行拟合,并计算最大羧化速率(vcmax)和最大光合电子传递速率(Jmax)[16]。
6)叶片解剖结构。将测定光合作用的叶片摘下,制作石蜡切片[17],并用Nikon Eclipes E100光学显微镜(日本)观察和拍照,用Image J软件(1.8.0,美国)测定叶片各项指标。
1.3 数据处理
试验数据均采用Excel 2007和SPSS 13.0分析处理,LSD法进行差异显著性检验,采用Origin Pro(2017C SR2b.4.2.380)进行相关图表制作。
2 结果与分析
2.1 光合色素含量及荧光特性比较
1)光合色素含量。3种植物的光合色素含量如表1所示,辐花苣苔的叶绿素a及(叶绿素a+叶绿素b)显著低于紫花粗筒苣苔(P<0.05),与都匀马铃苣苔差异不显著;3种植物的叶绿素b及类胡萝卜差异不显著;辐花苣苔的叶绿素a/叶绿素b显著低于紫花粗筒苣苔和都匀马铃苣苔(P<0.05)。
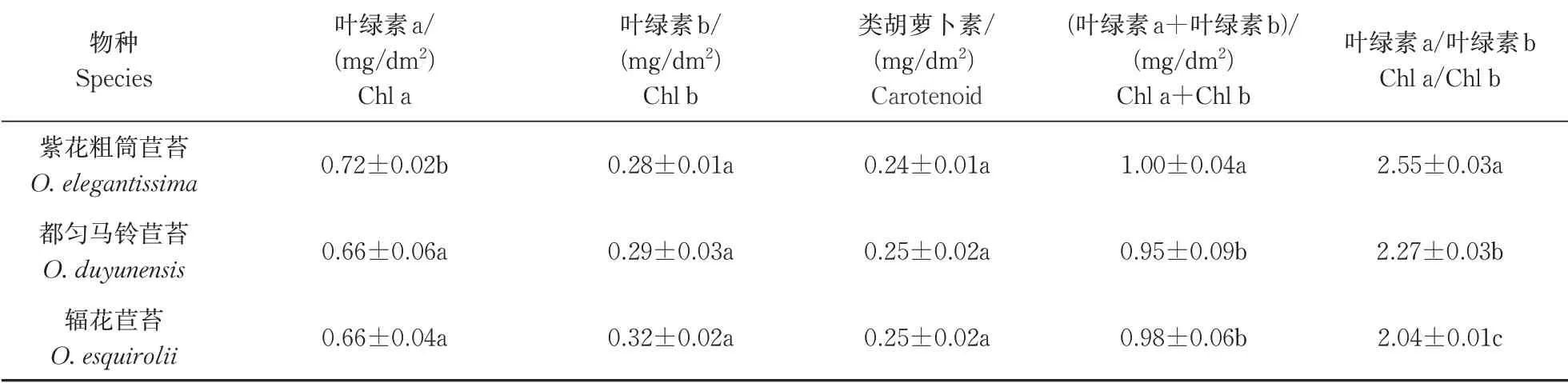
表1 叶片光合色素含量Table 1 Leaf photosynthetic pigment content
2) 叶绿素荧光参数。由图1可见,辐花苣苔的初始荧光(Fo)为320.5 μmol/(m2·s),显著高于紫花粗筒苣苔和都匀马铃苣(P<0.05),最大光化学效率(Fv/Fm)、PSⅡ潜在光学活性(Fv/Fo)、实际光化学量子产量Y(Ⅱ)、表观电子传递速率(ETR)在3种植物中为最小,且Fv/Fm和Y(Ⅱ)显著低于同属另外2种植物(P<0.05),辐花苣苔的Fv/Fo显著低于紫花粗筒苣苔(P<0.05),但与都匀马铃苣苔差异不显著;最大荧光(Fm)和表观电子传递速率(ETR)与同属另2种植物差异不显著。

图1 辐花苣苔与紫花粗筒苣苔和都匀马铃苣苔的叶片叶绿素荧光参数比较Fig. 1 Comparison of chlorophyll fluorescence parameters in leaves of O. esquirolii between O. elegantissima and O. duyunensis
2.2 光合日进程及参数比较
3种植物的净光合速率(Pn)日变化呈现出较一致的双峰曲线特点(图2A),Pn值均在11:00时呈现第1个明显的峰值,随后Pn急剧下降,在15:00时有所回升,呈现第2个微峰值,在日落18:00降为最低。3种植物的光合作用主要在上午进行,在15:00会有1个小的峰值,但是总体明显低于12:00前的光合作用。3种植物相比,辐花苣苔的日均Pn值[0.31 μmol/(m2·s)]为最低,相对波动幅度最小,紫花粗筒苣苔的Pn值[1.47 μmol/(m2·s)]为最高,波动幅度最大。
3种植物的胞间CO2浓度(Ci)趋势大致呈“W”型,辐花苣苔和都匀马铃苣苔Ci的第1个波谷是在上午11:00,而紫花粗筒苣苔Ci的第1个波谷是12:00,3种植物Ci的第2个波谷均出现在下午15:00,3种苦苣苔在上午11:00-12:00以及下午15:00时光合作用较强且呈现出辐花苣苔>都匀马铃苣苔>紫花粗筒苣苔的趋势(P<0.05,图2B)。
气孔导度(Gs)随时间推移呈下降趋势,14:00出现短暂升高后下降,呈现都匀马铃苣苔>紫花粗筒苣苔>辐花苣苔的趋势,且辐花苣苔的Gs值显著低于同属另2种植物(P<0.05,图2C)。
蒸腾速率(E)在12:00降到较低点,期间上升到14:00至最大值,说明3种植物在12:00出现短暂的休眠,E大小依次为都匀马玲苣苔>紫花粗筒苣苔>辐花苣苔(P<0.05,图2D)。
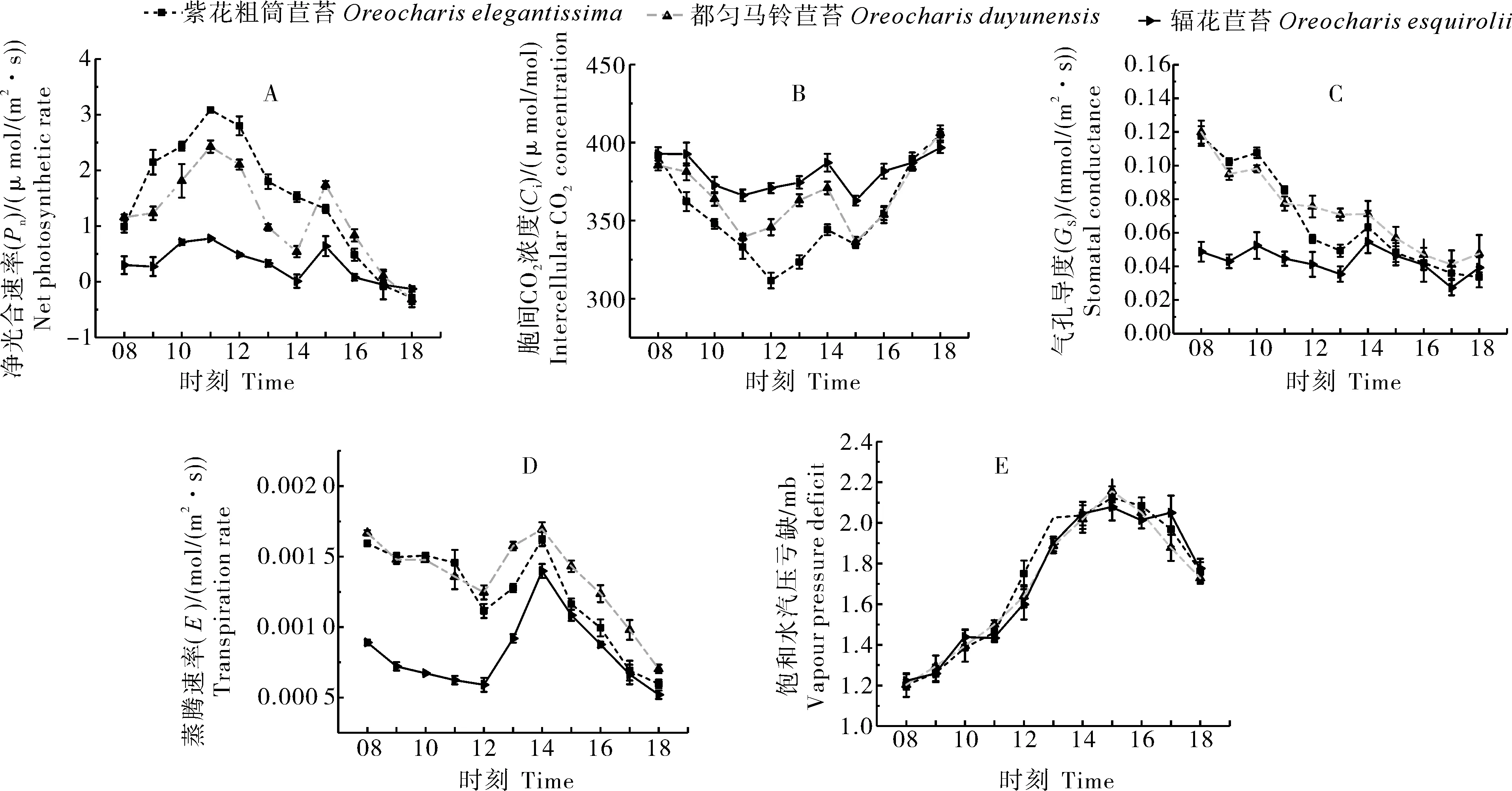
图2 辐花苣苔与紫花粗筒苣苔和都匀马铃苣苔的叶片光合日变化参数比较Fig. 2 Comparison of diurnal variation parameters of leaf photosynthesis between O. esquirolii between O. elegantissima and O. duyunensis
3种植物的饱和水汽压亏缺(VPD)趋势基本一致,呈单峰型,VPD最小值均出现在08:00,最大值均出现在15:00(图2E)。
2.3 响应曲线及特性参数比较
1) 光响应曲线。光响应曲线反映了植物光合速率随光强改变而变化的规律。如图3所示净光合速率(Pn)随着光合有效辐射的升高而增加,当光照强度达到饱和点后,Pn增长曲线变化趋于平缓。主要光合特性参数指标如表2所示,辐花苣苔叶片Pnmax为2.24 μmol/(m2·s),显著低于都匀马铃苣苔的4.98 μmol/(m2·s)和紫花粗筒苣苔的7.01 μmol/(m2·s) (P<0.05);暗呼吸速率Rd和光补偿点LCP均值分别为1.14 μmol/(m2·s)和51.85 μmol/(m2·s),显著高于紫花粗筒苣苔和都匀马铃苣苔(P<0.05);光响应曲线光饱和点LSP均值为294.47 μmol/(m2·s) (P<0.05),显著低于紫花粗筒苣苔的427.15 μmol/(m2·s),与都匀马铃苣苔的277.02 μmol/(m2·s)差异不显著。
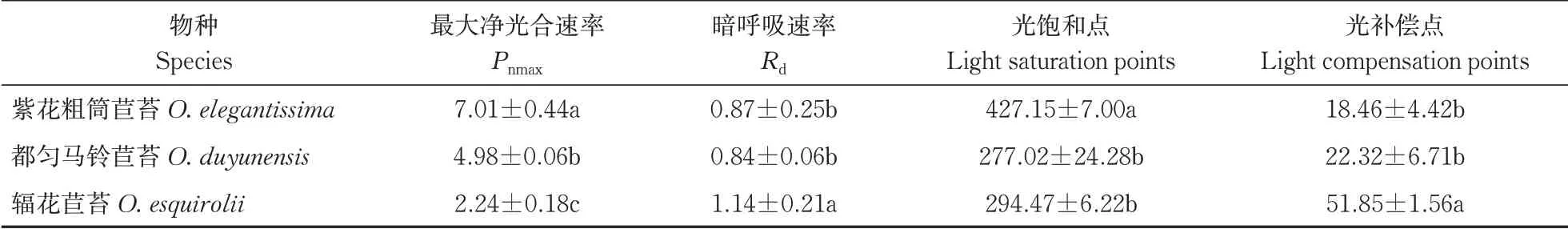
表2 3种植物叶片光响应曲线特征参数Table 2 Leaf light response curve characteristic parameters μmol/(m2·s)
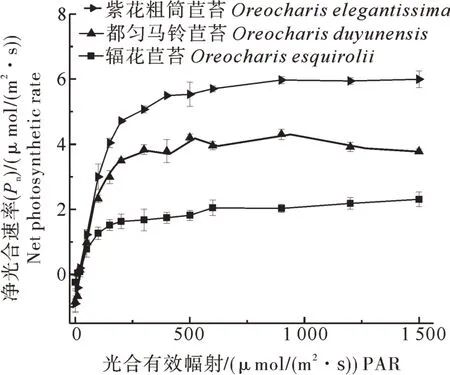
图3 辐花苣苔与紫花粗筒苣苔和都匀马铃苣苔的叶片光响应曲线Fig. 3 Light response curve of leaves of O. esquirolii between O. elegantissima and O. duyunensis
2)CO2响应曲线。通过拟合得到光合CO2响应曲线(图4),由图4可见,在CO2浓度为0~1 800 μmol/mol时,叶片净光合速率Pn随CO2浓度升高而增大;当CO2浓度超过1 800 μmol/mol时,3个物种的光合CO2响应曲线趋于平缓。由表3可知,辐花苣苔的最大羧化速率(vcmax)为7.63 μmol/(m2·s),显著低于紫花粗筒苣苔的30.25 μmol/(m2·s)和都匀马铃苣苔的19.90 μmol/(m2·s),最大光合电子传递速率(Jmax)为26.04 μmol/(m2·s),也显著低于紫花粗筒苣苔和都匀马铃苣苔(P<0.05)。

表3 3种植物叶片CO2响应曲线模拟的光合参数Table 3 Photosynthetic parameters simulated by leaf CO2 response curve μmol/(m2·s)
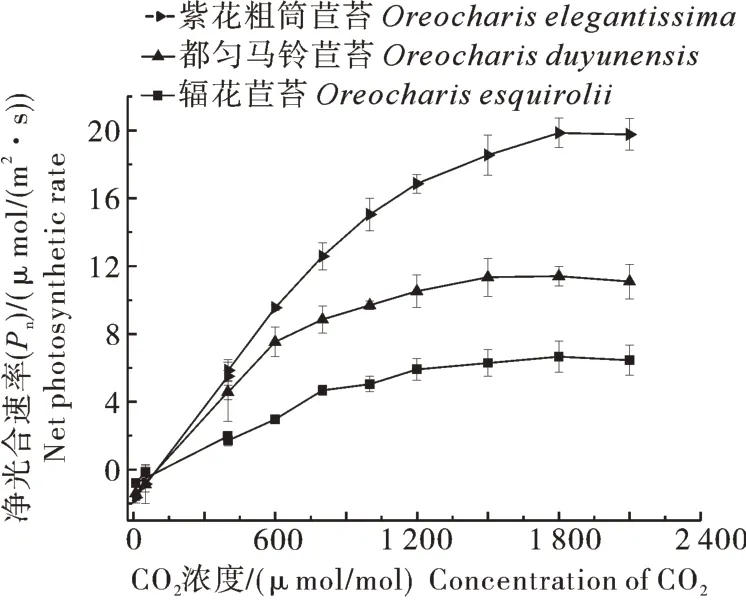
图4 辐花苣苔与紫花粗筒苣苔和都匀马铃苣苔的叶片CO2响应曲线Fig. 4 CO2 response curves of leaves of O. esquirolii between O. elegantissima and O. duyunensis
2.4 叶片解剖结构的比较
经光学显微镜观察,辐花苣苔的横切结构与紫花粗筒苣苔和都匀马铃苣苔存在较大差异,叶表面的绒毛密度较大,栅栏组织细胞较少(图5)。解剖结构参数见表4,辐花苣苔平均叶片厚度(LT)为304.48 μm,显著低于另2种植物(P<0.05);上表皮厚(UE)为37.80 μm,显著大于紫花粗筒苣苔(P<0.05);下表皮(LE)为38.09 μm,显著大于都匀马铃苣苔(P<0.05);栅栏组织厚度(PT)和海绵组织厚度(ST)分别为40.79和30.07 μm,均显著低于另外2种植物(P<0.05);3种植物组织密实度(PT/LT)和组织疏松度(ST/LT) 差异不显著。由此可知,辐花苣苔UE、LE较厚,PT和ST较薄,这可能与辐花苣苔长期生长在荫蔽且土壤极薄的岩壁上的贫瘠生境有关。
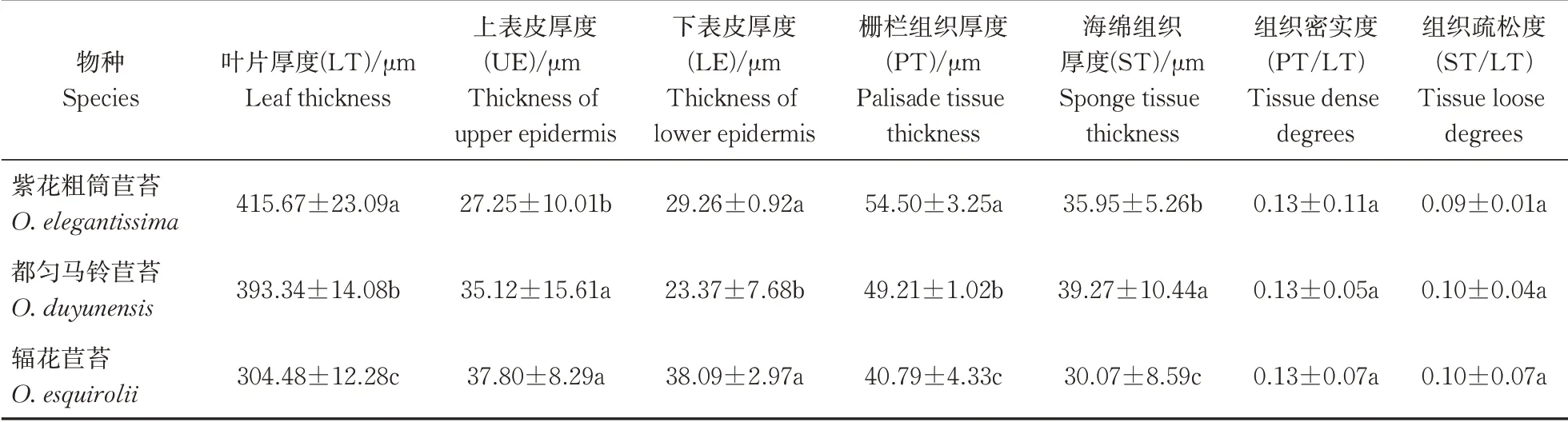
表4 叶片解剖参数Table 4 Leaf anatomical parameters

图5 紫花粗筒苣苔(A)、都匀马铃苣苔(B)与辐花苣苔(C)的叶片解剖结构比较Fig. 5 Leaves anatomical comparison of O. elegantissima (A), O. duyunensis(B) and O. esquirolii(C)
3 讨论
叶绿素a与叶绿素b具有捕获和吸收光能的作用,是植物光合作用的物质基础,其含量和比值反映植物适应和利用环境因子的重要指标。类胡萝卜素等在弱光条件下辅助提高对总光量子的吸收[18-19]。本研究中辐花苣苔的叶绿素a及(叶绿素a+叶绿素b)含量显著低于紫花粗筒苣苔(P<0.05),与都匀马铃苣苔差异不显著;辐花苣苔的(叶绿素a+叶绿素b)含量显著低于紫花粗筒苣苔和都匀马铃苣苔(P<0.05)。初步表明辐花苣苔对光能的吸收能力以及强光下的光保护能力较弱,而紫花粗筒苣苔对环境下的强光具有更强的适应能力。
叶绿素荧光参数作为评价植物光合能力的重要指标,对研究植物光系统及其电子传递过程起重要作用[20]。PSⅡ最大光化学效率(Fv/Fm)能反映叶绿素吸收光量子以及被过强光量子破坏的程度,Fv/Fo值是反映植物光合作用过程中潜在光化学活性的重要参考指标。本研究中,模拟生境下的紫花粗筒苣苔的PSⅡ最大光化学效率Fv/Fm值最大,未受到光抑制的影响[21-22],紫花粗筒苣苔的PSⅡ潜在光化学活性Fv/Fo值显著大于辐花苣苔和都匀马铃苣苔,辐花苣苔的叶绿体光系统Ⅱ实际光化学量子产量(Y(Ⅱ))及表观电子传递速率(ETR)显著低于其他2种苦苣苔,表明了辐花苣苔植株体内电子信号的传导受抑制程度较高,进一步说明与紫花粗筒苣苔和都匀马铃苣苔植物相比,辐花苣苔对生境的适应能力较低。
光合作用日变化是衡量植物内在节律及对环境适应能力的重要指标,通常表现为“单峰”和“双峰”型[23]。气孔与非气孔因子是导致光合作用下降的重要因素,由胞间CO2浓度及其变化作为主要依据[24]。饱和水汽亏缺压(VPD)在全球温度持续升高的趋势下而增加[25]。VPD增加会显著影响植株生长和发育过程,如增加蒸腾速率、降低净光合速率、减小植株体内一些酶的活性等,这个过程是不可逆转的[26-27]。本研究结果显示,3种植物的净光合速率(Pn)日变化呈现出较一致的双峰曲线特点,均在11:00时呈现第1个明显的峰值,在下午15:00时呈现第2个微峰值;胞间CO2浓度大致呈“W”型,第1个波谷出现在12:00,第2个波谷均出现在下午15:00;蒸腾速率在12:00降到较低点,均呈现出辐花苣苔最低的特点,3种植物均出现明显的光合“午睡”现象,说明3种植物对高温强光的适应能力较低,且可能是由植物的气孔限制因素引起,导致影响植株体内碳积累过程并导致光合速率降低。在3种植物中辐花苣苔的各项光合指标均为最低,说明辐花苣苔的光合能力最弱。
光响应曲线中最大净光合速率(Pnmax)是衡量叶片光合能力的重要指标。判断植物耐荫性的重要指标主要是叶片的光饱和点和光补偿点,也反映了植物在生境中对光照条件的要求,3种马铃苣苔属植物叶片的LSP为427.15~294.47 μmol/(m2·s),LCP为18.46~51.85 μmol/(m2·s),符合阴性植物光饱和点与光补偿点的特征[28],有较低的暗呼吸速率(Rd)和光补偿点(LCP)是植物能够适应弱光环境并获取最大物质收益适应性策略的标志[29-30]。CO2通过抑制呼吸作用及增加与羧化酶活性位点的结合来提高植物光合能力[31]。最大羧化速率(vcmax)与羧化酶活性有显著相关性[32],其大小主要受到叶片内部羧化酶活性和数量的影响;最大电子传递速率(Jmax)的降低会使叶片的vcmax受到限制,是因为降低后的电子传递速率会限制光合磷酸化和还原辅酶Ⅱ(NADPH)的再生[33]。本研究发现,辐花苣苔的最大净光合速率(Pnmax)显著低于同属其他2种苦苣苔,光补偿点(LCP)显著高于紫花粗筒苣苔和都匀马铃苣苔,说明辐花苣苔对弱光的利用率较低,可能是此物种极度濒危的因素之一,紫花粗筒苣苔叶片的光饱和点(LSP)值较高,对强光的适应能力相对较强(表3),紫花粗筒苣苔的vcmax与Jmax显著高于都匀马铃苣苔与辐花苣苔,表明紫花粗筒苣苔在羧化阶段RuBP再生能力更强,能更适应环境并利用光能进行碳同化,提升光合作用能力。
已有的研究表明,叶片适应弱光环境的生理特性主要为表皮厚度减小、栅栏组织及海绵组织发达[34]。影响叶片厚度的内部因素是植物叶片内的细胞体积,外部因素是对水分及营养的吸收,研究表明植株生长需要有较厚的表皮细胞及发达的栅栏组织保持其内部水分[35-36]。栅栏组织厚度与海绵组织厚度可以作为判断植物生产力强弱的指标,栅栏组织与海绵组织越厚,越有利于提高光合利用率,光合能力越强[37-38]。上下表皮的厚度决定了植株能否有效避免强光对叶肉细胞的灼伤及有效地进行气体交换,植物叶片的组织结构密实度、组织结构疏松度与水分利用率是反映植物适宜强光照射程度的重要指标[39]。在叶片解剖结构中,辐花苣苔叶毛密度大于紫花粗筒苣苔和都匀马铃苣苔,有利于增强光合作用能力(图5),辐花苣苔叶片厚度、栅栏组织厚度与海绵组织厚度显著低于紫花粗筒苣苔和都匀马铃苣苔,与净光合速率的趋势一致,表明辐花苣苔对弱光环境的适应能差,光能利用率低。
综上,3种植物的光合生理特性与叶片结构之间的差异,反映其适应外界生态环境调节机制的差异。作为国家一级保护的珍稀濒危植物辐花苣苔各项光合指标整体低于同属的非濒危植物紫花粗筒苣苔与都匀马铃苣苔,对环境的适应能力最弱,这可能是其濒危的主要内在因素之一。

