火龙果HpGST基因克隆及表达分析
屠凯,文晓鹏,张惠敏,申洛男
贵州大学生命科学学院/农业生物工程研究院/山地植物资源保护与保护种质创新教育部重点实验室,贵阳 550025
谷胱甘肽S-转移酶(GSTs)是一种普遍存在的参与多种细胞功能的蛋白,参与植物花青苷运输与定位。花青素的运输需要与GSH结合才能运输到液泡中,而谷胱甘肽泵能够识别与GSH结合标记的内源底物并将它们定位到合适部位[1]。在苹果中,MdGSTF3基因的表达与果实不同组织花青苷的积累和分布密切相关[2]。在葡萄中,葡萄果皮和果肉花青苷的积累与GST相关[3],GST参与小泡运输花青苷[4],并且在葡萄中,葡萄ATP结合蛋白ABCC1运输花青苷依赖于谷胱甘肽的含量[5]。
火龙果(Hylocereus)为仙人掌科(Cactaceae)量天尺属(Hylocereusundatus)果树,因其富含甜菜素而具有很高的经济价值,被贵州省列为重点支持的特色产业[6]。研究表明,甜菜素是以酪氨酸为起始底物,经众多酶促反应和自发反应合成,其关键酶是酪氨酸羟化酶和4,5-多巴双加氧酶[7]。虽然甜菜素合成通路日渐清晰,对于甜菜素合成后的运输机制尚不清楚。火龙果的主要色素是甜菜素而不是花青素,鉴于GST在植物中参与花青苷运输与定位的重要作用,火龙果GST是否参与甜菜素的运输与定位?为探究这一科学问题,本研究克隆火龙果HpGST基因的cDNA全长序列,分析HpGST在火龙果不同组织和发育时期的表达情况,测定相应时期和组织中甜菜素含量,进而对该基因表达与甜菜素含量间的相关性进行分析,旨在全面认识HpGST基因在火龙果甜菜素代谢过程中的分子机制, 为通过基因工程手段对果实色泽性状进行定向改良提供新信息。
1 材料与方法
1.1 试验材料
选取贵州省罗甸县火龙果种植基地紫肉(紫红龙)、粉肉(粉红龙)、白肉(晶红龙)类型适龄植株挂牌标记,每种色泽类型品种选3株,采集开花后10、20、25、26、27、30 d果实,并分别标记为S1(10 DAF)、S2(20 DAF)、S3(25 DAF)、S4(26 DAF)、S5(27 DAF)、S6(30 DAF)。每个采样时期从3株植株各采1果,经清水洗净后液氮速冻,并置于-80 ℃超低温冰箱备用。
1.2 总RNA提取与cDNA合成
取约0.2 g样品经液氮速冻充分研磨后,采用多糖多酚植物RNA提取试剂盒(张家口赛诺生物科技有限公司),根据说明书操作步骤提取果实总RNA,利用全波长扫描酶标仪(Thermo Fisher)和1%琼脂糖凝胶电泳检测总RNA的浓度和质量;利用TaKa‑Ra公司反转录试剂盒(PrimeScriptTMTR reagent Kit with gDNA Eraser)进行反转录,合成cDNA第1链。
1.3 基因克隆
根据HpGST基因序列,使用Prism 5.0本地软件设计特异性引物(表1)。利用 PrimeSTAR HS DNA Polymerase (TaKaRa, 大连)高保真酶进行 PCR 扩增,PCR反应条件为:98 ℃变性10 s,61 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min;4 ℃保存。扩增采用10 μL体系,包括5 μL PrimerSTAR Buffer、3.5 μL ddH2O、0.5 μL正 向 引物、0.5 μL反向引物、0.5 μL cDNA模板。产物用1%琼脂糖凝胶电泳检测后,目的片段胶回收后与Blunt克隆载体连接并转化大肠杆菌感受态中,送生工生物工程(上海)股份有限公司测序。
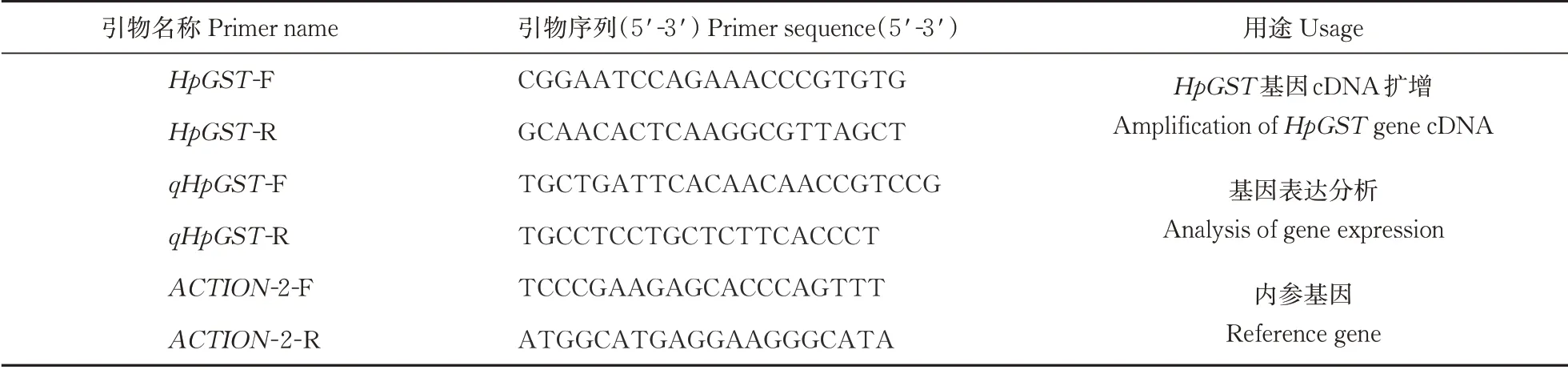
表1 火龙果HpGST基因克隆的相关引物。Table 1 Primers used for HpGST gene cloning in pitaya fruit
1.4 基因生物信息学分析
利用美国国家生物技术信息中心(National Cen‑ter for Biotechnology Information,NCBI)进行核苷酸和氨基酸序列比对及保守结构域分析;使用MEGA 8.0 软 件构 建 系统 发 育树;使 用Expasy(https://www.expasy.org/resources/protparam)在线分析软件预测蛋白质的理化性质和亲疏水性;TMHMM Serv‑er2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)在线软件分析蛋白质的跨膜结构域;使用Cell-PLoc 2(http://www.csbio.sjtu.edu.cn/bio‑inf/Cell-PLoc-2/)预测蛋白质的亚细胞定位,GOR4(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_gor4.pl)预测蛋白质二级结构。
1.5 RT-PCR分析
根据笔者所在课题组前期获得的火龙果转录组数据[8]中的HpGST基因序列,设计荧光定量引物,qHpGST-F和qHpGST-R(表1),以ACTION-2为内参,分别设计其特异性引物ACTION-2-F、ACTION2-R(表1),采用2-△△Ct法分析相对表达量。
1.6 甜菜素提取和测定
参考曾灿彬[9]的方法并进行改进。准确称取不同色泽类型品种及不同发育时期火龙果果肉0.2 g,经液氮研磨,利用80%乙醇提取甜菜素,在紫外分光光度计上分别于波长538、470 nm处测定甜菜红素和甜菜黄素吸光度并计算其含量。
2 结果与分析
2.1 HpGST基因克隆与生物信息学分析
将提取的火龙果总RNA反转录获得火龙cDNA,以火龙果cDNA为模板,利用引物HPGST-F和HPGST-R(表1)扩增得到1条500~900 bp的特异性条带。利用ExPaSy-Protparam预测HpGST蛋白分子质量为2.5 ku,理论等电点为7.02。编码氨基酸包含了20种常见氨基酸。其中赖氨酸含量最高,达到10%。分子式为C1193H1834N304O326S7。蛋白不稳定系数为44.46,属于不稳定蛋白。利用TMHMM-2.0分析跨膜结构域,发现该蛋白不具有跨膜结构域,推测其在膜外发挥作用。利用在线分析软件Cell-PLoc 2.0分析蛋白的亚细胞定位,发现该基因主要定位于细胞质。利用ExPASy的ProtScale程序分析火龙果HpGST编码蛋白疏水性和亲水性,结果显示,该蛋白质属于亲水性蛋白。通过GOR 4在线分析软件对HpGST蛋白进行二级结构预测,其中α-螺旋占该蛋白的比例最高为33.94%,不规则卷曲所占比例为46.15%,延伸链所占比例为19.91%(图1)。
使用NCBI的CDD在线分析软件对HpGST进行蛋白质保守结构域预测,结果(图2)显示,该基因编码蛋白含有GST_N_Tau和GST_C_Tau的保守结构域,第1个保守结构域由第6~80个氨基酸之间的74个氨基酸组成,第2个保守结构域由第91~214个氨基酸之间的123个氨基酸组成,并将该编码蛋白命名为HpGST。

图 2 火龙果HpGST保守结构域分析Fig. 2 Conserved domain analysis of HpGST in pitaya
使用NCBI的BlastP在线分析软件进行在线比对,在蛋白质序列库中对HpGST进行同源性检索和比对分析。获取来自藜麦(Chenopodium quinoa)、甜菜亚种(Beta vulgarissubsp.vulgaris)、菠菜(Spina⁃cia oleracea)、阿尔巴尼亚牧豆(Prosopis alba)等8种植物的15个蛋白氨基酸序列。利用MEGA7.0软件将HpGST蛋白与这15个GST蛋白序列进行多重序列比对并构建系统进化树(图3)。结果显示:火龙果HpGST蛋 白 与 藜 麦(XP_021720754.1、XP_021715456.1、XP_021746029.1、XP_021715455.1),甜菜亚种(XP_010594823.1),菠菜(XP_021839481.1,XP_021866921.1)亲缘关系最近,与阿尔巴尼亚牧豆(XP_028752413.1、XP_028752382.1、XP_028752391.1、XP_0288045421.1)亲 缘 关 系较远。
使用DNAMAN8.0将HpGST的氨基酸序列与亲缘性较近的几个物种的GST氨基酸序列进行多重比对(图4),结果显示,HpGST蛋白与其他物种的GST蛋白的氨基酸序列同源性比较高,其中与藜麦(XP_021720754.1、XP_021715456.1、XP_021746029.1、XP_021715455.1)相 似 性 分 别 为81%、81.02%、79.64%、76.50%,与甜菜亚种(XP_010594823.1)相似性 为77.98%,与 菠 菜(XP_021839481.1、XP_021866921.1)相似性为71.15%和71.61%。
2.2 HpGST的表达分析
利用qRT-PCR分析HpGST在火龙果不同色泽类型品种、不同发育期果肉中的表达情况,表达结果(图5A)显示,在有色果肉中S3期开始表达量明显上升,紫肉S3期表达量是S2期表达量的9.96倍,粉肉中则是5.54倍。而白肉中直到S4期表达量才显著上升,且表达量整体上较低。此外,紫肉火龙果中基因表达量变化早于粉肉火龙果;紫肉火龙果S4期表达量是S3期表达量的3.32倍且两者差异明显,S5期表达量是S4期表达量的3.80倍且两者差异明显。而粉肉火龙果中S4期表达量是S3期表达量的1.37倍,两者差异不明显,S5期表达量是S4期表达量的12.0倍且2个时期差异显著。而对应时期白肉中表达量则分别是0.99和0.48且表达量较低。
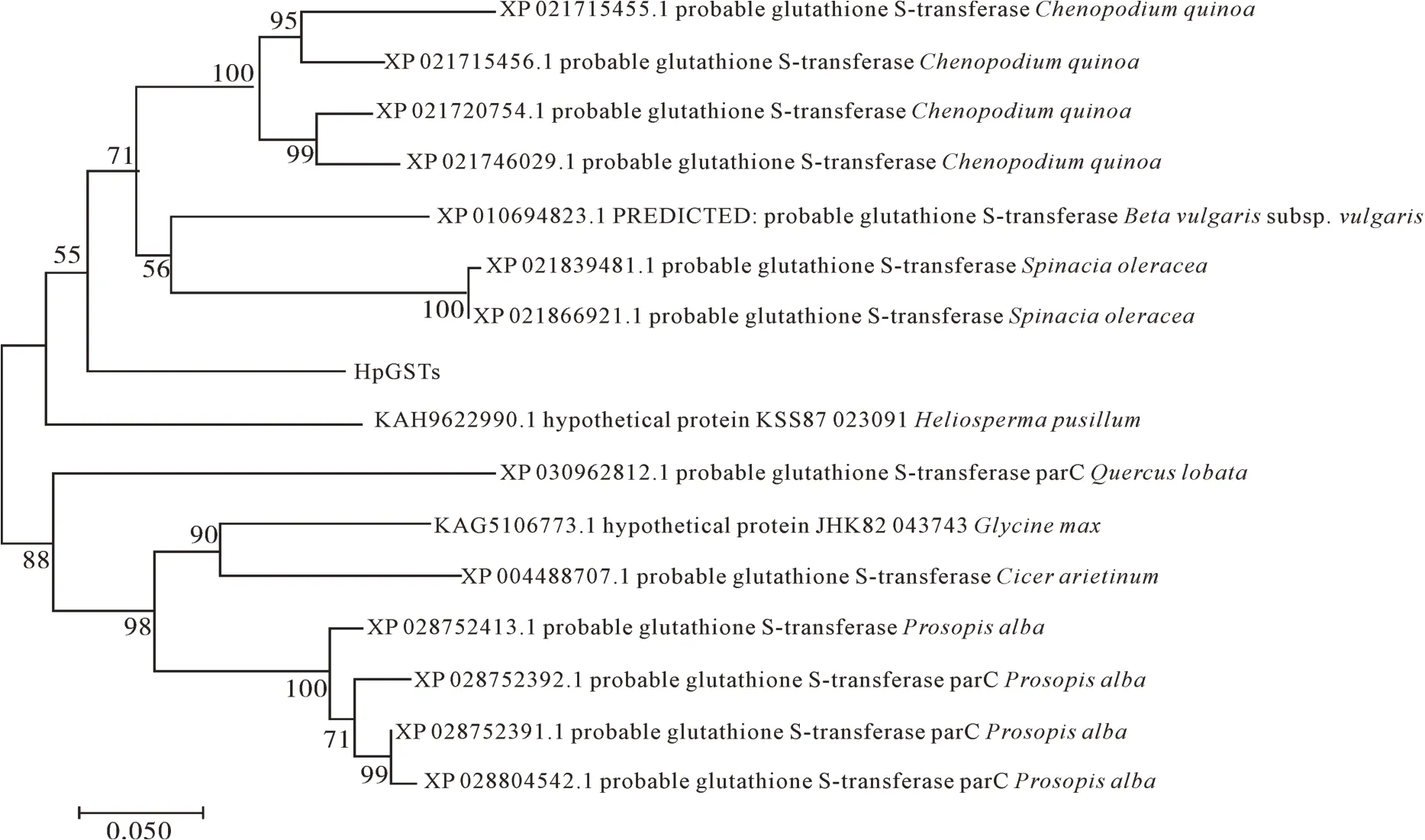
图 3 HpGST与其他物种GST氨基酸序列系统进化树分析Fig. 3 The phylogenetic tree analysis of GST amino acid sequences of HpGST and that of other species
分析HpGST在火龙果不同发育期、不同色泽类型品种果肉中的表达情况,结果(图5B)显示,在S1-S2期,HpGST在3个色泽类型品种果肉表达量无明显差异。而从S3期开始,在有色果肉中表达量明显高于白肉;在紫肉中表达量是白肉的8.12倍,差异显著,而在粉肉中表达量是白肉的4.49倍,差异显著。S4期在紫肉中表达量远高于在粉肉和白肉中的表达且均差异显著,分别是粉肉的4.11倍、白肉的6.82倍。而在该时期HpGST在粉肉中的表达量是白肉的1.66倍。此后的S5期和S6期,HpGST在有色果肉表达量无显著差异但都远高于白肉中的表达量且差异明显,S5期HpGST在紫肉中表达量是白肉中表达量的26.09倍,在粉肉中的表达量是白肉中的17.36倍,而S6期对应的分别为20.02倍和21.45倍。
上述结果表明,HpGST基因在不同色泽类型品种果肉中均有表达,但表达特性不同。HpGST在有色素累积的果肉中表达量明显远高于无色素累积的白肉火龙果,且整体上呈现紫肉>粉肉>白肉,发育时期上呈现出随时间的延长而先上升后下降的趋势,其中在紫肉和粉肉类型的S5期(27 DAF)相对表达量最高,而白肉类型S4期(26 DAF)表达量最高。
2.3 火龙果发育过程中甜菜素含量的变化
甜菜红素在不同发育时期果肉中的含量变化结果(图6A)显示,紫肉火龙果中甜菜红素含量整体呈现随发育时期的延长而不断上升的趋势,从S3期开始急速升高,S3-S6期甜菜素含量均与S1、S2期含量有显著差异。而在粉肉火龙果中,S1-S4期甜菜红素含量均无显著差异,S5-S6期差异显著,但整体含量较低。而甜菜红素含量在白肉火龙果中全时期均含量极低且无显著差异。
甜菜红素在不同色泽类型品种火龙果果肉中的含量变化(图6B)显示,S1-S2期在不同色泽类型品种火龙果果肉中虽有差异,但整体含量较低不进行讨论。比较S3-S6期不同色泽类型品种果肉甜菜红素含量差异;S3期紫肉中含量是粉肉的7.50倍,是白肉的9.68倍、而S4期对应的差异分别是16.47倍和20.29倍、S5期对应的差异分别是17.52倍和24.82倍、S6期对应的差异分别是15.04倍和34.00倍。即从S3期开始,不同色泽类型品种火龙果中甜菜红素含量开始出现显著差异,不同色泽类型品种间甜菜红素含量从高到低分别为紫肉>粉肉>白肉。
甜菜黄素在火龙果不同发育时期果肉中的含量变化(图7A)显示,甜菜黄素与甜菜红素具有相同的累积趋势即在不同色泽类型品种火龙果中甜菜黄素含量随发育时期的增加色素含量不断上升但含量都较低。

图 4 火龙果HpGST和其他植物GSTs蛋白序列比对Fig. 4 Alignment of HpGST protein sequences of Hylocereus and GSTs protein sequences of other plants
甜菜黄素在不同色泽类型品种火龙果果肉中的含量变化结果(图7B)显示,紫肉中甜菜黄素含量变化最大,而粉肉和白肉变化较小。对比紫肉与粉肉、白肉类型的甜菜黄素含量发现,紫肉的含量均比粉肉高,S2-S6期 依 次高出1.16倍、2.20倍、2.68倍、2.78倍、2.88倍;而紫肉的甜菜黄素含量更显著高于白肉类型,S1-S6期依次高出1.86倍、2.06倍、3.30倍、3.46倍、3.71倍、3.39倍。甜菜黄素含量在不同色泽类型品种间表现为紫肉>粉肉>白肉,虽然与甜菜红素趋势相同但整体含量较低(P<0.05)。

图 5 火龙果果肉HpGST基因相对表达量Fig. 5 Relative expression level of HpGST gene in Hylocereus

图 6 不同色泽类型品种火龙果不同发育时期甜菜红素含量变化Fig. 6 Variation of betacyanin content in different Hylocereus cultivars at different development stages
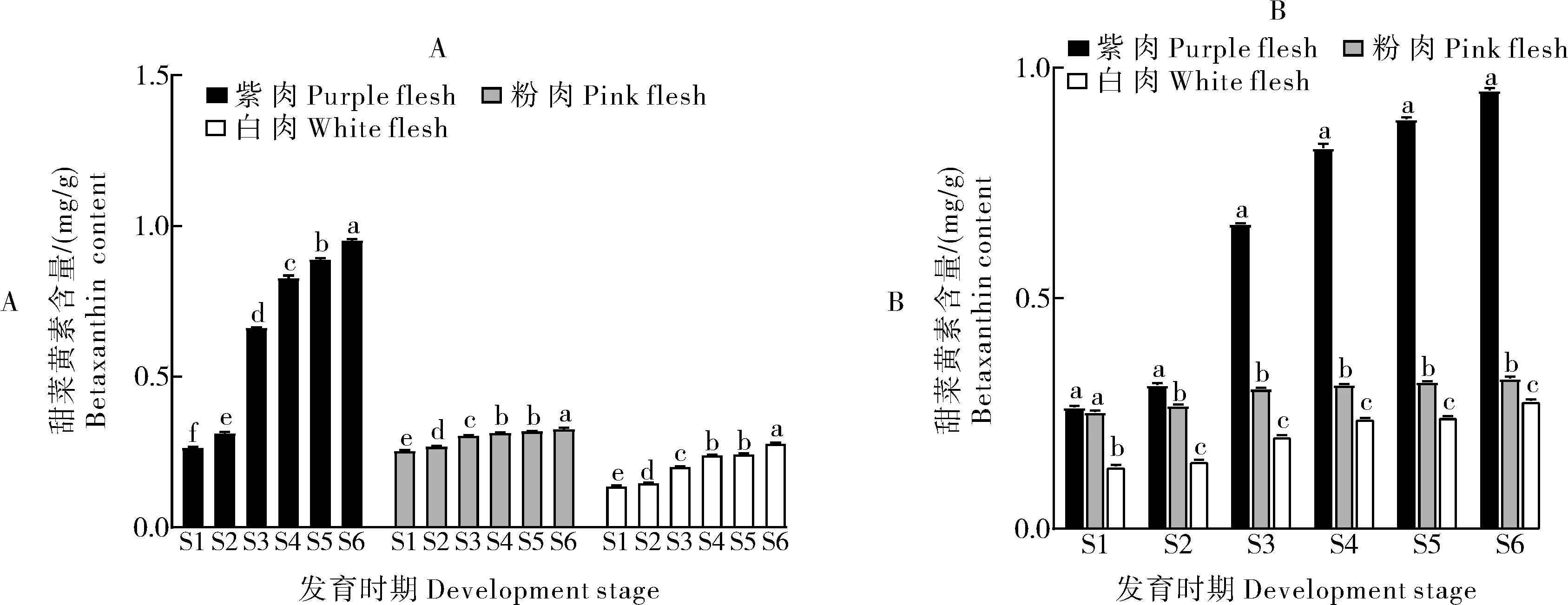
图 7 不同色泽类型品种火龙果不同发育时期甜菜黄素含量变化Fig.7 Variation of betaxanthin content in different varieties of Hylocereus at different development stages
2.4 甜菜素含量与HpGST基因表达的相关性分析
比较HpGST基因在火龙果中的表达与甜菜素的含量变化,发现在火龙果发育时期,HpGST基因的表达与色素累积呈现相同趋势(不同发育时期基因表达量和色素含量趋势相同,且在不同色泽类型品种表达量和甜菜素含量也呈现出显著的同一性),而成熟期甜菜素累积到一定程度会抑制HpGST基因的表达。对比不同色泽类型品种火龙果中Hp⁃GST基因的表达与甜菜素的含量变化发现,在S1-S2期HpGST基因表达量及甜菜素含量都极低,且都是从S3期开始,不同色泽类型品种间基因表达量及甜菜素含量都呈现出紫肉>粉肉>白肉的趋势。即HpGST基因表达与甜菜素含量变化具有高度统一的时空性。
3 讨论
甜菜素作为一种重要的天然色素,应用前景广阔,消费市场潜力巨大,然而有关甜菜素的研究多集中在合成通路上,而对于甜菜素合成后运输与定位的研究却鲜有报道。
谷胱甘肽-S转移酶(GSTs)在植物中具有对花青素的运输标记功能,因GST具有特殊的亲和性,能将花青苷和谷胱甘肽形成偶联连物[10-11],GST作为载体标记运输到液泡中从而保护细胞[11]。现有研究发现,甜菜素在植物中的功能同花青素类似[12]。然而甜菜素在自然界中仅仅在石竹目植物中发现,尚未发现同一植物中同时存在甜菜素和花青素2种色素[13]。此外,甜菜素起始底物酪氨酸和花青素合成前体物质——对香豆酰CoA都来源于苯丙氨酸[14]。二者都作为一类水溶性色素,同样合成于细胞质中,储存于液泡[15-16]。此外,二者在植物中的功能相同,合成底物同源,合成部位和最后运输到的细胞器相同,推测2种色素在细胞质中合成后运输到液泡的方式存在相同的可能。
本研究对比火龙果中谷胱甘肽S-转移酶基因(HpGST)编码蛋白定位部位和蛋白类型都与花青素来源植物中的GSTs编码蛋白相似,对HpGST在火龙果中的表达与甜菜素含量进行相关性分析发现,火龙果中甜菜素(包括甜菜红素和甜菜黄素)含量的变化随发育时期的延长而不断增加,并且与HpGST基因表达量具有相同趋势。且甜菜素(包括甜菜红素和甜菜黄素)含量在不同色泽类型品种火龙果中的含量与HpGST基因的表达量表现出高度一致的趋势即紫肉>粉肉>白肉。推测HpGST基因与火龙果果肉中甜菜素的累积和分布有着紧密联系。
本研究通过对比不同色泽类型品种、不同发育时期火龙果中HpGST基因的表达和甜菜素的含量变化,对参与色素运输的谷胱甘肽S-转移酶基因(GST)在火龙果中的作用进行了初步研究。鉴于GST在花青苷运输与定位的重要作用,推测HpGST基因对火龙果中甜菜素的运输、积累和储存起到重要调控作用,其具体的分子作用机制还需进一步探究,为火龙果果实中甜菜素累积与运输的深入研究提供一个新的视角,进而为解析甜菜素的合成代谢调控提供科学根据。

