重组酶聚合酶扩增技术在现场物证唾液鉴定中的应用
许 炎,曹 禹,郝思静,黄江平,王旭芳,吴 丹
(1.上海市公安局物证鉴定中心 法医物证学现场应用技术公安部重点实验室,上海200083;2.上海公安学院,上海201210;3.浙江中和司法鉴定中心,浙江 宁波 315300)
人类组织和体液的来源认定一直是法医物证学研究的热点。来自犯罪现场的体液斑痕类型和组织来源对于帮助现场重建,证明DNA证据与犯罪活动之间的联系,指明侦查方向,完善司法鉴定证据链等均有着重要的意义。目前,绝大部分法医物证实验室仍在使用常规的化学显色和酶联免疫反应等传统方法来进行体液识别。这类检验均属于蛋白质水平上的检测,如免疫金标试剂条法检测人前列腺特异抗原(prostate specific antigen,PSA)和人血红蛋白,其检测灵敏度较低[1],且通常需要耗费一定的检材,不适用微量物证检验。对于唾液等其他体液,目前尚未见类似试剂条法。
重组酶聚合酶扩增(recombinase polymerase amplification,RPA)是2006年由英国TwistDx生物技术公司开发的一种体外核酸等温扩增新技术[2]。该技术解决了需要利用准确控温的热循环仪器来进行PCR扩增的限制,操作简单,反应速度快,无需特殊设备,更适合快速检验,已在疾病诊断、农业、食品、生物安全等领域得到广泛应用和发展。
目前,国内尚未见利用RPA技术进行法医物证体液斑痕属性鉴定的报道。本研究在前期筛选出多种体液特异性信使核糖核酸(messenger RNA,mRNA)分子标识[1]的基础上,利用反转录聚合酶链式反应(polymerase chain reaction,PCR)和RPA技术,通过DNA-RNA共提取,同时完成唾液的生物属性鉴定和短串联重复序列(short tandem repeats,STR)分型检验,为法医物证体液属性鉴定提供一种新的鉴定策略和方法。
1 材料与方法
1.1 材料
5名健康男性志愿者提供唾液样本5份,作为阳性对照。其他唾液样本20份均来自日常检案:被害人口腔拭子8份,现场提取饮料瓶瓶口涂取物5份,嚼过的口香糖涂取物5份,现场果核涂取物2份。
1.2 方法
1.2.1 DNA-RNA共提取
按照AllPrepR○DNA/RNA Micro试剂盒(德国Qiagen公司)说明书操作对样本进行核酸提取。总RNA用于反转录和RPA检测,基因组DNA用于STR分型。
1.2.2 RNA反转录
样本RNA使用TaqMan Gold RT-PCR试剂盒(美国AB公司)进行反转录,具体操作参见试剂盒说明书。反应体系均为10 μL,包括:10×TaqMan RT缓 冲 液1 μL、25 mmol/L MgCl22.2 μL、10 mmol/L dNTPs Mix 2 μL、50 μmol/L Oligo d(T)16 0.5 μL、20 U/μL RNase抑 制 剂0.2 μL、50 U/μL MultiScribe反转录酶0.25 μL、RNA模板3.85 μL。反应条件为:25℃10 min,48℃30 min,95℃5 min。反转录产物cDNA于-20℃条件下保存备用。
1.2.3 引物设计
参考RPA引物设计要求,根据唾液特异性分子标识HTN3基因保守序列设计并筛选RPA引物,进行特异性确认后,在上游引物5’端添加FAM荧光标记,由上海生工生物工程有限公司合成。最终设计的RPA检测引物如下,扩增产物为240 bp。
上 游 引 物HTN3RPA-F:CAT CAT TCA CAT CGA GGC TAT AGA TCA
下游引物HTN3RPA-R:AAA TGA TAA TTA GGA AGG GAA GTA TCC TGA AA
1.2.4 构建RPA检测方法
以1.2.2节制备的样本cDNA为模板,采用上述设计的引物进行RPA扩增,同时设置超纯水为阴性对照,测试在恒温39℃条件下进行,反应时长为20 min。
参照RPA扩增试剂盒TwistAmp Basic kit(英国TwistDX公司)配制RPA扩增体系(50 μL):将Rehydration Buffer 29.5 μL加入到含有冻干粉酶的0.2 mL Twist Amp反应管中,再依次加入上、下游引物各2 μL(最终浓度为0.4 μmol/L),去离子水12 μL,模板cDNA 2μL,最后加入乙酸镁溶液2.5μL(280 mmol/L)。
待反应结束后,将50 μL苯酚/三氯甲烷溶液加入到RPA扩增产物中,充分混匀,在12 000 r/min转速下离心2 min,取1 μL上清液在3500遗传分析仪(美国AB公司)上进行电泳,利用GeneMapper v3.2进行DNA片段分析。
1.2.5 RPA检测方法特异性验证
取纯化的RPA扩增产物2 μL进行1.5%琼脂糖凝胶电泳,使用1×TBE缓冲液在5V/cm条件下进行恒压电泳40~60 min,回收目标条带,测序验证,评价建立的RPA检测方法的特异性。
1.2.6 RPA检测方法应用效果评价
对来自日常检案的唾液样本20份进行RT-RPA检测,以结果的一致性评价方法应用效果。用Ver-FilerTMPlus PCR试剂盒(美国AB公司)进行PCR扩增,反应体系为25μL,取1μL扩增产物在3500遗传分析仪(美国AB公司)上进行电泳。利用GeneMapper v3.2进行STR分析,观察STR基因座的检出数。
2 结果
2.1 RPA检测方法的建立
以阳性对照唾液样本cDNA为模板,超纯水为阴性对照,利用HTN3RPA-F和HTN3RPA-R引物,经RPA扩增,在扩增时长为20 min时便可获得较为理想的扩增结果(图1),扩增产物为240 bp。扩增产物条带与目的条带大小一致,阴性对照未出现扩增条带。
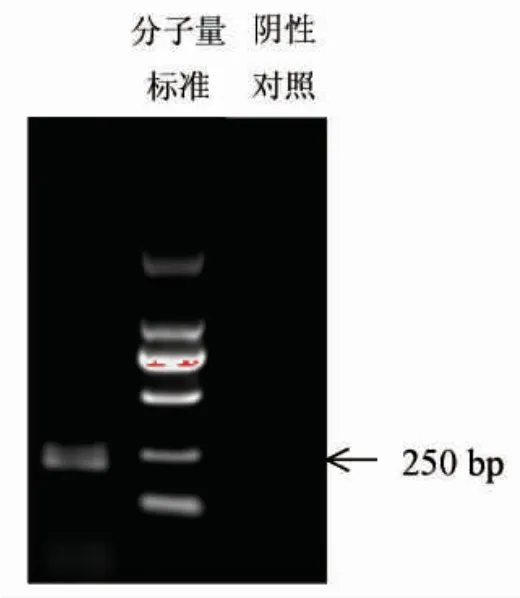
图1 RPA技术判定唾液的特异标记基因HTN3
2.2 RPA检测方法的特异性评价
实验回收并纯化扩增产物条带,直接测序验证,结果显示扩增条带与目的基因序列完全一致。
2.3 RPA检测方法的应用效果
应用本研究建立的RPA检测方法对来自日常检案的20份唾液样本进行HTN3 RPA检测和常规STR分型,结果显示:1份样本未获得STR分型,HTN3 RPA检测阴性;1份样本仅获得15个基因座的STR分型,HTN3 RPA检测阳性;其余样本均获得20个以上基因座的STR分型(VerFilerTMPlus PCR试剂盒共24个STR基因座),且HTN3 RPA检测也均为阳性(图2和表1)。结果表明,RPA检验方法与常规的STR鉴定可相互验证,排除RPA检验的假阳性结果。

表1 RPA检测方法在实际案件唾液类生物样本中的应用评价表
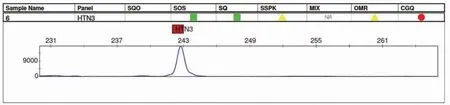
图2 RPA技术判定唾液的毛细管电泳图谱(阳性结果)
3 讨论
RPA技术以T4噬菌体核酸复制机制为原理[2],在恒温条件下,利用重组酶和单链结合蛋白协同实现引物与模板的特异性结合,定位后引发链交换反应并启动DNA合成,完成模板上目标片段的指数级扩增。与PCR技术相比,本研究建立的RPA方法具有以下优点:(1)设备简单。一般RPA反应温度在30℃~42℃之间,本实验仅需要一台恒温水浴锅在39℃条件下完成RPA检测,极大减少了传统PCR技术所需的设备成本和实验环境要求。(2)快速检测。本实验结果显示在39℃条件下扩增时长20 min时便可获得较为理想的扩增结果,相比传统PCR和实时荧光定量PCR[1],该技术极大缩短了检测时长,有利于快速检测。(3)特异性强。RPA反应与传统PCR均需要上、下游引物,且引物要求在30~35 bp之间,长于PCR引物,对靶序列的扩增更准确,特异性更强。HTN3和STATH是唾液鉴定常用的两种标记物[3-4]。前期研究[5]中显示,HTN3在唾液和口腔黏膜中有特异性高表达,而STATH则在鼻腔分泌物中显示出更高表达水平。因此,本研究选择了特异性更高的HTN3作为检测标记物。(4)结果易于判定。由于扩增产物为长度明确的DNA片段,完全可以在现有的法医物证DNA电泳分析技术平台上进行操作,并同步完成物证的STR分型检验。
由于RPA通常在较低温度(30℃~42℃)下进行,在目的基因含量低的情况下,容易出现由引物二聚体或非靶基因[2]形成的非特异性扩增产物,产生假阳性结果,干扰目的基因的检测,这对引物设计提出了更高的要求。RPA引物应避免5’端过多的鸟嘌呤,在3’端设计一个GC发夹结构以避免引物自身配对形成二聚体。本实验采用的是在设计的数对引物中筛选出的一对最佳引物,在对20份现场检材的HTN3标记检验中经测序验证未发现有假阳性结果。RPA技术在司法鉴定领域未有相关报道和应用,本研究引入RPA技术应用于法医物证的体液鉴定,可解决体液来源的实验室快速判定。后续研究将进一步利用RPA技术的优势,结合人类多种体液特异性分子标识,尝试建立一套特异性强、灵敏度高、重复性好、结果判定准确,可用于常规法医物证实验室的精准体液鉴定复合检测体系。

