rhIL23R-CHR/Fc融合蛋白通过下调ENST00000522718抑制Act-HaCaT细胞炎症和增殖
王黎明,蒋小猛,高 悦,马宇骁,曾爱中,郭 薇*
(1中国药科大学生命科学与技术学院,南京 211198;2南京医科大学逸夫医院消化内科,南京 211112)
银屑病(psoriasis)俗称“牛皮癣”,是一类免疫介导的,以角质细胞异常增殖为主要特征的慢性皮肤炎症疾病,全世界大约有1.25 亿人患有银屑病[1]。超过80%的银屑病患者表现为斑块状银屑病,患者皮肤表面出现大量红色斑块,表面覆盖多层银白色鳞屑,分布在全身多个组织[2]。高水平的细胞因子和活化的免疫细胞经血液循环影响全身多个组织或器官[3],引发Ⅱ型糖尿病[4]、炎症性肠病[5]、心血管疾病[6]等多种并发症。由于未及时就诊、临床诊断失误及社会偏见等原因,许多银屑病患者遭受极大的痛苦。
作为一种常见的自身免疫性疾病,银屑病的病因及发病机制尚未完全阐明。遗传、环境、感染、内分泌以及神经精神等因素均可诱发银屑病[7],适应性免疫应答参与自身抗体形成和自身反应性T细胞的应答,被认为是自身免疫性疾病中主要的致病因素[8]。近年研究发现,Th17 细胞及IL-23/IL-17 轴在银屑病中引起的表皮角质形成细胞的过度增殖和分化紊乱发挥主要致病作用[3]。虽然靶向IL-23/IL-17 治疗显著改善了银屑病患者病情,但由于存在部分患者治疗应答差等原因,仍需多种新的治疗策略或新型抗炎途径。因此,需要进一步阐明银屑病的发病机制,为开发新的诊断或治疗方法奠定基础。
随着测序技术的发展,非编码(non-coding,nc)RNA 对银屑病遗传性和致病性的影响成为人们关注的焦点。长链非编码(long non-coding,lnc)RNA 是一类长度大于200个核苷酸的ncRNA,通过碱基互补配对与 DNA,RNA 或蛋白相互作用来调节基因表达[9],几乎参与了生物学进程的各个方面。Gupta 等[10]获得了银屑病患者皮肤和健康皮肤lncRNA 差异表达谱,发现了lncRNA 在银屑病及阿达木单抗治疗中的潜在重要性,并通过基因共表达网络分析了差异表达的lncRNA 在银屑病中的初步作用机制[11]。研究发现,lncRNA PSORS1C3易感基因与银屑病发病显著相关[12]。银屑病非损伤皮肤中应激诱导的银屑病易感基因PRINS 过表达,导致非损伤表皮的应激反应发生改变,促进了银屑病的发病[12-13],并通过调节G1P3 降低角质形成细胞的凋亡[12-14]。Tsoi 等[15]在银屑病皮肤和正常皮肤中鉴定出1 214 个差异表达的lncRNA 分子,推测可能参与银屑病的免疫病理。lncRNA MEG3通过调节PI3K/AKT/mTOR 信号通路在TNFα 刺激的角质形成细胞和银屑病小鼠中促进自噬并 抑 制 炎 症[16]。 lncRNA SPRR2C[17],lncRNA MIR31HG[18],lncRNA RP6-65G23.1[19]及lncRNA H19[20]等通过改变角质形成细胞的表型和功能参与银屑病的病理过程。越来越多的研究证据表明,lncRNA与银屑病发病关系密切[21]。
本课题组前期获得了靶向IL-23 p19 亚基的rhIL23R-CHR/Fc 融合蛋白,在银屑病小鼠体内研究发现rhIL23R-CHR/Fc 融合蛋白与IL-23 结合后,阻断IL-23/IL-23R 结合,抑制Th17 细胞和ILC3 细胞等介导的炎症应答[22]。基于前期的研究基础,使用TNF-α 刺激人皮肤永生化角质形成细胞株(HaCat),建立银屑病细胞模型(Act-HaCaT),进一步在体外探究rhIL23R-CHR/Fc 融合蛋白调控Act-HaCaT 细胞功能的下游关键lncRNA 分子,并研究lncRNA 分子在Act-HaCaT 细胞中的作用机制。通过了解银屑病发病关键分子,寻找银屑病生物标志物,为个体化和针对性的治疗提供新的靶标。
1 材 料
1.1 试 剂
HaCat细胞(广州吉妮欧生物科技公司);FBS、DMEM-HG 基础培养基(美国Gibco 公司);硫酸链霉素、氨卞青霉素[中国生工生物工程(上海)股份有限公司];重组人TNF-α(美国PeproTech 公司);Trizol(美 国Intrivogen 公 司);HiScript®Ⅲ RT SuperMix、SYBR Green(南京诺唯赞生物科技公司);ELISA 检测试剂盒(杭州联科生物科技有限公司);MTT(德国Merck公司);siRNA(上海吉玛制药技术有限公司)。
1.2 仪 器
Nanodrop 2000、QuanstudioTM3 Real-Time PCR Instruction、细胞培养箱、Countstar 细胞计数仪[赛默飞世尔科技(中国)有限公司];全波长酶标仪[美谷分子仪器(上海)有限公司]。
2 方 法
2.1 银屑病细胞模型建立
HaCat 细胞在含有10% FBS 的DMEM-HG 基础培养基并加有终浓度为100 U/mL 硫酸链霉素和氨卞青霉素的完全培养基中培养。
按每孔1 × 105个细胞的密度种植细胞于24孔板中,并在37 ℃、5% CO2培养箱中过夜贴壁培养,24 h 后给药终浓度为10 ng/mL TNF-α,继续培养24 h,建立银屑病细胞模型(Act-HaCaT)。
2.2 全长转录组测序
利用全长转录组测序技术(广州基迪奥生物科技有限公司)获得Act-HaCaT 和HaCat 细胞的lncRNA表达谱,测序总共对26 566个lncRNA基因进行了检测,共有219 个lncRNA 显著差异表达(FDR < 0.05,|log2FC| ≥ 1,P< 0.05)。
2.3 RNA分离提取和qRT-PCR
根据说明书使用Trizol 试剂提取HaCat 和Act-HaCaT 细胞总RNA。使 用Nanodrop 2000 检 测RNA 的浓度和纯度。使 用HiScript®Ⅲ RT SuperMix 将每个样本的1µg 总RNA 逆转录 为cDNA,SYBR Green 通过qRT-PCR 对基因表达进行定量。具体方案如文献所述[23]。
2.4 酶联反应吸附法(enzyme linked immunosorbent assay, ELISA)
收集细胞培养上清液,1 000 r/min离心10 min,吸取上清液,使用ELISA 检测试剂盒,检测IL-6 和IL-8 的蛋白浓度。分别在对应孔中加入2 倍倍比稀释的标准品100 µL 和细胞上清液100 µL 后,在每个孔中加入检测抗体稀释液50 µL,300 r/min 摇床上震荡孵育2 h,洗涤;加辣根过氧化物酶标记的链霉亲和素100 µL 室温孵育45 min 并洗涤后,加底物100 µL 显色15 min,每孔加入反应终止液100 µL,使用酶标仪在450和570 nm下进行检测。
2.5 MTT
按每孔5 × 103个细胞培养细胞于96 孔板,每孔补加含血清浓度为1% DMEM-HG 完全培养基,至终体积为100 µL。将96 孔板细胞置于37 ℃、5% CO2培养箱中过夜贴壁培养。贴壁培养后给药10 ng/mL TNF-α(Act-HaCaT)和不加TNF-α 刺激的空白对照孔(HaCat),每组设置6 个复孔。继续培养24 h后,每孔加入5 mg/mL MTT 10 µL,37 ℃、5% CO2培养箱中静置培养 ,4 h 后使用1 mL 无菌注射器吸掉培养基,每孔加DMSO 150 µL,500 r/min 振荡10 min。将培养板在酶标仪上检测,检测波长为570 nm,校正波长为 630 nm。
2.6 统计分析
数据统计及分析应用GraphPad 8.0 软件进行,各项指标均以平均数 ± 标准误(±s)表示。两组间样本的差异显著性比较采用Unpairedt-test(two-tailed)进行,两组以上样本差异显著性比较使用One-Way ANOVA 分析。P< 0.05为组间差异具有统计学意义。
3 结 果
3.1 TNF-α 促进HaCat 细胞增殖和炎症因子的表达
TNF-α 体外刺激人角质形成细胞系HaCat 细胞,是建立银屑病细胞模型的常用方法之一。使用10 ng/mL 重组人TNF-α 刺激HaCat 细胞(Act-HaCaT 组)24 h 后,显著增加了HaCat 细胞IL-6(P< 0.01)、IL-8(P< 0.05)、IL-1α(P< 0.05)、IL-1β(P< 0.001)及IL-23(P< 0.001)细胞因子的转录(图1-A),TNF-α 刺激后IL-23 的转录增加的最为显著,其mRNA 水平提高了约5 倍。此外,Act-HaCaT 组细胞培养上清液中IL-6(P< 0.01)和IL-8(P< 0.05)炎症因子的分泌水平也显著升高(图1-B)。同时,TNF-α 还促进了HaCat细胞的增殖能力(P< 0.01)(图1-C)。
3.2 rhIL23R-CHR/Fc抑制TNF-α刺激的HaCat细胞的功能
在前期的体内实验结果中,发现rhIL23R-CHR/Fc融合蛋白通过抑制体内Th17和ILC3细胞介导的炎症免疫应答,降低炎症因子的转录水平和蛋白表达,能够显著改善银屑病样小鼠的症状。在银屑病病理皮损中,人角质形成细胞表达IL-23 等炎症因子,诱导Th17细胞的活化,形成银屑病的炎症反应回路。本研究结果显示rhIL23R-CHR/Fc 给药后抑制了Act-HaCaT 细胞的增殖,且具有浓度依赖性(P< 0.05),rhIL23R-CHR/Fc 质量浓度在100 和1 000 ng/mL时可极显著抑制Act-HaCaT细胞增殖,抑制率分别 为(25.49 ± 7.84)% 和(33.96 ± 6.44)%(图2-A),与100 ng/mL rhIL23R-CHR/Fc相比,1 000 ng/mL rhIL23R-CHR/Fc 对细胞增殖的抑制率更高,但无显著性差异,因此后续以100 ng/mL rhIL23R-CHR/Fc 作为合适的给药浓度。在给药100 ng/mL rhIL23R-CHR/Fc 融合蛋白后,在Act-HaCaT细胞中上调表达的IL-6、IL-8、IL-1α、IL-1β以及IL-23 等炎症因子其转录水平均受到明显抑制(P< 0.05)(图2-B)。
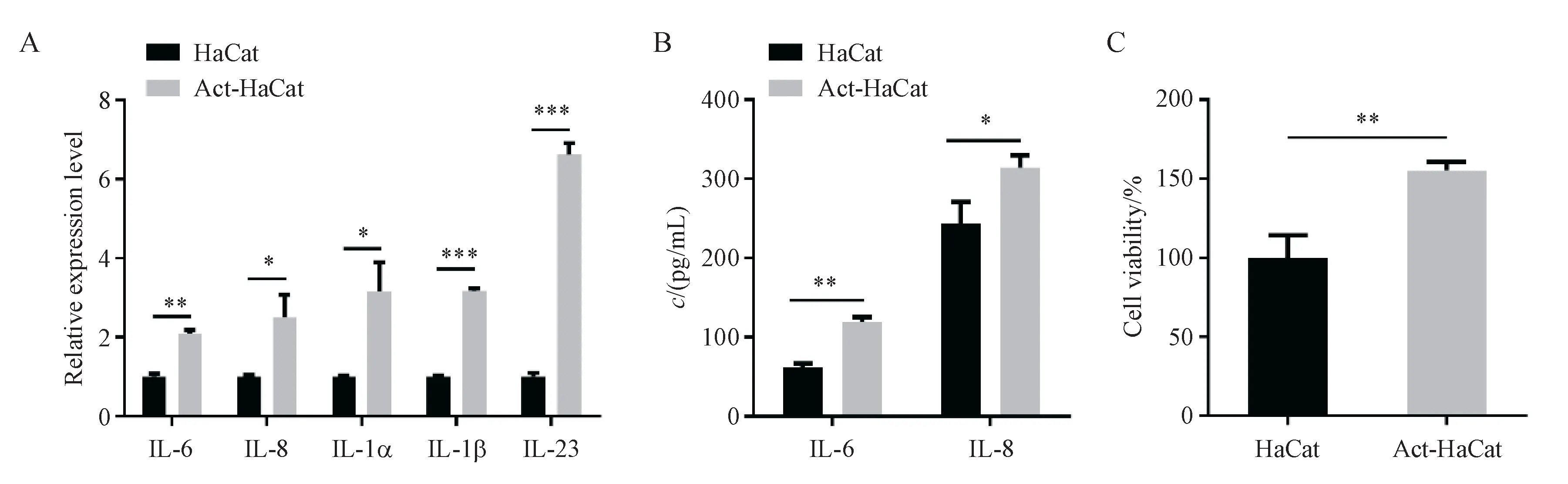
Figure 1 Pproliferation and inflammation factor production in HaCat cells and HaCat cells activating by TNF-α (± s, n = 3)
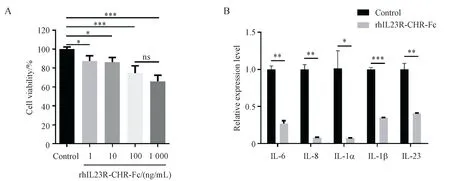
Figure 2 rhIL23R-CHR/Fc fusion protein inhibited proliferation and inflammation factor production in Act-HaCaT (± s, n = 3)
3.3 差异表达lncRNA和mRNA的生物信息学分析
利用全长转录组测序技术获得Act-HaCaT 和HaCat 细胞的lncRNA 的表达谱,结果显示,Act-HaCaT 与HaCat 细胞相比,差异表达的lncRNA 共有219 个,其中表达上调的有113 个,表达下调的lncRNA有106个(图3-A,3-B)。
基于生物信息学分析结果,利用qRT-PCR 对Act-HaCaT中前20个显著上调进行二次验证,与测序结果趋势一致的有3 个上调的lncRNA:ENST00000531381、 ENST00000522718 和ENST00000415917(图3-C)。因此接下来以显著上调的lncRNA作为研究对象。
通过rhIL23R-CHR/Fc 给药,探索rhIL23RCHR/Fc 在调控Act-HaCaT 细胞的功能时,可能参与调控的lncRNA 分子。以前期筛选显著上调的lncRNA 为基础,利用qRT-PCR 进行筛选,结果显示,在Act-HaCaT 细胞中给药100 ng/mL rhIL23RCHR/Fc 后,目 标lncRNA 分 子ENST00000531381(P< 0.001)和ENST00000522718(P< 0.001)的转录水平受到明显抑制,而lncRNA ENST00000415917在融合蛋白给药后转录水平增加(图3-D)。表明rhIL23R-CHR/Fc 可能通过调节ENST00000531381和ENST00000522718 的基因表达,进而影响Act-HaCaT细胞的功能。
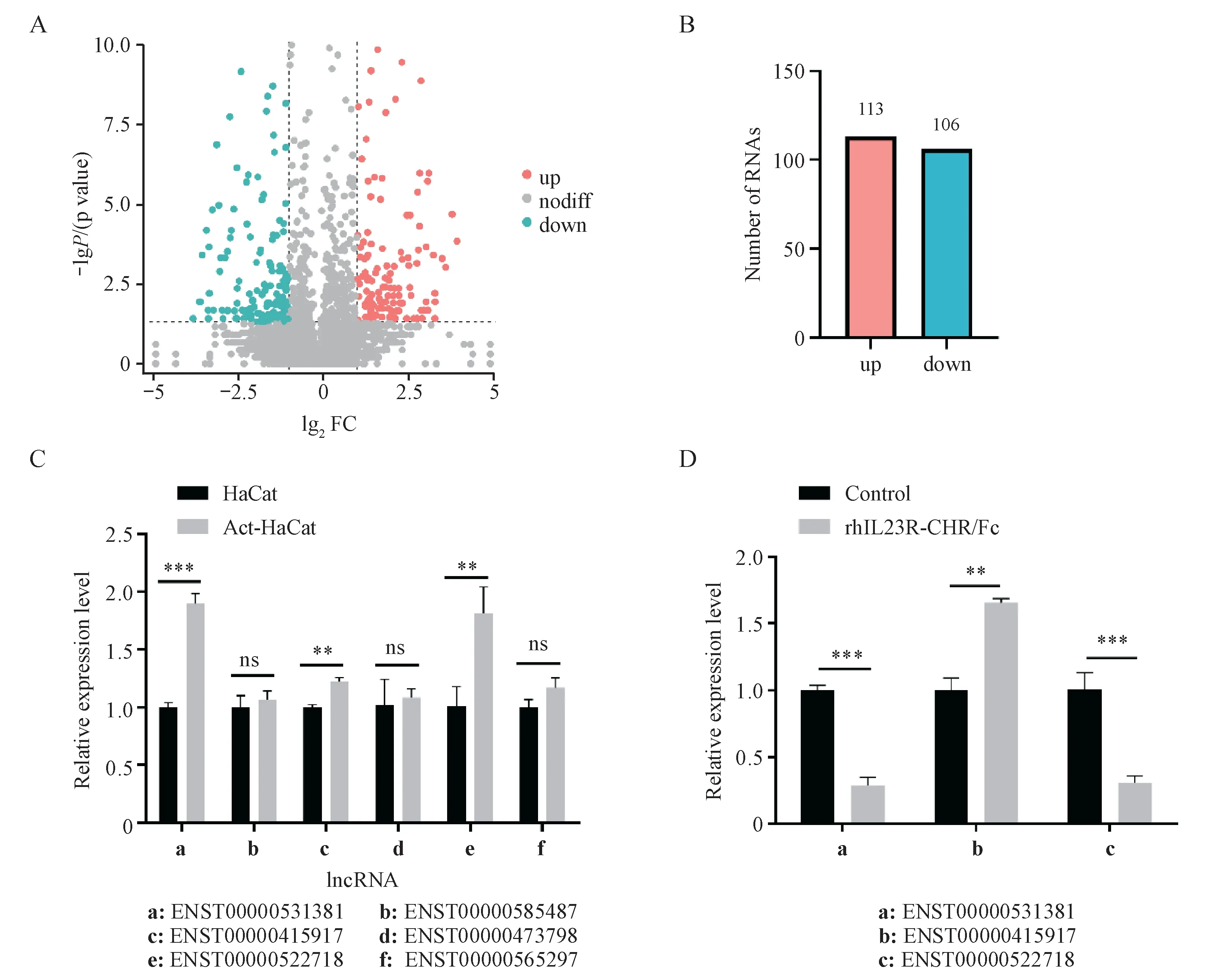
Figure 3 Screening of lncRNA downstream of rhIL23R-CHR/Fc (± s, n = 3)
3.4 目标lncRNA 抑制Act-HaCaT 细胞的增殖及炎症因子转录
通过rhIL23R-CHR/Fc 给药后,筛选得到可能参 与IL-23 通 路 的lncRNA ENST00000531381 和ENST00000522718。使 用siRNA 对 目 标lncRNA ENST00000531381 和ENST00000522718 进 行 敲减。与阴性对照(si-NC)组相比,siRNA 干扰后lncRNA靶基因的水平降低(图4-A)。
敲低目标lncRNA 后,利用MTT 检测其对Act-HaCaT 细胞增殖的影响。结果显示,与对照组相比,敲低ENST00000522718 后,Act-HaCaT 细胞的增 殖 受 到 明 显 抑 制(P< 0.01),而 敲 低ENST00000531381 对Act-HaCaT 细 胞 的 增 殖 无 显著影响(图4-B)。敲低ENST00000522718 显著抑制Act-HaCaT 细胞中炎症因子的转录(P< 0.05),而敲低ENST00000531381 不仅未抑制,而且还部分促进了Act-HaCaT 细胞中炎症因子的转录(图4-C)。因 此,ENST00000522718 可 能 是rhIL23RCHR/Fc 融合蛋白可能是参与IL-23 通路降低Act-HaCaT炎症和增殖能力的关键分子。
4 讨 论
角质形成细胞与免疫细胞异常增殖是银屑病主要病理特征[24]。活化的Th细胞产生炎性细胞因子诱导角质形成细胞的基因表达,调节角质形成细胞的应答反应。被激活的角质形成细胞参与银屑病病理,维持并加剧皮肤炎症,释放趋化因子等招募活化的T细胞,形成银屑病致病的炎症循环回路[25]。人正常皮肤角质形成细胞衍生的HaCat 细胞是银屑病药理学研究及药物筛选的常用体外模型。可通过添加TNF-α 诱导HaCat 细胞模拟银屑病的病理[16,26]。研究表明,TNF-α 不仅调节免疫和炎症反应,而且还调节组织重塑,细胞凋亡,细胞周期和细胞运动等进程。用10 ng/mLTNF-α 处理HaCat细胞24 h后细胞培养上清液中IL-17A、IL-23及IL-22 的表达明显升高[27]。此外,TNF-α 还能刺激HaCat 细胞IL-1α、IL-1β、IL-6 及IL-8 的转录[28]。本研究利用TNF-α 刺激的HaCat细胞为模型细胞,通过与未刺激的HaCat细胞比较,发现TNF-α 不仅诱导了HaCat细胞炎症因子的转录和蛋白表达,而且还促进HaCat细胞的体外增殖。
目前对于银屑病的病理机制尚不完全清楚,故而限制了相关临床检测和预后指标的发现。大多数哺乳动物和其他复杂生物体的基因组会转录成ncRNA,包括miRNA、lncRNA 和环状(circle,circ)RNA等。近年来ncRNA 调控网络调节机体复杂的生理过程逐渐被揭示,在自身免疫疾病、肿瘤及心血管疾病中发挥重要作用[29-32]。lncRNA 是ncRNA 中转录程度最高的RNA,在多种肿瘤中发挥了重要的生物学功能[33-34],然而关于lncRNA在银屑病中的作用了解较少。为了进一步发现银屑病发病的关键分子,通过二代测序发现HaCat 细胞和Act-HaCaT 细胞的差异表达lncRNA共有219 个,利用qRT-PCR 技术差异lncRNA 进行初步筛选,得到候选3 个差异上调的目标lncRNA分子ENST00000531381、ENST00000522718和ENST00000415917。

Figure 4 Determining the function of lncRNAs in cells (± s, n = 3)
在前期研究中发现rhIL23R-CHR/Fc 融合蛋白能够显著改善银屑病小鼠症状,并探讨了rhIL23RCHR/Fc 在银屑病小鼠体内的药理机制,基于以上结果,本研究试图探索rhIL23R-CHR/Fc 融合蛋白影响HaCat 细胞功能的潜在机制。体外实验结果显示,rhIL23R-CHR/Fc 可以以浓度依赖性的方式抑制Act-HaCaT 细胞增殖,还能抑制IL-23 等炎症因子转录和IL-6、IL-8 的分泌水平,但其作用的下游分子机制尚不明确。近年来不断有研究证明lncRNAs 通过多种机制调节角质形成细胞的促分化和抗分化,但lncRNA 在调节角质形成细胞分化中的确切作用尚不明确。Gupta 等[10]利用RNA 测序鉴定了阿达木治疗前后的银屑病患者及与健康个体皮肤中lncRNA 转录组,结果发现银屑病患者与健康人有971 个差异表达的lncRNA,阿达木单抗治疗前后有157 个差异表达的lncRNA,而阿达木治疗后与健康人有377 个差异表达的lncRNA。该研究充分说明了lncRNA 在银屑病病理发展及生物治疗中的潜在重要性。本研究中,通过Act-HaCaT 细胞给药rhIL23R-CHR/Fc 融合蛋白,进一步筛选rhIL23R-CHR/Fc 影响HaCat 细胞功能的下游lncRNA 分子。在3 个候选lncRNA 中,lncRNA ENST00000531381 和ENST00000522718 的 水 平 在rhIL23RCHR/Fc 给药后受到明显抑制。为了验证目标lncRNA 分子对HaCat 细胞是否具有调节功能,接下来利用siRNA 在Act-HaCaT 细胞中敲低目标lncRNA 的水平,检测细胞功能的变化,结果证实目标lncRNA ENST00000522718 能够调节HaCat细胞的增殖及炎症因子的水平;然而敲低lncRNA ENST00000531381 后HaCat 细胞的炎症因子转录水平部分降低,但对细胞增殖没有明显影响。因此本研究认为ENST00000522718 是rhIL23RCHR/Fc调节HaCat细胞功能的下游分子。
ceRNA 机制是目前研究最火热的调控方式之一,成为银屑病治疗中的潜在新型靶标[35]。本研究基于前期的研究基础,通过体外研究,得到了rhIL23R-CHR/Fc 融合蛋白调控Act-HaCaT 细胞功能的下游关键lncRNA ENST00000522718,并探究了ENST00000522718 在在Act-HaCaT 细胞中的作用机制。之后将继续探索ENST00000522718 下游的miRNA 以 及mRNA,阐 明ceRNA 网 络 在rhIL23R-CHR/Fc 融合蛋白影响HaCat 细胞功能中的调控机制。进一步揭示lncRNA 在银屑病发病及rhIL23R-CHR/Fc 治疗银屑病的潜在机制,为今后针对银屑病的核酸药物治疗研究提供候选分子。

