热休克蛋白90α激活PI3K/Akt通路介导乳腺癌他莫昔芬耐药的机制研究①
董 毅 徐贵颖 马牧松 刘 涛(吉林省肿瘤医院乳腺外二科,长春 132000)
乳腺癌是最常见的癌症类型,也是全球女性癌症相关死亡的主要原因[1]。雌激素受体α(estrogen receptor α,ERα)过度表达是ERα+乳腺癌的特征之一,且ERα+乳腺癌是一种主要的乳腺癌亚型[2]。ER是一种激素转录因子,通过与雌激素结合而被激活,促进细胞周期进程[3]。内分泌治疗是ERα+乳腺癌患者的常规治疗方法[4]。他莫昔芬(tamoxifen,TAM)是一种常用的激素治疗药物,通过与雌激素竞争与ER蛋白的结合抑制ER转录程序[5]。TAM虽然大大改善了乳腺癌患者的预后,但在临床治疗过程中经常观察到新发和获得性的TAM耐药,导致乳腺癌复发或转移,最终导致患者死亡[6]。PI3K/Akt通路是癌症中最频繁激活的通路之一,也是癌细胞产生耐药性的最重要原因之一[7]。PI3K蛋白具有丝氨酸/苏氨酸(Ser/Thr)激酶和磷脂酰肌醇激酶双重活性。细胞内PI3K的激活因子通过招募衔接蛋白促进p110和p85结合以激活PI3K。活化的PI3K可将3,4-二磷酸磷脂酰肌醇(PIP2)转化为3,4,5-三磷酸(PIP3),PIP3作为第二信使可与磷酸肌醇依赖性激酶-1(PDK1)结合,在Thr308处磷酸化Akt。Akt也可在Ser473处被mTORC2磷酸化。Akt是关键的信号转导蛋白,可磷酸化多种底物和下游效应物,并使癌细胞产生耐药性。基于此,本研究将以乳腺癌细胞HCC1937和MCF7为研究对象,通过高通量测序和siRNA筛选鉴定乳腺癌细胞TAM耐药的关键分子。
1 材料与方法
1.1 材料PI3K/Akt通路抑制剂Pectolinarin(货号:S3056)和Miltefosine(货号:S9054)、TAM(货号:S1238)购自Selleck公司;人乳腺癌细胞HCC1937、MCF7(货号:CL-0093、CL-0149)购自Procell公司、Li‐pofectamine 3000(货号:L3000001)购自北京索莱宝科技有限公司;siRNA、miR-5003-3p inhibitor、miR-5003-3p mimics和miRNA模拟物的适当阴性对照购自南京金斯瑞;TRIzol RNA Kit(货号:16096040)购自北京华威锐科化工有限公司;SuperScriptⅡ逆转录酶(货号:18064022)购自北京冬歌博业生物科技有限公司;iTaq Universal Probes Supermix(货号:1725131)购自武汉佰法生物科技有限公司;AO/EB染色试剂盒(货号:E607308-0200)购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 细胞培养与处理 人乳腺癌细胞HCC1937和MCF7培养于含10%胎牛血清(FBS)、50活性单位/ml青霉素和50 µg/ml链霉素的RPMI1640培养基中。TAM抗性细胞系HCC1937/TR和MCF7/TR通过与浓度逐步增加的TAM孵育衍生而来。处理HCC1937和MCF7细胞的TAM剂量从0.001 µmol/L增加到0.1µmol/L,处理12个月以上。处理过程中,每轮处理后,当存活细胞达到>70%汇合时,进行胰酶消化传代,并增加TAM剂量。根据制造商说明书,将HCC1937/TR和MCF7/TR细胞接种于12孔板孵育24 h以达到30%~40%的汇合度,并使用Lipofectamine3000以HSP90α siRNA或对照siRNA siGFP瞬时转染细胞。
1.2.2 RNA提取与实时荧光定量PCR TAM处理48 h后,使用TRIzol RNA Kit提取总RNA。总RNA使用SuperScriptⅡ逆转录酶生成cDNA。PCR使用iTaq Universal Probes Supermix以20 µl的最终反应体积进行3次重复,使用基因特异性引物/探针组和标准热循环程序(35个循环)在Bio-Rad CFX96TM实时PCR系统上进行。通过比较Ct方法(ΔΔCt)确定目标转录物的相对定量。在没有逆转录的情况下进行对照实验以确认总RNA没有被基因组DNA污染。以GAPDH为HSP90α的内参,U6为miRNA的内参。
1.2.3 蛋白免疫印迹 过表达或敲低miR-5003-3p 48 h后(或过表达或敲低HSP90α 48 h后),以细胞裂 解 液(0.1%SDS、1%NP-40、150 mmol/L NaCl、50 mmol/L Tris-HCl)裂解。采用BCA蛋白定量试剂盒对蛋白质进行定量。蛋白质样品通过10%SDSPAGE电泳分离,并转移至聚偏氟乙烯膜(0.45µm)。室温下用含5%牛血清白蛋白(BSA)的PBS-Tween-20(PBST)封闭膜60 min。与GAPDH、HSP90α、PI3K、p-PI3K、Akt、p-Akt抗体4℃孵育60 min。进一步与二抗在室温下孵育60 min。随后进行化学发光反应。
1.2.4 细胞周期检测TAM处理48 h后,采用流式细胞术进行细胞周期分析。使用FACS CantoⅡ流式细胞仪在405 nm下分析含胰蛋白酶化黏附物的样品,并使用450/50带通滤光片收集细胞发射物。进一步使用FlowJo V10软件分析结果,确定细胞周期分布。
1.2.5 细胞凋亡水平检测TAM处理48 h后,AO/EB法检测细胞凋亡。然后根据制造商说明书,以AO/EB染色细胞,于200倍放大的FV300/FV500激光扫描共聚焦显微镜下检查。凋亡细胞表现为核凝结和碎裂。
1.2.6 细胞活力检测TAM处理48 h后,MTT法检测细胞活力。将8×103个细胞接种于96孔板培养24 h,然后用不同浓度的药物处理。孵育48 h后,使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯四唑溴化铵(0.5 mg/ml)和Bio-Tec酶标仪在562 nm波长下检测细胞活力。
1.2.7 高通量测序TAM处理48 h后,使用TRIzol RNA Kit提取总RNA;使用NuGEN Ovation RNA System V2和NuGEN Ultra Low library System V2制备RNA-seq文库;使用RNA-Seq系统(NuGEN)对RNA-seq文库进行测序;使用Qubit和Agilent Bioan‐alyzer 2100分析评价扩增文库的质量和数量。
1.2.8 荧光素酶报告实验HSP90α-γ基因的3′-非翻译区(UTR)在与GV126荧光素酶基因融合前进行PCR扩增。HSP90α基因和miR-5003-3p的结合位点通过定点突变切除作为对照。胸苷激酶启动子和表达海参荧光素酶的质粒用于调整转染效率。采用荧光素酶报告载体将miR-5003-3p mimics和对照共转染至MCF7细胞,并进行荧光素酶实验。
1.3 统计学分析 所有实验重复3次。采用学生t检验和单因素方差分析(One-Way ANOVA with post-hoc Tukey's test)比较不同组的数据。P<0.05为差异有统计学意义。
2 结果
2.1 TAM抗性的人乳腺癌细胞HCC1937和MCF7的构建TAM处理可显著抑制亲本细胞的增殖并诱导细胞凋亡,但不能抑制抗性细胞,见图1A~C。此外,经TAM处理后,HCC1937/TR和MCF7/TR细胞周期阶段的分布发生显著变化。TAM处理可在HCC1937和MCF7细胞中显著诱导G1期停滞,但在HCC1937/TR和MCF7/TR中则不然,见图1D、E。提示已成功筛选出TAM抗性细胞(HCC1937/TR和MCF7/TR)。
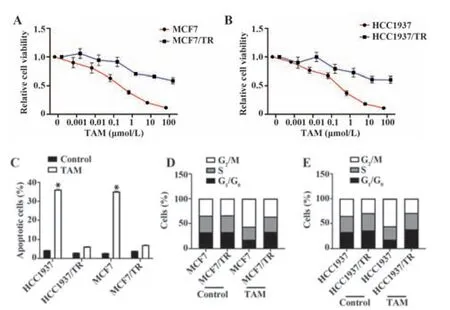
图1 TAM抗性的人乳腺癌细胞构建Fig.1 Construction of TAM-resistant human breast cancer cells
2.2 HSP90α激活PI3K/Akt通路引起乳腺癌细胞TAM耐药 将TAM处理和未处理的HCC1937/FR细胞进行高通量测序,发现TAM处理后,多个基因的表达水平被调节(图2A);通过siRNA筛选,发现当敲低HSP90α时,HCC1937/FR细胞凋亡水平升高(P<0.05,图2B);过表达HSP90α后,HCC1937/TR和MCF7/TR细胞凋亡水平降低(P<0.05,图2C、D);敲低HSP90α后,MCF7/TR细胞凋亡水平显著升高(P<0.05,图2E);在HCC1937和MCF7细胞中过表达HSP90α后采用TAM处理,HCC1937和MCF7显示出对TAM抑制增殖的抵抗(P<0.05,图2F、G);敲低HSP90α后,PI3K/Akt通路受到抑制(图2H);过表达HSP90α后,PI3K/Akt通路 激活(图2I);使 用PI3K/Akt通路抑制剂Pectolinarin或Miltefosine处理后,再用TAM处理,HCC1937/TR和MCF7/TR细胞凋亡水平显著升高(P<0.05,图2J)。
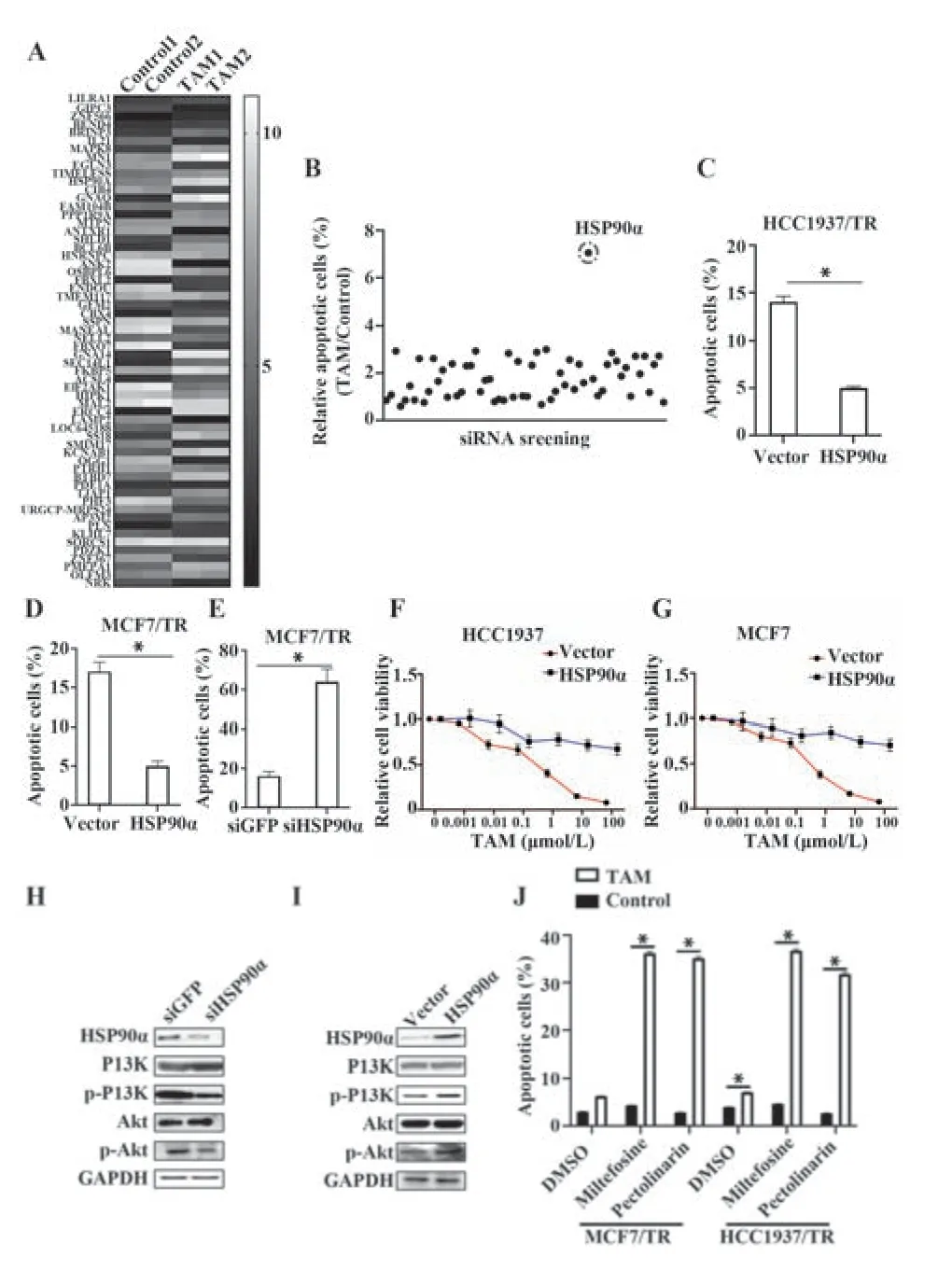
图2 HSP90α激活PI3K/Akt通路引起乳腺癌细胞TAM耐药Fig.2 HSP90α activates PI3K/Akt pathway to cause TAM resistance in breast cancer cells
2.3 miR-5003-3p靶 向HSP90α介导 乳 腺癌细胞TAM耐 药TAM处 理HCC1937/TR和MCF7/TR细胞 后,HSP90α mRNA水 平 均 升 高(P<0.05),但HSP90α转录水平无明显变化(P>0.05,图3A、B);miRDB在线分析发现,有多个miRNAs靶向HSP90α,TAM处理后,MCF7/TR细胞中miR-5003-3p表达水平降低(P<0.05,图3C);TAM处理后,HCC1937/TR细胞中miR-5003-3p表达水平降低(P<0.05,图3D);在HCC1937/TR和MCF7/TR细胞中过表达miR-5003-3p后,HSP90α表达水平降低(P<0.05);敲低miR-5003-3p后,HSP90α表达水平升高(P<0.05),见图3E;TAM处理后过表达miR-5003-3p,HCC1937和MCF7凋亡水平升高(P<0.05);TAM处理后并敲低miR-5003-3p,HCC1937和MCF7细胞凋亡水平降低(P<0.05),见图3F、G;同时,miR-5003-3p靶向HSP90α的3'UTR区(图3H);此外,敲低miR-5003-3p后,PI3K/Akt通路激活(图3I);过表达miR-5003-3p后,PI3K/Akt通路受到抑制(图3J)。
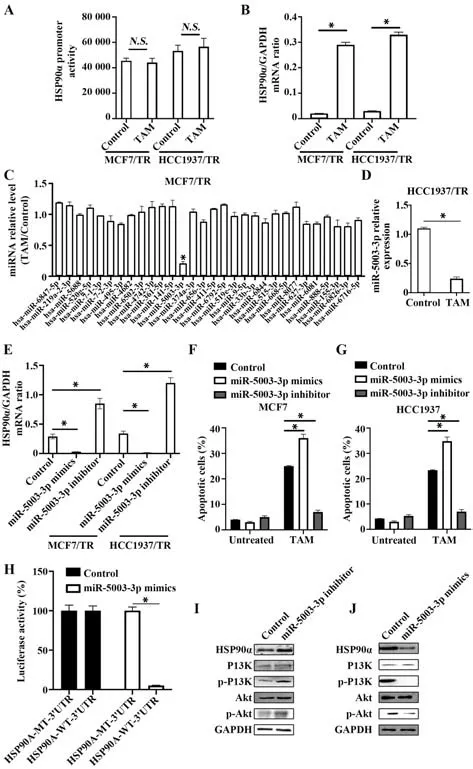
图3 miR-5003-3p靶向HSP90α介导乳腺癌细胞TAM耐药Fig.3 miR-5003-3p targeting HSP90α mediates TAM resistance in breast cancer cells
3 讨论
在过去的几十年,TAM是ER阳性乳腺癌最常见、最有效的内分泌治疗药物,显著提高了乳腺癌患者生存率[1]。然而,有30%~40%接受抗雌激素治疗的患者最终对TAM产生耐药性并导致复发,这是乳腺癌死亡的主要原因之一[8]。
本研究通过TAM梯度处理成功获得HCC1937/TR和MCF7/TR细胞。通过高通量测序和siRNA筛选鉴定了与乳腺癌细胞耐TAM的关键分子HSP90α。当敲低HSP90α时,HCC1937/FR细胞凋亡水平升高。过表达HSP90α后,HCC1937/TR和MCF7/TR细胞凋亡水平显著降低。敲低HSP90α后MCF7/TR细胞凋亡水平显著升高。在HCC1937和MCF7细 胞 中 过 表 达HSP90α并 用TAM处 理,HCC1937和MCF7显示出对TAM抑制增殖的抵抗(P<0.05)。HSP90α蛋白被称为癌症伴侣蛋白,是参与增殖、分化、凋亡、血管生成、转移、肿瘤发生、遗传变异等必要信号转导通路的蛋白质分子伴侣[9]。有研究报道,HSP90α在乳腺癌中的表达增加与细胞存活增加和预后不良相关[10]。此外,HSP90α抑制剂作为乳腺癌治疗的临床试验正在进行中[11]。因此,HSP90α抑制剂与TAM联合使用可能改善乳腺癌患者的预后。
据报道,内质网突变、内质网共激活因子上调、致癌途径激活等机制可导致内分泌治疗的耐药性[12-13]。尤其是TAM耐药乳腺癌细胞可能通过激活PI3K/Akt/mTOR和EGFR-MAPK信号通路克服药物诱导的细胞生存和增殖抑制[14]。敲低HSP90α后,PI3K和Akt的总体表达水平无明显变化,但磷酸化的PI3K和Akt表达水平降低,说明PI3K/Akt通路受到抑制;PI3K/Akt通路抑制剂Pectolinarin或Miltefo‐sine处理后,再用TAM处理,HCC1937/TR和MCF7/TR细胞凋亡水平显著升高。提示HSP90α通过激活PI3K/Akt通路引起乳腺癌对TAM的抗性。PI3K/Akt通路包括具有三个关键调控节点的细胞内信号转导酶家族:PI3K、Akt和mTOR[15]。PI3K可被多种信号激活,随后活化Akt[16]。激活后,p110 PIK3CA磷酸化磷脂酰肌醇PIP2以形成磷脂酰肌醇PIP3。Akt与PIP3的结合导致Akt从细胞质易位到质膜,其中3-磷酸肌醇依赖性蛋白激酶-1(PDK1)和Akt的共定位允许PDK1在苏氨酸308处磷酸化Akt。Akt的完全激活需要其在S473处被mTOR/Rictor复合物2(mTORC2)磷酸化。激活后,Akt磷酸化大量下游底物,这些底物通过调节mTOR/Raptor复合物1(mTORC1)活性调节细胞生长和蛋白质合成,随后增加增殖/细胞周期进程,抑制细胞凋亡,促进乳腺癌对TAM的抵抗。
miRNAs是真核生物中具有转录后调控基因表达功能的一类非编码小RNA[17]。本研究中,TAM处理后MCF7/TR和HCC1937/TR细胞中miR-5003-3p表达水平降低(P<0.05)。在HCC1937/TR和MCF7/TR细胞中,过表达miR-5003-3p后HSP90α表达水平降低;敲低miR-5003-3p后,HSP90α表达水平升高。TAM处理后过表达miR-5003-3p,HCC1937和MCF7凋亡水平升高(P<0.05);TAM处理后并敲低miR-5003-3p,HCC1937和MCF7凋亡水平降低。此外,敲低miR-5003-3p后,PI3K/Akt通路激活。过表达miR-5003-3p后,PI3K/Akt通路受到抑制。越来越多的证据表明,miRNA在肿瘤起始和恶性进展过程中发挥重要作用[18-19]。因此,基于miR-5003-3p的新抗癌疗法能够改善如乳腺癌患者TAM耐药问题。
综上所述,在受到持续化疗药物TAM处理后,乳腺癌细胞HCC1937和MCF7中靶向HSP90α mRNA的miR-5003-3p表达水平降低,HSP90α表达水平上升后激活PI3K/Akt通路,最终引起乳腺癌细胞对TAM的耐药。

