补体C5a/C5aR通路在小鼠缺血/再灌注肾损伤中的作用及机制①
张 坤 殷淑君 张 延 郑权友(解放军第305医院泌尿外科,北京 100017)
肾移植是治愈终末期肾病(end-stage renal dis‐eases,ESRD)的唯一手段。随着社会经济的发展和人口老龄化问题日益突出,我国ESRD患者人数不断攀升,而可移植的肾脏十分有限;此外,肾移植也面临很多关键问题尚未完全解决,特别是移植后肾功能的恢复及移植肾脏的长期存活。在肾脏移植过程中,缺血/再灌注损伤(ischemia reperfusion injury,I/RI)不可避免,将诱发急性肾损伤(acute kidney injury,AKI),增加移植物功能延迟恢复的风险,引发供体肾脏排斥反应,并最终导致移植肾功能丧失。因此,迫切需要明确缺血/再灌注肾损伤(isch‐emia reperfusion induced acute kidney injury,I/R-AKI)的发病机制,以便更好地保护移植肾功能。
多种因素参与I/R-AKI病理损伤过程,如缺氧,代谢应激,细胞死亡及氧自由基大量释放等。近年研究表明,免疫炎症反应在I/R-AKI病理生理过程中扮演重要角色,即“No inflammation,no I/R-AKI”。补体是天然免疫的重要组分,在清除病原微生物及调节免疫炎症反应过程中起着重要作用[1]。补体系统激活主要通过三种途径(经典途径、旁路途径和凝集素途径),并汇聚到C3和C5裂解,产生多种活性产物,最终组装为膜攻击复合物,介导细胞损伤并调节免疫炎症反应[2]。C5作为补体系统激活的枢纽分子,活化后裂解为C5a和C5b,C5a与靶细胞表面的C5aR结合发挥促炎、免疫调节等作用[2-3]。已有研究表明补体C5a/C5aR通路在肾间质纤维化及肾盂肾炎病理过程中发挥重要作用[4-6]。然而,补体C5a/C5aR通路介导I/R-AKI的作用及机制尚不明确。
中性粒细胞来源于骨髓的造血干细胞,是天然免疫系统的重要效应细胞,它吞噬病原体和颗粒,产生活性氧和活性氮,并释放抗菌肽。近年来的研究表明中性粒细胞在促进I/R-AKI病理过程中发挥重要的作用:在缺血后小鼠肾脏和早期AKI患者的活检标本中均检测到大量中性粒细胞浸润[7-8];中性粒细胞来源活性蛋白PAD4促进I/R-AKI[9];此外,研究发现抑制中性粒细胞活化因子分泌及向炎症部位趋化显著缓解I/R-AKI程度[10-11]。因此,研究中性粒细胞浸润及活化机制,探索可能的潜在治疗靶点具有十分重要的意义。然而,补体C5a/C5aR通路是否参与调节中性粒细胞浸润介导I/R-AKI尚不明确。本研究拟通过建立体内及体外I/R-AKI模型,探讨补体C5a/C5aR在I/R-AKI中的重要作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物60只雄性野生型小鼠,8~10周龄,20只同龄雄性C5aR基因敲除小鼠购自美国Jackson Mice,饲养于SPF级层流动物房,自由进食和饮水。
1.1.2 实验试剂及仪器C5aR、KIM-1及LY6G抗体(英国Abcam公司);Ccap3及Cyt C(美国Santa Cruz公司);人近曲肾小管上皮细胞系HK-2细胞(中国科学院昆明细胞库);TRIzol RNA提取试剂盒(美国Invitrogen公司);逆转录试剂盒(日本TaKaRa公司);实时荧光定量PCR试剂盒(美国Thermo公司);C5a ELISA检测试剂盒(美国BD公司);伊红染色液、苏木素染色液(上海碧云天生物技术有限公司);HRP标记山羊抗小鼠多克隆抗体、DAB显色试剂盒(北京中杉金桥生物技术公司);Dylight-594荧光标记二抗、Dylight-488荧光标记二抗(美国Bioleg‐end公司);DAPI(上海碧云天生物技术有限公司);PCR所需引物序列(上海生工生物工程股份有限公司);显微镜(Olympus);全自动生化分析仪(Dimen‐sion RXL Max)。
1.2 方法
1.2.1 小鼠的分组与建模40只野生型小鼠按随机数字表法分为假手术组、缺血20 min组、缺血30 min组、缺血40 min组,每组10只,再灌注24 h后取血及肾组织;剩余20只野生型小鼠和20只C5aR基因敲除小鼠进一步分为假手术组和缺血40 min组,每组各10只,再灌注24 h后取血及肾组织。采用夹闭双侧肾蒂的方法建立小鼠I/R-AKI模型[12]。首先腹腔注射1%戊巴比妥钠(50 mg/kg),麻醉后仰卧在37℃恒温手术台上,腹部备皮、消毒、铺无菌洞巾,沿腹部正中切口1 cm,分离左右肾蒂。假手术组不夹闭肾蒂,手术组用无损伤微动脉夹夹闭肾蒂,根据不同分组确定夹闭时间,恢复血流后,观察肾脏颜色由暗黑色恢复红色表明造模成功,逐层关腹,术后腹腔注射温生理盐水促进复苏。待小鼠苏醒后,放入鼠笼中正常进食进水。
1.2.2 人肾小管上皮细胞系HK-2的处理HK-2细胞2×105个/ml接种于6孔板或放置细胞玻片于12孔板中,轻轻摇晃混匀后于37℃、5%CO2培养箱中培养。待细胞长至约70%时,根据不同缺氧时间放入低氧箱(1%O2)中培养(6 h、12 h或24 h)后,弃上清并加入新鲜培养液混匀,放入37℃、21%O2、5%CO2培养箱,再行供氧培养6 h用于后续实验。
1.2.3 肾组织HE染色 肾组织标本经4%多聚甲醛固定后制成石蜡标本并切片(4 µm)。石蜡切片经脱蜡、水化后,伊红染色2 min,蒸馏水充分洗涤后,苏木素染色1 min,自来水冲洗返蓝,中性树胶封片,显微镜下观察并采集图像。采用双盲法进行肾损伤的半定量评价:在显微镜下观察皮髓质交界处肾小管上皮的损伤情况,每个肾脏在100倍光镜下至少选取5个视野,半定量评价分为7个等级(0级为无损伤;0<1级≤15%损伤;15%<2级≤30%损伤;30%<3级≤45%损伤;45%<4级≤60%损伤;60%<5级≤75%损伤;6级>75%损伤)。
1.2.4 血清尿素氮(BUN)、肌酐(Cre)测定 血清BUN、Cre值采用全自动生化分析仪测定。
1.2.5 IHC检 测C5aR、KIM-1、Ccap3和Cyt C表达 石蜡切片经脱蜡、水化、洗涤,微波修复抗原,3%H2O2去除组织中的内源性过氧化物酶,以5%BSA常温封闭30 min,加入抗C5aR(1∶200)、KIM-1(1∶400)、Ccap3(1∶200)和Cyt C(1∶200)抗体。4℃孵育过夜后,PBS洗涤,再以辣根过氧化物酶标记的二抗常温孵育1 h,经洗涤、DAB显色、苏木精复染、自来水返蓝、脱水、封片等步骤,最后于Olympus光学正置显微镜下观察并采集图像。图像采集后,通过Image J软件对各组图像染色面积进行半定量分析。
1.2.6 ELISA检测血清中C5a的水平 采用C5a ELISA检测试剂盒,按照说明书步骤测定小鼠血清中的C5a水平。
1.2.7 IF检测HK-2细胞C5aR表达 经缺氧再供氧培养处理的HK-2细胞玻片经PBS清洗,4%多聚甲醛固定,5%BSA常温封闭30 min,孵育抗C5aR(1∶200)抗体。4℃过夜后,PBS清洗,再以Dylight-594荧光标记的二抗常温孵育30 min,经洗涤、DAPI复染5 min,荧光抗淬灭剂封片后在Olympus荧光显微镜下观察并采集图像。
1.2.8 Western blot检测HK-2细胞C5aR表达 缺氧再供氧培养处理HK-2细胞加入蛋白裂解液进行冰上裂解30 min,低温离心并检测蛋白浓度。取50µg变性蛋白样品加入SDS-PAGE中进行电泳,经过转膜、漂洗、封闭,孵育一抗C5aR(1∶200)4℃过夜,再经过复温、漂洗,相应二抗室温孵育1 h,采用化学发光法上机检测。灰度值统计采用Image J软件进行半定量。
1.2.9 RT-PCR检测C5aR、KIM-1、CXCL2、MIP-1α和CXCR2的mRNA表达 取肾组织标本加液氮研磨后加入Trizol,依据试剂盒说明书提取总RNA。采用紫外分光光度计测量浓度,根据逆转录试剂盒说明书将mRNA逆转录为cDNA,然后用实时定量PCR法(ABSTEPONE)检测C5aR、KIM-1、CXCL2、MIP-1α和CXCR2的mRNA表达水平,以GAPDH作为内参,各样本的C值按公式2−ΔΔCt计算相对表达量。引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.10 IF检测肾组织中性粒细胞浸润情况 肾组织冰冻切片(6 µm)后,丙酮固定20 min,PBS洗涤,0.3%TritonX-100通透15 min,PBS洗涤,5%BSA封闭1 h,孵育一抗LY6G抗体(1∶100),4℃避光过夜,经复温、洗涤,孵育Dylight-488荧光标记的二抗1 h,经洗涤、DAPI复染核,再次洗涤、封片后在荧光显微镜下观察实验结果,并采集图像。
1.3 统计学处理 采用GraphPad Prism 5.0统计软件。计量资料以±s表示,两组间比较采用非配对t检验,两连续变量的相关性采用Pearson相关性分析,P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠I/R-AKI动物模型制备 为确保小鼠I/RAKI动物模型制备成功,实验组在37℃恒温条件下微血管夹同时夹闭双侧肾动脉;假手术组只打开腹腔,不夹闭肾动脉,可见肾脏呈鲜红色(图1A)。夹闭肾动脉后,肾脏颜色变为黑色(图1B),表明血管完全阻断;取出血管夹,肾脏再灌注后颜色逐渐转为红色(图1C),表明血供恢复。
图1 小鼠I/R前后肾脏颜色改变Fig.1 Color changes in progress of renal I/R in mice
2.2 小鼠不同缺血时间肾脏损伤比较和补体C5a、C5aR的表达情况 检测不同缺血时间肾脏病理损伤情况及补体C5a/C5aR表达水平,结果发现随着缺血时间延长,肾脏病理损伤逐渐加重,补体C5aR表达逐渐增强,且C5aR表达与肾损伤程度呈正相关(图2)。相应地,随缺血时间延长,BUN、Cre及C5a升高,且C5a与BUN及Cre之间具有显著正相关(图3)。以上结果表明,补体C5a/C5aR通路在小鼠I/R-AKI病理过程中发挥重要作用。
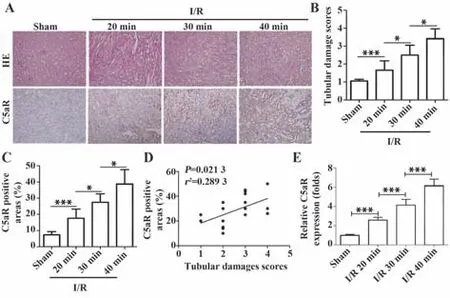
图2 小鼠不同缺血时间肾组织的病理改变和补体C5aR表达变化Fig.2 Histological changes and C5aR expression in renal tissues at different ischemic time points
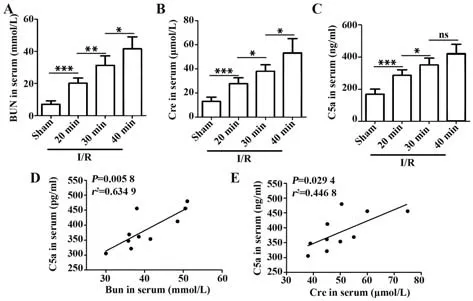
图3 小鼠不同缺血时间血清BUN、Cre和C5a水平Fig.3 Serum BUN,Cre and C5a levels in mice at different ischemic time points
2.3 HK-2细胞不同缺氧时间补体C5aR表达 采用HK-2细胞在体外模拟肾小管上皮细胞缺氧再供氧过程,不同缺氧时间条件下检测补体C5aR表达变化(图4)。结果发现,随着缺氧时间延长,补体C5aR表达逐渐增强,体外进一步证实补体C5aR参与缺氧再供氧引起的肾损伤过程。
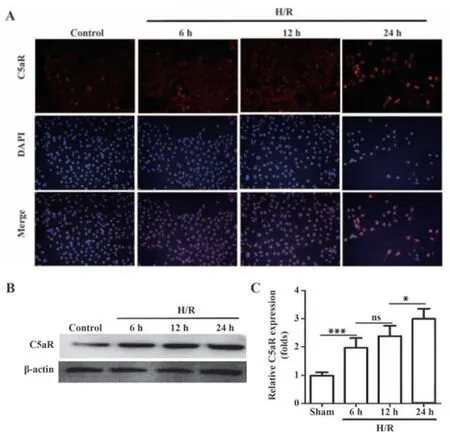
图4 HK-2细胞不同缺氧时间补体C5aR表达变化Fig.4 Expression of C5aR in HK-2 cells at different ischemic time points
2.4 C5aR基因敲除后小鼠肾脏损伤情况 建立野生型及C5aR基因敲除小鼠I/R-AKI模型,比较两组小鼠的肾功能及肾脏病理损伤等情况。结果发现,C5aR基因敲除小鼠相较于野生型小鼠BUN、Cre水平及肾脏病理损伤程度显著降低(图5)。同时检测各组小鼠肾损伤分子(KIM-1)及细胞凋亡蛋白(Ccap3和Cyt C)表达,发现C5aR基因敲除后上述指标表达显著下调(图6)。由此可知,C5aR基因敲除能显著减轻I/R-AKI。
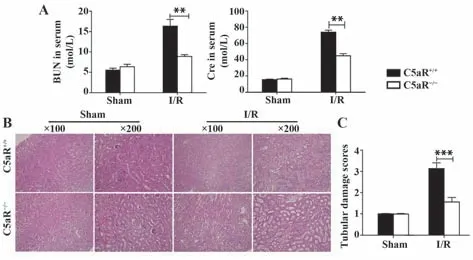
图5 C5aR基因敲除对I/R后BUN、Cre及肾组织病理损伤的影响Fig.5 Effect of C5aR gene knockout on BUN,Cre and histologic changes of renal tissues after I/R
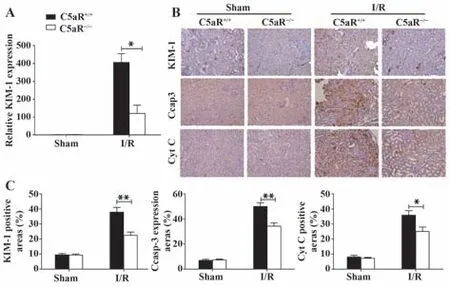
图6 C5aR基因敲除对I/R后肾组织KIM-1、Ccap3和Cyt C的影响Fig.6 Effect of C5aR gene knockout on expressions of KIM-1,Ccap3 and Cyt C in renal tissues after I/R
2.5 各组小鼠肾组织中性粒细胞浸润 检测I/R前后小鼠肾组织趋化因子CXCL2、MIP-1α和CXCR2的表达及中性粒细胞浸润情况。结果发现,I/R后中性粒细胞浸润相关趋化因子CXCL2、MIP-1α和CXCR2表达水平显著升高,中性粒细胞向肾组织大量迁移,而C5aR基因敲除后上述趋化因子水平及中性粒细胞的浸润较野生型小鼠明显降低(图7),表明补体C5a/C5aR通路可能通过促中性粒细胞浸润介导I/R-AKI病理过程。
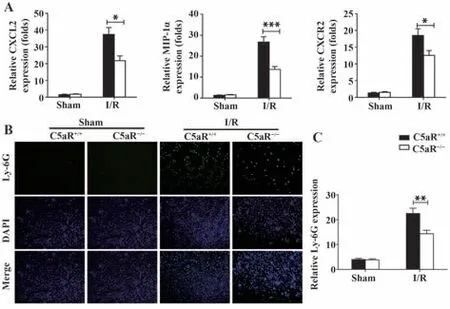
图7 C5aR基 因 敲 除 对I/R后 肾 组 织CXCL2、MIP-1和CXCR2的表达及中性粒细胞浸润的影响Fig.7 Effect of C5aR gene knockout on expressions of CXCL2,MIP-1 and CXCR2 in renal tissues and infiltration of neutrophils after I/R
3 讨论
肾移植过程中I/R损伤不可避免,可诱发急性肾损伤、移植物功能延迟恢复、排斥反应等,并最终导致移植肾功能丧失,但其机制尚未完全明确。本研究利用小鼠夹闭双侧肾蒂的方式构建动物模型,发现I/R后的补体C5a及C5aR的表达水平随着缺血时间的延长而明显增高,且与肾脏的损伤程度呈正相关。相应地,在体外利用人肾小管上皮细胞系(HK-2)上模拟细胞缺氧再供氧过程,发现C5aR表达随着缺氧时间的延长而明显上调。上述结果表明,补体C5a/C5aR可能在I/R-AKI病理过程中发挥重要作用。更重要的是,在补体C5aR基因敲除后,肾组织的病理损伤、BUN、Cre、KIM-1和细胞凋亡水平均明显降低,由此推断补体C5a/C5aR促进I/R-AKI病理过程。
免疫炎症反应介导I/RI,中性粒细胞浸润是加剧该病理过程的重要事件。有研究显示在肝I/R中发现大量嗜中性粒细胞募集到肝脏,细胞因子、趋化因子大量活化[13]。REID等[14]在肾的I/RI研究中发现I/R 6 h后,血液和肾脏中活化的中性粒细胞开始增加,I/R 24 h后,血液和肾脏中的绝对中性粒细胞计数显著增加,I/R 48 h后,肾脏中的中性粒细胞仍保持升高。相似地,本研究发现I/R 24 h后,大量的中性粒细胞向肾脏募集。那么在肾I/R过程中,中性粒细胞的募集是否受到补体C5a/C5aR的调控?有研究发现C5a是粒细胞的有效化学引诱物,C5aR缺乏的小鼠对粒细胞募集具有抗性[15]。另有研究发现补体C5aR能介导中性粒细胞的活化和扩增,加重ANCA引起的坏死性新月体肾小球肾炎[16]。本研究中C5aR基因敲除小鼠中性粒细胞的浸润相对野生组明显减少,证实了补体C5aR能调节中性粒细胞的募集,加剧缺血性损伤。有研究显示,CXCL2、MIP-1α和CXCR2等趋化因子在中性粒细胞的募集和激活中发挥关键作用[17]。本研究发现I/R 24 h后,CXCL2、MIP-1α和CXCR2等趋化因子表达显著升高,C5aR基因敲除小鼠相较野生型小鼠明显降低,证实了C5aR可能通过调节CXCL2、MIP-1α和CXCR2等趋化因子的表达,诱使中性粒细胞募集到肾组织中并激活,加重肾脏损伤。有研究证实抑制P38-MAPK信号通路能减轻肾I/R损伤,而补体系统能显著激活P38-MAPK信号通路[18]。由此,推断C5a/C5aR可能通过P38-MAPK信号通路促进中性粒细胞浸润介导I/R-AKI,有待下一步研究证实。
此外,有大量的研究通过抑制补体活性成分来改善器官的I/RI。有研究利用一种合成的siRNA抑制C3的信使RNA,从而抑制补体激活并预防IRI[19]。还有研究利用抑制全部或部分补体系统的药物来进行干预,如可溶性补体受体1型(sCR1),C1抑制剂(C1-INH)已被证明可以减少各种器官的I/R损伤[20]。因此,开发针对补体C5aR的抑制剂来减少I/RI具有重要研究意义和临床应用价值。
本研究还存在许多不足之处,如:缺乏对中性粒细胞功能的研究;缺乏对中性粒细胞与肾损伤之间进一步分子机制研究;所选文献资料有限,缺乏相关临床研究成果等;下一步将针对这些不足之处进行更深入的研究探讨。

