金银花提取液通过调控NLRP3/ASC/caspase-1信号通路对溃疡性结肠炎大鼠肠道黏膜的影响①
葛柳青 周 峰 王晓兵 聂家艳(武汉大学中南医院消化内科,武汉 430071)
溃疡性结肠炎(ulcerative colitis,UC)作为炎症性肠疾病具有非特异性,可累及结肠各部位,临床表现为腹痛、腹泻、脓血便等,威胁患者健康[1]。临床通常采用氨基水杨酸类、激素类或免疫抑制剂治疗UC,短期内可控制和缓解患者症状,但长期使用可能导致间质性肾炎、胰腺炎[2]。因此寻找有效治疗UC且无副作用的药物十分必要。金银花具有清热解毒、抗炎、抗氧化等多种药理性作用,是多种中药制剂主要成分,用于多种疾病治疗[3]。研究表明,金银花提取物多糖可改善葡聚糖硫酸钠(DSS)诱导的UC小鼠免疫力低下症状[4]。核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor family pyrin domain containing 3,NLRP3)炎症小体主要包括NLRP3、含CARD结构域的凋亡相关颗粒样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)及半胱氨酸天冬氨酸蛋白酶1(caspase-1),NLRP3炎症小体异常激活与炎症性肠病发生有关[5]。因此,本研究通过构建UC大鼠模型,并灌胃给予不用剂量金银花提取物,探讨金银花基于NLRP3/ASC/caspase-1信号通路对UC大鼠肠道黏膜的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物65只8周龄SPF级雄性成年Wistar大鼠购于辽宁长生生物技术股份有限公司[SCXK(辽)2020-0002],体质量(200±20)g,自由获得水和食物,23~25℃、60%相对湿度、12 h/12 h明暗交替饲养。
1.1.2 试剂与仪器 金银花提取液(1 g/ml)为本实验室提取;尼日利亚菌素钠盐(Nigericin sodium salt,NSS,美国MedChemExpress公司);2,4,6-三硝基苯磺酸(TNBS,美国Sigma公司);超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);反转录试剂盒、AceQqPCR SYBR Green Mix、Trizol Reagent核酸分离试剂(北京百奥莱博科技有限公司);TNF-α、IL-6 ELISA试剂盒(武汉菲恩生物科技有限公司);兔抗鼠NL‐RP3、ASC、caspase-1、IL-1β一抗(美国Cell Signaling Technology公司);HE染色试剂盒、RIPA裂解液、BCA蛋白检测试剂盒(北京索莱宝生物科技有限公司);辣根过氧化物酶标记的山羊抗兔二抗(A0208,上海碧云天生物技术有限公司);IX51荧光显微镜(日本Olympus公司);Multiskan FC酶标仪(美国Thermo Fisher公司);Gel-Doc凝胶成像系统、荧光定量PCR仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 UC大鼠模型构建及分组65只大鼠适应性喂养1周,随机选取10只作为对照组,其余大鼠采用TNBS诱导UC模型[6]。大鼠禁食不禁水24 h,3%戊巴比妥钠麻醉,距肛门约8 cm结肠处注射含5%TNBS和50%乙醇的混合液(4 ml/kg),捏紧肛门倒置5 min,置于头低足高位至自然苏醒。2~3 d后大鼠均出现稀便、肛周污秽、便血等症状,随机抽取5只大鼠进行结肠标本病理学检查,确认造模成功。将50只成功造模的大鼠随机分为UC组、金银花低、中、高剂量组和金银花+NSS(NLRP3激活剂)组,每组10只。
1.2.2 给药 造模成功后次日,金银花低、中、高剂量组分别灌胃给予40、80、120 mg/(kg·d)金银花提取液[7]。金银花+NSS组灌胃给予120 mg/(kg·d)金银花提取液和4 mg/(kg·d)NSS,对照组、UC组灌胃给予等体积生理盐水,1次/d,连续4周[8]。根据大鼠体质量、大便形状及便血情况对大鼠进行疾病活动指数(disease activity index,DAI)评分[9]。
1.2.3 样本收集 末次给药24 h后,3%戊巴比妥钠麻醉大鼠,腹主动脉取血2 ml,离心,收集上清,−80℃保存。处死大鼠,收集结肠组织,生理盐水冲洗,测量结肠长度,远端结肠固定于10%多聚甲醛,梯度乙醇脱水,石蜡包埋。近端结肠−80℃保存用于后续实验。
1.2.4 大鼠血清指标检测 取1.2.3中保存的血清,试剂盒检测大鼠血清SOD、MDA、LDH、TNF-α、IL-6水平,严格按照试剂盒说明书操作。
1.2.5 HE染色检测大鼠结肠黏膜病理学变化
取1.2.3中大鼠结肠黏膜石蜡切片,切片(4 µm),HE染色,进行显微病理观察,并对其损伤程度进行Morris标准评分[10]。
1.2.6 RT-PCR检测大鼠肠道黏膜NLRP3/ASC/caspase-1通路mRNA表达 取1.2.3中−80℃保存的大鼠结肠黏膜组织,提取总RNA,反转录为cDNA,进行RT-PCR反应,反应体系:ULtraSYBR mixture 10µl、cDNA 2.0µl、正反向引物各2.0µl、去离子纯化水4.0 µl;反应条件:93℃30 s、93℃5 s、65℃30 s,共40个循环。引物序列见表1,引物均由上海生工生物工程技术有限公司设计合成。2−ΔΔCt计算NLRP3、ASC、caspase-1、IL-1β mRNA相对表达。

表1 引物序列及产物长度Tab.1 Primer sequences and product length
1.2.7 Western blot检测大鼠肠道黏膜NLRP3/ASC/caspase-1通路蛋白表达 取1.2.3中−80℃保存的大鼠结肠黏膜组织,提取总蛋白,BCA试剂盒检测蛋白浓度,SDS-PAGE凝胶电泳分离蛋白,转至PVDF膜,TBST清洗,5%脱脂奶粉封闭,加入兔抗鼠NLRP3、ASC、caspase-1、IL-1β、GAPDH一抗稀释液4℃孵育过夜,TBST清洗3次,加入辣根过氧化物酶标记的山羊抗兔二抗稀释液室温孵育1 h,TBST清洗后结束,蛋白凝胶成像系统成像,Image Pro Plus 6.0软件分析目的条带灰度值。
1.3 统计学分析 采用SPSS19.0软件分析数据,计量资料以±s表示,多组间比较采用F值检验,组间两两比较采用SNK-q检验,P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠一般情况比较 对照组大鼠毛发光泽,饮食、活动、粪便正常,精神状态良好;UC组大鼠毛发干枯,饮食减少,粪便稀或不成形,肛周红肿有脓血分泌,精神状态不良;与UC组比较,金银花各剂量组大鼠饮食、精神状态有所改善,偶有稀便,肛周干燥,而金银花+NSS组大鼠饮食、粪便及精神状态改善不明显。与对照组比较,UC组大鼠DAI显著升高,结肠变短(P<0.05);与UC组比较,金银花低、中、高剂量组DAI显著降低,结肠增长,且呈剂量依赖性(P<0.05);与金银花高剂量组比较,金银花+NSS组大鼠DAI显著升高,结肠变短(P<0.05,图1、表2)。
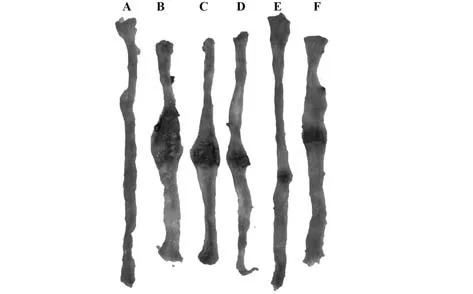
图1 各组大鼠结肠长度比较(×40)Fig.1 Comparison of colon length of rats in each group(×40)
表2 各组大鼠DAI及结肠黏膜损伤程度比较(±s,n=10)Tab.2 Comparison of DAI and colonic mucosal injury in each group(±s,n=10)
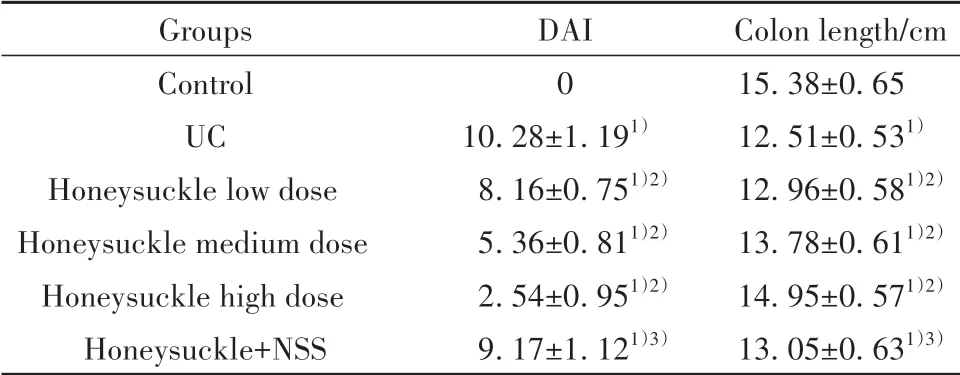
表2 各组大鼠DAI及结肠黏膜损伤程度比较(±s,n=10)Tab.2 Comparison of DAI and colonic mucosal injury in each group(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with UC group,2)P<0.05;compared with honeysuckle high dose group,3)P<0.05.
Groups Control UC Honeysuckle low dose Honeysuckle medium dose Honeysuckle high dose Honeysuckle+NSS DAI 0 10.28±1.191)8.16±0.751)2)5.36±0.811)2)2.54±0.951)2)9.17±1.121)3)Colon length/cm 15.38±0.65 12.51±0.531)12.96±0.581)2)13.78±0.611)2)14.95±0.571)2)13.05±0.631)3)
2.2 各组大鼠结肠黏膜病理表现HE染色结果表明,对照组大鼠结肠黏膜完整,固有层内腺体结构清晰,排列规则,杯状细胞丰富,上皮细胞排列整齐,无炎症细胞浸润;UC组大鼠结肠黏膜缺损严重,腺体破损或消失,杯状细胞减少,存在大量炎症细胞浸润;金银花低剂量组结肠黏膜部分缺损,存在部分炎症细胞浸润,相较于UC组,结肠黏膜形态有所改善;金银花中、高剂量组结肠黏膜缺损明显改善,存在少量炎症细胞浸润,腺体结构相对完整,且金银花高剂量组结肠黏膜形态与对照组相似;金银花+NSS组结肠黏膜缺损程度稍轻,与UC组相似(图2)。与对照组比较,UC组黏膜损伤程度评分显著升高(P<0.05);与UC组比较,金银花低、中、高剂量组黏膜损伤程度评分显著降低,且呈剂量依赖性(P<0.05);与金银花高剂量组比较,金银花+NSS组黏膜损伤程度评分均显著升高(P<0.05,表3)。
表3 各组大鼠结肠黏膜损伤程度比较(±s,n=10)Tab.3 Comparison of injury degree of colonic mucosa in each group(±s,n=10)

表3 各组大鼠结肠黏膜损伤程度比较(±s,n=10)Tab.3 Comparison of injury degree of colonic mucosa in each group(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with UC group,2)P<0.05;compared with honeysuckle high dose group,3)P<0.05.
Groups Control UC Honeysuckle low dose Honeysuckle medium dose Honeysuckle high dose Honeysuckle+NSS Degree of colonic mucosal injury 0 3.76±0.481)3.15±0.451)2)2.74±0.391)2)1.57±0.361)2)3.38±0.421)3)
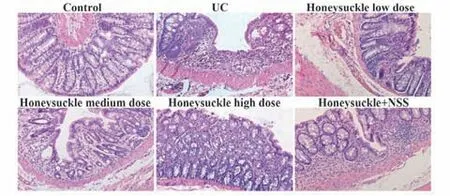
图2 HE染色观察大鼠结肠黏膜病理形态(×200)Fig.2 HE staining to observe pathological morphology of colonic mucosa in rats(×200)
2.3 各组大鼠血清SOD、MDA、LDH水平比较 与对照组比较,UC组血清MDA、LDH水平显著升高,而SOD水平显著降低(P<0.05);与UC组比较,金银花低、中、高剂量组各项指标逆转,且呈剂量依赖性(P<0.05);与金银花高剂量组比较,金银花+NSS组大鼠血清MDA、LDH水平显著升高,SOD水平显著降低(P<0.05,表4)。
表4 各组大鼠血清LDH、SOD、MDA水平比较(±s,n=10)Tab.4 Comparison of serum LDH,SOD and MDA levels of rats in each group(±s,n=10)
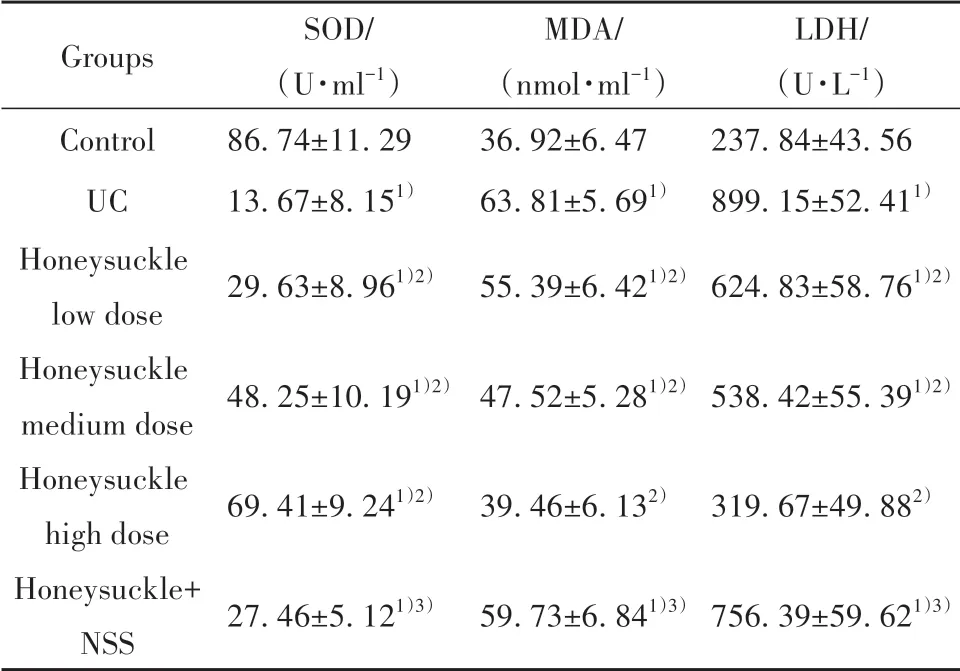
表4 各组大鼠血清LDH、SOD、MDA水平比较(±s,n=10)Tab.4 Comparison of serum LDH,SOD and MDA levels of rats in each group(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with UC group,2)P<0.05;compared with honeysuckle high dose group,3)P<0.05.
Groups Control UC Honeysuckle low dose Honeysuckle medium dose Honeysuckle high dose Honeysuckle+NSS SOD/(U·ml−1)86.74±11.29 13.67±8.151)29.63±8.961)2)48.25±10.191)2)69.41±9.241)2)27.46±5.121)3)MDA/(nmol·ml−1)36.92±6.47 63.81±5.691)55.39±6.421)2)47.52±5.281)2)39.46±6.132)59.73±6.841)3)LDH/(U·L−1)237.84±43.56 899.15±52.411)624.83±58.761)2)538.42±55.391)2)319.67±49.882)756.39±59.621)3)
2.4 各组大鼠血清TNF-α、IL-6水平比较 与对照组比较,UC组TNF-α、IL-6水平显著升高(P<0.05);与UC组比较,金银花低、中、高剂量组两项指标水平均显著降低,且呈剂量依赖性(P<0.05);与金银花高剂量组比较,金银花+NSS组大鼠TNF-α、IL-6水平显著升高(P<0.05,表5)。
表5 各 组 大 鼠 血 清TNF-α、IL-6水 平 比 较(±s,n=10,pmol/ml)Tab.5 Comparison of serum TNF-α,IL-6 levels of rats in each group(±s,n=10,pmol/ml)
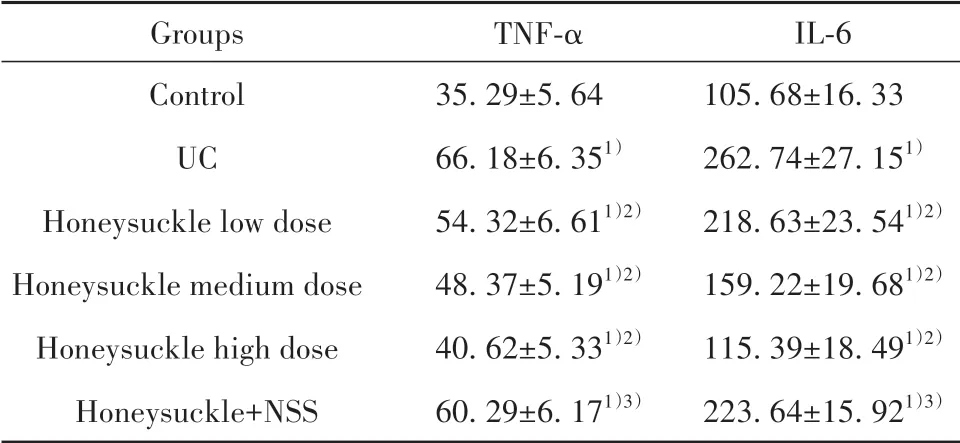
表5 各 组 大 鼠 血 清TNF-α、IL-6水 平 比 较(±s,n=10,pmol/ml)Tab.5 Comparison of serum TNF-α,IL-6 levels of rats in each group(±s,n=10,pmol/ml)
Note:Compared with control group,1)P<0.05;compared with UC group,2)P<0.05;compared with honeysuckle high dose group,3)P<0.05.
Groups Control UC Honeysuckle low dose Honeysuckle medium dose Honeysuckle high dose Honeysuckle+NSS TNF-α 35.29±5.64 66.18±6.351)54.32±6.611)2)48.37±5.191)2)40.62±5.331)2)60.29±6.171)3)IL-6 105.68±16.33 262.74±27.151)218.63±23.541)2)159.22±19.681)2)115.39±18.491)2)223.64±15.921)3)
2.5 各组大鼠结肠黏膜组织NLRP3/ASC/caspase-1通路mRNA表达比较 与对照组比较,UC组大鼠NLRP3、ASC、caspase-1、IL-1β mRNA表达显著升高(P<0.05);与UC组比较,金银花低、中、高剂量组NLRP3、ASC、caspase-1、IL-1β mRNA水平均显著降低,且呈剂量依赖性(P<0.05);与金银花高剂量组比较,金银花+NSS组大鼠NLRP3、ASC、caspase-1、IL-1β mRNA表达显著升高(P<0.05,表6)。
表6 各组大鼠NLRP3/ASC/caspase-1通路mRNA表达比较(±s,n=10)Tab.6 Comparison of NLRP3/ASC/caspase-1 pathway mRNA expressions in rats of each group(±s,n=10)
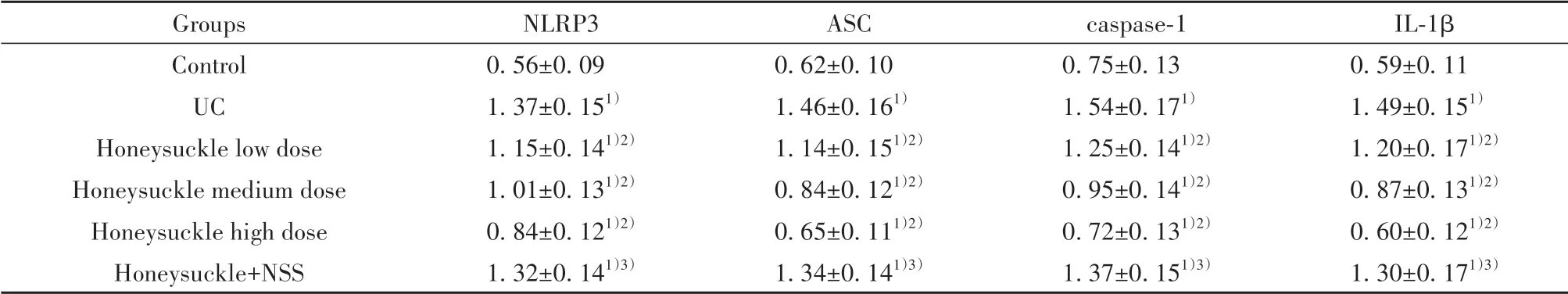
表6 各组大鼠NLRP3/ASC/caspase-1通路mRNA表达比较(±s,n=10)Tab.6 Comparison of NLRP3/ASC/caspase-1 pathway mRNA expressions in rats of each group(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with UC group,2)P<0.05;compared with honeysuckle high dose group,3)P<0.05.
Groups Control UC Honeysuckle low dose Honeysuckle medium dose Honeysuckle high dose Honeysuckle+NSS NLRP3 0.56±0.09 1.37±0.151)1.15±0.141)2)1.01±0.131)2)0.84±0.121)2)1.32±0.141)3)ASC 0.62±0.10 1.46±0.161)1.14±0.151)2)0.84±0.121)2)0.65±0.111)2)1.34±0.141)3)caspase-1 0.75±0.13 1.54±0.171)1.25±0.141)2)0.95±0.141)2)0.72±0.131)2)1.37±0.151)3)IL-1β 0.59±0.11 1.49±0.151)1.20±0.171)2)0.87±0.131)2)0.60±0.121)2)1.30±0.171)3)
2.6 各组大鼠结肠黏膜组织NLRP3/ASC/caspase-1通路蛋白表达比较 与对照组比较,UC组大鼠NLRP3、ASC、caspase-1、IL-1β蛋白表达显著升高(P<0.05);与UC组比较,金银花低、中、高剂量组上述蛋白表达均显著降低,且呈剂量依赖性(P<0.05);与金银花高剂量组比较,金银花+NSS组大鼠各蛋白表达显著升高(P<0.05,表7、图3)。
表7 各组大鼠NLRP3/ASC/caspase-1通路蛋白表达比较(±s,n=10)Tab.7 Comparison of NLRP3/ASC/caspase-1 pathway protein expressions in rats of each group(±s,n=10)
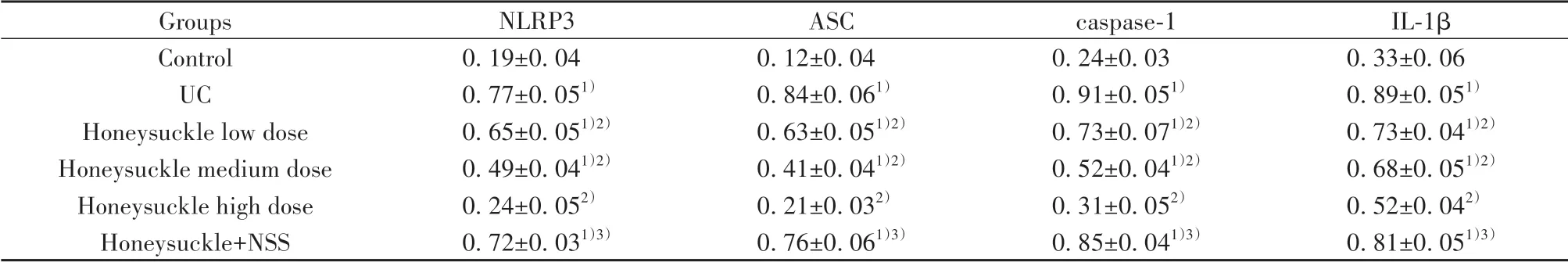
表7 各组大鼠NLRP3/ASC/caspase-1通路蛋白表达比较(±s,n=10)Tab.7 Comparison of NLRP3/ASC/caspase-1 pathway protein expressions in rats of each group(±s,n=10)
Note:Compared with control group,1)P<0.05;compared with UC group,2)P<0.05;compared with honeysuckle high dose group,3)P<0.05.
Groups Control UC Honeysuckle low dose Honeysuckle medium dose Honeysuckle high dose Honeysuckle+NSS NLRP3 0.19±0.04 0.77±0.051)0.65±0.051)2)0.49±0.041)2)0.24±0.052)0.72±0.031)3)ASC 0.12±0.04 0.84±0.061)0.63±0.051)2)0.41±0.041)2)0.21±0.032)0.76±0.061)3)caspase-1 0.24±0.03 0.91±0.051)0.73±0.071)2)0.52±0.041)2)0.31±0.052)0.85±0.041)3)IL-1β 0.33±0.06 0.89±0.051)0.73±0.041)2)0.68±0.051)2)0.52±0.042)0.81±0.051)3)
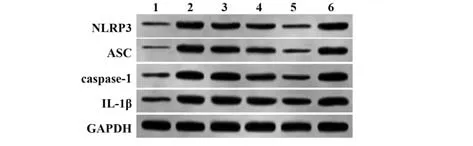
图3 各组大鼠NLRP3/ASC/caspase-1通路蛋白表达比较Fig.3 Comparison of NLRP3/ASC/caspase-1 pathway protein expressions in rats of each group
3 讨论
本研究采用TNBS法构建UC大鼠模型,结果表明UC组大鼠精神状态不良,饮食减少,粪便异常,肛周红肿有脓血分泌,结肠变短,HE染色结果表明UC大鼠结肠黏膜缺损严重,腺体破损或消失,杯状细胞减少,存在大量炎症细胞浸润,结肠组织损伤严重,提示UC大鼠模型构建成功,可用于后续实验。
炎症是机体对病原微生物感染和组织损伤的一种快速协调反应,炎症引起的肠黏膜通透性增加,肠道黏膜屏障功能障碍及肠黏膜坏死被认为是UC发生的重要机制[11]。炎症小体是由多个蛋白组成的复合物,是炎症反应中的重要组成,与UC等多种炎症性疾病发生有关[12]。本研究表明,UC大鼠血清TNF-α、IL-6水平显著高于对照组,结肠组织存在大量炎症细胞浸润,提示UC发生过程中存在炎症反应。NLRP3炎症小体与多种疾病发生有关,是研究最多的一种炎症小体,主要由NLRP3、ASC和cas‐pase-1组成。当NLRP3被微生物产物、内源性分子等激活后,NLRP3的吡咯结构域与ASC的同型相互作用,募集pro-caspase-1活化caspase-1,促进IL-1β分泌,参与炎症性疾病发生[13]。GONG等[14]研究表明,姜黄素通过抑制NLRP3/ASC/caspase-1通路抑制炎症因子IL-6、IL-1β激活,缓解DSS诱导的小鼠结肠炎。本研究表明,UC组大鼠NLRP3、ASC、caspase-1、IL-1β蛋白表达显著高于对照组,提示NLRP3/ASC/caspase-1信号通路与UC发生有关。
金银花属于忍冬科植物,是我国传统中药材,金银花提取物及其有效成分具有抗炎、抗菌、抗氧化、解热等作用,能够用于发烧、上呼吸道感染、喉咙炎症、类风湿关节炎等多种疾病治疗[15-16]。UC是一种由过度炎症和氧化应激引起的肠上皮损伤和破坏,钱雪芬等[17]研究认为,金银花水煎液可能通过降低炎症因子水平改善患者氧化应激损伤,提高UC患者临床治疗有效率。本研究表明,金银花能够改善UC大鼠状态,减轻大鼠结肠组织损伤,提示金银花可能用于UC临床治疗。JEON等[18]研究表明,DSS诱导的UC大鼠结肠组织脂质过氧化代表性产物MDA活性显著增强,而CAT、SOD等抗氧化酶表达显著降低。本研究发现,UC组大鼠MDA、LDH水平显著升高,而SOD水平显著降低,金银花提取液灌胃后大鼠血清MDA、LDH水平降低,SOD水平提高,提示金银花可能通过抑制结肠黏膜组织氧化应激减轻大鼠结肠组织损伤。LIU等[19]研究表明,金银花提取物抑制抑郁症小鼠海马组织NLRP3、cas‐pase-1、IL-1β表达,对抑郁症小鼠具有较强保护作用。阮辉辉等[7]研究表明,金银花提取物可能通过抑制ROS产生抑制NLRP3炎症小体通路介导的促炎因子IL-1β、IL-18释放,缓解重症急性胰腺炎大鼠肺损伤。本研究表明,金银花组大鼠NLRP3、ASC、caspase-1蛋白表达显著降低,提示金银花可能抑制UC大鼠NLRP3/ASC/caspase-1信号通路激活。NSS是NLRP3的激活剂,与金银花高剂量组比较,金银花+NSS组大鼠结肠损伤程度显著升高,大鼠血清MDA、LDH、TNF-α、IL-6水平显著升高,进一步说明金银花可能通过抑制NLRP3/ASC/caspase-1信号通路缓解UC大鼠结肠黏膜损伤,可能是金银花治疗UC的潜在机制。
综上,金银花提取液可能通过抑制NLRP3/ASC/caspase-1信号通路治疗UC大鼠结肠黏膜损伤,可能是临床治疗UC的潜在药物。本研究仅从大鼠实验探讨了金银花在UC结肠黏膜损伤中的可能机制,下一步需结合细胞实验进一步探讨金银花提取液通过调节NLRP3/ASC/caspase-1信号通路对结肠细胞损伤的影响,为保证实验完整性,后续实验应设置NLRP3激活剂对照组,为金银花临床治疗UC提供实验基础。

