血管支架内壁微织构参数对近壁面血流特性的影响
郑凯瑞,杨发展*,赵国栋,卞东超,黄 珂,车成业
(1.青岛理工大学 机械与汽车工程学院,山东 青岛 266250;2. 青岛大学 医学院附属医院,山东 青岛 266000)
心脑血管疾病因具有高发病率、高致残率、高复发率、高死亡率等显著特点,已成为人类健康的头号杀手[1-3]。动脉粥样硬化是心脑血管疾病最常见的病症形式,主要是由于血液中的油脂和未能及时排出体外的垃圾沉积在血管壁上造成血管狭窄堵塞,引发心脑血管疾病[4-5]。预计到2030年,全球每年因心血管疾病死亡人数达到2 330万[6]。目前最常用的治疗血管狭窄、堵塞的方式是介入治疗,通过在病变部位置入支架来撑开血管,保持血流畅通[7]。然而,现有的医学研究发现支架介入后的再狭窄率居高不下,严重影响治疗效果[8]。设计开发新型血管支架、降低支架出现再狭窄的概率是未来血管支架研究和发展的必然趋势。郭景振等[9]设计了一款新型药物洗脱支架,支架内表面直径为 8 mm,厚度为 0.08 mm,长度为38.3 mm。通过有限元仿真分析其力学性能,发现新型支架在回收过程中不会发生断裂,支架的压握均匀性较好,为血管再狭窄后的二次治疗提供了便利,但不能降低血管再狭窄的概率。Hehrlein等[10]设计了一种新型生物可吸收锌合金支架,支架长20 mm,将其置入21头幼猪的股动脉分叉处,随访1到3个月。通过血管造影和组织形态学研究发现,与刚性镍钛合金支架相比,可吸收锌支架显示出较少的新内膜增生,该支架为降低血管再狭窄提供了新的思路。然而,血管支架被降解吸收之后,再狭窄的问题仍不可避免。支架支撑血管示意如图1所示[11]。近年来对血管支架材料、表面涂层等方面研究较多,在其内表面设计加工微织构的研究鲜有报道。
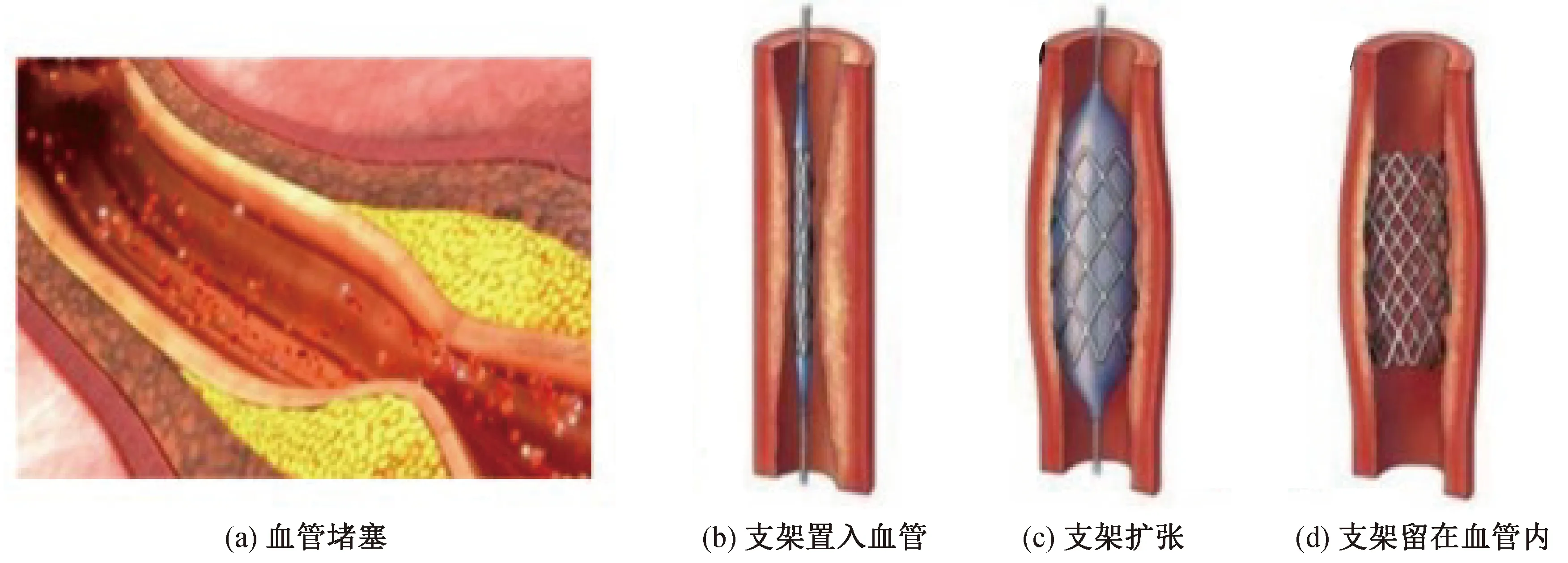
图1 支架支撑血管示意[11]Fig. 1 Schematic diagram of stent support vessel
仿生微织构因具有减阻、抗黏附的优势开始越来越多地被应用到加工制造领域。Sun等[12]在刀具表面加工出不同尺寸的沟槽微织构,通过进行干切削铝合金实验和仿真模拟,发现在一定尺寸范围内,与传统无织构刀具相比,微织构刀具对于减少刀-屑接触面积和摩擦系数有积极作用。同时,微织构的存在能够有效减少黏附区域,具有显著的抗黏附作用。Zhang等[13]采用激光加工技术在YG8刀具表面设计了直线形、正弦形和菱形微织构,通过进行切削钛合金实验,发现直线形微织构的存在能有效地减少前刀面和后刀面磨损面积,降低前刀面磨损强度,提高工件加工的表面质量。此外,表面微织构还具有良好的疏水性、减摩效果和生物相容性,在医学领域具有广泛的应用前景。李江澜等[14]采用飞秒加工技术在聚甲基丙烯酸甲酯(PMMA)表面上制备出光栅型和方柱型微织构,通过对上述微织构进行形貌分析和接触角测量,发现方柱型微织构具有较好的疏水性。刘宇航等[15]优化了在316L医用不锈钢表面加工微织构时的激光加工参数,减少沟槽宽度,增大沟槽高度且减少微织构加工过程中的热损伤,在医用不锈钢表面起到更好的减磨效果。Li等[16]发现仿生微/纳米结构具有最佳的生物活性和生物相容性,因而提出一种利用复合微/纳米结构控制钛合金种植体骨整合的创新功能化策略,在医学应用领域具有重要意义。Ezura等[17]通过实验研究发现,经过激光加工微织构处理的样品,其生物相容性比未经过激光加工处理的样品更好。Tahmasebifar等[18]通过细胞培养研究发现,在AZ91D镁合金板上加工出微织构可以使试样表现出良好的生物相容性。
基于上述学者的研究,本文在管状血管支架内表面设计了面积占有率为20.4%的正六边形凸起微织构,采用有限元分析法,探究在面积占有率相同的情况下,不同高度的微织构对近壁面处血流状态的影响,并揭示其影响机理,以期为新型血管支架的研发提供新方法。
1 模型与方程
1.1 模型构建
采用SolidWorks绘图软件建立无织构血管支架和面积占有率为20.4%,高度分别为30、35、40、45和 50 μm的管状正六边形凸起微织构血管支架三维模型。支架长10 mm、内径1.8 mm,微织构支架三维模型如图2所示。
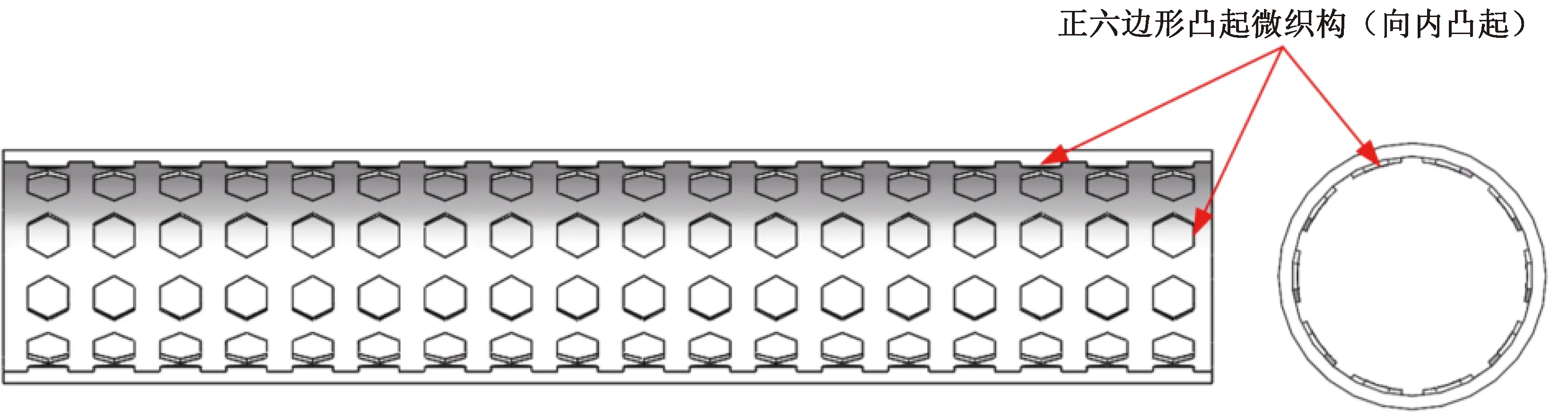
图2 管状微织构血管支架三维模型Fig. 2 Three dimensional model of tubular micro textured vascular stent
采用Ansys中的Workbench模块对血管支架模型进行流体力学仿真。根据文献[19-20]设置材料属性、边界条件:
1)将血液视为不可压缩的牛顿流体,密度ρ=1 060 kg/m3,动力黏度μ=0.004 Pa·s;
2)忽略血管厚度的影响;
3)心脏的搏动包括舒张期和收缩期,心脏每收缩和舒张一次构成一个心动周期,因而血液流速也会产生周期性变化;在一个心动周期内,血流速度随时间变化情况如图3所示;
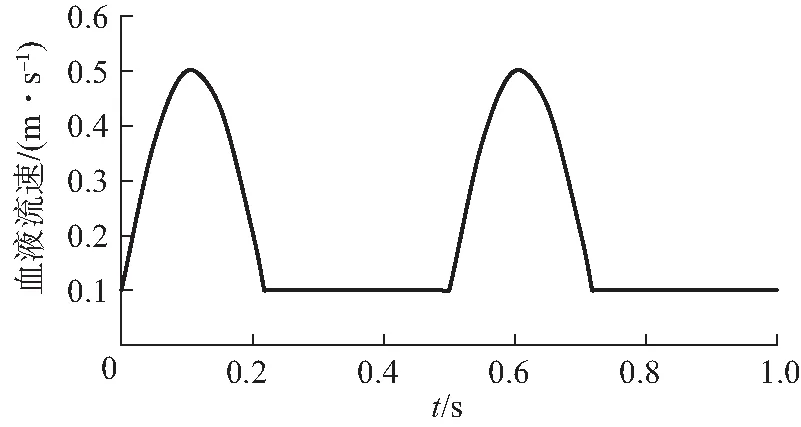
图3 心动周期内不同时刻血液流速Fig. 3 Blood flow velocity at different times in cardiac cycle
4)血液的出口压力为默认值。
1.2 血液流动方程与有限元分析步骤
血液在流动过程中的方程为三维非稳态N-S方程,其具体表达式为[21-22]:
(1)
(2)
(3)
式中:u、v、w分别为血液在x、y、z方向上的速度分量;p表示血液压力;ρ为血液密度;μ为血液黏度。
有限元方法是将整体分成有限个部分进行分析的方法,步骤如图4所示。首先在Solidworks中创建血管支架模型,然后将其导入Geomerty模块,在该模块中抽取流体域,并对所抽取的流体域命名为Blood。将血液在支架的入口和出口端分别命名为inlet、outlet,将血液与支架内壁面接触的部分命名为wall。在Mesh 模块中对流体域进行网格划分,在微织构处对网格进行加密细化;然后将上述材料属性、边界条件输入到Setup模块中,选择瞬态分析方法。各项参数设置完成后,对仿真模型进行初始化并启动迭代计算,仿真结果收敛后取支架中间平面的血液流域进行分析,获得无织构支架和不同高度微织构支架下的血液流动速度云图和血液流动矢量图。

图4 有限元分析步骤Fig. 4 Finite element analysis steps
2 结果分析与讨论
造成血管狭窄的原因有很多,其中血液流速是最重要的影响因素之一。血液流速过慢容易导致血液中脂类等物质沉积在血管壁上,堵塞血管,因此本文重点探究微织构血管支架对血流速度的影响。从图5可以看出,在一个心动周期内,不同支架内血液流速随时间变化的趋势基本一致,心脏收缩时血液流动速度处于峰值时刻,心脏舒张时血液流动速度逐渐平稳。微织构血管支架下最大的血液流速为0.643 8 m/s,而无织构支架下的最大血流速度为 0.591 m/s。这是因为相比于无织构支架,微织构支架能够有效改善近壁面处的血流特性,提高血液流动速度和近壁面处的扰动,缓解血液停滞现象,减少血液黏附,降低血管支架出现再狭窄的风险。

图5 一个心动周期内不同支架下的血液流速Fig. 5 Blood flow rate under different stents in a cardiac cycle
2.1 峰值时刻近壁面血液流动情况分析
仿真结束后,通过对仿真结果进行后处理得到图6和图7。图6和图7(a)~(e)分别为无织构血管支架和高度为30~50 μm的六边形凸起微织构血管支架在血流速度达到峰值时刻(心脏收缩时)的血液流速云图。从图中可以看出,血液流速出现明显的分层形式,在支架内的不同位置血液流速出现差异,这是因为血液与支架内壁面接触时引起血小板黏附并激活了凝血系统[23],使得血液黏附在支架内壁上产生停滞,血液流动受阻。此外,由于血液黏度较大,靠近壁面处的血液产生速度梯度,使得血液在近壁面处产生了边界层,越靠近支架内壁面处血液流动速度越慢,与壁面接触处血液速度近似为0。从图7(a)~(e)中可以看出,微织构支架下血液层与层之间出现明显的波动,流速越大,近支架内壁处的波动状态越明显。这是由于微织构的存在使得近壁面处的血流状态发生改变,血液流动不再平顺,出现一定程度的扰动,微织构越高,对血液造成的扰动越大,边界层内不同流速血液间的波动状态越明显。研究发现(图7(a)~(e)),在微织构支架下,接近微织构内壁处的血液停滞区相较于没有与微织构接触的血液停滞区较小,这是由于较佳的疏水表面一般拥有较高的表面粗糙度[24],而微织构的存在增大了支架内壁的表面粗糙度,因此织构化的表面提高了材料的疏水性,改善了支架内壁的疏水性,减少了血液的黏附。

图6 峰值时刻无织构血管支架下血液流动速度云图Fig. 6 Cloud diagram of blood flow velocity without vascular stents at peak time

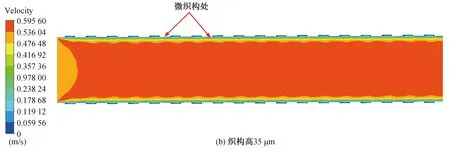
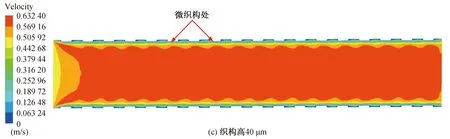
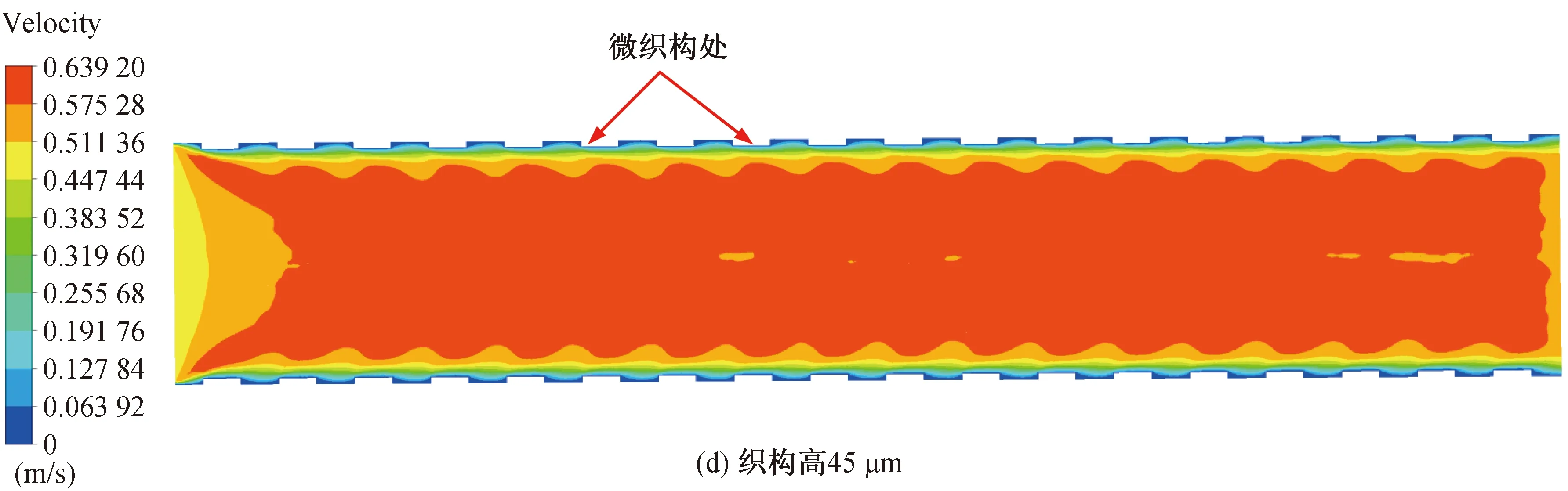
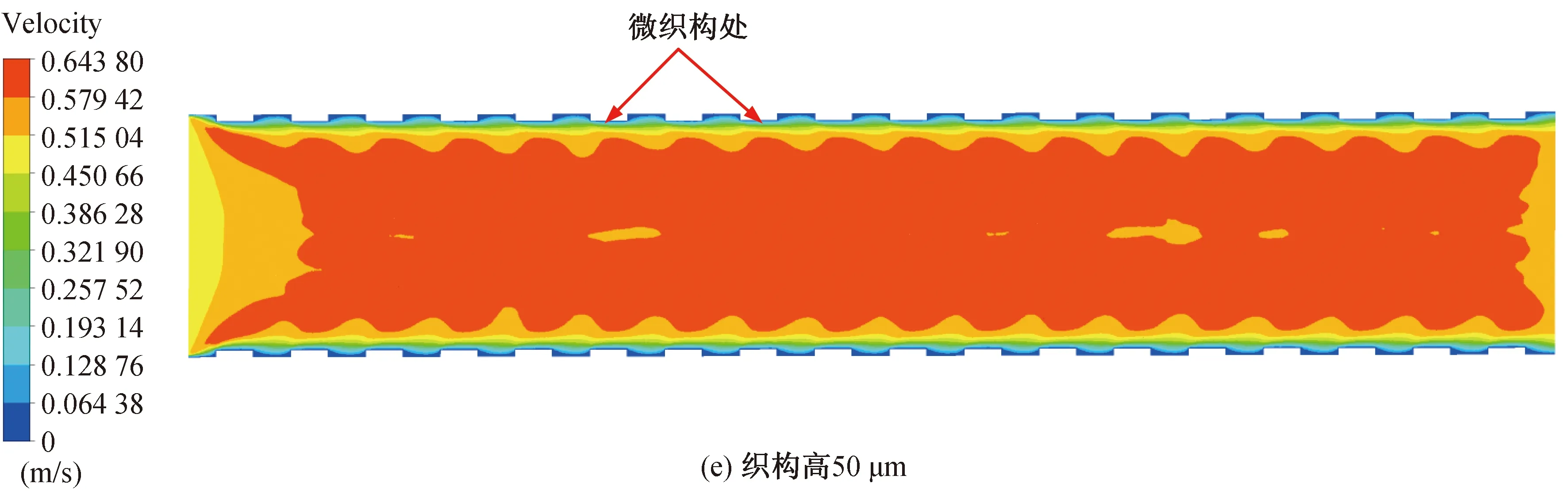
图7 峰值时刻不同织构高的血管支架下血液流动速度云图Fig. 7 Cloud diagram of blood flow velocity under different vascular stents at peak time
与无织构支架相比,微织构支架能够提高流域内主流区的平均速度。在无织构支架下,血液主流区速度为0.591 0 m/s。当微织构高度为35 μm时,流域内主流区速度为0.595 6 m/s,速度提高了0.78%,对于血液流速的提升效果最小。当微织构凸起的高度为50 μm时,主流区速度为0.643 8 m/s,相比于无织构支架,速度提高8.93%,对血液流速的提升效果最大。 织构参数为50 μm时对血液流速的提升效果最优,这是因为此时的表面粗糙度最大,因而具有更佳的表面疏水性,当血液流经支架内表面时,能更好地减少血液黏附,在一定程度上提高了血液的流动速度。
图8(a)~(f)分别为无织构血管支架和高度为30~50 μm的微织构血管支架在峰值时刻的血液流速矢量图。从矢量图中可以清晰地获得血液在近壁面处的流动状态。从图8(a)中可以看出,在无织构支架下,血液的流动方向与支架轴心平行,血液流动速度呈现出明显的差异:壁面处的血液流速为0,且血流量较小,越靠近轴心处,血液的流动速度越快,血流量逐渐增大,血液分布更加均匀。从图8(b)~(f)可以看出,当采用微织构支架时,与壁面接触的血液流动方向发生改变,尤其在半径方向出现波动,在血液波动过程中不同流速层之间的血液产生了混合,流速层边界出现波动,层间界面变得不规则。这是因为微织构的存在使得壁面处血液产生扰动,不同流速的血液混合在一起,减轻了壁面处血液停滞的状态,微织构的疏水性和减阻特性也降低了血液停滞概率。对比不同高度微织构支架下的血液流速矢量图,当微织构高度为30 μm时,近壁面处的血液扰动较轻(扰动高度约50 μm),血流紊乱强度较小。当微织构高度从30 μm增加到50 μm时,近壁面处血液扰动幅度逐渐增大,不同流速的血液混合趋势越来越明显,壁面处产生的血流扰动可以使边界层附近的血液更好地混合,改善血液停滞状态。高度为50 μm的微织构支架下,血液产生扰动的幅度更大(扰动高度约62 μm),说明高度为50 μm的微织构对近壁面处血液的影响效果更好。
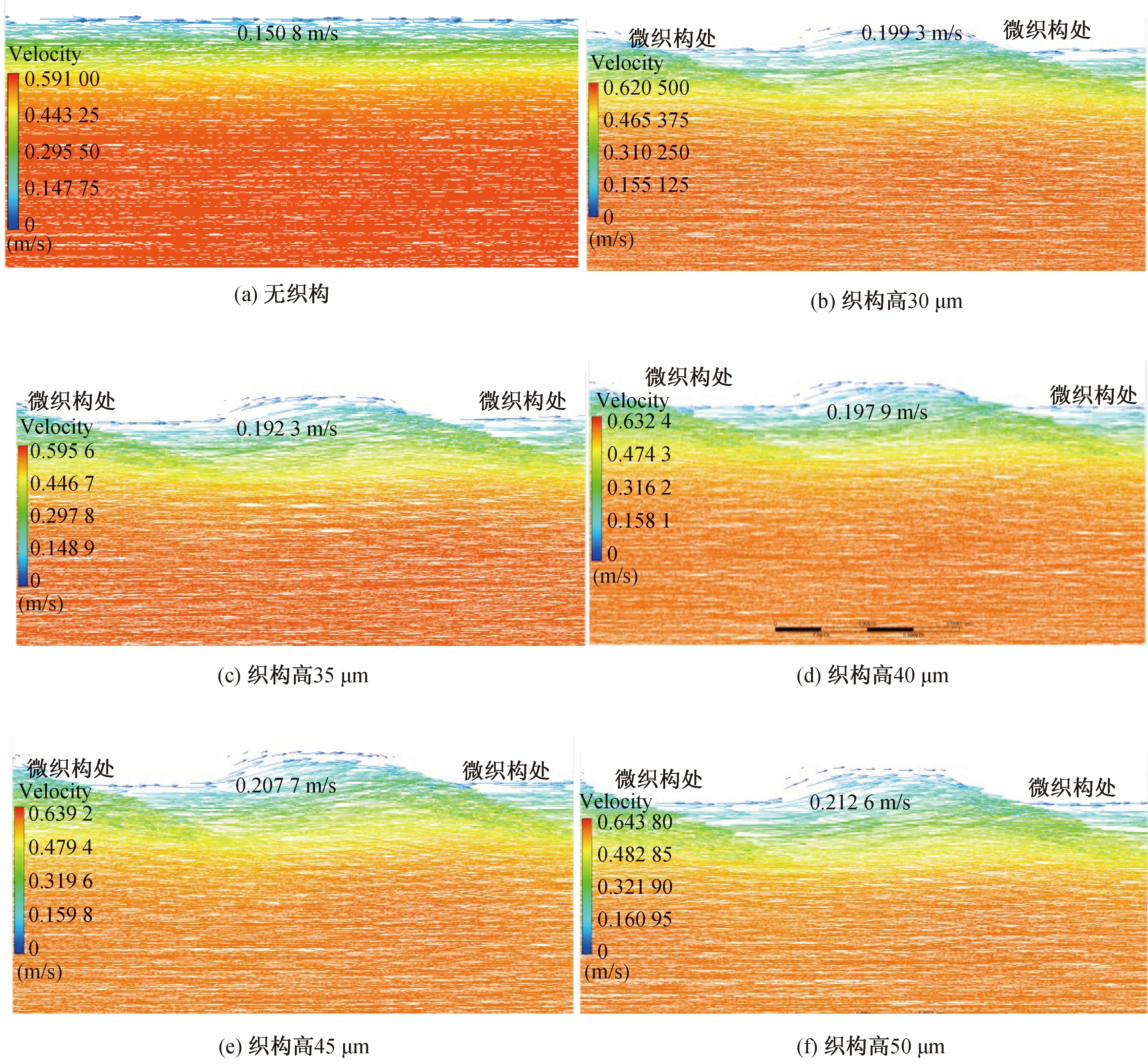
图8 峰值时刻不同血管支架下血液流动矢量图Fig. 8 Vector diagram of blood flow under different vascular stents at peak time
在峰值时刻,相比于无织构血管支架,采用微织构血管支架时,边界层的血液流速有所提升,一方面微织构的存在使得近壁面的血液出现扰动,使得不同流速之间的血液充分混合,增加血流强度,缓解血液停滞状态;另一方面,微织构起到减阻、抗黏附的作用,减少了血液黏附在壁面上的几率,从而增加了血液的流动速度。
2.2 稳定时刻边界层血液流动速度
图9和图10(a)~(e)分别为无织构血管支架和高度为30~50 μm的六边形凸起微织构血管支架在稳定时刻的血液流动速度云图。在峰值时刻和稳定时刻,支架入口处的边界层厚度均较小。随着血液在支架内流动,边界层的厚度逐渐增大。这是由于黏性流动壁面无滑移,随着血液不断向前流动,上下壁面间均产生边界层流动,边界层沿层发展,导致边界层厚度逐渐增加[25]。稳定时刻的边界层厚度较峰值时刻有所增加,这是因为边界层厚度与流体流速有关,若流体流速降低则边界层厚度增加[26]。稳定时刻的血流速度要明显低于峰值时刻的血流速度,因此边界层厚度相较于峰值时刻显著增加。当到达稳定时刻,血液层流状态发展更加充分,不同流速的血液之间分层更加明显。稳定时刻血流的动力比峰值时刻的动力小,因而与壁面的摩擦力度较小,血液在流动过程中更加稳定,不同流速层之间的血液波动程度比峰值时刻有所降低,近壁面处的扰动现象较轻。
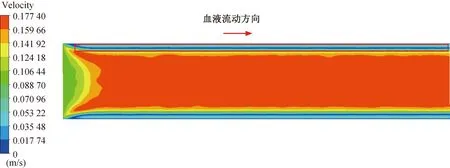
图9 稳定时刻无织构血管支架下血液流动速度云图Fig. 9 Cloud diagram of blood flow velocity without vascular stents at stable time
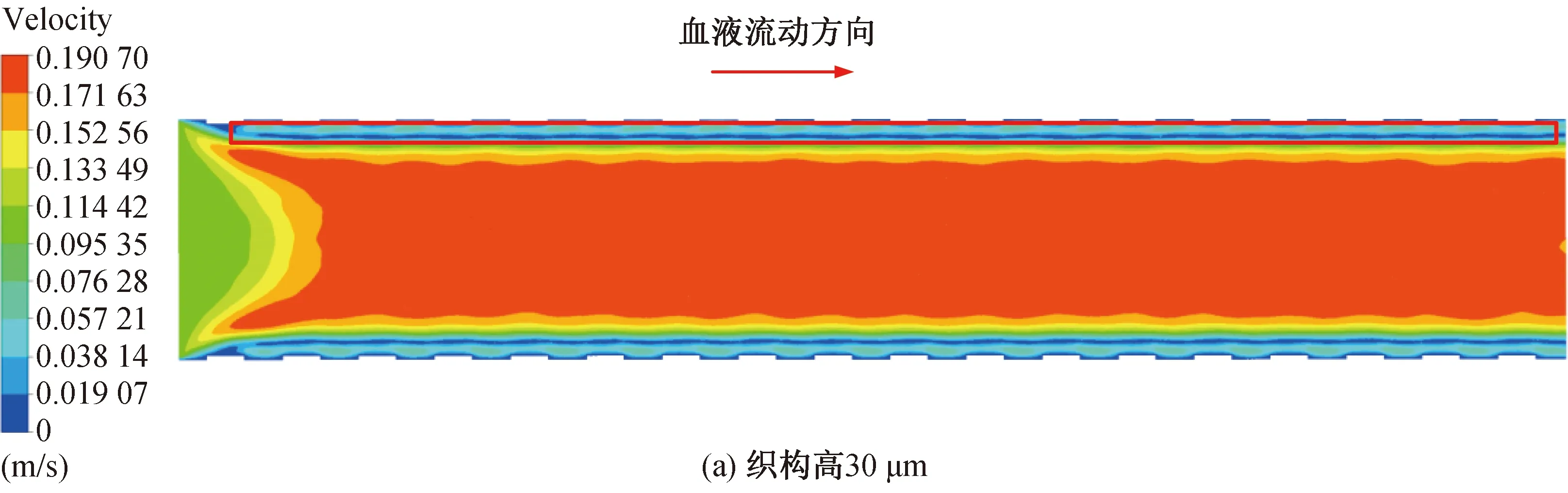

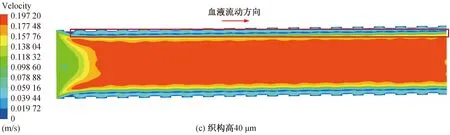
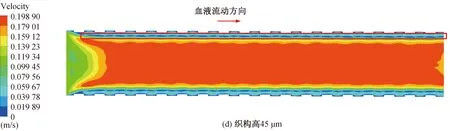

图10 稳定时刻不同血管支架下血液流动速度云图Fig. 10 Cloud diagram of blood flow velocity under different vascular stents at stable time
除了与壁面接触部分血液流速近似为0的区域外,在稳定时刻下边界层中也出现血液流速为0的区域,在速度云图中呈现出一条速度为0的线型区域,这说明除了壁面处,在边界层中也出现血流的停滞区。从图9中可以看出,采用无织构支架时,边界层中的血流停滞区在速度云图中是一条流速为0的连续线条。当采用微织构支架时,边界层中血流停滞区逐渐减小,如图10(a)~(e)所示,说明采用微织构支架时,边界层的血液流动比采用无织构支架时要更加充分,血液的流动状态更好。微织构支架下的轴心处的主流区速度要大于无织构支架下的主流区速度,采用无织构支架时,最大血流速度为0.177 4 m/s。在微织构高度为35 μm 时,流域内的最大血流速度为0.181 3 m/s,相比于无织构支架,流速提高了2.20%,对血液流速的提升效果最小;在微织构高度为50 μm时,最大血流速度为0.202 9 m/s,较无织构支架提高了14.37%,对血液流速的提升效果最大。 微织构高度为50μm时,高度较高的微织构使得近壁面处血液混合得更加充分,血液流动状态更好,有效减少了血液的停滞现象,使整个流域内的血液流速得到提升。
图11(a)~(f)分别为无织构血管支架和高度为30~50 μm的六边形凸起微织构血管支架在稳定时刻的血液流速矢量图。从图可以看出,在无织构血管支架下,边界层类型为层流边界层,血液流动方向与支架内轴线平行,血液层与层之间无径向脉动,互不混合。越靠近壁面,血液流速越低,与壁面接触的血液流速为0。近壁面处的血液流动方向与血液主流区的流动方向相反,这是因为此时心脏处于舒张期,血管内的压力降低,导致血液回流。回流的血液与正常流动的血液之间出现明显分层,血液分布不均匀,在流速矢量图上产生了空白区域。由图11(b)~(f)可以看出,在微织构支架下,壁面处的血液回流,回流区域中微织构处的血液流动方向与支架轴心平行,但非微织构区域的血液流动方向发生改变。回流区域的血液同正常流动的血液一样出现分层,并且与正常流动的血液形成漩涡。漩涡改变了血液在近壁面的流动状态,近壁面处的血液由层流变成湍流。微织构表面的疏水性对湍流流体起到的减阻作用要优于层流流动的流体[27]。具有微织构的固体表面在复杂的流场中能够发挥出更好的作用,降低黏性流体的黏性,进一步降低摩擦阻力[28]。
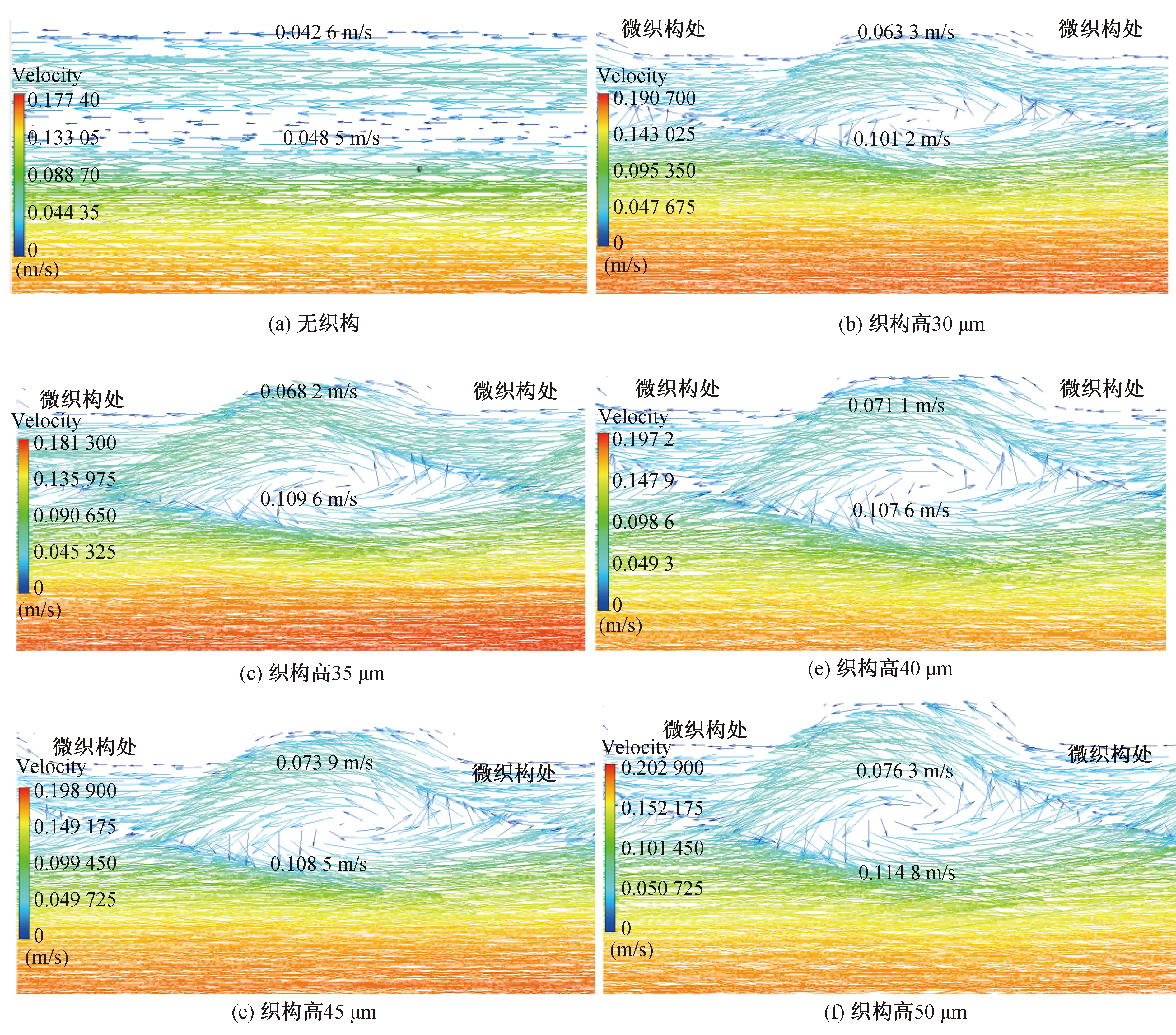
图11 稳定时刻不同血管支架下血液流动矢量图Fig. 11 Vector diagram of blood flow under different vascular stents at stable time
在稳定时刻,采用微织构血管支架时边界层的血液流速有所提升。对比不同微织构高度下的血液流动状态,当微织构高度为30 μm时,近壁面处血液产生的漩涡强度较小(漩涡高度约184 μm),壁面处的血液回流量较大,随着微织构高度的增加,近壁面处因扰动而产生的漩涡越明显。当微织构的高度增加到50 μm时,漩涡现象最为明显(高度约200 μm),血液的回流量减少。
通过仿真研究发现微织构能够改变近壁面的血液流动状态,有效改善血液停滞现象,使近壁面处的血液能够更好地混合,同时微织构的疏水性能够减少血液黏附,抑制血液沉积现象,进而减少支架置入后再狭窄的概率。将微织构应用于血管支架中,为新型血管支架的设计和开发提供新的方法与思路,为解决血管支架置入后再狭窄问题具有指导意义。
3 结语
本文建立了无织构管状血管支架和面积占有率为20.4%的不同高度的正六边形凸起微织构管状血管支架模型,采用Ansys有限元软件分析了一个心动周期内不同支架下的血流状态,得到以下结论:
1)微织构血管支架能够有效提高血液的流动速度。在峰值时刻,高度为50 μm的微织构血管支架能够将血液流速提高8.93%;在稳定时刻,高度为50 μm的血管支架血流速度能够提高14.37%。
2)不同高度的微织构对血液流动状态的影响效果不同。在峰值时刻,近壁面处血液出现扰动,壁面处产生了血流停滞区。微织构高度为30 μm时,血液扰动幅度较小,随着微织构高度的增加,血液扰动幅度逐渐增大,当微织构高度为50 μm时,血液扰动幅度最大,近壁面血液能够更好地混合。
3)在平稳时刻,近壁面血液产生回流和漩涡。高度为30 μm的微织构在平稳时刻血液的回流量较大,产生的漩涡强度较小;高度为50 μm的微织构在平稳时刻下血液的回流量最少,近壁面处产生的漩涡最明显。
4)微织构能够改变近壁面的血液流动状态,改善血液停滞现象,使近壁面处的血液能够更好地混合,同时微织构的疏水性能够减少血液黏附,抑制血液沉积现象,进而减小支架置入后再狭窄的概率。

