固相反应制备Li2FeSiO4/C及嵌/脱锂性能研究
李付绍,徐应仙,武青青,邓明森
(贵州省纳米材料模拟与计算重点实验室(贵州师范学院),贵州 贵阳 550018)
邓明森(1981—),男,湖北恩施人,贵州师范学院副教授,博士。E-mail:deng@gznc.edu.cn
锂离子电池已成为现代生产与生活中一种十分重要的能量存储设备,因具有工作电压高、容量大、体积小、质量轻、循环寿命长、安全性能好、无记忆效应等优点,广泛应用于电网储能、电动移动出行工具以及可穿戴电子设备等领域。然而,在组成锂离子电池的关键材料中,正极活性物质是当前锂离子电池发展的主要瓶颈[1-2]。在当前主流的锂离子电池产品中,正极活性物质为钴酸锂(LiCoO2)及其衍生物,它虽然具有优良的电化学性能及电极综合性能,但仍然面临着诸多棘手的问题:1)LiCoO2的制备工艺已趋成熟,其比容量已很难再有大幅度的提高;2)金属钴属于重要的战备物资,它在超耐热材料领域及工业催化领域均有重要应用,钴资源又相对匮乏,LiCoO2价格昂贵且有毒性;3)与有机电解液接触时表现出强氧化性而存在严重的安全隐患。因此,安全性更高的聚阴离子型正极材料越来越受到人们的青睐[3]。由于聚阴离子团中氧与中心原子具有很强的结合力,增强了聚阴离子型化合物的稳定性,进而降低材料的氧化性,提高了材料的安全性能。特别是LiFePO4,人们已对它进行了大量的研究[4-7],相对于传统的过渡金属氧化物电极,它的很多优势都还有待于进一步挖掘。
近年来,另一类新型的聚阴离子型化合物正极也开始受到人们的极大关注,它主要是基于正硅酸盐结构的化合物Li2MSiO4(M=Mn2+,Fe2+,Co2+等)[8-11]。相对于LiFePO4中的P—O键,Si—O的结合力更强,因此安全性能更高,同时还有另一个显著的特征,从结构式上看应该可以通过多电子的反应而脱出2个锂(即M2+/M3+与M3+/M4+氧化还原电对),并最终获得更高的理论容量(例如Li2MnSiO4的容量可大于300 mAh/g)。围绕这一类材料人们进行了大量的研究,特别是其中的硅酸铁锂Li2FeSiO4,它的容量可达约166 mAh/g[12](如反应式1所示),而且嵌/脱锂等综合性能也明显优于同类的其他几种材料。此外,该材料还具有另一个巨大的成本优势,硅和铁都是地壳中十分丰富的元素,而获得廉价安全的正极材料仍然是未来大规模锂离子电池工业的主要目标之一。

(1)
然而,相对于LiFePO4,Li2FeSiO4的合成结构更难控制,物理化学性质更加复杂[13-15],因此对制备条件的要求也更为苛刻。为了制得纯度较高的Li2FeSiO4,通常采用多步骤与多途径相结合的方法,如通常先采用溶胶-凝胶化以及其他湿化学工艺进行预处理,再进行繁琐的分离、干燥、高温固相反应等步骤[16-17],因此,这类合成方法要么工艺流程较长,要么对反应试剂及反应气氛等均有特殊的选择和要求,增加了工艺的复杂性和操作的危险性,同时也增加工艺的成本,难以实现大规模的工业化生产和推广应用。另一方面,由于Li2FeSiO4与LiFePO4一样,具有较大的电子禁带宽度,材料的电导率较低,这也是硅酸盐正极材料电化学性能普遍较差的主要原因之一。制备碳复合的Li2FeSiO4/C是解决此问题的主要途径之一,碳复合是指含碳物质在高温惰性气体下分解成多孔结构的碳[18],它不仅可以抑制材料颗粒在加热过程中的长大,而且还能为材料提供电子隧道,从而提高其导电性。碳复合主要包括碳掺杂和表面碳包覆[19-21],碳复合不仅可以提高电极材料的电子导电率,而且有利于电极材料与电解质充分接触,从而改善微粒内层锂离子的嵌入/脱出性能,进而提高材料的充放电容量和循环性能,同时碳还可起到还原剂的作用,抑制高温反应过程中三价铁的生成。
为了简化Li2FeSiO4的制备过程,同时提高材料的嵌/脱锂等电化学性能,本文以纳米SiO2为前驱体,同时利用蔗糖碳化对材料进行复合改性,并结合机械活化的前处理方法,在惰性气氛下通过简单的直接高温固相反应合成制备得到Li2FeSiO4/C复合材料,并研究碳复合改性对Li2FeSiO4的结构、电导率、嵌/脱锂性能、循环比容量等方面的影响。
1 实验部分
1.1 实验试剂和仪器
碳酸锂(Li2CO3)、草酸亚铁(FeC2O4·2H2O)、纳米级二氧化硅(SiO2)均为分析纯,购于阿拉丁试剂有限公司;蔗糖购于国药集团,分析纯。
OTF-1200X-80管式高温炉(合肥科晶材料技术有限公司);QM-ZSP2行星式球磨机(南京大学仪器厂)。
1.2 材料制备
采用直接高温固相反应合成制备Li2FeSiO4/C正极复合材料,制备过程如图1所示。1)根据锂、铁、硅3种元素在Li2FeSiO4中的化学计量比,称取适量FeC2O2、Li2CO3·H2O、纳米SiO2并充分研磨得到固体混合反应物;2)在350 ℃将固体混合反应物煅烧,自然冷却后得到固体分解产物;3)向固体分解产物中加入50%的蔗糖(加入量经过初步优化),并在球磨机中240 r/min球磨3 h,再用圆形压片磨具轴压成片,轴向压力为50 MPa;4) 在700 ℃、Ar气流氛围中对压片试样煅烧退火10~20 h并自然冷却,使原料充分反应,结晶成相,碳化复合得到Li2FeSiO4/C胚料。作为对比,Li2FeSiO4的制备过程与Li2FeSiO4/C基本一致,唯一不同的是在上述步骤中不添加蔗糖,从而得到未经过复合改性的Li2FeSiO4。

图1 直接高温固相反应制备Li2FeSiO4/C的技术路线Fig. 1 Schematic rout to preparation of Li2FeSiO4/C
1.3 结构表征
利用X-射线衍射仪(XRD, RigakuUltima-IV)对Li2FeSiO4/C复合材料的物相组成进行分析。在样品的测试中,样品台固定,射线源和探测器同时旋转,平面反射方式,光源为铜靶,Kα1和Kα2射线,管电压40 kV,扫描速率:5°/min,扫描范围:10° ≤ 2θ≤ 90°。复合材料的形貌用扫描电镜观测(型号:Hitachi S4500),电子加速电压20 kV。复合材料的表面包覆层结构及晶粒结构采用透射电镜(TEM, FEI: Tecnai G2 F30) 进行观测分析,测试的电子加速电压200 kV。
1. 4 性能测试
利用循环充放电测试对Li2FeSiO4/C复合材料的嵌/脱锂性能进行考察,测试采用实验室自制的模块化测试电池。测试电池的组装过程如下:首先,将反应胚料产物压碎并充分研磨至粉状得到Li2FeSiO4/C复合材料,应用Li2FeSiO4/C复合材料作为电极的活性材料,将活性物质、乙炔黑、聚四氟乙烯悬浮液黏结剂按质量比8∶1∶1的比例混合,用研钵磨细磨均匀后手工擀制在铝箔纸上,最后在120 ℃的真空干燥箱中烘烤12 h而得到电极片;极片按照面积进行切割、称量、活性物质核算之后,再在干燥的Ar气手套箱中进行模块化测试电池的组装,负极为锂片,隔膜为Celgard 2300微孔隔膜,电解液为1 mol/L LiPF6(Ferro公司),V(EC)∶V(DMC)=1∶1有机电解液(EC为碳酸乙烯酯,DMC为碳酸二甲酯),其中平均每片电极含正极活性物质3~7 mg。电池充放电测试在“蓝电”充放电仪上进行,在室温下以0.1C的倍率进行充放电,充电和放电终止电压分别是4.2 V和1.5 V。采用2273高级电化学工作站(Princeton Applied Research: PARSTAT 2273)测量电池的电化学阻抗谱(EIS),并通过PowerSuite驱动程序对测量参数进行设置和数据采集。EIS测量电压扰动信号的幅值为10 mV,频率从100 kHz到10 mHz进行扫描。
2 结果与分析
2.1 材料的结构
将直接高温固相反应制得的样品Li2FeSiO4/C与未经碳复合的产物Li2FeSiO4作比较发现,物料的外观差异较大,通过肉眼观察即可辨识,如图2所示。图2(a)是没有加蔗糖碳化复合的样品,其外观颜色为褐色,图2(b)是加了蔗糖进行碳化复合的样品,其色泽为深黑色,样品有明显的碳复合迹象。从材料电子结构上预测,碳复合的产物Li2FeSiO4/C应该具有良好的导电能力。此外,相对于没有碳复合的产物Li2FeSiO4,样品Li2FeSiO4/C的颗粒也相对均匀细腻,“手感”也更好。根据我们实验研究经验,作为锂离子电池正极材料, Li2FeSiO4/C各方面的性能在直观上便要优越于Li2FeSiO4。

图2 高温固相反应制备的样品及TEMFig. 2 Photographs of samples prepared by high-temperature solid-state reaction
为了进一步考察碳复合的结构形式,利用透射电镜(TEM)对碳复合改性的Li2FeSiO4/C样品做进一步的表面结构及晶粒结构分析,结果如图2所示。图2(c)是TEM外观形貌图,图2(d)是高分辨TEM图,从中可以明显看出,颗粒的晶格条纹明显,表明样品的结晶度较高,同时从颗粒的表面结构看,碳复合成分在晶粒的表面形成一层厚度较薄的不定型碳包覆层,包覆层包裹紧密,包覆的质量很高,没有丝毫的裂纹。
为了研究粉末材料的物相与颗粒结晶情况,利用XRD进一步分析碳复合对样品合成结构的影响,结果如图3所示。图中对比显示了Li2FeSiO4碳复合改性前后的谱图。图3(a)结果表明,2种样品的结晶成相结果都比较理想,除了Li2FeSiO4晶相外,均没有非常明显的杂质衍射峰出现,与文献报道的结果吻合较好[22]。研究表明[23],Li2FeSiO4通常只有一种晶型结构,属正交晶系,空间群为Pmn21,图3(b)为Li2FeSiO4晶体原子排布示意图,图3(c)为Li2FeSiO4晶格中多面体连接与分布情况。在Li2FeSiO4的这种晶体结构中,O原子以正四面体紧密堆积方式排列,Li、Fe与Si各自与4个O原子分别形成LiO4、FeO4和SiO4四面体结构,每个FeO4通过与周围的2个Li—O四面体,1个Si—O四面体及1个Fe—O四面体只通过共用顶点的O原子连接[24-25],如图3(c)所示。
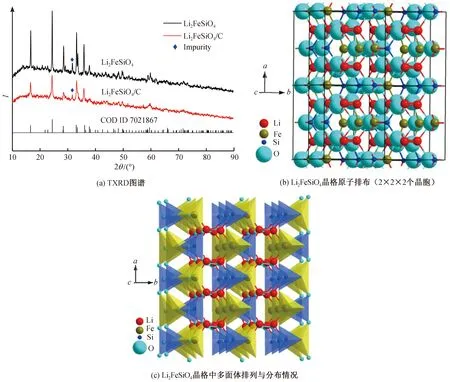
图3 样品晶体结构分析Fig. 3 Confirmation of crystal structure
进一步对比图3(a)中不同样品的衍射峰强、峰型发现,与没有碳复合的Li2FeSiO4产物相比,多晶粉末样品Li2FeSiO4/C的衍射峰位置没有发生明显变化,表明碳源对产物的晶格参数没有产生明显影响,由此推测碳没有进入Li2FeSiO4的晶格内部,主要以表面包覆或负载为主。然而,Li2FeSiO4/C衍射峰的强度有所降低,半峰宽也略有增加,可能的原因有:1)碳对X-射线的吸收;2)晶体粉末尺寸的影响,从式(2)中的Scherer可以知道,同一种晶体材料,晶粒尺寸越小,半峰宽越大。
(2)
式中:D为晶粒的直径;R为Scherer常数(0.89);λ为入射X光波长(0.154 06 nm);θ为衍射角(°);β为衍射峰的半高峰宽(rad)。
理论上说,晶粒的大小同样会影响材料的循环性能,因为晶体颗粒尺寸的降低可以大大缩短电子或锂离子的传输路径,从而减少极化并最终提高其循环性能。可以想象,如果颗粒尺寸太大,电子不能在晶格内部有效传递,锂离子又不能自由地“穿梭”,那么材料的充放电循环性能就可能大打折扣。
为了从微观上分析碳复合对Li2FeSiO4颗粒结构的影响,我们利用场发射电子扫描显微镜(SEM)对其进行观察,结果如图4所示。图4表明,Li2FeSiO4与Li2FeSiO4/C单个微粒的尺寸大小相当,均在几十纳米到几百纳米之间,但是Li2FeSiO4/C的均匀性相对较好,单个晶粒的尺寸也更小,这与XRD结果和TEM分析结果吻合较好,这应该与颗粒之间碳源试剂的热分解沉积有关。而且,从图像的清晰度上看,Li2FeSiO4/C拍照效果更好,根据电子成像的原理,Li2FeSiO4/C颗粒的导电性能明显优于Li2FeSiO4,从而也导致了Li2FeSiO4的SEM图明显模糊变形,由此可以推测,Li2FeSiO4/C充放电循环性能将优于Li2FeSiO4。

图4 样品在不同放大倍数下的SEMFig. 4 SEM images of samples under different magnification
2.2 电化学性能
利用充放电测试对样品的嵌/脱锂性能进行研究,结果如图5所示。为了更好地对比碳复合对Li2FeSiO4嵌/脱锂性能的影响,图中只显示首次、第2次、第5次和第15次的充放电结果。从图5可以看出,特别有意思的是,2种样品在充放电过程中均有一个共同特征,即首次充电与后续充电情况差别较大。从文献报道来看,这是Li2FeSiO4正极材料很独特的一个性质特征,说明该材料在经历首次循环后其充电后电压平台会从3.10 V 左右降为2.80 V左右,而后续的循环电压平台大致稳定在2.6~2.8 V。对此, Larsson等[26]通过密度函数理论(DFT)计算认为,实验观察到的充电平台存在0.3 V左右的差距,可归结为由充电产物LiFeSiO4发生Li+和Fe3+重排而形成更稳定的结构引起;Nytén等[27]利用原位XRD和Mössbauer谱从结构上进行研究,通过对比试样在不同充放电状态下的谱图,认为是由于首次循环后材料晶体结构中4b位的锂离子和2a位的铁离子发生内部置换;而Lv等[28]研究发现,充电产物LiFeSiO4结构中Si和Fe将由最初的2D平面结构转化为3D立体结构排布,结构的变化必然导致充放电平台的变化。考虑到硅酸盐结构的多样性,对于Li2FeSiO4充电过程中充放电平台变化所对应的结构演变及其相变机理还需要进一步研究。
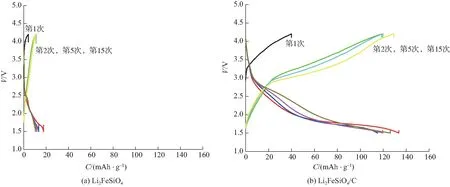
图5 正极材料在倍率0.1C下的充放电曲线Fig. 5 Charge/discharge curves of cathode materials under rate of 0.1C
图5中另一个重要的结果是,碳复合对材料的嵌/脱锂性能影响非常显著。相比于没有碳复合的产物Li2FeSiO4,Li2FeSiO4/C的容量大大提升。其次,从充放电曲线看,充电电压与放电电压也有较大的差距,说明电极材料内部的极化现象较为严重,也就是说,尽管表面包覆的碳能改善Li2FeSiO4活性颗粒与集流体或颗粒之间的导电行为,但很难降低电子通过表面进入晶粒内部的阻力,也难改善锂离子在活性颗粒内部的传输通道。
将2种材料的循环性能进行对比(如图6)可以看出,对Li2FeSiO4进行碳复合改性后,容量显著提升,首次放电容量高达120 mAh/g,经历15次循环后,容量仍然能保持在110 mAh/g;相比之下未经过改性的Li2FeSiO4首次放电容量仅为20 mAh/g左右,经历15次循环后,容量更小,只有10 mAh/g左右。需要指出的是,2种材料的嵌/脱锂性能在总体上均不够理想,特别是循环放电容量在初始阶段具有明显的衰减,对此我们也进行了相应的分析。在我们的研究中,测试电池的电解液采用LiPF6作为电解质,由于F-对含硅元素的物质腐蚀性较强,因此Li2FeSiO4正极材料在含LiPF6电解液中的结构稳定性还需要进一步考察。此外,碳复合虽然可在一定程度上改善Li2FeSiO4晶粒表面的电子导电性能,然而晶格内部的电子导电性能却没有提高,同时从晶体结构上看(图3b),由于Li2FeSiO4内部缺乏固定有序的锂离子传输通道,电池测试又在常温下进行,锂离子的迁移速度有限,因此,为了提高材料的嵌/脱锂性能,研究工作在很多方面都还有待进一步深入和完善,即便如此,碳复合对Li2FeSiO4正极材料嵌/脱锂性能的改善和循环充放电比容量的提高是显著的,也是成功的,是值得大力提倡和推广的。
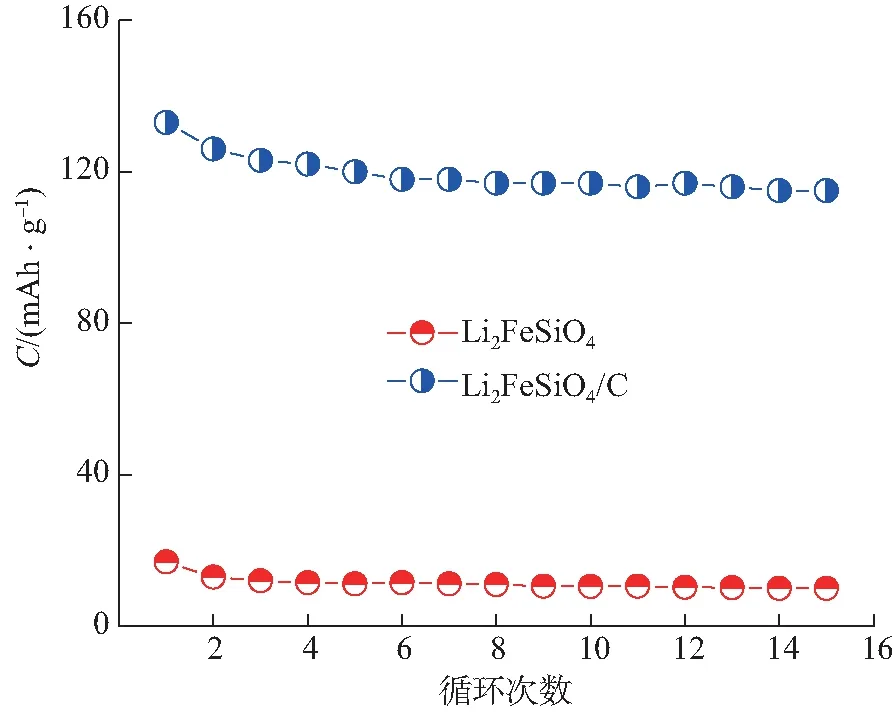
图6 正极材料在倍率0.1C下的循环性能Fig. 6 Cycling performance of cathode materials under rate of 0.1C
最后,我们利用电池在C/10倍率经1次循环活化后在室温下进行EIS测试,所得结果如图 7 所示。从图 7(a)中EIS通过Nyquist图来看,2种材料均由一个半圆和一条直线组成,高频区的半圆对应于电解质/电极界面的电荷阻抗(Zct),低频区的直线代表 Li+离子在电极材料中扩散引起的Warburg 阻抗(Zw),再加上体系中电解液和电极的欧姆电阻Rohm,以及电解质/电极双电层电容Q1,整个电池可以用图7(b)中的等效电路Rohm(Q1(ZctZw))来表示[29]。放电时电极上发生的过程为:Li+从液态电解质内部向电极迁移,首先通过电极/电解液界面膜,然后到达固体电极界面。在界面处发生电荷迁移,最后是Li+由固体表面向内部扩散,脱出反应为上述的逆过程。由图7可以看出:碳包覆使得Li2FeSiO4的Zct从120 Ω 左右降低到 70 Ω左右,大幅降低电解质/氧化物电极界面的电荷传递阻抗,从而有助于提高和改善材料的电化学性能,这也与充放电测试结论一致。
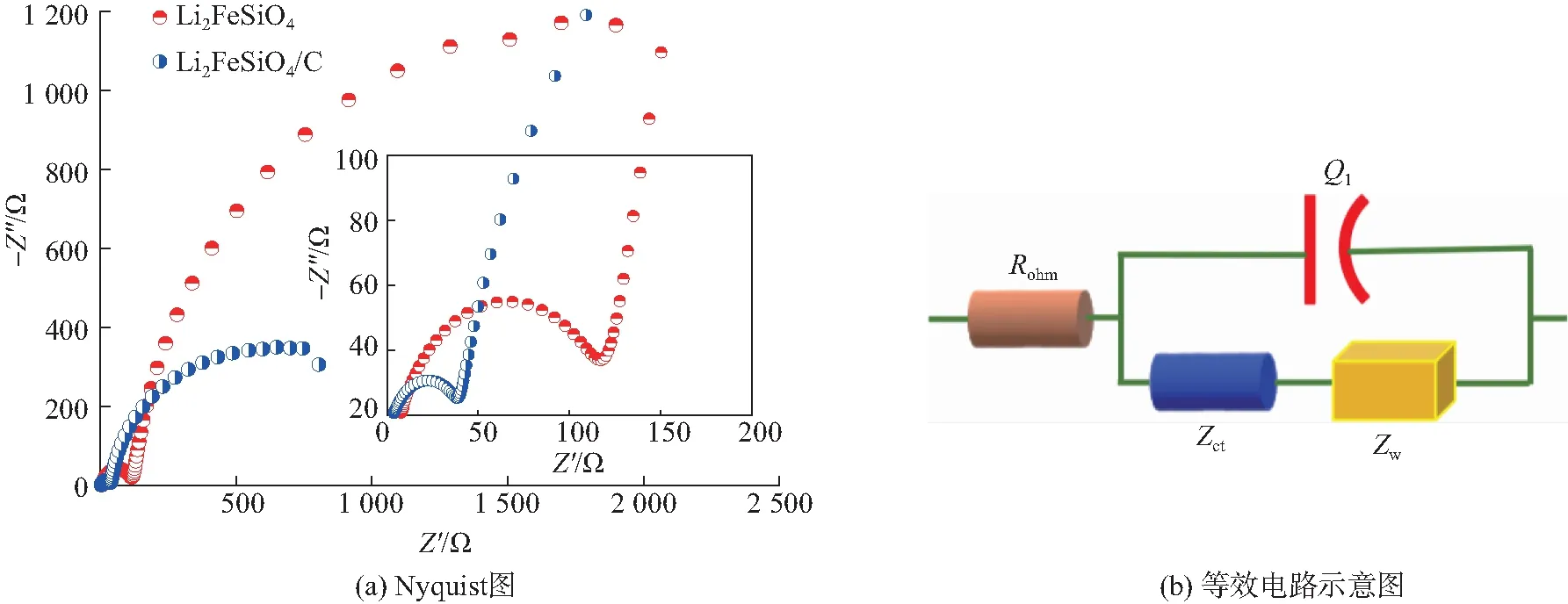
图7 正极材料的EIS结果Fig. 7 EIS result of cathode materials
在后续的研究中,可以通过对晶粒大小、晶粒形貌、碳化层厚度等亚结构参数作进一步控制,通过对晶格的铁位、锂位、硅位甚至氧位等亚格子原子组成作进一步掺杂调节,以及通过对电解液的匹配度作进一步筛选,Li2FeSiO4/C的嵌/脱锂性能应还有很大的提升空间,是一种很值得研究的锂离子电池正极复合材料。在这些方面,前人已开始一系列探索性的研究,例如,Xu等[30]通过采用水热反应合成了一种中空球形的特殊形貌结构,从而表现出更加优越的电化学性能;Yan等[31]基于第一性原理的量化计算预测,利用Ga、Ge和As等离子对Si位进行掺杂有利于改善Li2FeSiO4的结构、性能;Zeng等[32]和Kumar等[33]则通过实验研究发现,利用Co、Mg等离子对Fe掺杂可以大大提升Li2FeSiO4的电化学性能;Singh等[34]还认为,利用Cl对O的掺杂可以强化Fe2+/Fe3+和Fe3+/Fe4+氧化还原电对,从而提高Li2FeSiO4的电化学性能。
3 结论
碳复合的方法,为聚阴离子型锂离子电池正极材料提供了一种便捷有效的改性途径,本研究中:
1)通过直接高温固相反应,合成制备了Li2FeSiO4,利用蔗糖碳化进行碳复合,制备了Li2FeSiO4/C正极材料,材料的制备工艺流程简单易行,有利于规模化生产。
2)碳复合改性有利于提高Li2FeSiO4正极材料的导电性能,改善了材料在成相反应后的粒度分布。
3)碳复合改性显著提升了Li2FeSiO4正极材料的嵌/脱锂性能和循环充放电容量。
致谢:感谢贵州省创新研究团队计划(QKHPTRC-[2020]5023)以及贵州省高层次创新型人才百层次(QKHPTRC[2016]5675)为本文提供的研究资助;感谢曲靖师范学院“云贵高原化学功能材料与污染治理研究中心”, 以及曲靖师范学院“磁性材料及器件研究中心”为本文提供的研究和分析测试平台。

