水稻杂种偏分离位点SegD8的精细定位
袁洋 敖和军 周仲华 应杰政 张健 倪深,
(1湖南农业大学 农学院, 长沙 410128;2中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006; *通信联系人, email: asen1225@126.com)
偏分离(segregation distortion,SD)是指在分离群体中观察到的标记基因型频率与预期孟德尔比率存在的偏差,使用传统的方法不能加以分析甚至会产生错误[1,2]。在杂交-渐渗的过程中,双亲的等位基因不断发生交换,在后代中呈现不均等分布,导致偏分离的发生,对生物进化和物种形成起到巨大作用[3]。偏分离作为生物进化的重要动力之一,通过影响基因或基因型的比例,影响群体潜在的进化方向[4]。大量的研究结果表明,偏分离在大多数动植物中均有发现[5],且可以被几乎任意一种分子标记检测出[5-6]。依据分子标记在连锁群上的分布情况,偏分离的偏分方向主要分两种:一种是少量并且随机地偏向亲本或杂合子,不具有规律,可以分布在不同的染色体上;另一种则是分子标记在连锁群上成簇分布,且多数偏分离位点偏分方向一致[7-10]。多数偏分离是由于遗传搭车效应、偏分离热点区域和配子体基因等因素造成的[8,9,11],基因互作[12]、细胞质遗传[13]、非同源重组、环境因素[14-15]以及标记和群体的选择等也会造成偏分离。此外,在对群体的基因型分析过程中,标记基因型和统计分析中的错误也是一个重要因素,会导致预期分离率的系统性偏差[9]。自1926年第一例偏分离报道以来,经过前人的不断研究,部分生物的偏分离系统已研究得较为清楚,比如黑腹果蝇和小鼠的偏分离系统[16-17]以及水稻中控制雄性不育的S5位点偏分离系统[18]、控制雌性不育的Sa位点偏分离系统[19]和重复隐性基因致死系统[20-21]。在作物遗传改良过程中,偏分离成为亚种或种间杂种优势利用的障碍,研究者通过操纵偏分离系统,利用CRISPR/Cas9技术分解偏分离系统中的“杀手”成分,大大加快育种过程,以期达到恢复杂种优势或育性的目的[22-23]。在遗传作图群体中确定偏分离的分布和导致偏分离的遗传因素的影响,可为调查新偏分离位点的全基因组及其与生殖障碍的关系提供重要线索。并为进一步研究生物体偏分离的遗传机制奠定基础,在作物遗传改良中具有巨大的应用潜力。
水稻因种间和亚种间杂种不育或杂种弱势,携带同源等位基因的后代具有不同的生存能力甚至无法生存,且更容易发生偏分离[24-25]。Li等[26]证实了偏分离在水稻中的高发生率。水稻的基本分化是籼稻亚种和粳稻亚种之间的分化[27],这是由于与环境相关的遗传适应性在不同生态条件下分化的结果。在水稻种间和亚种间杂交获得的群体中,经常观察到基因和标记的分离扭曲。多数的分离扭曲是发生在籼粳杂交之间,鲜有籼-籼、粳-粳杂交中出现偏分离的报道[28]。Kim等[29]发现籼型等位基因在水稻亚种间杂交中受到育种家的强烈青睐。籼-籼、粳-粳杂交群体因显示种质间多态性的分子标记数量有限而未能得到很好的研究[30]。Iwata等[31]最先在水稻中展开对偏分离的研究,他们在第6染色体上发现配子体基因ga1,并认为水稻特定标记位点的扭曲分离主要是由于该标记与位于同一染色体附近的配子体基因连锁导致的。研究者又陆续发现了ga2~g14、gax等14个配子体基因,这些基因大多会造成特定标记的偏分离。此外,研究者还发现34个不育基因S1~S34和5个杂交分解基因(hbd1~hdb3,hwh1~hwh2),其中多数基因都与偏分离有关[32]。
近期关于水稻偏分离的研究结果表明,分离扭曲是由杂交不育性通过杂交不亲和基因或等位基因的上位性相互作用引起的,并且已经证明杂交不育性是粳稻和籼稻品种之间以及水稻及其亲本之间的生殖障碍,是导致杂交后代中基因产生分离畸变的主要原因[18-21]。水稻中的偏分离对于水稻克服亚种或种间杂种优势的利用具有重要意义。因此,本研究应用常规恢复系籼型水稻华占和热带粳型水稻Koliya构建杂交渐渗系群体,在水稻第8染色体上发现了一个染色体区段在后代中的分离比偏离正常孟德尔分离定律,经进一步研究发现该现象受到两个位点的调控(暂命名为SegD8A、SegD8B),接着我们以子一代基因型的分离比作为表型对这两个位点进行精细定位,为进一步克隆这两个基因打下基础,以期最终解析杂种偏分离在水稻繁殖中的主要作用及其产生的遗传机制。
1 材料与方法
1.1 渐渗系群体构建和田间试验
以籼稻华占为母本、粳稻Koliya为父本进行杂交,得到F1,再以华占为轮回亲本进行3次回交得到BC3F1,再经连续多代群体内自交获得BC3F2~BC3F4。2018年冬至2019年春于中国水稻研究所海南陵水南繁基地种植70株单株,这些单株由BC3F1发展而来。2019年正季通过筛选BC3F2,从中挑选6个单株后代发展成株系,分别命名为NFX5~NFX10,每个株系200株,种植于中国水稻研究所富阳试验基地。2020年正季从4800株BC3F4代中筛选出332株重组单株种植于中国水稻研究所富阳试验基地,每行种植6株,株行距16.5 cm×26.4 cm,按正常大田管理。
1.2 DNA的提取
对每季材料单株剪取叶片1~2 cm,参考穆春华等[33]的方法并加以改进以提取水稻叶片基因组DNA,主要步骤如下:1)将剪取的1~2 cm叶片放入2 mL 离心管中,加入一颗钢珠以及300 µL TPS提取液(组成:100 mmol/L Tris-HCl,pH=8.0;10 mmol/L EDTA,pH=8.0;1 mol/L KCl)用MM400研磨仪(德国Retsch)进行研磨,频率50 Hz;2)研磨后放入75℃水浴锅中温浴20 min; 3)在12 000 r/min条件下离心10 min; 4)取200 µL上清液置于另一离心管中,加入等体积异丙醇,混匀,在8000 r/min条件下离心5 min;5)弃上清液,加入400 µL 75%乙醇洗涤沉淀,以8000 r/min离心5 min;6)弃上清液,将沉淀干燥,加入100 µL蒸馏水,-20℃下保存。
1.3 分子标记和偏分离性状的检测
引物设计均参考日本晴的基因序列,日本晴的基因序列从水稻基因组注释项目网站(http://rice.plantbiology.msu.edu/)上获取。根据亲本差异区段序列信息,使用Primer Premier 5软件设计引物,引物的合成由浙江尚亚生物技术有限公司完成。PCR扩增体系为:2×预混合液5 µL;DNA模板1µL;正反向引物各0.2 µL;蒸馏水补足至10 µL。
PCR扩增程序为:95℃下预变性5 min;95℃下变性30 s;55℃下退火30 s(各引物的退火温度根据具体情况而定);72℃下延伸30 s(延伸时间根据产物片段大小而定);共35个循环;72℃下延伸5 min;最后12℃下运行1 min。PCR产物用4%琼脂糖凝胶进行电泳检测,Gel Doc XR+凝胶成像系统拍照,记录基因型与分离比率,参照谭军等[34]的方法计算分离卡方值。
1.4 花粉育性
取海南低温环境(日平均温度20℃~25℃)下生长的水稻的颖花,将成熟花药放到载玻片上,加碘-碘化钾溶液,用镊子将花药捣碎,盖上盖玻片,用镊子轻轻按压,最后将其放置在10倍显微镜下观察,统计可育花粉与不育花粉的数目。
2 结果与分析
2.1 偏分离的发现
2018年对BC3F1代中的一株单株(命名为NS139.5,具有低温不育现象)进行基因芯片检测(图1),检测结果显示在第1染色体和第8染色体上存在大量的染色体片段交换,其余的10条染色体上则较少或是没有染色体片段交换。2018年冬至2019年春,以NS139.5单株自交产生的种子发展BC3F2代群体,最终获得70株单株,所有单株种植在海南陵水南繁基地,在移栽一周后提取叶片DNA保存备用。依据基因芯片定位结果,在第1染色体和第8染色体上设计InDel标记,对这70株进单株进行分子标记检测,发现第8染色体上同一标记处基因型比例偏离正常的孟德尔分离比。卡方检验结果显示与孟德尔分离比1∶2∶1有显著的差异(表1),其中标记CHR8-24的卡方值达到15.11,差异极显著。为了验证这一偏分离现象,在BC3F2代收获的种子中进行了验证,结果仍表明在第8染色体上的分子标记存在偏分离现象。为确定低温不育是否影响该偏分离,我们分析了低温条件下不同基因型植株的结实率(表2)与花粉碘染结果(图2-A、B)。结果表明在低温条件下当植株的可育花粉数显著下降时,其结实率也会相应地降低,但仍会在第8染色体上出现偏分离现象(如SD-4)。而一些花粉育性和结实率正常的植株(如SD-1, SD-2, SD-3)也同样出现了偏分离。这些结果说明低温并不影响该偏分离现象。

图1 NS139.5的SNP基因型Fig. 1. SNP microarray genotype of NS139.5.

表1 分子标记在第8染色体上的偏分离Table 1. Segregation distortion of molecular markers on chromosome 8.

表2 自交群体偏分离株系正常花粉率与结实率Table 2. Normal pollen rates and setting rates of segregation distortion in inbred populations.
根据前人研究结果,第8染色体上只报道过一个与花粉半不育相关的偏分离基因S27(t)[35]。对BC3F2代的群体不同基因型单株的花粉进行碘染测试,结果表明,正常植株的花粉碘染结果(图2-C)与分离比异常的植株花粉碘染结果(图2-D)没有太大差异。在海南低温短日照条件下对华占及偏分离植株的花粉育性进行了检测,结果表明,不同基因型植株的花粉育性均超过90%(表2),这表明花粉不育性不是分离率扭曲的原因。这一结果说明该偏分离不影响花粉的育性,并非S27(t)基因控制,但在某一方面又影响着基因的偏向性遗传。同时,该偏分离现象也没有引起结实率的变化(表2),由此推测此偏分离发生作用的时间可能是在花粉粒发育形成之前,这种分离畸变在稻属植物中尚未见报道。

图2 BC3F2代群体花粉染色图Fig. 2. Pictures of pollen stained of BC3F2 population.
2.2 SegD8基因的初定位
根据基因芯片检测的结果,在第8染色体上设计分子标记进行基因定位。以收获的BC3F2代筛选重组单株,发展了6个株系共1200株单株,形成BC3F3群体。以分子标记检测在目标区间具有重组交换的单株,分析子代的分离比率。标记结果显示共筛选到276株子代具有偏分离的单株。统计分析发现子代偏分离的比例分别出现了1∶5∶4和0∶1∶1两种结果(表3)。结合比较群体基因型的组成,发现目标染色体区段相近的一段染色体片段影响着子代的分离比。前人研究表明许多偏分离现象是由多个基因共同作用造成的[18,20,36]。经过验证,该偏分离作用的产生是由两个基因相互作用造成的,因此将基因分解成SegD8A和SegD8B两个位点。
在BC3F3群体中,自交产生的后代在分子标记检测后分离比表现异常时,目标区间SegD8A的基因型为杂合型,而当目标区间SegD8A的基因型为纯合华占型或纯合Koliya型时,子代则表现出正常的孟德尔分离比,由此说明SegD8A基因杂合是造成子代偏分离的关键因素,且只在SegD8A基因表现为杂合时,子代才出现偏分离。在SegD8A表现为杂合的基础上,SegD8B的基因型为纯合Koliya型时,子代分离比表现为0∶1∶1;SegD8B的基因型为杂合基因型时,子代分离比表现为1∶5∶4;SegD8B的基因型组成为纯合华占型时则恢复正常的分离比。根据群体单株鉴定结果成功将SegD8A基因和SegD8B基因分别定位在标记CHR8-45~CHR8-53(约518.1 kb)和CHR8-53~CHR8-86(约1626.6 kb)的染色体区间内(图3-A)。

图3 SegD8A在水稻第8染色体上的精细定位Fig. 3. Fine mapping of SegD8A on chromosome 8 of rice.
2.3 SegD8基因的精细定位
依据初定位的结果及分离规律,利用BC3F3群体收获的种子进行萌发并培养至幼苗阶段,共用了4800株单株进行剩余杂合体的筛选。用标记CHR8-45、CHR8-53和CHR8-86筛选重组单株,结果显示标记CHR8-45和CHR8-53筛选到的交换株有229株,标记CHR8-53和CHR8-86筛选到的交换株154株,其中包括在两个组标记组合上都筛选到交换的单株51株,总计332株。为进一步对目标基因进行精细定位,分别在标记CHR8-45~CHR8-53和CHR8-53~CHR8-86之间设计精细定位分子标记(表4),并检测了重组单株后代杂合位点的基因型分离比,其基因型组成如图4。其中单株NFX10-33-4的子代基因型分离比为4∶26∶18(P=0.014),NFX9-21-4为0∶23∶25(P<0.001),NFX9-26-4为12∶24∶12,NFX10-73-4为32∶72∶29(P=0.593),NFX10-130-6和NFX9-34-1的子代基因型分离数值分别为13∶24∶10(P=0.817)和1∶24∶23(P<0.001)。
研究结果表明,SegD8A基因位于标记CHR8-78与SNP8-6之间。NFX10-33-4与NFX9-21-4在区间组成上只在标记CHR8-78与SNP8-6之间发生了重组交换,两单株的子代均发生偏分离;NFX9-26-4与NFX10-73-4在标记CHR8-78与SNP8-6之间表现为纯合,与这两个标记相邻的标记上发生重组交换,结果子代表现为正常的分离比,由此可以确定SegD8A基因位于标记CHR8-78与SNP8-6之间(图4-B),此段区间长度约为46.5 kb。
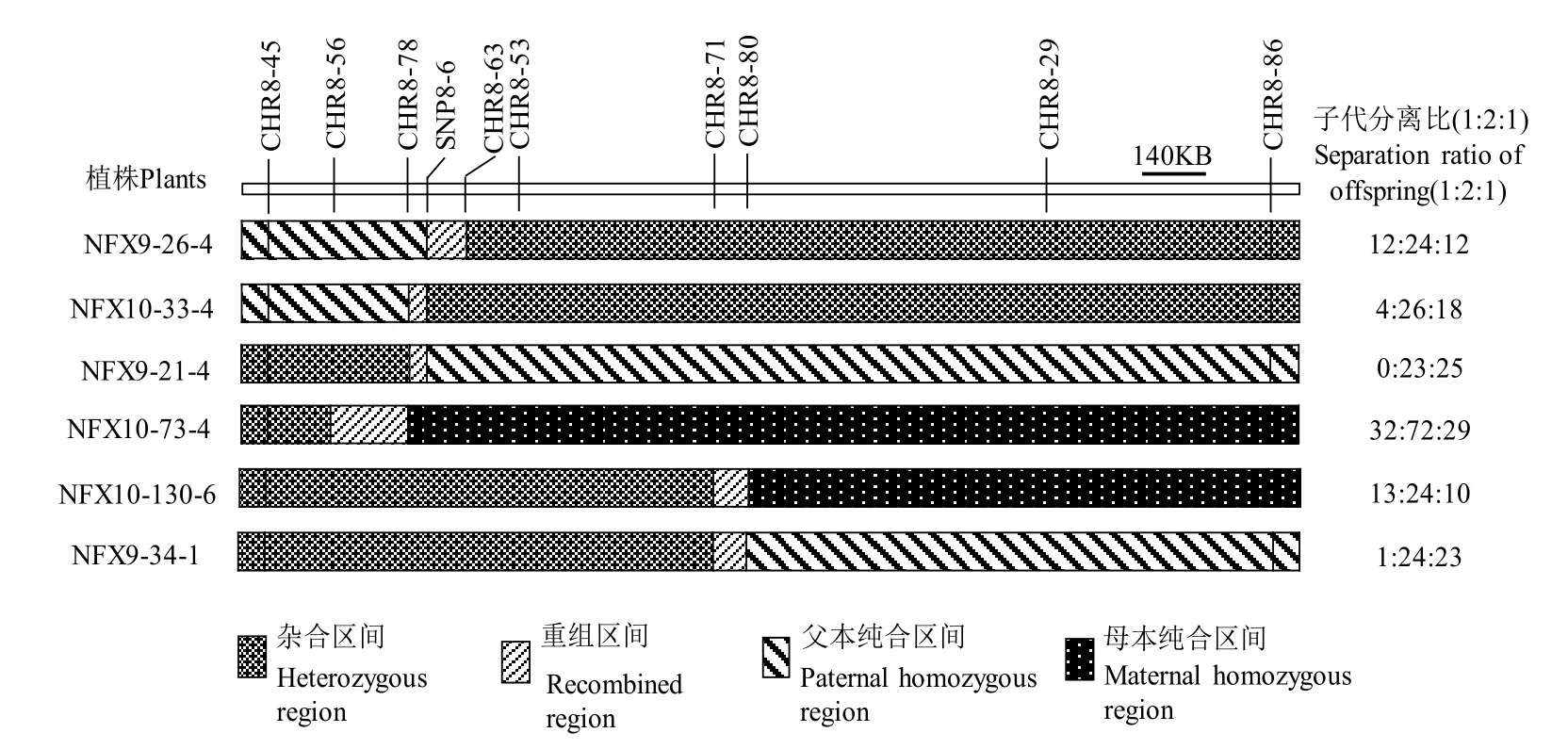
图4 渐渗系在目标区间的基因型组成Fig. 4. Genotypic compositions of introgression lines in target region.
NFX10-130-6在CHR8-80与CHR8-86之间表现为纯合华占型,子代则表现正常分离比,NFX9-34-1在CHR8-80与CHR8-86之间表现为纯合Koliya型,子代基因型出现偏分离,此结果表明SegD8B基因为纯合华占型时,可以消除SegD8A基因杂合时带来的偏分离影响。SegD8A基因被定位于46.5 kb 区间内。通过籼稻基因组序列预测该区段内存在的所有开放阅读框(Open reading frame,ORF)并参考水稻基因注释网站(RGAP)后与粳稻基因组序列进行比对,预测该区间内含有3个候选基因(图4-C)。分析候选基因发现,ORF1编码一个受体样激酶;ORF2基因可能与稻瘟病抗性有关,其过表达植株会提高稻瘟病抗性;ORF3则是一个功能未知的基因。
3 讨论
根据作用时间,偏分离可分为配子选择和合子选择两类,通常情况下偏分离是由两种作用共同引起[37]。作为一种常见的遗传动力,偏分离可以改变遗传群体中双亲和杂合等位基因的频率,可以使得群体更好地适应环境[38-39]。研究结果显示,SegD8基因是由相互作用的两个位点共同调控。SegD8A基因控制子代基因型偏分离的出现,只有该位点为杂合型时,子代才会发生偏分离,为纯合父本型或是纯合母本型时均不会出现。SegD8B控制子代出现不同的基因型偏分比例,其中SegD8B基因为纯合父本型时,子代中纯合母本型完全消失;SegD8B基因为杂合时,子代中纯合母本型约占总类型的1/10;SegD8B基因为纯合母本型时,子代分离比恢复为1∶2∶1。这样的结果与水稻中已发现的S5杂种不育位点功能类似,水稻S5位点由三个紧密连锁的基因共同编码一个“杀手-护卫者”系统来调节籼粳杂种的生育能力。分析两个位点携带的父本等位基因的数目,在SegD8A为杂合的条件下,SegD8B若为纯合父本等位基因时,后代中将不会出现SegD8AHH类型,此时SegD8BKK类似于“杀手”因子,两个位点共携带了3条父本等位基因;SegD8B为杂合子时,此时携带着来自父母本的各一条等位基因,子代中出现了少量的SegD8AHH,说明来自母本的等位基因削弱了父本等位基因的“杀手”能力,使得SegD8AHH得以部分存活;SegD8B为纯合母本等位基因时,SegD8AHH存活比例与正常分离比一致,类似于“护卫”因子,消除了SegD8A基因杂合带来的偏分离影响,由此认为父本基因的引入是造成偏分离的关键原因,SegD8B基因的作用与是否存在父本等位基因以及存在的父本等位基因数目有关。渐渗系群体的构建过程中,来自一个亲本的基因经过连续杂交进入另一个亲本[40],此过程可能会使杂交后代清除来自一个亲本或是双亲的基因[3],造成偏分离。外源导入的片段可能因其携带重要的基因而导致严重的偏分离。Gardner等[41]研究发现一些高程度扭曲的片段与基因组的非中心高密度标记区域呈现共线性关系,表明它们是从其他草种中导入小麦基因组的候选导入片段;Wang等[42]在引起严重偏分离的染色体区间上发现一个与棉花纤维强度显著相关的QTL。
综合来看,SegD8B位点上携带的父本等位基因的多少决定了子代的分离比率,但当SegD8B位点表现为纯合华占型时,子代又呈现正常分离比,说明SegD8B位点是纯合华占型时对SegD8A位点具有恢复能力。如图4所示,根据群体在目标区间的基因组成,将SegD8A位点定位在标记CHR8-78与SNP8-6标记之间46.5 kb区间内。由于SegD8B基因所在的染色体区段上可用的分子标记稀少,区段内重组交换较少,定位区间仍比较大,需要进一步精细定位。尽管对于这两个位点的作用规律研究得较为清晰,但其作用机理尚不明确。目前水稻中已知的偏分离可分为功能缺失型和功能获得型两类,前者因基因互作而导致原有基因功能丧失,如重复隐性雄配子致死基因导致的偏分离[20-21];后者则因为杂交后代中某些基因组合产生了新的功能影响配子生存,如水稻的S5[18]和Sa位点偏分离[19]。本研究中的偏分离作用是否属于上述的两种,还需进一步的深入研究。

