双表型肝细胞癌的临床病理分析
姚 瑶,范钦和,李红霞,朱 岩,宋国新,印永祥,肖 璇 (.无锡市妇幼保健院/江南大学附属妇产医院病理科,江苏 无锡 400;.江苏省人民医院/南京医科大学第一附属医院病理学部,江苏 南京 009)
双表型肝细胞癌(dual-phenotype hepatocellular carcinoma,DPHCC)于2011年被首次报道[1],发生率约占肝细胞癌(hepatocellular carcinoma,HCC)的10%,属于新定义的亚型,临床上相对少见。DPHCC在组织病理形态学上与典型的HCC并无太大差别,但其特点是同一肿瘤细胞可同时表达任意HCC免疫表型和任意胆管细胞癌免疫表型,因同时具有HCC和胆管细胞癌的生物学行为,所以与普通型HCC相比,DPHCC的微血管侵犯、肝内外转移及术后复发率更高,临床预后更差。因此,准确诊断DPHCC对其临床治疗具有一定的指导意义。《原发性肝癌规范化病理诊断指南(2015 年版)》将DPHCC纳入病理常规诊断[2]。本研究现结合文献复习对我院诊断的9例DPHCC患者进行回顾性分析,探讨其诊断及鉴别诊断的要点、免疫表型、相关治疗方法及预后特点,以期进一步提高对该肿瘤的认识。
1 资料与方法
1.1 临床资料
纳入2018年10月至2022年5月江苏省人民医院/南京医科大学第一附属医院病理学部诊断的DPHCC患者9例,其中男7例,女2例;年龄30~71岁,中位年龄54岁。收集患者的临床表现、影像学及血清学检查结果、手术方式等资料。所有患者对本研究知情同意。
1.2 病理资料
9例标本中,4例为穿刺标本,5例为局部或全肝切除标本,穿刺标本全部取材,局部或全肝切除标本采用肝癌“7点”基线取材法取材。
1.3 免疫组织化学染色
标本采用10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚切片,行HE染色制片及免疫组织化学染色。其中免疫组织化学染色采用EnVision法,DAB显色,苏木精对比染色。所用抗体包括CK19、CK7、Arginase-1、Glypican-3、AFP、Hepatocyte-1、Ki67,均购自福州迈新生物技术开发公司。CK19、CK7、AFP、Hepatocyte-1表达于细胞质,Arginase-1表达于细胞核和细胞质,Glypican-3表达于细胞质和细胞膜,Ki67表达于细胞核,相应部位显示棕黄色着色为阳性表达,同时设立阴性对照和阳性对照。
1.4 随访
9例患者均通过查阅电子病历及电话随访获取信息,每3个月随访一次,随访1~24个月,其中7例获得完整随访资料,2例失访。
2 结果
2.1 临床资料
9例患者中1例为门诊病例,8例为住院病例,均因“肝占位性病变”收治入院。5例表现为右上腹疼痛症状,4例为体检发现肝内实性占位。6例有乙肝病史多年,3例否认肝炎病史。DPHCC患者临床资料见表1。
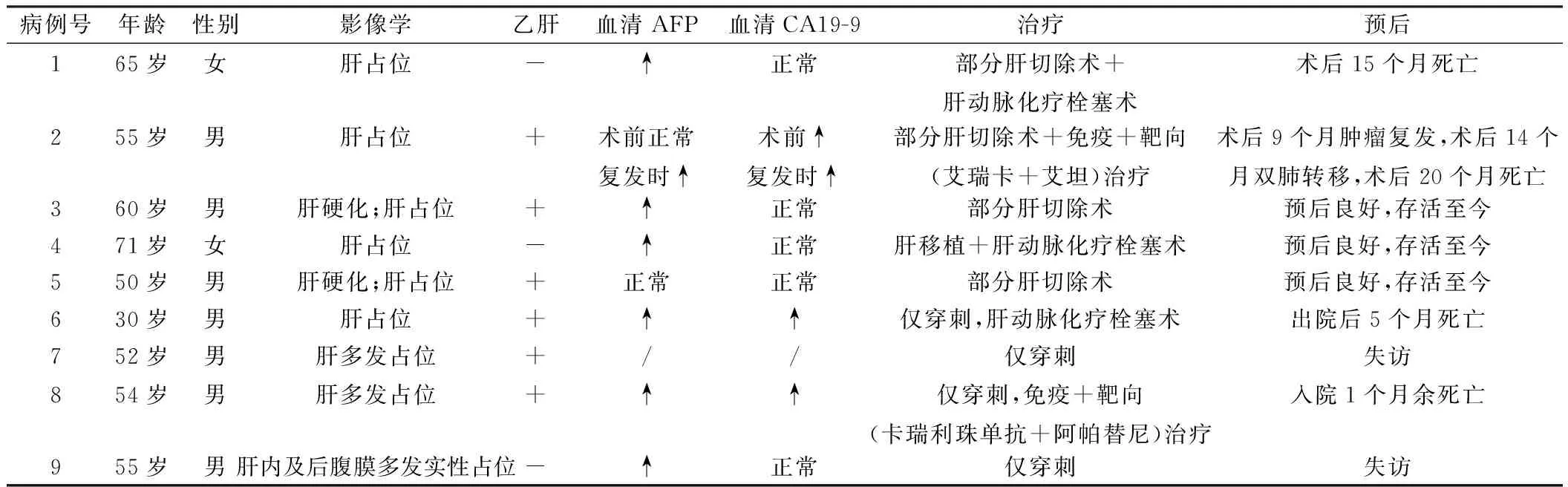
表1 9例DPHCC患者的临床资料
2.2 病理检查
9例标本的肿块大小为2.3 cm×1.8 cm×1.5 cm~14.5 cm×10.5 cm×8 cm,切面灰白质硬,呈结节状,大体检查3例肿块紧邻肝被膜。镜下观察:肿瘤细胞排列呈粗梁状、假腺样及团片状,肿瘤细胞间有丰富的血窦样腔隙,纤维间质少;肿瘤细胞呈多角形,体积较大,胞浆丰富且嗜酸(图1),局灶见透明细胞及瘤巨细胞;肿瘤细胞核仁明显,核分裂象多见。根据Edmondson-Steiner分级,7例为Ⅲ级,2例为Ⅱ~Ⅲ级;其中3例见微血管侵犯(microvascular invasion,MVI),均为2级,未见明显卫星结节;2例肿瘤累及但未穿透肝被膜(表2)。
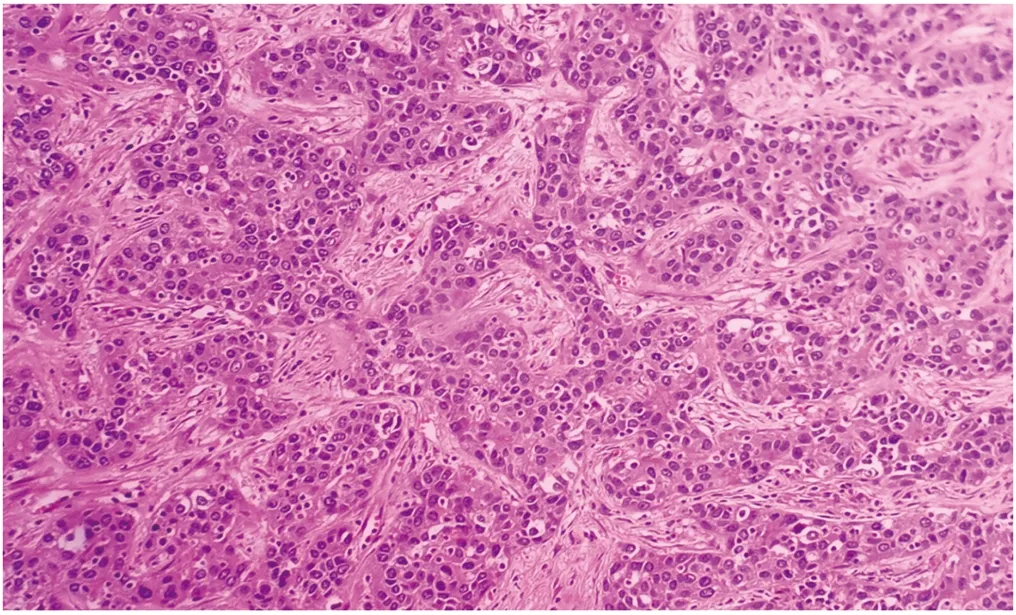
图1 肿瘤细胞HE染色(×200)
2.3 免疫表型
9例患者的肿瘤细胞表达CK19(图2a),其中4例患者的肿瘤细胞同时表达CK7(图2b);8例患者的肿瘤细胞表达Glypican-3;5例患者的肿瘤细胞表达AFP;4例患者的肿瘤细胞表达Hepatocyte-1;7例肿瘤细胞表达Arginase-1(图2c)。Ki67为20%~60%(表2)。

表2 9例DPHCC患者病理及免疫组织化学检测结果

a:肿瘤细胞 CK19弥漫阳性;b:肿瘤细胞表达 CK7;c:肿瘤细胞表达Arginase-1
2.4 随访及预后
9例患者中,3例肝多发占位者均有不同程度其他部位转移,均未经手术治疗,其中1例入院行免疫及靶向治疗1个月余后死亡,2例放弃治疗出院后失访。其余6例肝单发占位患者中,只有1例仅行肝动脉化疗栓塞术、未切除肿块,住院治疗1个月余,出院5个月后死亡;另5例均经手术治疗且术后获得7~24个月随访,其中1例术后9个月复查发现肿瘤复发,术后14个月复查发现双肺转移,术后20个月死亡;1例术后15个月死亡;其余3例生存状态良好,暂未复发及转移。
3 讨论
世界卫生组织将原发性肝癌分为HCC、ICC和混合型肝细胞-胆管细胞癌(combined hepatocellular cholangiocarcinoma,cHCC-CC )三类[3]。DPHCC是在HCC的范围内分离出的一种新亚型。目前DPHCC的发病机制主要有两种学说。一是肝祖细胞(hepatic progenitor cells,HPC)起源学说,HPC具有肝细胞与胆管上皮细胞双向分化的潜能,是肝的储备细胞,主要在肝受到损伤时发挥修复功能[4],过去研究证实,HPC与 HCC 的发生密切相关[5-6]。由于DPHCC的肿瘤细胞能同时表达HCC和胆管细胞癌的免疫标记物,因此DPHCC的肿瘤细胞可能起源于具有双向分化潜能的 HPC。二是HCC去分化学说,以往的研究发现,虽然CK19可在部分HCC细胞中表达,但HCC的癌前病变中CK19是阴性的,表达CK19的细胞是成熟肝细胞在恶变的过程中逐渐去分化形成的,而非HPC来源[7]。还有研究表明,在低氧环境中,部分CK19表达阴性的HCC细胞可经去分化途径转变为CK19阳性[8]。 因此,DPHCC的发生也有可能是HCC部分细胞发生去分化的结果。
临床表现方面,DPHCC患者的发病年龄、性别、HBV感染史等与HCC患者无明显差异[9],但部分DPHCC患者可出现血清AFP和CA19-9含量同时升高的现象,这是由于DPHCC细胞同时开放HCC管家基因AFP和ICC管家基因CA19-9,此现象常预示预后不良[1]。本组患者中,有3例出现了血清AFP和CA19-9含量同时升高的现象,且其中1例患者术后9个月和14个月复查分别发现肿瘤复发和双肺转移。研究还发现,DPHCC患者的血清AFP含量较HCC患者高,肿瘤细胞分化更差,且更易出现脉管内癌栓以及被膜侵犯[1]。本组患者中,有3例镜下可见脉管内癌栓;有3例大体标本检查时见肿块紧邻肝被膜,其中2例肿瘤累及但未穿透肝被膜。因此,我们认为AFP、CA19-9含量升高是导致DPHCC患者预后更差的相关因素。
在病理表现方面,DPHCC在组织学上与典型的HCC特征相似,如瘤细胞的生长结构可为梁状、实性或假腺样,周围可见肝窦样血管网,纤维间质少,瘤细胞胞浆丰富且嗜酸。因此,要准确诊断DPHCC,需行免疫组织化学检测。当肿瘤具有单一的HCC成分,在超过15%的肿瘤细胞中,有一种或多种肝细胞标记物表达呈强阳性,同时有一种或多种胆管细胞标记物表达也呈强阳性,可诊断为DPHCC[2]。本组患者肿瘤细胞的组织学形态均具有典型的HCC特征,免疫组织化学的表达情况也符合此诊断标准,因此诊断准确无误。此外,有研究发现在DPHCC的肿瘤标本中,CK7、CK19同步阳性的瘤细胞多分布在肿瘤的边缘,并且脉管内的瘤栓也依旧保留着双表型的免疫表达特征[10]。本研究中的标本也发现了类似情况,由此可以证明具有双表型特征的瘤细胞比一般的HCC细胞分化更差、侵袭性更强、更容易转移。近年来还有研究发现,DPHCC的肿瘤细胞还可表达HPC免疫标记物,如EpCAM、CD133等,EpCAM和CD133阳性的DPHCC患者预后相对更差,并且EpCAM和 CD133在肿瘤的发生和发展过程中具有协同作用,因此推测EpCAM和CD133的高表达也可能是 DPHCC早期复发率较高的原因之一[11]。
鉴别诊断方面,DPHCC主要需与典型的cHCC-CC相鉴别,后者一般是在同一个肿块内含有明确的HCC和胆管细胞癌两种组织学成分,并且分别各自表达HCC和胆管细胞癌的免疫标记物[12-15]。但DPHCC在同一个肿块内仅表现出单一的HCC组织学成分,而部分细胞呈双向分化和基因双向开放,这部分细胞同时表达HCC和胆管细胞癌的免疫标记物[3,16-17]。
DPHCC还需与肝中间细胞癌鉴别。肝中间细胞癌由2019年《WHO消化系统肿瘤分类》提出[18],其镜下表现为单一的形态特征,在细胞水平上介于肝细胞和胆管细胞之间,形态学表现为肿瘤细胞较小,细胞质稀少,肿瘤细胞在丰富的纤维间质中排列成条索状、线状、小梁状,偶尔出现腺样结构。与DPHCC相似,肝中间细胞癌也双重表达HCC和胆管细胞癌标记物,但DPHCC细胞胞浆丰富且嗜酸,一般纤维间质较少,可相互鉴别。
治疗与预后方面,目前DPHCC患者的治疗主要以手术完整切除为主,必要时可辅助免疫治疗、靶向治疗、化疗等。研究显示,DPHCC患者的总生存期和无复发生存期均较普通型HCC患者低[11,19]。本组患者中,3例患者发现肿瘤时已有不同程度其他部位转移,失去了外科手术治疗的机会,其中1例入院1个月余死亡;5例经手术治疗的患者术后随访7~24个月,其中1例肿瘤复发且转移至双肺,术后20个月死亡;1例术后15个月死亡。本研究共9例患者,仅3例后期生存状态尚可。
CK19的表达是DPHCC的重要特征,有研究表明 CK19 与EpCAM 可共同参与 Wnt-β-catenin 信号通路,增强DPHCC的增殖活性和侵袭能力,促进肿瘤的复发与转移[20]。因此,CK19阳性表达是DPHCC预后较差的影响因素之一。 本组9例患者CK19的表达均为阳性。另外,CK19的表达与治疗药物的耐药性和敏感性相关,也可能是导致DPHCC预后更差的原因之一。

