利培酮对抑郁症大鼠海马区神经元细胞损伤和免疫紊乱的调节
谢莲萍,赵玉梅,陈丽萍,王 崇,国树梅 (.衡水市第七人民医院药剂科,河北 衡水 053000;.牡丹江医学院附属红旗医院药剂科,黑龙江 牡丹江 57000)
抑郁症是抑郁障碍的典型情况,是一种患病率和治愈率均较高的精神障碍,但大众对该疾病的认知程度和重视程度欠缺,能够坚持接受正规治疗的病例较少,导致治疗后易复发[1-2]。抑郁症会使植物神经系统功能发生紊乱,进而影响免疫系统功能,引起神经性头痛、神经衰弱、反应迟钝等神经损伤性疾病。抑郁症的治疗包括药物、心理以及物理治疗,旨在帮助患者提高生活质量、恢复社会功能以及预防复发。氟西汀、舍曲林、文拉法辛、米氮平等可用于抑郁症治疗,但伴有恶心、呕吐等不良反应[3-4]。利培酮是新一代非经典抗精神病药物,能够选择性拮抗分布于中脑和边缘脑组织中的多巴胺D2受体、5-羟色胺2A(5-hydroxytryptamine 2A,5-HT2A)受体,对精神分裂症具有较好的治疗效果,且锥体外系不良反应发生率较低,患者的耐受性更好[5]。有研究表明,利培酮在治疗抑郁症患者方面具有较好效果[6],但利培酮是否是通过影响神经元细胞损伤和免疫调节来发挥治疗作用目前尚不明确。基于此,本研究通过制备抑郁症大鼠模型,探讨利培酮对抑郁症大鼠神经元细胞损伤和免疫紊乱的影响,以期为抑郁症治疗方案的制定提供参考。
1 材料和方法
1.1 主要试剂及仪器
兔抗鼠Bax抗体(批号:191114)、兔抗鼠Bcl-2抗体(批号:191208)、兔抗鼠脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)抗体(批号:200311)购自上海恒斐生物科技有限公司,ECL试剂盒(批号:200603)购自上海经科化学科技有限公司,DMSO(批号:191117)购自Sigma公司,尼氏染色液(批号:200412A)购自北京索菜宝科技有限公司,白细胞介素-6(interleukin-6,IL-6)试剂盒(批号:191212)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(批号:191124)、白细胞介素-10(interleukin-10,IL-10)试剂盒(批号:191019)、5-羟色胺(5-hydroxytryptamine,5-HT)试剂盒(批号:200216)购自武汉益普生物科技有限公司,5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)试剂盒(批号:200321)购自南京森贝伽生物科技有限公司,兔抗鼠谷氨酸转运体(glutamate transporter-1,GLT-1)抗体(批号:200522)购自上海谷研实业有限公司。
主要实验仪器包括:Avanti J-15R冷冻离心机(Beckman Coulter)、Primo Star iLED正置荧光显微镜(Carl Zeiss)、RM2255全自动轮盘式切片机(LEICA)、多功能酶标仪(上海闪谱生物科技公司,SuPerMax 3000AL)。
1.2 实验动物
SPF级雄性SD大鼠100只,5~6周龄,体质量(270±20)g,购自牡丹江医学院[SCXK(黑)2019-003],适应性饲养1周,饲养条件:温度20~25 ℃,湿度50%~55%,人工光照(昼12 h/夜12 h),全天自由饮水、进食。
1.3 模型制备与动物分组处理
将100只SD大鼠分为对照组、模型组、利培酮低剂量组、利培酮中剂量组、利培酮高剂量组,每组20只。除对照组外,其余各组均参考文献[7]采用慢性不可预见应激(chronic unpredictable stress,CUS)法制备抑郁症大鼠模型,刺激方式包括:①禁水17 h;②禁食和禁水20 h;③持续光照20 h;④夹尾60 s;⑤ 30 V电压电击足底;⑥ 4~5 ℃冷水游泳5 min;⑦饲养笼加入湿锯屑垫料;⑧将饲养笼倾斜45 ℃,连续17 h。所有刺激方式在模型制备过程中均使用,连续刺激21 d,但每种刺激方式不能连续使用2 d。与健康大鼠相比,大鼠活动能力下降、探索能力减弱表明模型构建成功。对照组大鼠正常饲养条件同1.2。
实验进行第22天时,参考文献[8]中利培酮的给药剂量,分别给予利培酮低剂量组、利培酮中剂量组、利培酮高剂量组0.05 mg/kg、0.10 mg/kg、0.20 mg/kg利培酮腹腔注射干预,模型组和对照组注射相应体积生理盐水,每天1次,连续14 d。每组选取5只大鼠采用Longa法评估神经功能,然后再用于跳台实验,实验结束后麻醉处死大鼠,但不用于后续实验数据检测;余下15只大鼠均麻醉处死,取5只大鼠海马组织用于神经递质水平和GLT-1、BDNF和凋亡相关蛋白表达检测,另取5只大鼠海马组织用于HE染色、尼氏小体染色,余下5只大鼠用于外周血、脑组织炎症因子水平检测。
1.4 Longa法评估大鼠神经功能
每组随机选取5只大鼠,采用Longa法[9]评估大鼠神经功能情况:正常,无神经缺损症状(0分);不能伸展前爪,轻度损伤(1分);行走时向单侧转圈,中度损伤(2分);行走时向单侧倾倒,重度损伤(3分);不能自发行走,意识丧失(4分)。
1.5 跳台实验测量大鼠犯错误次数
在跳台装置中放置绝缘平台(直径4.5 cm,高5 cm),神经功能评估完成后,将大鼠放入被动条件反射箱内绝缘平台上适应3 min,适应结束后,接通40 V交流电,大鼠一般情况下会跳上绝缘平台以躲避电击,记录训练5 min内大鼠被电击次数(错误次数),训练结束24 h后,在通电情况下再次将大鼠放置于绝缘平台,记录大鼠5 min内错误次数。
1.6 ELISA检测大鼠海马组织神经递质水平
取出大鼠脑组织,4 ℃预冷生理盐水冲洗,滤纸吸干表面水分,分离出海马组织,按照质量体积比(1∶9)加入4 ℃预冷生理盐水,于冰台上研磨成匀浆,然后于4 ℃、35 000 r/min离心10 min,取上清液于-80 ℃保存,采用ELISA法检测上清液中5-HT、5-HIAA水平,步骤严格按照试剂盒说明书操作,重复3次。
1.7 HE染色观察大鼠海马组织病理损伤情况
取大鼠完整脑组织,并快速分离出海马组织固定于10%中性甲醛溶液中,常规脱水、透明、浸蜡、石蜡包埋、切片(5 μm),再进行脱蜡、水化、HE染色、水化、透明封片,显微镜下(×400)观察海马区病理情况。
1.8 尼氏小体染色观察大鼠海马区神经元损伤情况
每组大鼠海马组织取样至脱蜡和水化步骤均与1.7相同,37 ℃尼氏染色液染色5 min,蒸馏水清洗2次,95%无水乙醇进行分色,后续脱水、透明、封片等步骤同1.7,在高倍镜(×400)下观察海马区尼氏小体染色情况,其中尼氏小体呈蓝紫色,细胞核为蓝色。
1.9 Western blot检测大鼠海马区GLT-1、BDNF和凋亡相关蛋白表达
提取大鼠海马区总蛋白,采用Bradford法调整蛋白浓度至一致,经SDS-PAGE凝胶电泳(70 V恒压电泳1.5 h,再100 V电泳1 h)、电转(恒定电流200 mA、2 h)至PVDF膜,密封2 h,分别加入Bax、Bcl-2、Caspase-9、Caspase-3、、GLT-1、BDNF、GAPDH一抗(均1∶500),然后4 ℃孵育过夜,TBST漂洗40 min,加入HRP标记的二抗(1∶500)继续孵育1 h,参照ECL试剂盒说明书进行显影、定影,收集影像。重复3次。
1.10 ELISA检测大鼠外周血、脑组织炎症因子水平
断头处死大鼠前,采集心脏血0.5 mL,4 ℃下35 000 r/min离心10 min,取上清液保存于-80 ℃;取1.6中的海马组织匀浆上清液,采用ELISA法检测上清液中IL-6、TNF-α、IL-10水平,步骤严格按照试剂盒说明书操作,重复3次。
1.11 统计学方法

2 结果
2.1 利培酮对抑郁症大鼠神经功能的影响
与对照组相比,模型组大鼠跳台实验犯错误次数、神经功能损伤评分显著增加/升高(P<0.05)。与模型组相比,利培酮中剂量组、利培酮高剂量组跳台实验犯错误次数、神经功能损伤评分显著减少/降低(P<0.05),见图1。
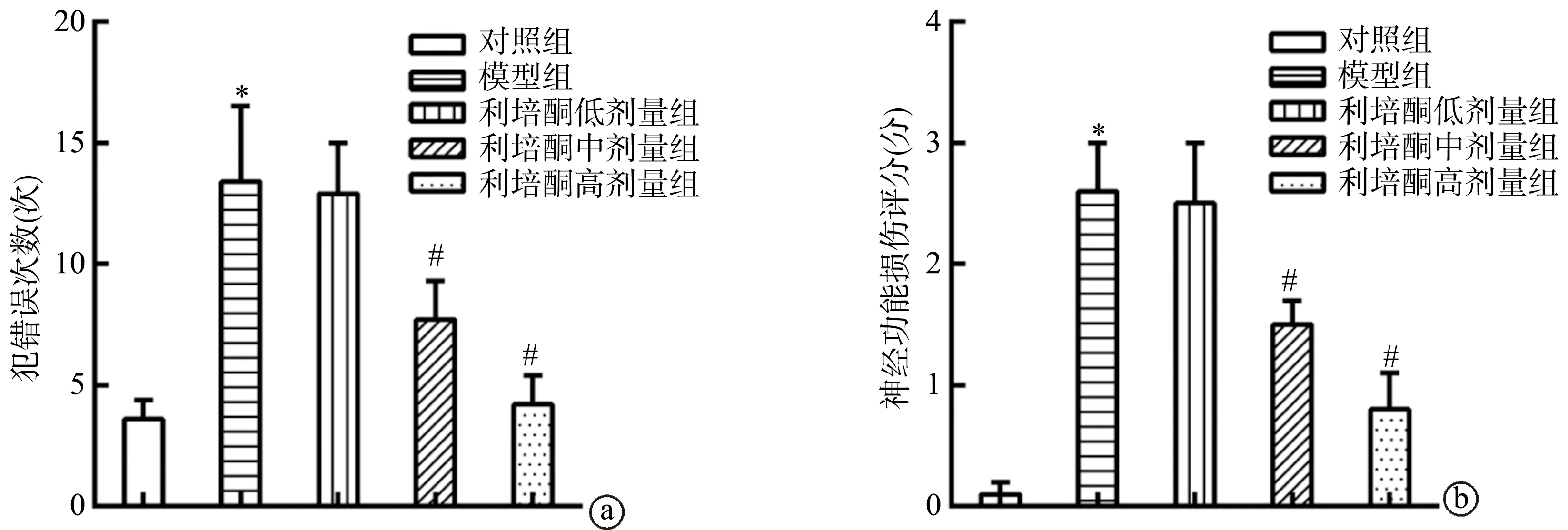
a:跳台实验犯错误次数;b:神经功能损伤评分 *:与对照组相比,P<0.05;#:与模型组相比,P<0.05
2.2 利培酮对抑郁症大鼠神经递质水平的影响
与对照组相比,模型组大鼠5-HT、5-HIAA水平显著降低(P<0.05);与模型组相比,利培酮中剂量组和利培酮高剂量组5-HT、5-HIAA水平显著升高(P<0.05),见图2。

a:跳台实验犯错误次数;b:神经功能损伤评分 *:与对照组相比,P<0.05;#:与模型组相比,P<0.05图2 利培酮对抑郁症大鼠神经递质水平的影响
2.3 各组大鼠海马区GLT-1和BDNF蛋白水平比较
与对照组相比,模型组大鼠GLT-1、BDNF蛋白水平显著降低(P<0.05);与模型组相比,利培酮中剂量组、利培酮高剂量组GLT-1、BDNF蛋白水平显著升高(P<0.05),见图3。
2.4 各组大鼠海马区HE染色结果
HE染色结果显示,对照组大鼠海马区神经元细胞排列整齐,细胞形态规则;模型组大鼠和利培酮低剂量组大鼠的海马区神经元细胞均表现为核固缩、胞质浓缩,细胞排列杂乱无章;利培酮中剂量组、利培酮高剂量组海马区神经元细胞排列较紧密有序,损伤程度减轻,见图4。
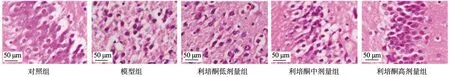
图4 大鼠海马区HE染色
2.5 各组大鼠海马区尼氏小体染色
尼氏小体染色结果显示,对照组大鼠海马区细胞形态较好,且染色蓝紫色的尼氏小体颗粒较多;模型组、利培酮低剂量组大鼠的海马区尼氏小体颗粒减少,细胞形态发生改变,胞质着色变浅;利培酮中剂量组、利培酮高剂量组海马区尼氏小体颗粒增多,神经元细胞形态相对较好,见图5。

图5 大鼠海马区尼氏小体染色
2.6 各组大鼠海马区Caspase-9、Caspase-3和Bcl-2/Bax水平比较
与对照组相比,模型组大鼠Caspase-9、Caspase-3、Bcl-2/Bax蛋白水平显著升高(P<0.05);与模型组相比,利培酮中剂量组、利培酮高剂量组Caspase-9、Caspase-3、Bcl-2/Bax蛋白水平显著降低(P<0.05),见图6。

a:蛋白凝胶成像结果;b:蛋白相对表达水平 *:与对照组相比,P<0.05;#:与模型组相比,P<0.05
2.7 各组大鼠外周血和脑组织中IL-6、TNF-α和IL-10水平比较
与对照组相比,模型组外周血和脑组织中IL-6、TNF-α、IL-10水平显著升高(P<0.05);与模型组相比,利培酮中剂量组、利培酮高剂量组外周血和脑组织中IL-6、TNF-α水平显著降低(P<0.05),IL-10水平显著升高(P<0.05),见图7。

a:外周血IL-6、TNF-α和IL-10水平;b:脑组织IL-6、TNF-α和IL-10水平 *:与对照组相比,P<0.05;#:与模型组相比,P<0.05
3 讨论
抑郁症是病情易反复的慢性情感性疾病,诱导抑郁症发病的因素众多,并且各种因素之间会相互影响[9-10]。普遍认为抑郁症发病与遗传、心理、神经内分泌以及神经递质功能异常有关,大部分抑郁症患者存在认知功能损伤,表现出反应变慢、注意力分散、记忆损伤等症状,患者日常生活受到较大影响[11-12]。目前多采用抗抑郁药物进行治疗,主要是通过改变单胺类神经递质功能发挥治疗效果,但存在药物起效慢和副作用反应大等缺点[13]。
利培酮是治疗精神分裂症的非典型精神药物,属于苯丙异噁唑类衍生物,其可以减少感染性脑膜炎引起的精神障碍患者的行为、精神障碍症状[14]。5-HT、5-HIAA为单胺类神经递质,在调节机体正常精神活动中具有重要作用[15]。本研究结果显示,抑郁症大鼠的跳台实验犯错误次数、神经功能损伤评分较健康大鼠显著增加/升高,而海马组织中5-HT、5-HIAA水平显著降低,说明抑郁症大鼠存在认知障碍和神经功能损伤。有研究表明,鸡豆黄素A可通过增加抑郁症大鼠海马组织中5-HT含量和促进cAMP-CREB-BDNF信号通路蛋白表达而发挥抗抑郁作用[16]。本研究结果显示,当利培酮干预剂量为0.10 mg/kg时可以显著减少/降低抑郁症大鼠跳台实验犯错误次数、神经功能损伤评分,提高抑郁症大鼠海马组织中5-HT、5-HIAA的水平,说明利培酮具有抗抑郁作用,这可能与调节单胺类神经递质水平有关。
海马组织在学习、记忆过程中具有重要作用,可通过调节下丘脑释放促肾上腺皮质激素释放激素来参与脑应激反应过程,而持续性脑应激反应会缩小海马体积,降低海马的可塑性,同时还会使海马神经发生减少[17],而海马神经发生在人类学习、记忆和情感控制方面具有重要作用。本研究结果显示,抑郁症大鼠的海马区神经元细胞胞质浓缩、核固缩且排列杂乱,而中、高剂量利培酮干预后的神经元细胞的损伤程度明显减轻,说明中、高剂量利培酮可以缓解抑郁症大鼠的海马组织损伤,对海马损伤具有改善作用。
尼氏小体是神经元胞体或树突内大嗜碱性团块或颗粒,其主要功能是合成/更新细胞器、神经递质所需的蛋白质和酶类,其形状、数量和分布情况因神经元类型不同而存在差异[18]。分布于轴突端的大量蛋白质均是由胞体的尼氏体合成,代谢旺盛的神经元中含有大量尼氏体。当神经受损时,尼氏体含量降低,甚至消失;当受损神经元恢复时,尼氏体含量又会恢复至正常水平,故尼氏体可作为神经元功能的观察对象。本研究结果显示,抑郁症大鼠海马区尼氏体呈现出明显减少趋势,而中、高剂量利培酮干预后大鼠海马区尼氏体呈明显升高趋势,说明抑郁症大鼠存在海马区神经元损伤,而给予中、高剂量的利培酮干预有助于抑郁症大鼠海马区神经元功能恢复。
BDNF是海马区神经元发生、存活的重要神经营养因子,正常生理状态下在海马、皮层中呈高表达,其表达水平降低可能加速应激反应引起的海马区神经元损伤程度[19]。氟西汀可通过减少抑郁症大鼠的海马细胞凋亡、提高BDNF水平来发挥对海马神经元的保护作用[20]。GLT-1为胶质细胞性转运体,可清除突出间隙中的兴奋性氨基酸谷氨酸。Caspase-9、Caspase-3均属于细胞凋亡级联反应途径中的细胞凋亡因子,凋亡信号刺激可使无生物活性的Caspase-9、Caspase-3快速转变为活化状态,促进神经元凋亡[21-22]。Bax和Bcl-2分别分布于线粒体膜上和线粒体膜外,可调节线粒体膜通透性,两者比值可反映细胞凋亡情况[23]。本研究结果显示,抑郁症大鼠海马组织中的GLT-1和BDNF蛋白水平明显降低,Caspase-9、Caspase-3、Bcl-2/Bax蛋白水平明显升高,而通过给予中、高剂量的利培酮干预可以逆转上述趋势,说明中、高剂量的利培酮可以调节GLT-1和BDNF、Caspase-9、Caspase-3、Bcl-2/Bax蛋白水平,提示利培酮可能通过提高抑郁症大鼠海马区BDNF、GLT-1蛋白水平、降低凋亡相关蛋白水平来发挥对神经元的保护作用。
组织损伤凋亡受到多种因素激活,免疫炎症反应增强就是其中之一,IL-6、TNF-α均属于促炎因子,IL-10属于抑炎因子,炎症因子主要是由辅助性T细胞、巨噬细胞等免疫细胞所合成分泌,调节机体免疫应答。本研究发现抑郁症大鼠外周血和海马组织IL-6、TNF-α、IL-10水平较健康大鼠呈升高趋势,而中、高剂量的利培酮干预可降低抑郁症大鼠外周血和海马组织IL-6、TNF-α水平,增加IL-10水平,说明中、高剂量的利培酮干预可能对抑郁症大鼠的免疫功能存在改善作用,但其中具体机制尚还需要深入研究。
综上所述,在0.10 mg/kg利培酮作用下可以缓解抑郁症大鼠海马区神经元细胞损伤程度和免疫紊乱状态,但利培酮是通过何种信号通路调节抑郁症大鼠海马区神经损伤和免疫状态,还需要进一步深入研究。

