CT引导下经皮穿刺活检食管占位性病变的有效性及安全性
张容铭,王 猛,周志刚
(郑州大学第一附属医院放射科,河南 郑州 450052)
消化系统肿瘤在我国发病率和死亡率均较高[1]。消化道内镜超声引导下细针穿刺活检(endoscopic ultrasound-guide fine-needle aspiration, EUS-FNA)能明确诊断多数食管占位性病变,而对消化系统黏膜下肿瘤(submucosal tumor, SMT)及少数仅表现为局部黏膜增厚且管腔狭窄、内镜无法通过的进展期恶性肿瘤,常规内镜下活检阳性率较低,EUS-FNA诊断率亦不理想[2-3]。CT引导下经皮穿刺活检具有定位准确率高、并发症少等优点,但目前该技术较少用于食管占位性病变。本研究观察CT引导下经皮穿刺活检食管占位性病变的有效性及安全性。
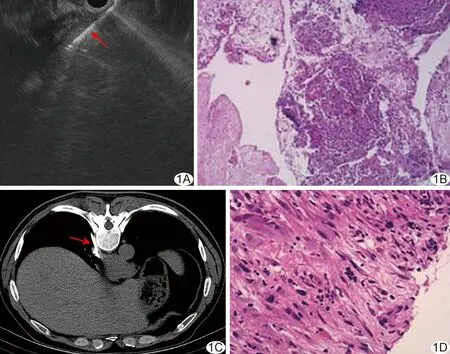
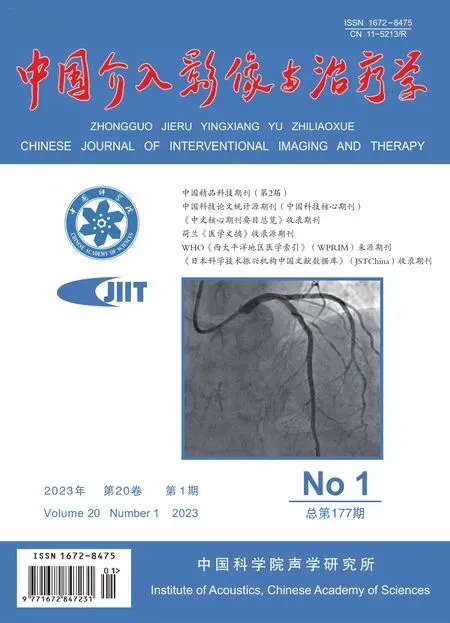
图1 患者男,67岁,体检发现食管下段占位性病变 A.二维声像图示食管下段占位,行EUS-FNA,红箭示穿刺针; B.EUS-FNA组织病理图(HE,×100)示炎性渗出及坏死组织,考虑炎性病变; C.行CT引导下经皮穿刺活检,红箭示穿刺针; D.CT引导下穿刺活检组织病理图(HE,×400),诊断为炎性脂肪肉瘤
1 资料与方法
1.1 一般资料 回顾性分析2015年1月—2021年5月37例于郑州大学第一附属医院接受CT引导下经皮穿刺活检的食管占位性病变患者,男23例、女14例;年龄15~87岁、平均(57.4±13.6)岁,其中<56岁者18例、≥56岁者19例;共37个病灶,7个位于食管上段、6个食管中段、24个食管下段及胃食管结合部;28个位于黏膜下层或固有肌层且向腔外生长;病灶最大径12~104 mm,平均(47.03±22.61)mm。37例中,20例接受消化内镜活检及EUS-FNA检查,结果均为阴性;10例仅接受消化内镜活检,其中8例阴性、2例因靶组织较少未获得明确病理诊断;7例因食管狭窄内镜无法通过而直接行CT引导下穿刺活检。 纳入标准:①CT显示食管占位性病变,且消化内镜和/或EUS-FNA活检阴性;②病历资料完整;③检查前签署知情同意书。排除严重凝血功能障碍及罹患严重心、肺、脑等基础疾病者。
1.2 仪器与方法 术前完善胸部CT,明确病灶位置及与周围组织的关系,并计划穿刺路径。适当选择患者体位,采用GE Discovery CT590 16层螺旋CT仪,管电压120 kV、管电流200 mAs、层厚0.375 cm,行局部 CT扫描,以确定穿刺点。以2%利多卡因行局部浸润麻醉,采用17G同轴穿刺针(Angiotech)沿计划路径步进式进针,使针尖位于病灶内,期间避免损伤食管;退出针芯,置入18G全自动活检针(Angiotech),沿不同方向取标本2~4条;每次取材后立即还纳针芯,如针道经过肺组织,退针前予0.9%无菌生理盐水封堵针道。即刻再行CT扫描,观察有无出血、气胸等穿刺并发症。
1.3 病理学检查 将穿刺活检病理结果为肿瘤性病变定义为阳性,穿刺病理结果为炎性病变或正常组织定义为阴性。以手术后病理和/或最后随访(均≥12个月)临床诊断为最终诊断。
1.4 统计学分析 采用SPSS 22.0统计分析软件,以Fisher精确概率法比较不同大小及部位病灶穿刺活检病理阳性率的差异。P<0.05为差异有统计学意义。
2 结果
2.1 有效性 37个病灶均穿刺取材成功并获明确病理诊断,病理阳性32个、阴性5个,穿刺病理诊断率100%;对既往接受消化内镜活检及EUS-FNA均为阴性的20例患者,CT引导下穿刺活检阳性率为90.00%(18/20)。见图1、2。食管上段病灶穿刺活检病理阳性率为100%(7/7),食管中段病灶为66.67%(4/6),食管下段及胃食管连接处病灶为87.50%(21/24),三者差异无统计学意义(P=0.213);穿刺活检病理阳性率在最大径<47.03 mm病灶为79.62%(10/13),≥47.03 mm病灶为87.50%(21/24),差异无统计学意义(P=0.321)。
图2 患者男,47岁,食管中段占位性病变 A.胃镜图示食管右侧壁局部隆起(箭); B.超声声像图示食管隆起处管壁结构正常,可见血流信号,考虑大血管压迫; C.行CT引导下经皮穿刺活检,红箭示穿刺针; D.穿刺组织活检病理图(HE,×100),诊断为平滑肌瘤
术后随访12~40个月,中位随访时间26个月。32例穿刺结果阳性患者中,19例接受放射治疗(放疗)、化学治疗(化疗)及其他治疗;11例接受手术治疗,4例术后病理诊断为平滑肌瘤、3例为胃肠道间质瘤、胃食管结合部低分化腺癌及食管低分化鳞癌各2例,穿刺活检病理结果均与术后病理结果一致;1例穿刺病理为胃肠间质瘤患者服用靶向药物,1例穿刺病理为平滑肌瘤者未行其他治疗,随访期间病情均稳定。5例穿刺结果阴性患者中,3例活检病理为食管黏膜慢性炎症;2例为少量纤维组织,予手术切除,术后病理均为胃肠间质瘤。见表1。CT引导下经皮穿刺活检对于食管占位性病变的诊断准确率为94.59%(35/37),假阴性率40.00%(2/5)。
2.2 安全性 14个病灶的穿刺针道途经肺组织,在退出穿刺针前以无菌生理盐水封堵针道,其中2例(2/14,14.29%)出现少量气胸(肺组织压缩量<20%),患者无明显不适,未予特殊处理,术后随访1周,期间气胸自行吸收;其余病灶穿刺针道均未经过肺组织,但术后复查CT发现3例穿刺针道周围少量出血,随访1周出血自行吸收。穿刺活检并发症发生率为13.51%(5/37)。
3 讨论
随着内镜的普及,消化系统肿瘤检出率逐年升高。常规内镜对于多数消化道肿瘤可取得满意标本,但对于尚未突破食管壁的肿瘤,内镜活检常为阴性[4]。超声内镜检查(endoscopic ultrasonography, EUS)通常可显示病灶处消化道管壁层面、形态及范围,有助于判定病变性质[5],但当肿瘤范围超出探头扫查范围或病变导致消化道管壁结构紊乱时可能出现误诊[6-7],需结合组织活检加以明确诊断。既往研究[3,6,8-9]报道,EUS-FNA对SMT的诊断准确率为20%~93%,结果差异较大的原因主要在于EUS-FNA获取标本量少,且增加穿刺次数或更换更大直径的穿刺针并不能显著提高穿刺活检阳性率。

表1 CT引导下经皮穿刺食管占位性病变活检病理、临床处理及最终诊断(n=37)
影像学引导下穿刺活检获取细胞和组织可明确病变性质,为肿瘤分型及个体化治疗提供依据。既往研究[10]结果显示,CT引导下经皮纵隔穿刺活检定性诊断纵隔肿块的准确率可达94%[95%CI(0.90,0.97)],并发症发生率则为13%[95%CI(0.09,0.19)]。本研究纳入37个消化内镜和/或EUS-FNA活检阴性食管占位性病变,且多数位于黏膜下层或固有肌层且向腔外生长,CT引导下经皮食管占位性病变穿刺活检均取得满意病理标本,诊断准确率达94.59%(35/37),且对20例既往曾接受消化内镜活检及EUS-FNA均为阴性者经活检阳性率为90.00%(18/20),提示此法诊断效能较高。
食管上段邻近气管、颈内外动脉及静脉,穿刺路径为气管与颈部血管之间的间隙,范围较小,主要宜采用仰卧位前入路谨慎穿刺,避免损伤周围组织。本组对7个食管上段病灶中的6个采用前入路穿刺。1个病灶位于胸廓入口处,前方有锁骨阻挡,故采取俯卧位经肺尖后入路进针。对于食管中段病灶,心脏阻挡前入路,可采取俯卧位经后入路穿刺,于周围肺组织内建立安全穿刺通道。本组对全部6个食管中段病灶均采用后入路,且均于右侧进针,以避开胸主动脉。食管下段及胃食管结合部前方有心脏、肝脏,后方有主动脉等重要结构,可通过肺组织甚至经过肝脏建立穿刺通道。本组24个病灶位于食管下段及胃食管结合部,经前、后入路各12个,前入路者中3个穿过肝脏。本研究所用全自动活检针具有弹射速度快、射程固定、穿透力大等优点;遇穿刺病灶周围结构复杂时,宜选用结构设计轻巧、穿刺深度更为可控[11]的半自动活检针。
CT引导下经皮穿刺活检纵隔病变的主要并发症包括气胸、纵隔血肿、血气胸及纵隔感染等,气胸发生率高达20%~46%,主要是因穿刺针到达病变位置需两次穿过脏层胸膜,发生气胸风险较高[10,12-13]。有研究[13-14]尝试采用人工气胸、套管内自体血注入及液体撤退等方法降低CT引导下经皮穿刺活检食管及纵隔内病变的气胸发生率。本组14例穿刺针道经过肺组织到达病变位置,在退出穿刺针前以无菌生理盐水封堵针道,仅2例出现少量气胸。
综上所述,CT引导下经皮穿刺活检食管占位性病变的有效性及安全性均较好。但本研究为回顾性分析,且样本量小,有待更大样本的前瞻性研究进一步验证。